肝细胞、肝窦内皮细胞分离培养及肝细胞支架的制备
陈世钻,俞富祥,陈俊予,唐银河
(温州医科大学附属第一医院 肝胆外科,浙江 温州 325015)
我国是慢性肝病大国,更是肝恶性肿瘤的高发国家。严重慢性肝病和肝恶性肿瘤的晚期需要肝脏移植治疗[1]。肝移植治疗对肝脏供体的巨大需求与肝脏供体的严重短缺形成了巨大反差[2],因此,肝脏再生的研究刻不容缓。肝脏再生一直是肝脏疾病研究中的重要环节,但经过多年的探索对其机制仍是知之甚少,一个重要的原因是缺乏一个简单方便的可重复的肝再生动物模型。2014年JIANG等[3]利用整个肝脏组织去细胞制备成去细胞支架。此后又有多个研究小组报道运用各种去细胞方式制备去细胞支架[4],但目前仍未有简单可重复的肝脏再生模型。本研究旨在探究新型大鼠肝脏再生模型,为肝脏再生及肝脏移植的研究奠定基础。
1 材料和方法
1.1 实验动物 雄性SD大鼠,体质量200~250 g,由温州医科大学实验动物中心提供,动物许可证号:SYXK(浙)2015-0009。普通饲料喂养,实验前禁食12 h。
1.2 主要试剂及仪器 DMEM培养液购自美国Sigma公司,胰蛋白酶消化液、Triton X-100、Percoll分离液、IV胶原酶、内皮素-1(endothelin-1,ET-1)一抗、ET-1二抗、DAPI染液、肝细胞细胞角蛋白18(cytokeratin 18,CK-18)一抗、CK-18二抗、DAB显色试剂盒购自北京Solarbio公司,倒置荧光显微镜购自广州明美光电有限公司,密度梯度离心机购自长沙英泰仪器有限公司。
1.3 方法
1.3.1 肝细胞分离:取SD大鼠,用75%乙醇浸泡消毒5 min后,在无菌条件下取出肝脏,剪碎,并用Hanks液反复清洗3次后,用0.1%的IV型胶原酶消化30 min,此后用3倍体积的完全培养基终止消化,最后将组织悬液经100目钢网过滤,然后反复洗涤残渣,收集滤液。滤液用50×g离心2 min,上清富含非实质细胞,而沉淀则富含肝细胞。收集沉淀,用DMEM+20% FBS+双抗培养基将细胞进行重悬铺板后继续培养48 h。
1.3.2 肝窦内皮细胞分离:将上述上清液进行100×g离心5 min,再次收集上清,用350×g离心10 min,取得沉淀后经洗涤后混悬于20 mL PBS中。在50 mL离心管内,每10 mL细胞悬液平铺在二层Percoll梯度的上层(底层是15 mL 50% Percoll,中间层是20 mL 25% Percoll),这样在50 mL离心管内从下至上形成50% Percoll、25% Percoll和细胞悬液3层梯度。用900×g离心20 min,吸取中间带混悬液约10 mL(在50% Percoll与25% Percoll之间),予PBS等量稀释后再经900×g离心10 min,保留沉淀。加入DMEM/F12+20% FBS+双抗培养液将细胞重悬形成肝窦内皮细胞悬液铺板后,置于37 ℃、5% CO2培养箱中继续培养48 h。
1.3.3 免疫荧光法检测肝窦内皮细胞表面ET-1的表达:分离出的肝窦内皮细胞用4%的多聚甲醛固定,加入5% BSA液封闭后,加入一抗ET-1(1:200),37 ℃孵育3 h后,加入Cy3(1:200)免疫荧光二抗,并随后用DAPI标记细胞核,然后在荧光显微镜下观察采集图像。
1.3.4 细胞免疫组织化学染色:分离出的肝细胞用4%的多聚甲醛固定,用0.5% Triton X-100(PBS配制)通透20 min;在培养皿加入新鲜配制的3%双氧水,去除内源性过氧化物酶封闭液,然后滴加足够量的稀释好的一抗:CK-18(1:600),此后滴加聚合HRP标记抗兔IgG二抗工作液,DAB显色5~10 min,在显微镜下掌握染色程度,经脱水、透明、封片后镜检。
1.3.5 肝细胞支架制备:选取正常状态良好的SD大鼠取肝脏,注意保护好肝脏的完整性;用0.9%氯化钠溶液反复冲洗,高浓度双抗液体(灭菌用水配制,青霉素及链霉素浓度分别为4 000 U/mL)浸润消毒10 min;从SD大鼠肝脏门静脉处插管,用PBS循环灌注肝脏标本2 h以冲出残留血液;之后用0.02%胰酶循环灌注2 h以消化肝脏组织;随后用Triton X-100循环灌注15 h清除残余的肝组织;最后依次用0.1%过氧乙酸灌洗消毒1 h,灭菌PBS灌洗1 h,制备成去细胞支架。之后行HE染色检查和扫描电镜检查鉴定肝细胞支架。
2 结果
2.1 肝细胞及肝窦内皮细胞数量形态 每个肝脏标本能成功分离出1×107个肝细胞,低倍镜下可见活细胞呈圆形,饱满,胞核清晰。肝窦内皮细胞培养扩增至1×106,大部分细胞光镜下为小圆形,大小均匀,2 h后开始贴壁,出现三角形或不规则形,随着时间延长,肝窦内皮细胞形态逐渐呈梭形,细胞边缘清楚,细胞核突起位于中央。
2.2 肝细胞免疫组织化学实验 肝细胞进行CK-18免疫组织化学鉴定,200倍显微镜下可见肝细胞胞浆内存在棕黄色颗粒,细胞核呈蓝紫色(见图1)。
2.3 肝窦内皮细胞荧光单染实验 肝窦内皮细胞经ET-l多抗间接免疫荧光法鉴定,90%的细胞荧光染色阳性;因此培养48 h的肝窦内皮细胞纯度可达90%左右。肝窦内皮细胞核经DAPI染色后在倒置免疫荧光显微镜下呈蓝色,见图2。
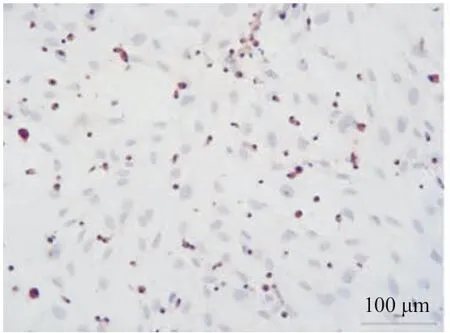
图1 肝细胞CK-18免疫组织化学染色结果
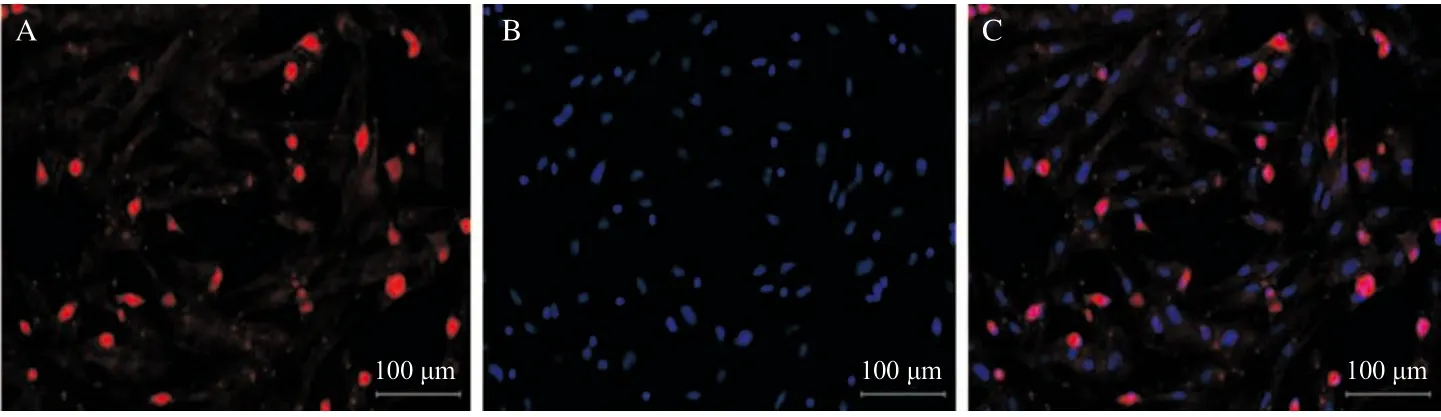
图2 肝窦内皮细胞免疫荧光染色结果
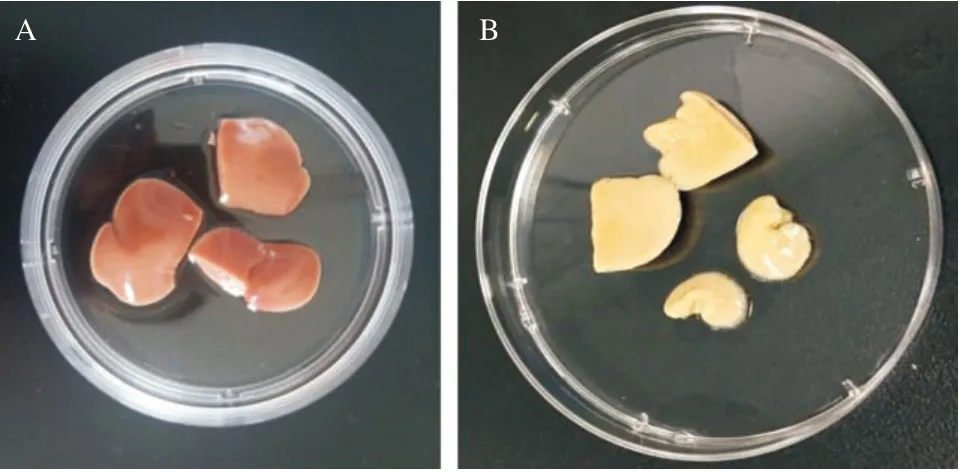
图3 排尽血液前后大鼠肝脏组织大体观
2.4 肝细胞支架制备及鉴定 SD大鼠肝组织标本呈暗红色(见图3A),经PBS灌注排尽血液后呈蜡黄色(见图3B),此后经0.02%胰酶灌注消化、3% Triton X-100循环灌注后,残留血液逐渐被冲净,细胞成分逐渐被脱除,大鼠肝脏标本逐渐趋于透明胶冻样(见图4A-B)。制备的大鼠肝脏去细胞基质呈无色透明,表面平整,肝脏包膜完整(见图4C)。HE染色显示肝脏去细胞支架呈蜂窝样孔隙结构,纤维样细胞外基质保留,未见细胞核及细胞质成分残留(见图5)。扫描电镜证实肝组织去细胞支架内仅存留多孔隙样细胞外基质结构,孔隙内原有占位的细胞成分被完全脱除,视野内尚可见较为完整的血管断面、中央静脉结构和门管三联结构(见图6)。
3 讨论
近年来,随着终末期慢性肝病患者及肝恶性肿瘤患者数量日益增多,肝移植技术的运用愈发广泛,而短缺的肝脏供体问题愈发突出[5]。为解决肝源紧缺问题,“人造肝”成为近年来的研究热点。其中天然的组织器官去细胞支架制备而成的“人造肝”具有完整脉管系统和天然的细胞外基质[6],并且能够高度模拟细胞自然生长的微环境,为细胞生长提供氧气和养分,可以保证定植细胞发挥效能。肝脏去细胞基质从生理、生化和几何角度等方面都更接近肝脏细胞自然生长环境[7],提高肝脏细胞重新植入肝细胞支架后存活的成功率。本研究利用SD大鼠的肝脏标本经Triton X-100循环灌注成功制备了符合标准的肝组织去细胞支架,未见明显细胞核,并保留了完整的血管网络系统。扫描电镜检查证实在有效去除细胞的同时,保留原有肝脏的细胞外基质的组成和脉管结构。并且制备成的支架具有良好的孔径和孔隙率,这有利于受体细胞的浸润和植入,有利于后续肝细胞植入、再生方面实验研究的开展[8]。
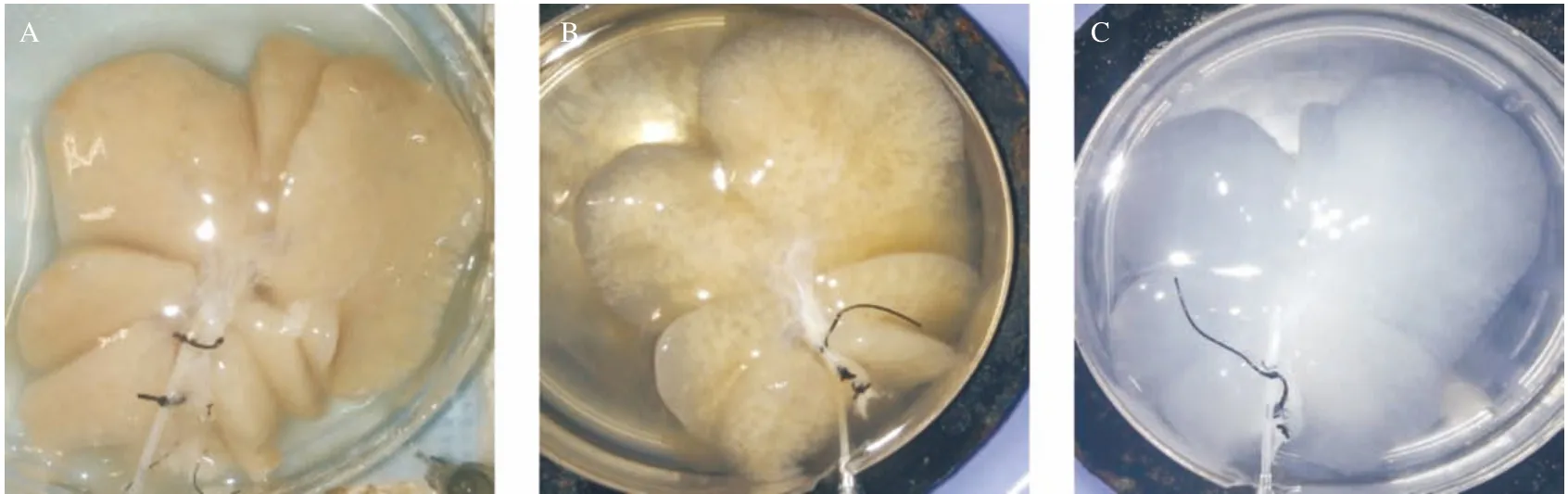
图4 肝细胞灌注过程
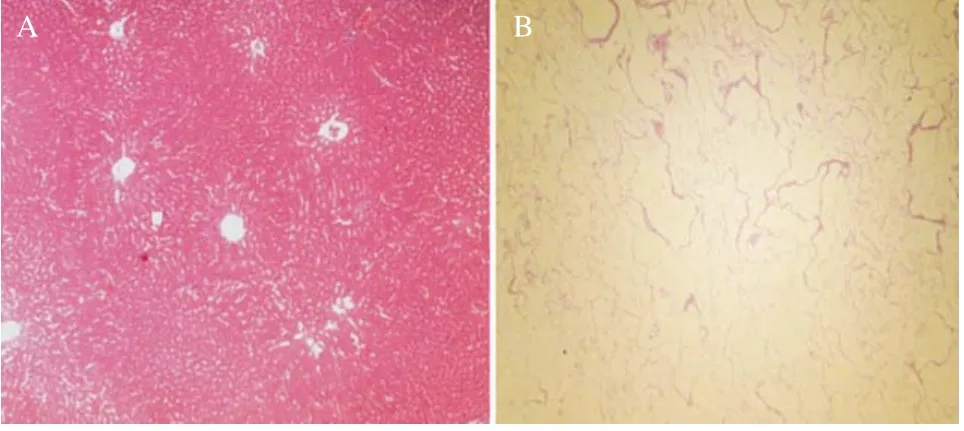
图5 正常肝脏组织和肝脏去细胞支架HE染色结果(×100)
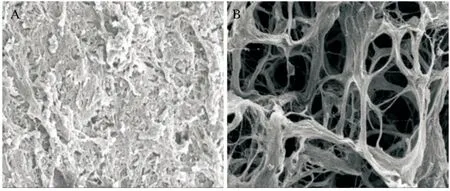
图6 正常肝脏组织和肝脏去细胞支架扫描电镜观查结果
肝细胞和肝窦内皮细胞在肝脏病理生理及器官移植中的作用已引起人们重视[8],获得高纯度和活力的肝窦内皮细胞和肝细胞是进行细胞重新植入去细胞支架再生形成“人工肝”的基础[9]。本研究在分离培养的过程中,多次调整分离原代肝细胞和肝窦内皮细胞方法[10],总结出一套较为稳定且分离纯度较高的肝细胞和肝窦内皮细胞的分离方法[11]。通过摸索与实验我们发现,大鼠肝细胞和肝窦内皮细胞的成功分离与以下因素密切相关:①选择合适的胶原酶消化肝组织。胶原酶IV主要针对肝脏组织中的胶原成分及纤维组织有消化分解作用,而对上皮细胞的影响不大。可以利用此特性分离提纯肝细胞[12]。②消化酶的浓度一般以0.1%~0.15%为宜,消化酶的浓度过高会破坏肝细胞膜,浓度过低则会使对肝脏消化不彻底,均会使分离下来的肝细胞成活率低。③采用低速离心(50×g)分离法既可将肝实质细胞与非实质细胞分离开,又可减少对肝脏细胞的损害[13],提高分离出的肝脏细胞的存活率。④选择含有多种因子的培养液,并且加入足够的血清及营养[14],保证实验期间肝细胞和肝窦内皮细胞的稳定及较高的存活率。⑤在肝窦内皮细胞分离培养的过程中,分离出的肝窦内皮细胞纯度主要取决于Percoll密度梯度离心是否彻底。选择合适的离心机及合适的离心转数显得尤为重要[15]。⑥梯度离心时可以将离心机调节为慢刹车状态,这样更有助于形成梯度离心后的悬浮细胞层。
总之,本研究成功分离出了肝细胞以及肝窦内皮细胞,并成功制备了肝脏去细胞支架,为下一步的肝细胞和肝窦内皮细胞的植入及肝再生鉴定了基础。希望给后续以临床为导向的肝脏组织工程研究提供参考。

