东极岛养殖区内分泌干扰物污染状况调查
赵泓睿 赵晟

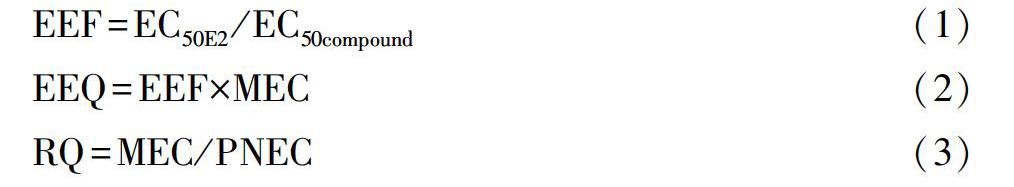

摘要 [目的]在舟山东极岛养殖区检测海水和水生动物中的内分泌干扰物(EDCs)含量,对该地区EDCs的生态风险进行初步评价,为管控与治理提供参考,扩展东极岛养殖区EDCs的基础数据。[方法]在舟山东极岛养殖区采集3个点位的水生生物样品及海水样品,测定雌酮(E1)、雌二醇(E2)、雌三醇(E3)、双酚A(BPA)、壬基酚(4-NP)、六氯环己烷(HCHs)和滴滴涕(DDTs)浓度。[结果]海水和水生动物样品中均未检出BPA、HCHs与DDTs。在海水水样中,雌激素E1、E2、E3未检出,4-NP浓度为2.94~6.70 ng/L。生物样品中,E1、E2、E3浓度为0.24~9.36 ng/g;4-NP在厚壳贻贝中含量为104.40 ng/g,在近江牡蛎中的含量为 11.86 ng/g。[结论]EDCs对东极岛养殖区已经造成一定影响,E3的最大风险熵大于1,表明已对该地养殖海域生态环境造成威胁,需进行定期监控以防止危害扩大。
关键词 内分泌干扰物;环境雌激素;污染分布;养殖区
中图分类号 X714文献标识码 A
文章编号 0517-6611(2019)17-0074-04
Abstract [Objective]The content of endocrinedisrupting compounds(EDCs) in seawater and aquatic animals was investigated in Zhoushan, Dongji Island. The ecological risk of EDCs in this area was evaluated, which provide reference for control and governance, and expand the basic data of EDCs of Dongji Island aquaculture area.[Method]A total of 3 sites were selected as study sites in the aquaculture area of Dongji Island, the samples included seawater and aquatic animals. The pool of EDCs analyzed in the present study included natural steroids (E1, E2, E3),estrogenic phenolic chemicals (BPA, NP), and organochlorine pesticides(HCHs,DDTs). [Result]Bisphenol A (BPA) and organochlorine pesticides were not detected in all samples collected from seawater and aquatic animals. The compound 4nonylphenol (4NP) was detected in seawater (2.94-6.70 ng/L) and animals (Mytilus coruscus, 104.40 ng/g; Ostrea rivularis Gould, 11.86 ng/g). Natural steroids were detected in aquatic animals (0.24-9.36 ng/g). [Conclusion]The values of RQE3 exceeds 1, showing that the concentration has a potential risk for health and ecological environment and needed to be monitored regularly to prevent the pollution situation from getting worse.
Key words Endocrinedisrupting compounds;Environmental estrogen;Pollution distribution;Aquaculture area
內分泌干扰物(EDCs)是一类外源性物质,包括一些广泛使用的工业化合物,它们以各种方式干扰生物内分泌,影响天然激素合成、代谢、降解等过程,从而影响生物体稳定性和正常的生长发育[1],又称环境雌激素(EEs),主要有天然雌激素、雌激素酚类化合物和有机氯农药等。EDCs是水生动物的污染源之一,在人口快速增长、工业化和城市化进程中,EDCs的产量和消费量迅速增加,排放到海洋的废弃物也在迅速增加。EDCs广泛分布在许多日常产品中,已有超过200种化学品被认为是EDCs,其来源广泛,有食品,药妆品,各种常见杀虫剂,各类塑料制品等。尽管EDCs是存在于水环境中且浓度极低的伪持久性化学物质,但它可以干扰内分泌系统并诱导生殖系统异常,甚至导致癌症。EDCs可通过基因组或非基因组信号转导途径,激活或抑制内源性雌激素活性,从而产生干扰其正常生理功能的抗/类雌激素作用,是持久性污染物,且难以生物降解。在纳克级别就可导致动物的内分泌紊乱和雌化趋势。EDCs可以通过海鲜生物富集,进而引起人类健康问题[2-3]。
舟山群岛位于浙江省东北部水域和长江三角洲东南部,拥有我国最大的渔场——舟山渔场,被称为“中国渔业之都”。海洋水产养殖是解决人类对水产品不断增长的需求与海洋生物资源困乏之间尖锐矛盾的重要途径[4]。近年来舟山近海养殖业蓬勃发展,EDCs对生态环境、海洋生物以及人类健康的负面影响直接威胁到水产养殖产业的发展并引发水产品食物安全问题,影响了海洋渔业资源的可持续利用。研究舟山东极岛地区水体及主要海产品中的EDCs污染情况对于评估舟山渔场生态环境、推动海洋生物多样性保护、海洋渔业资源可持续利用具有重要意义。目前已有少量研究表明舟山渔场海域内的海产品以及海岛地区土壤受到不同程度的有机氯农药污染,但尚未形成持续监测,时间跨度较长,且该地区水体内其他代表性内分泌干扰物的含量状况仍少有报道[5]。以东极庙子湖岛和青浜岛周边养殖区海水和海洋生物为研究对象,选择3个养殖区研究点,检测并对比海水和水生动物的EDCs含量,并探讨其来源与污染状况,进一步对该地区EDCs的生态风险进行初步评价,为管控与治理提供参考,并扩展东极岛养殖区EDCs的基础数据。
1 材料与方法
1.1 样品采集
2018年2—3月,在舟山市東极岛庙子湖岛和青浜岛的养殖区采集3个生物样品和3个相应水样,采样点位见图1。采样点A(30°11′15.34″N、122°41′0.64″E)设置在庙子湖岛码头西南侧养殖区,采集的样品为厚壳贻贝和底层海水水样1;采样点B(30°12′5.82″N、122°41′51.99″E)位于青浜岛西侧,采集的样品为近江牡蛎和表层海水水样2;采样点C(30°11′53.03″N、122°41′54.98″E)设置于青浜岛西侧,采集的样品为大黄鱼和中层海水水样3。将生物样品放于PE聚乙烯密实袋中并-4 ℃冷冻,用表层采水器采集1 m左右的海水1 000 mL,并使用棕色玻璃瓶密封保存。所有样品均在采样后尽快运回实验室测定。
1.2 仪器和材料
Agilent 1200(美国),SHISEIDO SP-TSQ Quantum Ultra(日本),Agilent 7890A(美国),双酚A(A chemtek inc,100 μg/mL,BPA),壬基酚(4-NP Dr.99.6%,Ehrenstorfer),雌酮(E1,98%,CNW),雌二醇(E2,95.4%,Dr.Ehrenstorfer),雌三醇(E3,97.9%,Dr.Ehrenstorfer),α-666(100 μg/mL,AEPI),β-666(100 μg/mL,AEPI),γ-666(100 μg/mL,AEPI),δ-666(100 μg/mL,AEPI),o,p-DDT(100 μg/mL,AEPI),p,p-DDT(100 μg/mL,LGC),o,p-DDE(100 μg/mL,AEPI),p,p-DDE(100 μg/mL,AEPI),o,p-DDD(100 μg/mL,AEPI),p,p-DDD(100 μg/mL,AEPI)。CNW色谱纯:甲醇、甲基氰、氯仿、醋酸乙酯、六氢化苯;国药分析纯:氯化钠、氨水。
1.3 样品分析
1.3.1 E1、E2、E3测定。
E1、E2、E3的生物样品处理和测定方法参照农业行业标准NY/T 918—2004,并略有修改。
称取约10 g海水样品,置于50 mL离心管中,精确加入10 mL氯仿进行萃取,静置分层后,取5 mL氯仿层旋转干燥,用1 mL甲醇复溶,过0.22 μm滤膜,然后上机分析。仪器:HPLC,进样量10 μL。色谱柱:Agilent C18(4.6 mm×250 mm×5 μm),柱温25 ℃,波长254 nm,流动相为50%乙腈∶50%水,流速0.8 mL/min。
1.3.2 BPA和4-NP测定。
称取10 g样品,在25 mL比色管中加入10 mL乙酸乙酯∶环己烷(1∶1,体积比),均匀涡旋,超声提取15 min,4 ℃3 000 r/ min离心15 min,取上清液用于氮吹管中,在45 ℃水浴中氮吹干,加入2 mL 0.1%氨∶甲醇(1∶1,体积比)定容,在-18 ℃下冷冻12 h,3 000 r/min离心5 min,将上清液直接倒入进样瓶中进行液质分析。色谱柱:SHISEIDO,C18,2.1 mm×150 mm×5 μm,柱温35 ℃,流速0.3 mL/min,进样量为10 μL,流动相A:0.1%氨水,B:甲醇。质谱条件:离子源,电喷雾电离ESI(-);干燥气温度350 ℃;干燥气流速14 L/min;雾化气压137.9 kPa,毛细管电压4 000 V。
1.3.3 滴滴涕(DDTs)与六氯环己烷(HCHs)测定。
DDTs与HCHs的样品处理和测定方法参照农业行业标准NY/T 761—2008。
1.4 EEQ和RQ计算
雌二醇当量浓度(EEQ)由雌二醇当量因子(EEF)和测量的环境物质浓度(MEC)计算,风险熵(RQ)广泛用于环境风险评估,计算主要基于欧盟的风险评估指南[Commission(EC)2003]。预测无影响浓度(PNEC),EC50等的毒性数据来自于美国环境保护局的ECOTOX数据库。
2 结果与分析
2.1 HCHs和DDTs的含量以及时间分布
HCHs和DDTs的浓度见表1,在所有点位的海水样本和生物样本中,HCHs与DDTs都未检出。从以往的研究来看,东极地区的有机氯农药含量在2月达到最低值,在11月左右达到一年的最高值,该研究时间处于2月中旬至3月中旬,全部未检出的结果与以往研究基本相符,2—3月的东极岛养殖区有机氯污染物含量符合《海水水质标准》(GB 3097—1997),对当地环境没有威胁。有机氯农药作为持久性有机污染物,在历史上曾被滥用,至今仍广泛存在于环境中。2月含量最低主要是由于冬季寒冷,西北风使得日本暖流无法轻易到达东极,另外,冬季属于枯水时期,杭州湾地区、长三角地区以及舟山本岛的地表径流只能输入有限的污染物,因此这些主要污染源输入的HCHs和DDTs较少。而当天气回暖,日本暖流逐渐进入东极养殖区,杭州湾、长三角以及舟山本岛的陆地径流也开始增加,HCHs和DDTs含量将开始增加。到了夏季,有机氯农药等污染物浓度受到丰水期和暖流以及长三角、杭州湾、宁波等地区地表径流的多重影响,不会达到最高点,甚至会出现更低的情况[5]。进入秋冬季后,随着气温的降低,黄海中央水团限制了HCHs和DDTs污染物的扩散,而日本暖流仍然进入了东极水产养殖区域,此期间(10—11月)处于平水期,地表径流的稀释作用有限,将会携带大量的HCHs和DDTs污染物,因而HCHs和DDTs将会在11月左右到达年度最峰值[6]。后续将在6—8、11月设置采样点并采样,以持续监测东极海域HCHs和DDTs的污染程度。
2.2 E1、E2和E3的含量
E1、E2和E3的含量如表1所示,海水水樣中的雌激素均未检出,在生物样品中,E1、E2、E3的含量为0.24~9.36 ng/g,平均含量为3.62 ng/g,其中厚壳贻贝体内E1、E2、E3的浓度为5.32~9.36 ng/g,大黄鱼体内E1、E2、E3的浓度0.24~2.88 ng/g,检出率高达100%,E1、E2和E3在东极养殖区普遍存在,在厚壳贻贝中含量最高。E1、E2、E3是疏水性化合物,在被沉积物吸附后,会对底栖生物生存环境造成影响,这也可能是厚壳贻贝雌激素含量高于大黄鱼的原因,且RQE3超过1,表明类固醇类EDCs已经造成一定安全风险[7-8]。可能的原因是东极位于杭州湾、长江三角洲地区附近,人类活动频繁。舟山、东极岛旅游业较为发达,旅游旺季时东极岛生活废水排放量较大,旅客对环境的干扰也是东极海域雌激素检出率高的重要原因,东极岛缺乏废弃物处理措施、处理能力较差,生活废水、塑料等垃圾不可避免地排入水体。环境温度导致污染物排放差异大,同时也造成污染程度的差异化[9]。国内外其他河流、湖泊、河口、近海海域和口岸等均存在一定的雌激素污染,污染源主要来自沿岸河口排污和支流污染汇入。在我国沿海地区广泛检测到EDCs,平均为263.4 ng/g,包括大连、青岛、上海、汕头和深圳,我国许多重要沿海水域的环境雌激素污染严重,严重影响了当地生态安全[10]。研究采样时间2—3月,是东极旅游淡季。东极常住人口和流动人口相对较少,人口密度相对较低。同时,虽然东极养殖区相对远离舟山市本岛和大陆工业区,但东极岛养殖海域的E3含量仍维持在威胁生态环境的水平,相关部门应该重视,进一步增加监测点和监测频率。
2.3 BPA和4-NP的含量
BPA和4-NP的含量见表1,BPA在海水和生物样品中全部未检出。壬基酚4-NP除了在大黄鱼体内未检出,在其他海水水样和生物样品中都检测到。在生物样品中,采样点A位置的厚壳贻贝中4-NP含量为104.4 ng/g,近江牡蛎中4-NP含量为11.86 ng/g,海水水样中4-NP浓度为2.94~6.70 ng/L,在海水水样中的检出率为100%。根据美国环境保护局的4-NP环境水质标准,东极养殖区的4-NP浓度比海水中慢性毒性的浓度标准1.7 μg/L要低很多,根据先前的研究,长江口的表层水4-NP浓度最高为173.09 ng/L,因而该地区4-NP浓度与江浙地区河口、海域的以往研究相符[7]。据报道,胶州湾某河流表层水的4-NP浓度最高达28 600 ng/L,国内黄河、海河流域的4-NP污染情况严峻[11],并且其浓度与季节变化相关,环境温度越高,4-NP与BPA的浓度也越高,而该研究采样在温度较低的情况下4-NP仍在表层海水和底栖生物中有着100%的检出率,且在养殖区厚壳贻贝体内的浓度最高,说明4-NP对底栖生物已造成一定的潜在威胁,应继续监测其在水生动植物体内的含量,而BPA在夏秋季高温季节的浓度也需要持续检测。同时采样点A的位置靠近庙子湖码头,考虑附近旅游景点多,餐饮业发达、宾馆众多,餐饮废水、洗涤废水、废物排放也最为密集且大部分直接排入海中,环境承载力较低,也会对采样点A的牡蛎体内4-NP浓度有一定影响[12]。在东极岛夏秋季旅游旺季时应对4-NP浓度进行持续且密集监测,同时政府应对东极废物处理措施加以优化和完善,以防止其影响人类健康和威胁当地旅游业、水产养殖业的发展。另有研究报道,经过污水厂处理和生物降解,以及活性污泥吸附等联合作用,去除后的4-NP浓度相对较低。而东极地区地处偏远且面积较小,岛上没有污水处理厂,生产生活排放的固体废弃物主要由政府收集并进行焚烧处理,且仍旧缺乏合理的污水等其他废弃物的处理措施,更应警惕4-NP的潜在威胁[13]。
2.4 东极地区海水和水生动物EDCs生态风险分析
海水和水生动物的EEQNP和RQNP均小于1,表明对生态系统潜在威胁较小。厚壳贻贝的EEQE2超过1,但RQ小于1,表明E2含量尚不足以对水生动植物直接造成影响,但潜在的风险仍需警惕[14]。而EEQE3和RQE3超过1,表明E3的污染程度已威胁到该地区的生态系统,已经影响到水生动物和植物的生长,如不加以管控,将严重影响人类健康。
3 结论
通过对舟山东极岛养殖海域的调查可以看出,该地受到了一定的EDCs污染,其中E1、E2、E3、BPA、4-NP、HCHs和DDTs处于相对安全水平,但E3浓度存在一定的生态风险,RQE3值大于1,需要定期监测,并引起政府重视。同时,东极海域潜在的EDCs污染源包括周边的内陆径流、周边城市工业农业废水、东极本岛污水等其他污染源,应加强适当的废弃物处理措施。同时EDCs浓度差异取决于温度、人类活动和径流,仍需持续监测。该研究结果将扩展我国东海岸地区现有的EDCs污染数据,为建立有效的环境雌激素生态风险评价和管控提供基础数据。
参考文献
[1] KAVLOCK R J,DASTON G P,DEROSA C,et al.Research needs for the risk assessment of health and environmental effects of endocrine disruptors:A report of the U.S.EPAsponsored workshop[J].Environmental health perspectives,1996,104(S4):715-740.
[2] CAMPBELL C G,BORGLIN S E,GREEN F B,et al.Biologically directed environmental monitoring,fate,and transport of estrogenic endocrine disrupting compounds in water:A review[J].Chemosphere,2006,65(8):1265-1280.

