不同产区紫苏种子发芽过程酶活力的研究
王菲 崔新爽 李晓雪 杨逢建

摘 要:为了比较分析不同产区紫苏种子发芽过程中生化指标的活力,本研究根据我国最新行政区划分的7大区域,选择7个产区的紫苏种子,将其在培养箱内进行发芽,采用可见光比色和碱性滴定等方法测定种子发芽过程中的淀粉酶、蛋白酶、糖化酶以及脂肪酶的活力。结果显示,各产区之间脂肪酶活力均在15~17 u/g之间;河南产区的紫苏种子在发芽过程中酶活力均高于其他产区,淀粉酶活力在31.37 mg/(g·min),脂肪酶活力达到17 u/g,蛋白酶活力在180.96 u/g,而糖化酶活力最高的是甘肃和云南,均达到17.40 u/ml。本研究结果可为不同产区的紫苏种子发芽过程中分析比较生化指标的活力提供一定的理论依据。
关键词:产区;紫苏种子;发芽;酶活力
中图分类号:S567.219 文献标识码:A 文章编号:1006-8023(2019)05-0022-05
Abstract:In order to compare and analyze the activity of biochemical indexes in the germination process of perilla seeds from different producing areas, this study selected perilla seeds from seven producing areas according to the seven major regions divided by the latest administrative regions of our country, germinated them in an incubator, and determined the activity of amylase, protease, glucoamylase and lipase in the seed germination process by visible light colorimetric method and alkaline titration method. The results showed that the lipase activity was between 15-17u/g in all production areas. The activities of perilla seeds in Henan production areas were higher than those in other production areas during germination, amylase activity was 31.37mg/(gomin), lipase activity was17u/g, protease activity was 180.96u/g, while glucoamylase activity was highest in Gansu and Yunnan, both reaching 17.40 u/ml. The results of this study can provide some theoretical basis for analyzing and comparing the vitality of biochemical indexes in the germination process of Perilla friescens seed from different producing areas.
Keywords:Production areas; perilla seed; germination; enzyme activity
0 引言
紫蘇(Perilla frutescens)又名苏子、红苏、赤苏和引子等,紫苏为唇形科,即使在生存条件较严苛的情况下都可以生长良好[1],紫苏是我国卫生部第一批公布的既是60种药品中之一同时又可作为食品的植物[2]。目前,在世界均有着显著性的商业化栽植[3],所以有着栽培历史悠久、种质资源丰富的特点[4],其种子品质除了主要受遗传基因的控制,还受环境因子的影响[5],并且已有3000多年的长久历史[6]。近些年来,随着人们对紫苏更深入的认识,研究热点已成为紫苏所含的活性物质和营养成分的开发利用[7],紫苏因为有一定的抑制血栓形成、美容、防治冠心病以及营养价值,所以人们对其开发利用研究越来越重视[8]。前人对紫苏籽粒研究的方面主要集中于其油用价值[9-11],但是对于紫苏籽粒中其他的营养成分的研究鲜有报道[12],尤其是对于紫苏籽发芽过程中营养成分和生化指标的研究鲜有报道。
第一个参与脂肪分解代谢反应的就是脂肪酶,它可以催化水解天然油脂,是一种特殊性的酯键水解酶[13],在脂肪的转化速率起着调控的作用,从而导致脂肪水解反应发生[14]。淀粉酶属于水解酶类,因此可以水解糖原和淀粉等各种酶,并且是催化糖原和糊精中糖苷键等一类酶的总称。曾有报道指出,在种子萌发过程中,蛋白酶的活力要先于其他的酶类,并且在发芽的过程中会明显提高[15]。糖化酶的全称是葡萄糖淀粉酶,它可以水解生成淀粉酶或者是一些低聚糖,而且是一种单链酸性的糖苷水解酶,同时具有淀粉外切酶活性。本研究主要是以紫苏种子为实验原料,对不同产区的紫苏种子发芽过程中酶的活性进行比较分析,为进一步研究开发利用紫苏种子以及对其优质品种的筛选提供可靠的理论基础。
1 材料与方法
1.1 实验材料
根据中国7大地理分区,以东北地区的黑龙江、西北地区的甘肃、华中地区的河南、华东地区的安徽、西南地区的云南、华南地区的广东和华北地区的河北等7个地区的紫苏种子作为实验材料。
1.2 仪器与设备
TB-215D型电子天平;北京中仪汇丰科技有限公司;TGL-20M台式高速冷冻离心机;上海卢湘仪离心机仪器有限公司;恒温水浴锅;旋转蒸发仪等。
1.3 实验方法
1.3.1种子发芽
选择大小均匀,外观完整且无病虫害的紫苏种子作为实验材料。将种子清洗干净,浸泡4 h后,置于铺有3层滤纸的培养皿中,放于培养箱中,温度在25~30 ℃,湿度不低于15%即可,滤纸每天保持湿润,以第一颗种子发芽的时间开始计时为第一天。
1.3.2 淀粉酶活力测定
准确称取1 g发芽且已去皮的种子,加4 ml蒸馏水和少许石英砂,于冰浴中研磨至匀浆,然后转移到15 ml的离心管中,再用6 ml蒸馏水洗涤研钵一并倒入离心管中,摇匀于25 ℃室温放置15~20 min,在0~4 ℃、10 000 r/min下离心30 min,用吸管取上清液,作为酶提取液备用。
(1)α-淀粉酶活性的测定
取3支试管,其中2支为测定管,1支为对照管,然后每支试管内加1 ml酶提取液,于79 ℃恒温水浴中加热15 min,取出迅速冷却,在每支试管内加入1 ml pH为5.6的柠檬酸缓冲液,为了钝化酶的活性,在对照管中加入3,5一二硝基水杨酸试剂2 ml,然后将3支试管放在40 ℃水浴中保温10 min,再向每支试管加入1 ml在40 ℃下预热1 %的淀粉溶液,摇匀立即于40 ℃水浴中保温5 min,取出后迅速向测定管内加入3,5一二硝基水杨酸试剂2 ml。最后将3支试管放在沸水浴中煮沸5 min,冷却后加10 ml蒸馏水,摇匀后立刻在540 nm波长下比色,测定吸光值。
(2)α+β-淀粉酶活性的测定
同样取3支试管,标明2支为测定管,1支为对照管,然后向每支试管加1 ml酶提取液,在对照管中加入3,5一二硝基水杨酸试剂2 ml,从而钝化酶的活性。将3支试管放在40 ℃恒温水浴中保温10 min后加入预热(40 ℃)的淀粉溶液1 ml,摇匀,迅速放入40 ℃水浴中准确保温5 min,取出后向测定管加入3,5一二硝基水杨酸试剂2 ml,摇匀后在沸水浴中煮沸5 min,迅速冷却,然后在每支试管内加入10 ml蒸馏水,摇匀在540 nm波长下比色,测定吸光值。
(3)计算:
α-淀粉酶活性=C×VTW×VS×t[mg/(g·min)]。
α+β-淀粉酶活性=C×VTW×VS×t[mg/(g·min)]。
式中:C为α-淀粉酶水解淀粉生成的麦芽糖(在标准曲线上查的值),mg;C为α+β-淀粉酶水解淀粉生成的麦芽糖(在标准曲线上查的值),mg;W为样品重量, g;VT为淀粉酶原液的总体积, ml;VS为反应所用淀粉酶原液体积, ml;T为反应时间, min。
1.3.3 脂肪酶活力测定
采用传统的橄榄油乳化法测定[16]。稱取1 g去皮的种子芽,加5 ml磷酸缓冲液(pH为7.5)于冰浴中研磨成匀浆,然后在12 000 r/min下离心10 min,用吸管将上面浮着的脂肪层除去,取上清液作为酶提取液备用。
取150 ml的三角瓶两只,其中一只为空白瓶(A)另一只为样品瓶(B),然后各加入4 ml PVA橄榄油乳化液和5 ml 0.025 mol/L磷酸缓冲液(pH7.5),再向A瓶中加入15 ml的95%乙醇,将两只三角瓶放在40 ℃水浴中保温5 min后各加入1 ml酶提取液,立即计时,15 min后取出,向B瓶中加15 ml的95%乙醇,然后加入2滴酚酞指示剂,用0.05 mol/L 氢氧化钠标准溶液滴定至微红色为止。脂肪酶活力计算公式:
酶活力(U)= 氢氧化钠消耗量(ml)反应时间(min)×M×N(1)。
式中:M为1 m L 氢氧化钠标准液所含的微克分子数;N为稀释倍数。
1.3.4 糖化酶活力测定
准确称取去皮后的种子芽1 g,加乙酸缓冲液于研钵中研磨至匀浆,倒入并定容在50 ml的容量瓶,摇匀后用4层纱布过滤,滤液作为酶提取液备用。
取两支比色管,其中一支为样品管(B),另一支为空白管(A),然后向两支试管中25 ml可溶性淀粉溶液和5 ml缓冲液,摇匀,置于40 ℃水浴中加热5 min,向B管中加2 ml酶液,摇匀后立即在此温度下反应30 min,每支试管加入0.2 ml氢氧化钠溶液,取出迅速冷却,再向A管中加2 ml酶液,样品管与空白管各取5ml置于两个碘量瓶中,然后分别加入10 ml碘溶液和15 ml氢氧化钠溶液,摇匀,加盖,在暗处反应15 min后加2 ml硫酸溶液,立刻用硫代硫酸钠溶液滴定,蓝色消失为终点。
计算公式:
X=(A-B)c×90.05×32.2/5×1/2×n×2=579.9×(A-B)c×n。
式中:X为样品酶活力,u/ml;A为空白消耗硫代硫酸钠溶液的体积,ml;B为样品消耗硫代硫酸钠溶液的体积,ml ;c为硫代硫酸钠溶液的浓度;90.05为与1 ml硫代硫酸钠标准溶液(1 mol/L),相当的以克表示的葡萄糖的质量;32.2为反应液的总体积 ;5为吸取反应液的体积 ;1/2为吸取酶液2 ml,换算为1ml;n为稀释倍数;2为反应30 min,换算为1 h的酶活力系数所得的结果表示至整数。
1.3.5 蛋白酶活力测定
称取发芽并且已去皮的种子2 g,加入已4 ℃预冷pH 8.2的三羟甲基氨基甲烷-盐酸5 ml,在10 000 r/min、4 ℃离心15 min,吸取上清液作为酶提取液。
两支试管,一支为调零对照,另一支为样品,各加2 ml酶液,30%乙酸1 ml,再向样品试管中加入0.4 mg/ml Na-苯甲酰-DL-精氨酸-4-硝基苯胺盐酸盐(BAPNA)3 ml(提前在37 ℃水浴中预热),在37 ℃恒温水浴中反应1h后在对照管内加入0.4 mg/ml BAPNA 3 ml,在410 nm波长下进行比色,测定吸光度值。
总蛋酶活性(U/(g·h))=(ΔA410×VT)/
(0.01×Fw×VS×t)
式中:ΔA410为410 nm 处吸光度值的变化 ;VT为提取液总体积,mL;Fw为称取马铃薯样品质量,g;VS为测定时取用酶液体积,mL;t为反应时间,h。
1.4 数据处理
用Excel2010对数据进行计算和绘图,采用林肯方法进行显著性差异分析(p<0.05)。
2 结果与分析
2.1淀粉酶活力分析
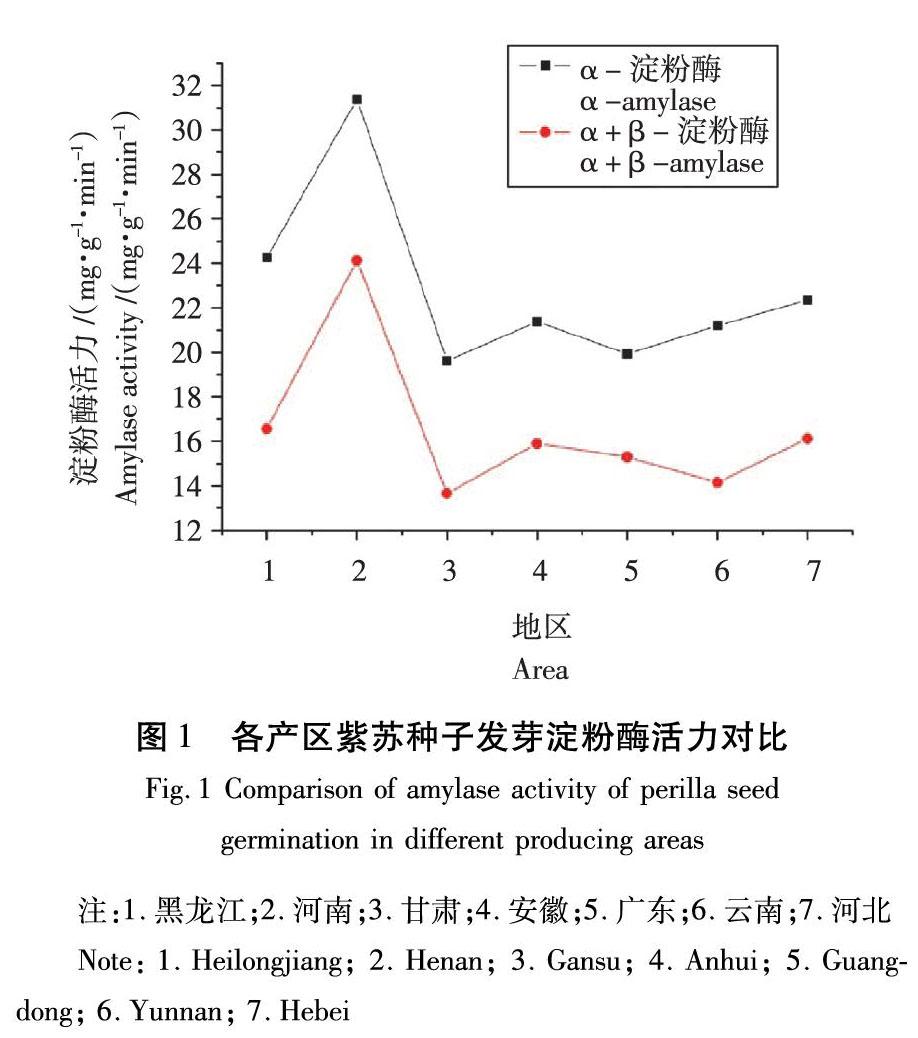
由图1可知,不同产区紫苏种子芽所含的α-淀粉酶和α+β-淀粉酶存在极显著差异性,P=0.008。河南达到最高,分别为31.37 mg/(g·min)和24.13 mg/(g·min),其次是黑龍江地区,分别是24.26 mg/(g·min)和16.56mg/(g·min),活力最低的产区是甘肃,分别为19.62 mg/(g·min)和13.65 mg/(g·min)。安徽和云南产区的α-淀粉酶活力高低没有明显差异;安徽和广东产区的α+β-淀粉酶活力差别不明显。
2.2 脂肪酶活力分析
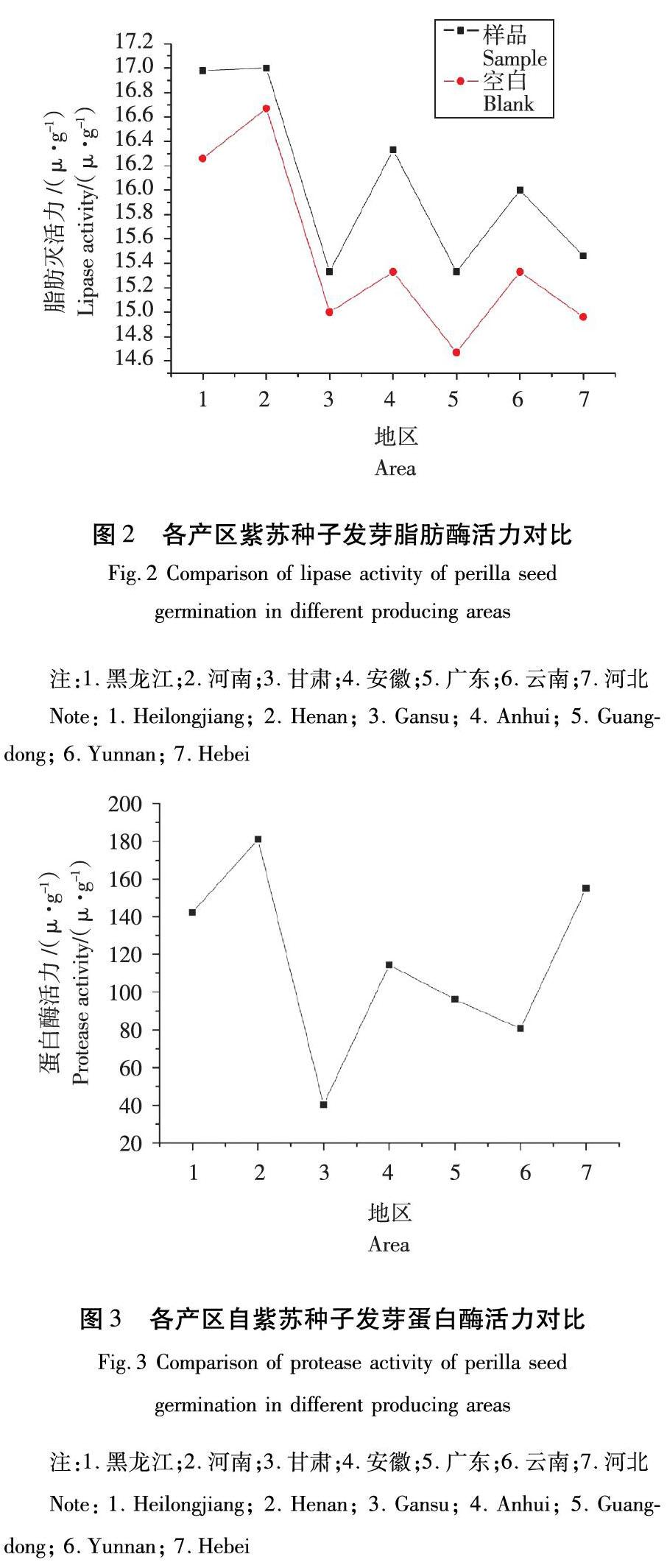
根据图2可知,河南产区紫苏种子芽脂肪酶活力最高,为17 u/g,黑龙江产区的达到17.67 u/g,仅次于河南,广东和甘肃产区的脂肪酶活力一样,均为15.33 u/g,云南和安徽产区差别不大。
从图2可看出,在样品瓶中后加入15 %的乙醇的做法的耗碱量要大于空白组,且酶活力也高于空白组,所以,在样品组内加入不含酶的缓冲液可以比较准确的提高酶活力,也增加了此方法的可信度。
2.3 蛋白酶活力分析
由图3可看出,7个地区间蛋白酶活差别明显。河南地区的紫苏种子芽蛋白酶活力显著高于其他产区,其酶活为180.96 u/g,其次是河北地区,为154.98 u/g,黑龙江产区的紫苏种子发芽过程中蛋白酶活力为142.25 u/g,活力最低的是甘肃,为40.31 u/g。
2.4 糖化酶活力分析
从图4可看出,各产区之间糖化酶活力无明显差别。安徽地区的紫苏种子发芽过程中糖化酶活力明显低于其他地区,为8.7 u/ml,甘肃和云南地区无差异,均为17.4 u/ml,广东与河南地区的酶活都为14.5 u/ml,而黑龙江与河北产区的酶活一样,均为11.6 u/ml。
3 讨论与结论
3.1 讨论
种子在开始萌发的时候,它本身的一些水解酶会被激活,在种子萌发的初期酶量会比较少,但酶量会随着发芽天数的增加而增长,因此,发芽时间越长,其活力也越强,所以就出现了不同的种子发芽天数,其酶活力的大小存在一定的差异[17],另外,酶活的测定比较容易受环境因素的影响[18-19],在不同环境测得的酶活可能会存在一定的差异。因为甘肃年平均气温在0~15 ℃,大部分地区比较干燥,将该产区的紫苏种子放在恒温25 ℃和湿度15%的培养箱内进行发芽,可能种子本身不能很好的适应从而导致发芽力低于其他地区,所以其酶活力较其他产区偏低。脂肪酶是种子萌发阶段的最主要的能量来源,它主要存在于油料种子中[20]。本研究发现,种子发芽速度与脂肪酶活力呈正相关。由于河南的湿润-半湿润季风气候,使该产区的种子能在一定条件下的培养箱内发芽良好,所以其酶活较其他产区高。
种子的来源、样品的处理、测定的时间和方法及在实验中的误差都会对测定结果造成一定的影响,而主要与种子样品来源的鉴定有关的就是它们之前的生长环境。因为本实验选择的是来自7个不同产区的紫苏种子,又因为本实验是将7个不同产区的紫苏种子同时放在相似的生长环境下进行发芽测定,由于各个产区的地理位置、气候环境等外界因素不一样,导致种子的发芽力不同,从而影响各产区紫苏种子在发芽过程中的酶活力。因此,不同产区的酶活会存在一定的差异,通过测定结果来看,发现种子的生长环境对各种酶活的测定有很大的影响。
3.2 结论
综上所述,本实验结果表明,河南产区的紫苏种子在发芽过程中,其各种酶活均高于其他产区;且本实验所采用测定方法的稳定性和准确度均符合样品的测定要求,为以后的种子生产服务奠定了良好的基础。
【参 考 文 献】
[1]张鑫,张志军,李会珍,等.紫苏叶中迷迭香酸的提取及测定[J].食品工业与科技.2009,41(11):235-237.
ZHANG X, ZHANG Z J, LI H Z, et al. Extraction and determination of rosmarinic acid in perilla leaves[J]. Food Industry and Technology, 2009, 41(11):235-237.
[2]国家药典委员会.中华人民共和国药典:一部[M].北京:人民卫生出版社,1990.
State Pharmacopoeia Commission. Pharmacopoeia of the Peoples Republic of China: Part I[M]. Beijing: Peoples Medical Publishing House, 1990.
[3]薛山.不同提取方法下紫苏叶精油成分组成及抗氧化功效研究[J].食品工业科技,2016,37(19):67-74.
XUE S. Study on composition and antioxidant effect of essential oil from perilla leaves under different extraction methods[J]. Science and Technology of Food Industry, 2016, 37(19):67-74.

