松材线虫Bx-ubc-3基因克隆及泛素通路鉴定
许佳瑶 陈俏丽 张瑞芝 李丹蕾
摘 要:泛素途径可以调节许多关键的细胞功能。为探究松材线虫中是否存在泛素途径以及泛素途径中的关键酶基因—泛素结合酶基因ubc3,构建松材线虫cDNA文库,并进行测序、ORF分析、同源性分析、系统发育树构建、蛋白相互作用预测和分子动力学模拟等工作。克隆到长度为957bp的Bx-ubc-3基因片段。随后的序列分析表明,其开放阅读框长度为738 bp,编码245个氨基酸;氨基6酸同源性分析结果表明,Bx-UBC-3与已知的泛素结合酶高度同源;蛋白互作和分子对接分析及分子动力学模拟结果表明,Bx-UBC-3的结合位点位于一个α螺旋、一个Loop1(L1)环与一个Loop2(L2)环;形成硫酯的Cys103位于L2上,构成催化裂隙;Bx-UBC-3和Bx-Rbx1之间以及Bx-UBC-3和Bx-泛素之间形成氢键。这些结果表明松材线虫中存在一条理论泛素通路,其中的关键酶Bx-UBC-3是开发高效抗线虫生物药剂的潜在靶标。
关键词:松材线虫;泛素结合酶3;E2;泛素途径
中图分类号:S763.11 文献标识码:A 文章编号:1006-8023(2019)05-0009-07
Abstract:The ubiquitin pathway is able to regulate many critical cellular functions. In order to explore the existence of the ubiquitin pathway and a key enzyme gene in ubiquitin pathway, ubiquitin-conjugating enzyme named as ubc3 in B. xylophilus, a cDNA library of B. xylophilus was constructed and sequenced, ORF analysis, homology analysis, phylogenetic tree construction, protein interaction prediction, docking and molecular dynamics simulation were carried out. The full-length cDNA generated by the nematode spliced leader method was 957 bp. Analysis of the Bx-ubc-3 cDNA sequence indicated that its open reading frame (ORF) was 783 bp and 245 amino acids were encoded. Comparison of the identified amino acid sequence with the current databases revealed extensive homology of Bx-ubc-3 to all known ubiquitin-conjugating enzymes. The modeling and prediction of protein interaction, docking and molecular dynamics simulations showed that the binding sites in Bx-ubc-3 were located in α helix, Loop 1 (L1) ring and Loop 2 (L2) ring. The thioester-forming Cys103, which was located in L2, constituted a catalytic cleft. The interfaces of Bx-ubc-3 to Bx-Rbx1 and Bx-ubc-3 to Bx-Ubiquitin were also supported by several obvious hydrogen bond interactions. Results show that there is a theoretic ubiquitin pathway in B. xylophilus, and support the notion that Bx-ubc-3 is a potential target for developing potent antinematodal drugs against B. xylophilus.
Keywords:Bursaphelenchus xylophilus; ubiquitin-conjugating enzyme 3; E2; ubiquitin pathway
0 引言
泛素化是一種重要的转录后修饰方式[1],控制着真核生物整个蛋白质组。泛素途径是由泛素激活酶(Ubiquitin-activating enzyme, E1)、泛素结合酶(Ubiquitin-conjugating enzyme, E2)和泛素连接酶(Ubiquitin-protein ligase, E3)介导的级联反应[2],是细胞内蛋白质选择性降解的重要途径。E2是泛素途径的关键酶,它与E1、E3通过蛋白间的相互作用使泛素与靶蛋白结合,形成一条多泛素链,从而使靶蛋白被26S蛋白酶体识别降解[3]。E2家族蛋白都有着相似的催化结构域,这些催化结构域都包含形成E2-泛素硫酯复合物的活性位点半胱氨酸(thioester-forming cysteine)。在对酵母的研究中,ubc-3(CDC34的同源基因)被证明是E2家族成员[4],编码Ⅲ类E2,负责细胞周期G1期的蛋白降解[5]。尽管已有研究表明E2在酵母等模式生物的细胞中起着重要作用[6],但是目前国内外对于植物寄生线虫中这类分子的研究仍然非常有限。
在模式生物秀丽线虫(Caenorhabditis elegans)中,E2家族的UBC-18与UBC-3共同参与对同一底物的泛素化。UBC-18率先给底物标记一个泛素分子,随后UBC-3负责在标记有一个泛素分子的底物上形成泛素链[1]。对秀丽线虫相关基因的抑制或敲除均可引起秀丽线虫不育或胚胎致死[7]。
松材线虫(Bursaphelenchus xylophilus)是松材线虫病的病原体[8],是一种对东亚松林危害极大的入侵生物,现入侵中国、日本和韩国等东亚国家及欧州国家葡萄牙与西班牙[9],对当地松林生态造成了严重破坏,对林业经济造成了巨大损失。松材线虫的胚胎发育和生命周期与秀丽线虫非常相似[10],因此假设泛素途径蛋白有可能是开发杀线药物的潜在靶点。
2011年公布的松材线虫基因组数据[11]使得对松材线虫泛素途径的研究更加容易。本研究克隆到松材线虫Bx-ubc-3基因,分析了可能参与控制Bx-UBC-3与泛素途径其他组分相互作用的区域并推测其功能,分析了泛素途径中关键要素Bx-UBC-3、E3和泛素形成的复合物的结构。分析该途径中的组分不仅有助于进一步理解其功能,建立一条理论的泛素通路,为后期的试验打下理论基础,还可以为今后的抗线虫药物的开发提供必要的思路。
1 材料与方法
1.1 线虫培养、cDNA合成与转录组测序
试验所用到的松材线虫分离自中国广东省患松材线虫病的马尾松(Pinus massoniana)。利用PDA培养基培养的灰葡萄孢菌进行线虫人工扩繁培养[12]。用M9缓冲液[13]洗脱松材线虫悬浮液100 μl(混合虫龄),用TRIzol试剂提取松材线虫总RNA,并利用DNA酶降解基因组DNA后构建cDNA文库[14]。将上述cDNA文库送华大基因生物公司测序。使用美国生物技术信息中心(NCBI)的在线BLASTN工具对测序结果进行鉴定。鉴定出ubc-3同源基因片段,命名为Bx-ubc-3。
1.2 基因克隆
用线虫SL法(method of nematode spliced leader)[15]从松材线虫的cDNA文库中扩增了松材线虫Bx-ubc-3基因序列的5端片段。在此基础上,以SL1(GGT-TAT-ATC CAA GTT TGA G)和Ubc3-WH-2A(TCG AGA ACG TCC ACA TCA TC)为靶点,用oligo(dt)引物和以Ubc3-WH-1S为靶点的引物(GTT CGGA-ACA GTA GAGA GA)扩增3端片段。将纯化的DNA片段克隆到pGEM-T载体(Promega,美国)中并测序。将5端和3端片段组装成全长编码序列,并提交给GenBank。
1.3 氨基酸序列及同源性分析
利用NCBI在线工具 ORF Finder进行ORF分析。用BLASTX/BLASTP进行核酸序列和氨基酸序列的同源性分析,E-value阈值为1×10-10。利用Clustal W进行多重序列比对,并用MEGA 5.05结合JTT+G模型构建系统发育树(phylogenetic trees)[16]。使用上述ORF序列作为查询序列在完整的松材线虫基因组序列数据库的TBLASTN搜索中发现了同源序列。
1.4 泛素途径相关蛋白互作的建模与预测
提交FASTA格式的泛素途径相关蛋白氨基酸序列至SWISS Model服务器进行蛋白质结构建模。输出的模型通过定型模型能量分析(Qualitative Model Energy Analysis,QMEAN)赋值而着色,从而表示模型区域的准确度[17]。利用STRING 9.0预测泛素结合酶与其他蛋白之间可能的相互作用[18]。
1.5 泛素途径相關蛋白对接与分子动力学模拟
为了定位分子对接位点,利用SWISS-PDB Viewer计算了蛋白质的静电表面电位,并绘制到分子表面。利用已经公布的基因组数据[11]进一步确定Bx-UBC-3的配体。通过将Bx-UBC-3与Bx-泛素/Bx-Rbx1(Bx-ring-box1)对接,用HEX 6.3证实蛋白质相互作用。
使用NAMD 2.9进行分子动力学的模拟。用VMD、PyMOl、BioEdit和POV-Ray等程序对蛋白质进行了注释说明。
2 结果与分析
2.1 松材线虫Bx-ubc-3基因克隆
线虫SL法产生的全长cDNA为957 bp。将这个cDNA序列命名为Bx-ubc-3,并提交给GenBank(GenBank ID:EU333281)。
基于松材线虫基因组数据的TBLASTN同源性搜索发现CADV01004468.1与Bx-ubc-3所在contig(E-value:1×10-131)相关。
2.2 氨基酸序列及同源性分析
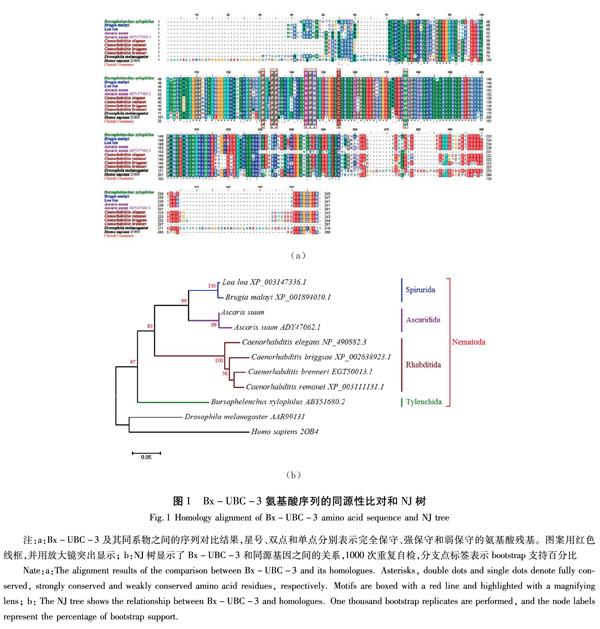
Bx-ubc-3的cDNA序列分析表明,其开放阅读框(ORF)长度为783 bp,编码245个氨基酸。将所鉴定的氨基酸序列与现有数据库进行比较,发现与所有已知的泛素结合酶具有同源性,其中与秀丽线虫ubc-3同源性为94%(GenBank ID:NP_490882;E-value:3×10-86),与马来丝虫(Brugia malayi)ubc-3同源性为90%(GenBank ID:XPY9001894010,E-vlaue:3×10-91)。
Bx-UBC-3与人(Homo sapiens)、黑腹果蝇(Drosophila melanogaster)和其他7种线虫即非洲眼线虫(Loa loa)、马来丝虫、猪蛔虫(Ascaris suum)、秀丽线虫、广杆属线虫(C. briggsae)、C. brenneri和C. remanei的同源序列的多重比对表明,所有蛋白质的基序同源(图1(a))。UBC酶超家族的一般特征基序是HPN(组氨酸-脯氨酸-天冬酰胺)三肽和E2活性位点,即形成硫酯的Cys103(半胱氨酸)[19]。在上述所有物种的序列中都有发现上述所有特征基序和氨基酸残基(图1(a)方框),包括Pro(脯氨酸)和Trp(色氨酸)残基(图1(a) Pro134、Pro135和Trp176)、HPN三肽基序(图1(a) His145-Pro146-Asn147)和保守的Cys155残基(图1(a))。
线虫UBC-3 NJ树(图1(b))显示了5个簇[20]。因为没有发现其他的垫刃目(Tylenchida)UBC-3,松材线虫是系统发育树中唯一的植物线虫。松材线虫与尾目(Spirurida)、蛔虫目(Ascaridida)和小杆目(Rhabditida)在遗传距离上远大于人和果蝇。这一结果也得到了另一个基于Bx-UBC-3和100个同源基因而构建的NJ树的证实。
2.3 Bx-UBC-3结构分析
用SWISMOST服务器在线预测Bx-UBC-3蛋白结构模型,进一步推测其功能。结果表明,Bx-UBC-3以β折叠为核心,两侧为4个α螺旋(H1-H4)、基本保守的310螺旋(h,残基i和i+3之间有氢键)和两个环(L1和L2)。L2是极性残基Asp112(天冬氨酸)、Asp113、Gln115(谷氨酰胺)、 Gly117(甘氨酸)、Glu118和Glu122的酸性环。
人、果蝇和其他4种线虫的同源序列同样存在类似的结构变异。当Bx-UBC-3在同系物上叠加时,显示出高度保守的N端序列。尽管总体结构相似,但这些蛋白在一些区域没有显著的构象特征。
2.4 泛素途径相关蛋白间互作预测
以人同源细胞分裂周期34(CDC34,E-value:1×10-80)为模板预测了与Bx-UBC-3可能存在功能关系的基因相互作用蛋白的相互作用网絡。结果表明,Bx-UBC-3和SKP1-CUL1-F-box蛋白(SCF)E3之间存在蛋白质-蛋白质相互作用。7个蛋白与UBA-1的发生高度相关。这些蛋白中有3种是SCF相关蛋白:CUL1(cullin 1,the core component of multiple cullin-RING-based SCF)、RBX1(ring-box 1)和BTRC(β-transducin repeat, SCF的底物识别成分)。
2.5 泛素途径相关蛋白Bx-UBC-3与SCF E3对接及结合位点分析
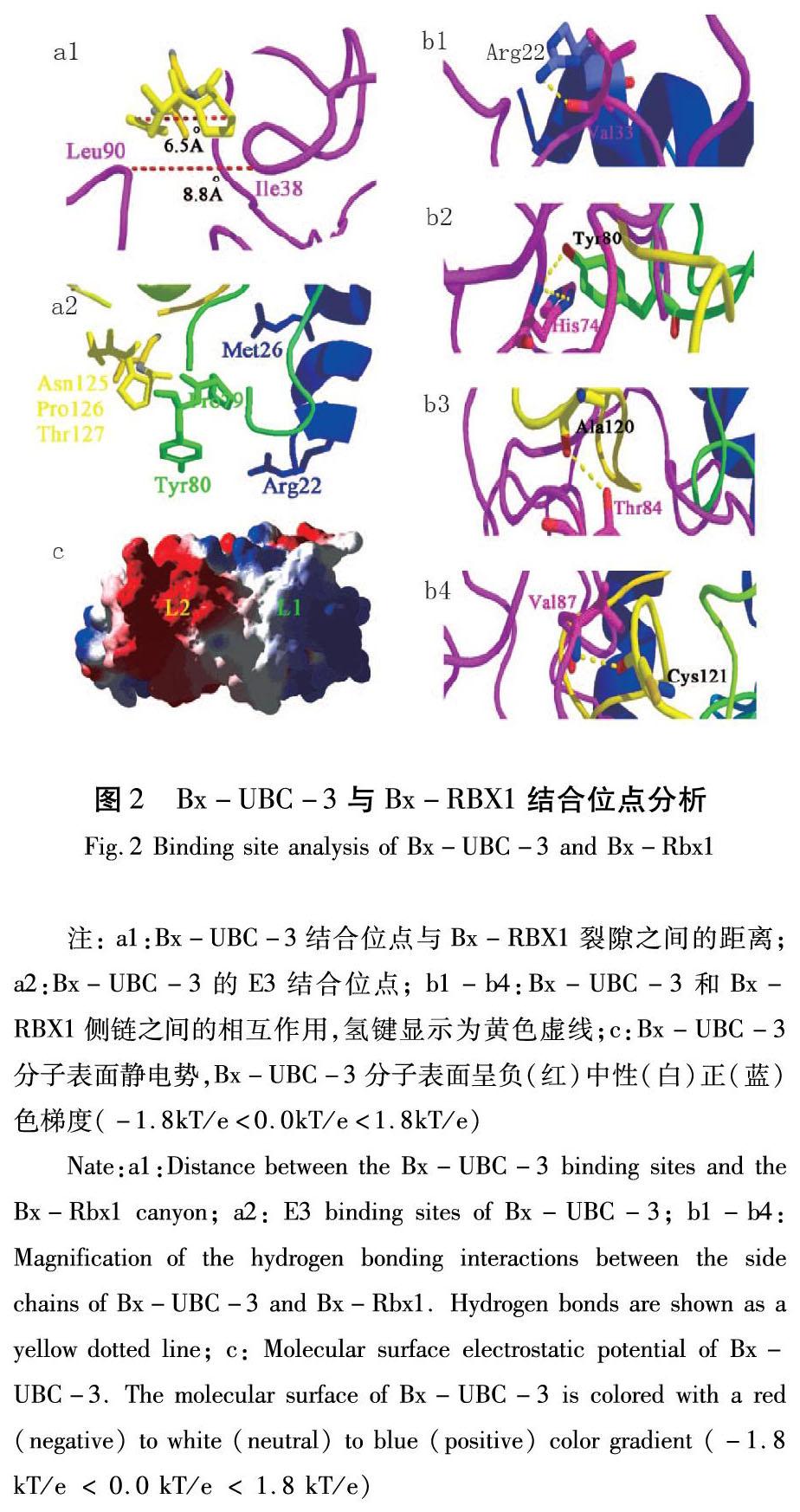
由于蛋白质间相互作用预测表明Bx-UBC-3与SCF相关蛋白相互作用,基于全基因组数据分析[11],发现了两个与松材线虫SCF相关的蛋白(Bx-Cul1和Bx-Rbx1)。基于已发表的X射线晶体结构数据,将Bx-UBC-3与Bx-Cul1/Bx-Rbx1复合物对接,建立了完整的Bx-UBC-3、Bx-Cul1和Bx-Rbx1三元复合物的模型。
为了识别候选的对接位点,计算了Bx-UBC-3和Bx-Rbx1的静电表面电位,并将其绘制到分子表面。基于Bx-UBC-3、Bx-Cul1和Bx-Rbx1三元配合物和静电表面,进一步预测Bx-UBC-3和Bx-Rbx1的相互作用。Bx-UBC-3位于Bx-Rbx1下方相对的静电表面电势裂隙上,在Bx-UBC-3上鉴定出带正电荷的L2和带负电荷的L1。
从Bx-UBC-3对接到Bx-Rbx1上,观察到L1残基Pro79和Tyr80(酪氨酸)可以与Bx-Rbx1结合(图2(a2))。L2残基Asn125和Pro126被埋入由Bx-Rbx1残基Leu90(亮氨酸)和Ile38(异亮氨酸)形成的中心凹槽中(图2(a1))。基于Bx-UBC-3和Bx-RBX1的界面特征,分析了4个氢键间的相互作用(图2(b1-b4))。Bx-UBC-3中常见的E3结合位点是Arg22(精氨酸)(H1)、Pro79(L1)、Tyr80(L1)、Ala120(丙氨酸)(L2)和Cys121(L2)。
2.6 泛素途径相关蛋白Bx-UBC-3与泛素对接及结合位点分析
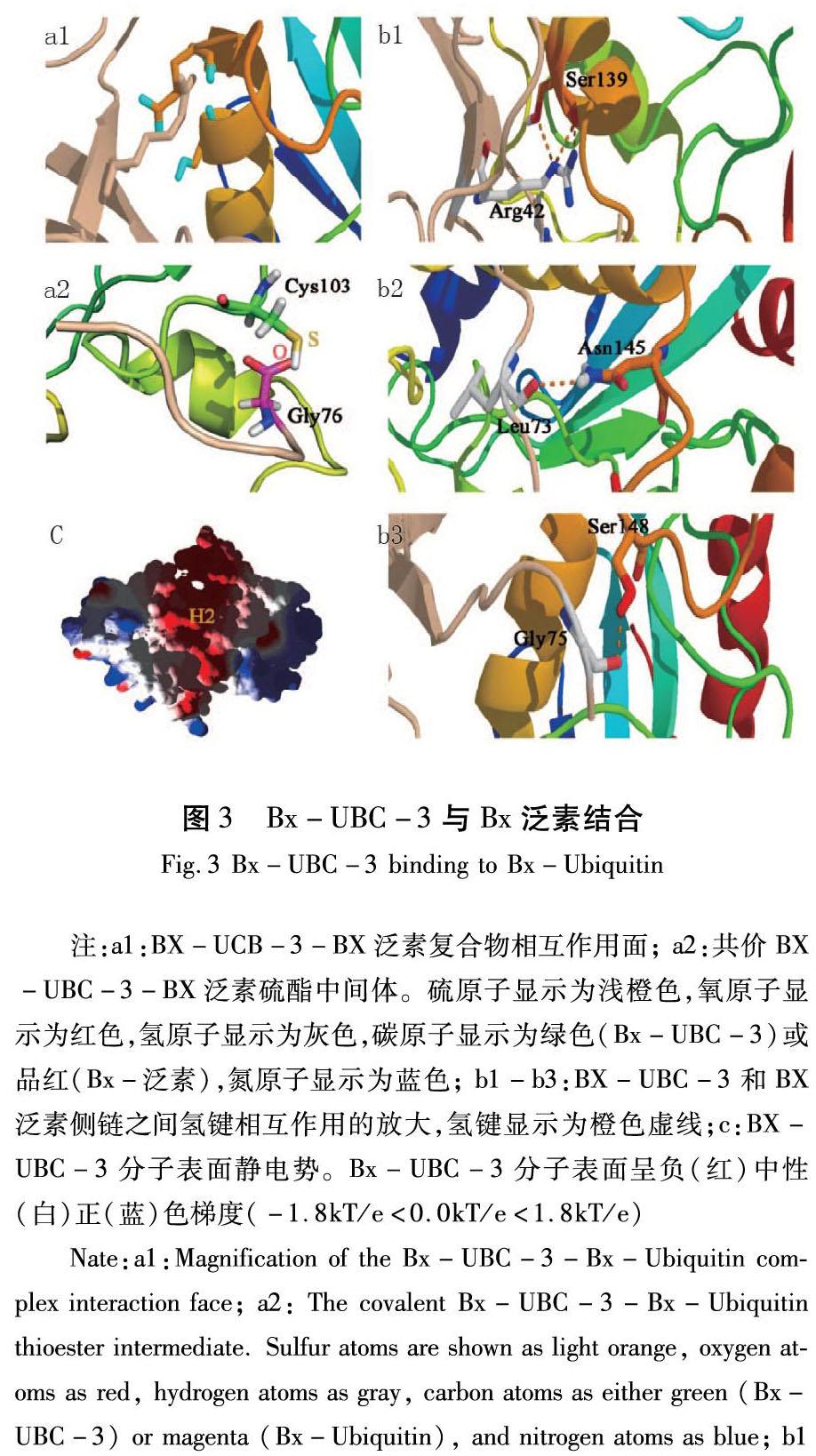
松材线虫Bx-泛素基于全基因组数据鉴定。通过E2-泛素复合物结构比对,鉴定得到Bx-UBC-3与松材线虫泛素复合物模型。在Bx-UCB-3与Bx-泛素复合体中结合位点中,Bx-UBC-的催化裂隙处中心是Bx-泛素的残基Arg42和Gly76,Bx-UBC-3浅裂处的一侧是残基Ser139(丝氨酸)和Glu143,另一侧是残基Cys103。
模拟对接数据说明Bx-UBC-3和Bx-泛素通过硫酯模型相互作用。在Bx-UBC-3和Bx-泛素蛋白上发现了互补表面结构,Bx-泛素蛋白C端围绕Bx-UBC-3蛋白,终止于Cys103(Bx-UBC-3)和Gly76(Bx-泛素)(图3(a2))。形成硫酯的Cys103位于连接S4和H的相对非结构化区域(L2)上。
2.7 泛素途径相关蛋白分子动力学模拟
通过分子动力学模拟研究了Bx-UBC-3的动态性能。同时计算了蛋白质结构的催化裂痕的柔度曲线和相关性(图4)。绘制了Bx-UBC-3级联轨迹的仿真帧(图4(a)),并根据每个残基的均方根偏差(root mea square deviation,RMSD)着色(图4(b))。结合位点的RMSD值用红星标记(图4(d))。在酸性环L2中除了Ala120和Cys121外,大多数结合位点在平衡过程中表现出较少的运动。低RMSD值表明了模型的质量符合要求并可用于对接模拟。
分子动力学模拟证实,酸性环L2在Bx-UBC-3中具有最高的构象自由度。L2环与E2活性位点(形成硫酯的Cys103)紧密相连,其酸性插入特征是高构象变异(图4(a)和图4(c)),这可以用RMSD定量描述(图4(d))。这些结果与其他E2 X射线晶体学的结果一致[21]。
蛋白质泛素化[22]过程中,E2的磷酸化是由蛋白激酶2介导的,酪蛋白激酶2依赖于保守Ser和酸性残基之间的静电排斥[23]。在动力学模拟中,L2中的酸性极性残留物瞬间接近催化裂隙(从28.2到10.3 )(图4(c))和Ser139所在的H2。这一结果表明,引入强负电荷基团的Ser139磷酸化可能导致与上述酸性残基的静电排斥,从而有利于L2开放构象。此外,L2在与Bx-RBX1对接(图4(c))时呈现拓扑扭曲(32.7 )。这些结果表明,L2具有较高的构象自由度,证实了L2在这种相互作用中起着关键作用。
3 讨论与结论
在过去的数十年中,不断有新的泛素化酶及其参与的生理过程被发现[24]。现有的研究方法多数以蛋白降解过程为切入点,即目的蛋白通过泛素途径被蛋白酶体降解的过程。诱导降解更直接的方法是将目的蛋白直接与蛋白质降解酶靶向连接。E2靶标的识别可通过E2生物酶工程还原,即在非细胞的体外条件下,将含有合适蛋白结合肽的E2融合到靶蛋白C末端[25]。这种蛋白质间的相互作用将降解酶与目标蛋白非共价结合的策略应用于蛋白酶体介导的降解过程。本试验克隆了松材线虫Bx-ubc-3基因,研究了该基因编码的泛素结合酶Bx-UBC-3的晶体结构,模拟了相关蛋白的相互作用,基于这些研究,发现了一个理论泛素通路。本研究获得的信息将有助于今后Bx-UBC-3的功能研究、工程化蛋白的开发利用,以及开发用于植物保护的Bx-UBC-3功能控制技术。对松材线虫中泛素依赖途径调控的蛋白质降解选择性靶向性的进一步认识,也将为植物线虫的有效防治提供新的思路。
本试验克隆了松材线虫的一种泛素结合酶(E2)基因Bx-ubc-3,并对其功能进行了研究。研究鉴定了Bx-UBC-3和Bx-泛素之间的相互作用。其结构研究表明了Bx-UBC-3与其配体的互作机理,说明了Bx-UBC-3是开发有效的松材线虫药物的一个潜在靶标,为Bx-UBC-3抑制剂的开发提供了理论基础,同时也为松材线虫的防治工作提供了新的思路。
【參 考 文 献】
[1]DOVE K K, KEMP H A, BONA K R D, et al. Two functionally distinct E2/E3 pairs coordinate sequential ubiquitination of a common substrate in Caenorhabditis elegans development[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(32):E6576-E6584.
[2]BELLARE P, SMALL E C, HUANG X, et al. A role for ubiquitin in the spliceosome assembly pathway[J]. Nature Structural & Molecular Biology, 2008, 15(5):444-451.
[3]倪晓光,赵平.泛素-蛋白酶体途径的组成和功能[J].生理科学进展,2006,37(3):255-258.
NI X G, ZHAO P. The components and functions of ubiquitin-proteasome pathway[J]. Progress in Physiological Sciences, 2006, 37(3):255-258.
[4]HAMILTON K S, ELLISON M J, BARBER K R, et al. Structure of a conjugating enzyme-ubiquitin thiolester intermediate reveals a novel role for the ubiquitin tail[J]. Structure, 2001, 9(10):897-904.
[5]SAHA A, LEWIS S M, KLEIGER G, et al. Essential role for ubiquitin-ubiquitin-conjugating enzyme interaction in ubiquitin discharge from cdc34 to substrate[J]. Molecular Cell, 2011, 42(1):75-83.
[6]LIU X, ZHANG Y, HU Z, et al. The catalytically inactive mutation of the ubiquitin-conjugating enzyme cdc34 affects its stability and cell proliferation[J]. Protein Journal, 2018, 37(2):132-143.
[7]AVGOUSTI D C, PALANI S, SHERMAN Y, et al. CSR-1 RNAi pathway positively regulates histone expression in C. elegans[J]. Embo Journal, 2012, 31(19):3821-3832.
[8]刘立宏,王峰,马玲,等.松材线虫乙酰胆碱酯酶1基因沉默及蛋白抑制剂[J].林业科学,2015,51(1):66-73.
LIU L H, WANG F, MA L, et al. BxACE1 gene RNAi and protein inhibition of Acetylcholinesterase in pine wood nematode Bursaphelenchus xylophilus[J]. Scientia Silvae Sinicae, 2015, 51(1):66-73.
[9]何龙喜,吉静,邱秀文,等.世界松材线虫病发生概况及防治措施[J].林业工程学报,2014,28(3):8-13.
HE X L, JI J, QIU X W, et al. General situation and control measures of pine wood nematode disease in the world[J]. Journal of Forestry Engineering, 2014, 28(3):8-13.
[10]HASEGAWA K, FUTAI K, MIWA S, et al. Early embryogenesis of the pinewood nematode Bursaphelenchus xylophilus[J]. Development Growth & Differentiation, 2004, 46(2):153-161.
[11]KIKUCHI T, COTTON J, DALZELL J J, et al. Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphelenchus xylophilus[J]. Plos Pathogens, 2011, 7(9):e1002219.
[12]王峰,馬玲,陈俏丽,等.松材线虫热激转录因子Bx-HSF-1基因的克隆及表达分析[J].林业科学,2016,52(12):92-98.
WANG F, MA L, CHEN Q L, et al. Cloning and expression analysis of the heat shock transcription factor Bx-HSF-1 gene in Bursaphelenchus xylophilus (Aphelenchida: Aphelenchoididae)[J]. Scientia Silvae Sinicae, 2016, 52(12): 92-98.
[13]陈俏丽,王峰,李丹蕾,等.‘大白谷CC-NBS-LRR蛋白编码基因抗干尖线虫侵染时空表达研究[J].中国农学通报,2015,31(21):279-283.
CHEN Q L, WANG F, LI D L, et al. Spatial-temporal expression of CC-NBS-LRR protein-coding gene resisting to infection of Aphelenchoides besseyi in Oryza sativa L. ssp. Indica[J]. Chinese Agriculture Science Bulletin, 2015, 31(21):279-283.
[14]WANG F, WANG Z Y, LI D L, et al. Identification and characterization of a Bursaphelenchus xylophilus (Aphelenchida Aphelenchoididae) thermotolerance-related gene: Bx-HSP90[J]. International Journal of Molecular Sciences, 2012, 13(7):8819-8833.
[15]WANG F, LI D L, CHEN Q L, et al. Genome-wide survey and characterization of the small heat shock protein gene family in Bursaphelenchus xylophilus[J]. Gene, 2016, 579(2):153-161.
[16]WANG B W, MA L, WANG F, et al. Low temperature extends the lifespan of Bursaphelenchus xylophilus through the cGMP Pathway[J]. International Journal of Molecular Sciences, 2017, 18(11):2320.
[17]BIASINI M, BIENERT S, WATERHOUSE A, et al. SWISS-MODEL: modelling protein tertiary and quaternary structure using evolutionary information[J]. Nucleic Acids Research, 2014, 42(W1):252-258.
[18]SZKLARCZYK D, FRANCESCHINI A, KUHN M, et al. The STRING database in 2011: functional interaction networks of proteins, globally integrated and scored[J]. Nucleic Acids Research, 2011, 39:561-568.
[19]ZHENG N, WANG P, JEFFREY P D, et al. Structure of a c-Cbl-UbcH7 complex: RING domain function in ubiquitin-protein ligases[J]. Cell, 2000, 102(4):533-539.
[20]CHEN Q L, LI D L, FENG W, et al. Trehalose metabolism genes of Aphelenchoides besseyi (Nematoda: Aphelenchoididae) in hypertonic osmotic pressure survival[J]. Biology Open, 2017, 6(5):664-672.
[21]ARAI R, YOSHIKAWA S, MURAYAMA K, et al. Structure of human ubiquitin-conjugating enzyme E2 G2 (UBE2G2/UBC7)[J]. Acta Crystallographica Section F, 2006, 62(4):330-334.
[22]LIU X, ZHANG Y, HU Z H, et al. The catalytically inactive mutation of the ubiquitin-conjugating enzyme CDC34 affects its stability and cell proliferation[J]. Protein Journal, 2018, 37(2):132-143.
[23]PAPALEO E, RANZANI V, TTRIPODI F, et al. An acidic loop and cognate phosphorylation sites define a molecular switch that modulates ubiquitin charging activity in cdc34-like enzymes[J]. Plos Computational Biology, 2011, 7(5):1-11.
[24]METZGER M B, PRUNEDA J N, KLEVIT R E, et al. RING-type E3 ligases: master manipulators of E2 ubiquitin-conjugating enzymes and ubiquitination[J]. Biochimica Et Biophysica Acta, 2014, 1843(1):47-60.
[25]CALLIS J. The ubiquitination machinery of the ubiquitin system[J]. The Arabidopsis Book, 2014, 12(12):e0174.

