外周血CD4+CD25+Foxp3+调节性T细胞与HCV感染的相关性
蒋自卫
CD4+CD25+调节性T淋巴细胞(T regulatory lymphoey cell,Treg )可抑制T细胞免疫反应,正常外周血中 CD4+CD25+Treg 约占CD4+T细胞的5%~10%。越来越多的研究表明CD4+CD25+Treg在人类体内对诱导和维持免疫耐受起着重要作用且与多种疾病的免疫有关[1-6]。CD25既是CD4+CD25+Treg的特征性标志,又是T细胞激活的标志,因此,不能仅借助CD25将两者鉴别开来,而Foxp3是Treg的主要转录因子,可调控Treg的生长发育与功能效应[6-7],故以CD4+CD25+Foxp3+标志Treg更为可靠。本研究旨在探讨HCV感染时外周血中CD4+CD25+Foxp3+Treg出现的频率及其与HCVRNA含量的相关性。
资料与方法
一、材料
(一)研究对象 收集2015年1月至2016年12月南京二院所收治的慢性丙型肝炎患者50例、以及献血人群中HCV携带者50例和正常健康对照者50例。各组年龄、性别比具有可比性。HCV 携带者及慢性丙型肝炎患者最近半年未使用抗病毒或免疫调节治疗,均未重叠HBV、HIV等感染,未合并自身免疫性疾病和糖尿病等。
二、方法
(一)主要仪器和试剂 FACSCalibur流式细胞仪(BD公司)lighteyeler荧光定量PCR仪(瑞士),Biofuge pico 离心机(Germany ),CD4、CD25抗体(BD公司),PE anti一human Foxp3染色试剂(eBioscinece公司)HCV RNA定量试剂(深圳匹基生物工程公司)。
(二)CD4+CD25+Foxp3+Treg检测 取枸椽钠抗凝血100 μL,经Fieoll分离出PBMC,先与荧光标记的CD4,CD25抗体,孵育再和PEanti-human Foxp3+试剂孵育,利用FACSCalibur流式细胞仪检测,可得CD4+CD25+Foxp3+Treg细胞在CD4+T细胞中比率。
(三)HCVRNA定量检测[8]采用荧光定量聚合酶链反应(FQ-PCR )样本处理:各取血清样本100 μL,加入300 μL核酸提取液(200 mL Trizol,3 mol/L NaAc 6 mL,10 mg/mL tRNA 120 μL),用移液器反复吹打混匀,室温放置5 min,加100 μL三氯甲烷,用手来回振荡混匀15 s,室温放置5 min,4 ℃ 1 200 rpn 离心15 min,将上清移入新的离心管,加入200 μL异丙醇,振荡5 s,室温沉淀10 min ,4 ℃ 1 200 rpn 离心10 min ,弃上清,再加入500 μL预冷的乙醇洗涤,上下颠倒10次,4 ℃ 1 200 rpn 离心5 min ,吸干上清,沉淀室温干燥15 min ,即可定量检测。阴性对照处理方法与标本相同。
PCR扩增:按待扩增样本数n ,取PCR缓冲液(500 mmol/L Tris-HCI,10 mmo1/L MgCl2,250 mmol/L KCI,1 mg/mL明胶)n x×2.5 μL,MgCl2n×2.5 μL,HCV荧光探针n×2.5 μL,Taq酶n×2.5 μL混于一个离心管中,旋涡振荡器上振荡10 s,按每反应管20 μL分装。取上述处理样本5 μL,加入反应管中,振荡混匀,低速离心数30 s,每个反应管中取出20 μL加入对应的毛细管中,低速离心15 s,取出置lightcycler检测仪上。
扩增条件:在50 ℃反应2 min,然后94 ℃ 保温5 min,再93 ℃ 20 s,52 ℃ 20 s,65 ℃ 15 s循环40次。在Proportional计算方式下判断结果,检测灵敏度500拷贝/mL,>500拷贝/mL为阳性。
(四)统计学处理 采用方差分析比较慢性丙型肝炎患者、HCV感染者与正常对照者之间CD4+CD25+Foxp3+Treg的差异,采用直线相关性分析HCVRNA载量(转为自然对数)与CD4+CD25+Foxp3+Treg 的相关性。
结 果
一、各组外周血CD4+CD25+Foxp3+ Treg在CD4+中的频率
外周血CD4+T细胞中CD4+CD25+Foxp3+Treg 出现的频率慢性活动性丙型肝炎者和HCV携带者均高于健康对照者(P<0.01),慢性丙型肝炎者高于HCV携带者(P<0.05),见表1。

表1 各组人群外周血CD4+CD25+Foxp3+ Treg在CD4+T细胞中的频率
*P<0.01;#P<0.05
二、CD4+CD25+Foxp3+ Treg与HCVRNA病毒载量的相关性
HCVRNA病毒载量转化为自然对数后与CD4+CD25+Foxp3+Treg在CD4+T 细胞中的频率进行直线相关性分析,见表2。外周血CD4+CD25+Foxp3+Treg在CD4+T 细胞中的频率与HCVRNA病毒载量呈正相关性(r=0.79 ,P<0.01)。
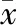
表2 HCVRNA载量与CD4+CD25+ Foxp3+ Treg频率相关性(±s %)
r=0.79;P=0.006
讨 论
CD4+CD25+Treg具有免疫抑制性及免疫无能性,主要表现在:经TCR介导的信号刺激活化后能抑制CD4+、CD8+T细胞的活化与增殖以及细胞因子的分泌;对高浓度IL-2 的单独刺激、固相包被或可溶性抗-C3 单抗以及抗C3单抗、抗CD28单抗的联合作用呈无应答状态[9]被人们认为与机体免疫耐受有关。一些研究[10-11]表明Tregs起着免疫自稳的功能,避免引起自身免疫反应过度及自身免疫疾病的发生,Treg Foxp3过度表达会导致机体免疫应答下降,产生免疫耐受。
本次结果显示外周血CD4+T 细胞中CD4+CD25+Foxp3+Treg的比例数在慢性丙型肝炎组和HCV携带组均高于健康对照组(P<0.01 ),且慢性丙型肝炎组高于HCV携带组(P<0.05)。表明慢性肝炎和HCV携带者存在着调节性T 细胞的Foxp3+过度表达,CD4+CD25+Foxp3+调节性细胞可能参与了丙型肝炎病毒感染慢性化的过程。在丙型肝炎患者中,CD4+CD25+Foxp3+Treg可能加强了对病毒特异性CD8+T淋巴细胞增殖的抑制作用[12],这种作用与外周血中CD4+CD25+Foxp3+Treg高频率出现直接相关。慢性丙型肝炎CD4+CD25+Foxp3+Treg出现的频率更高,说明慢性HCV感染导致CD4+CD25+Foxp3+Treg增多,而CD4+CD25+Foxp3+Treg能够抑制CD8+T 淋巴细胞对不同病毒抗原的应答,这一现象也提示CD4+CD25+Foxp3+Treg可能促进了丙型肝炎患者感染的持续化。有资料显示表型为CD4+CD25+Foxp3-的T 细胞在体外用TGFβ刺激,其表型可转化CD4+CD25+Foxp3+,在体内有可能慢性肝炎能产生某些因子,刺激CD4+CD25+Foxp3+Treg的增生与成熟。因此,我们认为HCV 感染导致了CD4+CD25+Foxp3+Treg 增殖与活化,患者外周血中CD4+CD25+Foxp3+Treg的频率升高促进机体对病毒的免疫应答不完全,导致慢性活动性感染。

