前入路肝切除术在原发性肝癌手术中的应用价值分析
王恒 蔡庆和 涂华 张林菲 封彦青 周华东
原发性肝癌好发于中年男性,具有隐匿性强﹑病死率高的特点,饮酒﹑肝炎病毒感染等均可影响其发生[1]。手术治疗是原发性肝癌的主要治疗手段,而肝切除术又是手术的首选,对于失去手术机会的患者,可选用化疗联合其他非手术治疗方案[2]。常规入路肝切除术是目前被广泛接受的手术方式,是在游离肝脏后进行肿瘤的切除,而前入路肝切除术则是在控制肝脏血供并不完全离断肝脏的情况下切除病灶,有研究表明[3],对于大肝癌前入路肝切除术可使患者获得更好的生存效果。然而目前对于两种手术方式的优劣仍然存有争议,为此,我们对比了两种手术对患者的各方面影响以期为手术方案的选择提供依据。
资料与方法
一、一般资料
将2014年1月-2017年6月我院收治的100例原发性肝癌患者随机分为观察组50例和对照组50例。观察组中男37例,女13例;年龄33-64岁,平均(48.34±3.91)岁。对照组中男32例,女18例;年龄36~61岁,平均(49.25±3.27)岁。两组性别﹑年龄无统计学差异(χ2=1.173,P=0.280;t=1.262,P=0.210)。本研究通过了我院伦理委员会批准。
纳入标准:经病理学确诊为原发性肝癌;接受了常规入路或者前入路肝切除术,无附加手术;配合度高,签署知情同意书;资料完整。排除标准:继发性肝癌;凝血功能异常;存在心肾等重要脏器功能障碍;合并严重感染;既往有肝手术病史。
二、手术方案
对照组:应用常规入路肝切除术,患者取仰卧位,常规消毒麻醉,游离肝周韧带,并阻断第一肝门,分离胆道和出入肝脏的重要血管并离断,结合影像学检查切除包含肿块的肝组织。观察组:应用前入路肝切除术,患者准备完毕后,暴露第二肝门,显露肝右、肝上、肝中静脉。左上方牵拉肝蒂,提开尾叶下缘,显露下腔静脉并将其分离,同时离断下腔静脉右侧的右下肝静脉。于右下肝静脉左侧,在尾状叶后方建立肝后隧道,牵引弹力带通过隧道,并使弹力带环绕肝脏,略向前提起。解剖第一肝门,结扎门静脉和右侧肝动脉,于此同时,提拉弹力带,紧贴肝正中,使肝实质分开,最后移除病灶。
三、观察指标
(一)手术指标 统计所有患者的总失血量﹑手术时间﹑输血率。
(二)术后恢复情况 统计患者手术后的住院时间、下床时间、进食时间及手术前后(入院时、手术后第3、7天)肝功能指标包括:丙氨酸氨基转移酶(ALT)、天冬氨酸转氨酶(AST)。
(三)炎症因子 于患者入院时﹑手术后第3天、手术后第7天抽取患者晨起空腹肘静脉血约5 mL送检验科,查血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)、白介素-8(interleukin-8,IL-8),同时计算出中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)。
(四)预后情况 对所有患者随访一年,统计手术后随访期间术后并发症的发生和处理措施、病死率、复发率。
四、统计学方法
用SPSS 19.0分析数据,正态分布计量资料采用均数±标准差表示,组间比较采用t检验;计数资料用率表示,组间比较用χ2检验,P<0.05表示差异有统计学意义。
结 果
一、两组手术指标比较
观察组总失血量、手术时间、输血率均小于对照组(P<0.05),见表1。
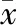
表1 两组手术指标比较(±s)
二、两组术后恢复情况比较
观察组住院时间小于对照组(P<0.05),两组下床时间、进食时间无差异(P>0.05)。入院时,两组ALT、AST无差异(P>0.05);手术后第3天及第7天,两组ALT、AST均比入院时升高,且观察组小于对照组(P<0.05),见表2。
三﹑两组炎症因子比较
入院时,两组血清TNF-α﹑IL-6﹑IL-8及NLR无差异(P>0.05),手术后第3天及第7天,两组以上指标均比入院时升高,且观察组小于对照组(P<0.05),见表3。
四、两组预后情况比较
观察组有2例患者发生胆瘘,2例发生术中大出血,1例发生术后感染;随访期间3例患者死亡,5例复发。对照组中有3例患者发生胆瘘,2例发生术中大出血,4例发生术后感染,3例发生胸腔积液,1例发生肝衰竭;随访期间11例患者死亡,14例复发。观察组并发症发生率(10.00%)、术后1年病死率(6.00%)和复发率(10.00%)均低于对照组(26.00%、22.00%、28.00%)(χ2=4.342,P=0.037;χ2=5.317,P=0.021;χ2=5.263,P=0.022)。对发生并发症患者给予输血﹑抗感染等对症治疗后患者均逐渐恢复。
讨 论
对于身体状况尚可且疾病还未进展至晚期的肝癌患者,手术切除是首选治疗措施。传统的肝切除术应用广泛,然而对于癌症肿块较大甚至膈肌受侵犯时会由于空间限制而使得手术预期效果下降。研究表明[4],对于合并膈肌受侵犯的肝右叶大肝癌,前入路肝切除术可提供与无膈肌受侵犯时相似的总生存率和无复发生存率。Beppu T等[5]指出,相比于传统的肝切除术,前入路肝切除术可提供更好的生存率。前入路肝切除术在大肝细胞癌中的疗效得到了多方验证,然而该手术方式由于并未完全游离肝脏,视野暴露无传统手术明显,一旦发生预料之外的大出血,可能会造成严重后果。为此,我们就两种手术方式对患者的影响进行了探索。
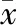
表2 两组术后恢复情况比较(±s)
注:*表示与入院时比较P<0.05
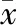
表3 两组炎症因子比较(±s)
注:*表示与入院时比较P<0.05
观察组总失血量﹑手术时间﹑输血率﹑住院时间均小于对照组,手术后,两组ALT﹑AST均比入院时升高,且观察组小于对照组,提示观察组手术方式对患者造成的损伤更小。这是由于传统手术中对肝脏进行游离时会因为部分结构所处的位置比较深且受到横膈制约而增加手术困难;同时,游离肝脏时需要进行翻转,容易引起第一肝门中动静脉受压造成血供不足,从而影响肝功能;翻转挤压的过程中肝脏内肿块也会受到压迫,可能会发生破裂转移及大出血等,造成患者预后较差[6]。而前入路肝切除术则先阻断重要血管再进行后续操作,可避免反复翻转挤压肝脏,对血供和肝功的影响较小;经隧道弹力带的应用既可以使管道结构变浅有助于进行及时止血,又可以提示断肝方向;肿瘤压迫下腔静脉是前入路手术出血的危险因素[7],由提拉而形成的肝脏与下腔静脉之间的空间则可以起到对下腔静脉的保护作用。因此,前入路肝切除术的术中出血量少,手术时间短,且对患者肝功影响较小,ALT、AST水平升高幅度小,术后并发症少。
有研究表明[8],肝脏慢性炎症可以参与原发性肝癌的发生,慢性肝炎逐渐进展为肝硬化,最终发展成肝癌。为此,我们对不同手术方式对患者炎症因子的影响也进行了调查。结果发现,手术后第3天及第7天,两组血清TNF-α、IL-6、IL-8及NLR均比入院时升高,且观察组小于对照组。由手术创伤而引起的机体应激性炎症反应会导致炎症因子水平升高,由上可知,观察组对患者生理状态的影响更小,因此其炎症因子水平较低。IL-6由巨噬细胞等产生,可刺激抗体的合成,TNF-α具有调节免疫﹑杀伤肿瘤细胞的作用;IL-8可参与NTS/IL-8炎症反应通路,介导上皮间质转化,从而影响肝癌的发生[9];由于中性粒细胞可以分泌血管内皮生长因子等促进肿瘤新生血管的形成,而调节性T细胞等可以发挥抗肿瘤作用,NLR的升高常提示预后较差[10]。上述指标既反映了患者的炎症状态,同时又可影响患者预后,这也解释了观察组术后1年生存率和复发率都更好的现象。
综上所述,前入路肝切除术治疗原发性肝癌的效果好,对肝脏造成的损伤小,效果确切。

