比较中央气道腺样囊性癌与黏液表皮样癌的临床及CT特征
骆伟杰,曾庆思,伍筱梅,李新春,林 琳,3,秦积龙,邓 宇*
(1.广州医科大学附属第一医院放射科,4.病理科,广东 广州 510120;2.广州花都区人民医院影像科,广东 广州 510800;3.广州市第八人民医院放射科,广东 广州 510000)
中央气道涎腺肿瘤为少见的低度恶性胸部肿瘤,发病率约占肺原发恶性肿瘤的0.1%~0.5%,其中黏液表皮样癌(mucoepidermoid carcinoma, MEC)及腺样囊性癌(adenoid cystic carcinoma, ACC)是最常见的2种类型[1-2]。MEC和ACC均起源于支气管混合性腺体,多发生于段以上中央气道[3],临床表现类似,首选治疗方式均为手术切除;但中央气道ACC患者预后较MEC差,更易转移,且复发率及总体生存率更低,鉴别诊断有重要意义[4]。本研究旨在对比分析MEC与ACC的临床及影像学特征,以期提高鉴别诊断水平。
1 资料与方法
1.1 一般资料 回顾性分析2010年11月—2018年5月在广州医科大学附属第一医院接受胸部CT检查并经手术或支气管镜病理证实的76例中央气道涎腺肿瘤患者,其中ACC 45例,男17例,女28例,年龄18~81岁,平均(46.0±13.2)岁;MEC 31例,男16例,女15例,年龄5~72岁,平均(30.9±16.3)岁。
1.2 仪器与方法 采用Toshiba Aquilion 16 层或Siemens Definition AS+128 排多层螺旋CT扫描仪。76例均接受胸部CT平扫,38例ACC、29例MEC接受增强扫描,扫描范围自肺尖至膈面,管电压120 kVp,管电流采用毫安自动调制技术(90~250 mAs),准直0.75~2.0 mm,螺距0.8~1.0,常规重建层厚/层间隔为7 mm/7 mm、2 mm/2 mm或1 mm/1 mm;薄层重建层厚/层间隔为1 mm/0.5 mm。增强扫描使用非离子碘对比剂优维显(300 mgI/ml)或欧乃派克(350 mgI/ml),剂量1.5 ml/kg体质量,流率4.0 ml/s,经肘静脉注射后20 s进行扫描。
1.3 图像分析 由2名分别具有3年、17年诊断经验的影像科医师在PACS及图像工作站进行MPR、MIP等后处理,分析肿瘤生长部位、大小(最大径)、生长方式、强化程度(轻度强化<20 HU,中度强化20~40 HU,明显强化>40 HU)及其他征象(阻塞性炎症、阻塞性肺不张、胸腔积液、淋巴结肿大)。生长方式分为浸润性与膨胀性。浸润性生长为肿瘤沿气道壁呈围管性生长,且管壁不均匀增厚,伴或不伴气道外结构侵犯;膨胀性生长为肿块向腔内呈息肉样或肿块样生长,多致管腔不同程度堵塞,常无气道外结构侵犯。
1.4 统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示,2组间比较采用两独立样本t检验;计数资料的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 MEC患者年龄低于ACC患者(P<0.01)。ACC患者与MEC患者咳嗽、咳痰、发热、咯血、呼吸困难、胸痛发生率差异均无统计学意义(P均>0.05,表1)。
2.2 CT表现 与MEC比较,ACC易发生于气管、多呈浸润性生长、强化程度较小、阻塞性炎症发生率较低(P均<0.05),而两者肿瘤最大径及阻塞性肺不张、淋巴结肿大、胸腔积液征象发生率差异均无统计学意义(P均>0.05)。见表2和图1、2。
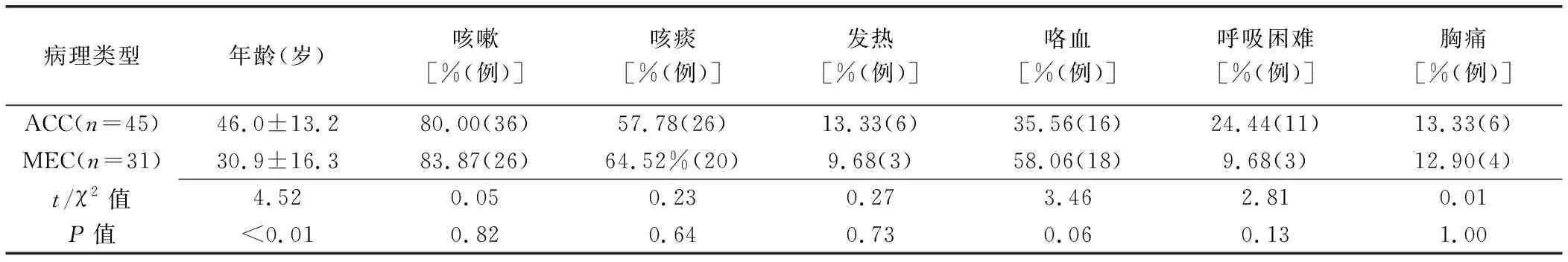
表1 ACC与MEC患者临床资料比较
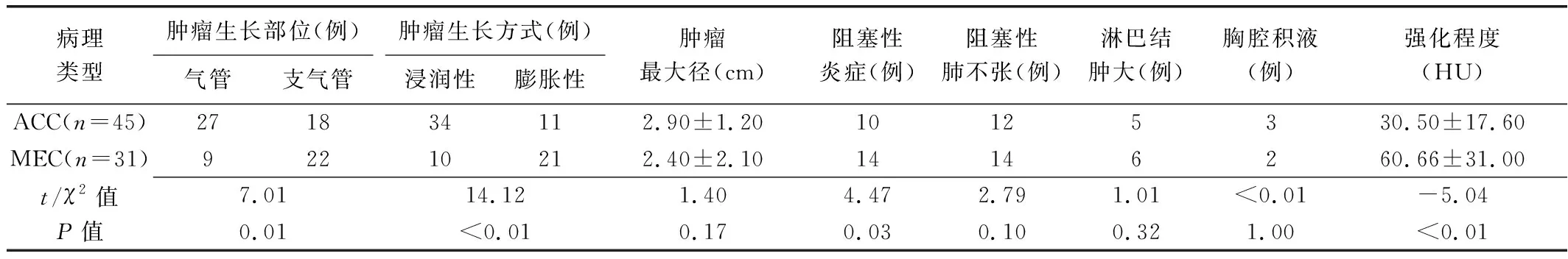
表2 ACC与MEC患者CT征象比较
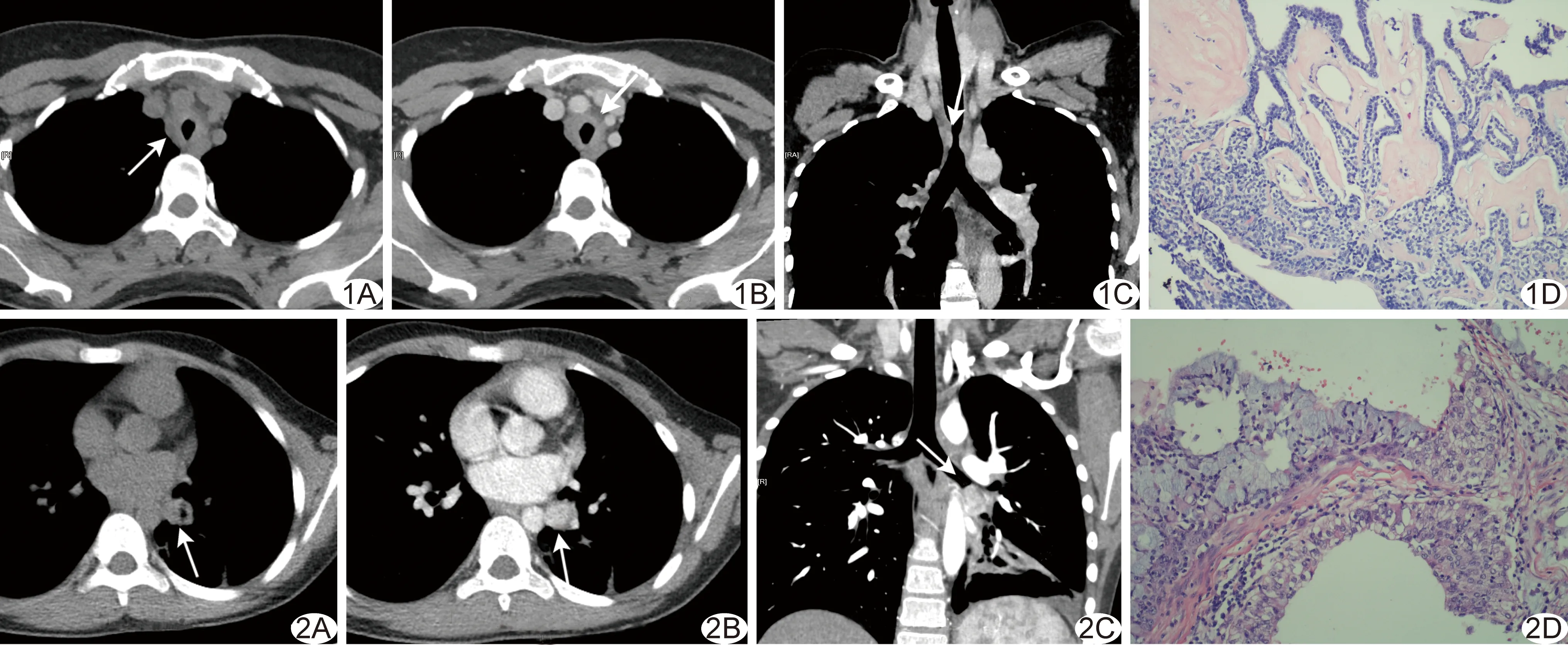
图1 患者女,37岁,气管下段ACC A.CT平扫示肿瘤致气管壁不规则环形增厚,局部管腔狭窄(箭); B.增强CT示肿瘤向气管壁外的纵隔浸润,并呈中度强化(箭),强化差值约20 HU; C.CT冠状位重建示气管下段管壁围管性增厚,表面欠光滑,管腔狭窄(箭); D.病理示基底样或肌上皮分化的肿瘤细胞向肺间质浸润,形成假腺样结构,同时可见肺间质玻璃样变性(HE,×200) 图2 患儿男,13岁,左下叶支气管MEC A.CT平扫示左下叶支气管腔内类圆形肿块,密度均匀,形态规则(箭); B.增强CT示肿块呈膨胀性生长并明显强化(箭),强化差值约100 HU; C.CT冠状位重建示左下叶支气管腔内明显强化肿块,阻塞管腔(箭),左下肺阻塞性肺炎及含气不全; D.病理示构成肿瘤的黏液细胞、表皮样细胞及中间细胞,于部分区域形成囊腔样结构(HE,×200)
3 讨论
3.1 ACC与MEC的临床特点 临床上,ACC及MEC患者的发病年龄低于上皮来源气道恶性肿瘤患者。而本研究发现MEC患者年龄[(30.9±16.3)岁]低于ACC患者[(46.0±13.2)岁],与封俊等[5]的结果一致,该组ACC发病年龄多为40~50岁,约50% MEC患者发病年龄<30岁。本组ACC与MEC患者临床症状相似,均表现为咳嗽、咳痰、咯血、呼吸困难、发热及胸痛等,原因可能在于2种肿瘤的发生部位、生物学行为较为相近。
3.2 ACC与MEC的病理学、影像学特征 混合腺与透明软骨存在于3级以上支气管黏膜下层,在更小的气道中几乎不存在,因而原发性气道涎腺肿瘤多为中央型,外周型罕见[2]。ACC源于支气管黏膜腺管或腺体的黏液分泌细胞,而气管侧壁及后壁等腺体丰富部位的发生概率较大,其病理特点是沿黏膜下及周围呈浸润性生长,肉眼观察常难以确定肿瘤范围[2,6];MEC来源于支气管的小涎腺,肿瘤上皮由黏蛋白分泌细胞、鳞状细胞及中间型细胞组成,排列成团状或腺腔样结构,腺腔内含黏液,肿瘤常以高分化型多见[7-10]。本研究结果表明,ACC多发生于气管,表现为沿气道壁浸润性生长,黏膜表面不光滑,肿瘤浸润气管壁及软骨环,并可见浸润至气道旁纵隔脂肪内;而MEC则多见于叶段支气管,呈腔内外膨胀性生长的球形病灶,较少伴气道旁结构侵犯。但是肿瘤大小对鉴别2种肿瘤价值有限。
本组MEC强化程度明显高于ACC,与李智勇等[11-14]报道一致。肿瘤强化程度对鉴别MEC与ACC具有重要作用,可能原因是MEC肿瘤组织中黏液分泌中含有特征性的富血管成分[5-6],而ACC肿瘤组织是由导管上皮、肌上皮双层细胞构成的腺体,呈小管状或筛状结构,内含黏液或嗜酸性基底膜样物质,间质内少有血管[6]。
此外,本研究还发现MEC患者阻塞性炎症发生率高于ACC患者,可能与肿瘤发生部位及生长方式有关:ACC常发生于气管,多呈浸润性生长,而MEC常发生于支气管(叶支气管、段支气管多见),多呈膨胀性生长,故MEC更易造成管腔重度狭窄,导致阻塞性炎症发生。由于MEC和ACC均为低度恶性肿瘤,生长速度相对较慢,故阻塞性肺炎发生概率较高,但一般需要较长时间才会出现肺不张,使得阻塞性肺不张对于鉴别2种肿瘤的意义不大。MEC和ACC患者淋巴结肿大、胸腔积液等CT征象的发生率差异亦无统计学意义。
3.3 临床治疗及预后 对于MEC和ACC,治疗方式均首选手术切除,预后较一般气管恶性肿瘤好。ACC手术切除后常需要结合放射治疗,预后较MEC差,因其多呈浸润性生长,若手术切除不完全,易发生远处转移。ACC患者的5年及10年生存率分别为55.0%和39.0%,而MEC可达87.0%[4]。此外,患者预后还与肿瘤大小、分期等相关。
3.4 鉴别诊断 MEC和ACC需与以下疾病鉴别:①鳞癌,患者年龄较大,多与吸烟相关,易发生淋巴结转移及远处转移[5];②类癌,典型表现为气道内息肉样结节影,增强扫描明显强化,较难与MEC鉴别[14];③气管内膜结核,病变范围广泛,可呈节段性分布,肺内可见支气管播散灶[9],应与ACC鉴别。
综上所述,ACC患者发病年龄相对较大,好发于气管,多呈浸润性生长,CT增强扫描呈轻-中度强化;MEC患者发病年龄较小,好发于叶、段支气管,多呈膨胀性生长,CT增强扫描呈明显强化,阻塞性炎症较ACC多见。MEC预后好于ACC。术前明确诊断肿瘤类型对判断预后及指导治疗方式有重要临床意义。

