磷铵两性离子改性血管脱细胞支架可以有效体外抗血栓和内皮化
冯苏,陈志鹏,刘澄,乔彤
磷铵两性离子改性血管脱细胞支架可以有效体外抗血栓和内皮化
冯苏,陈志鹏,刘澄,乔彤
南京医科大学 鼓楼临床医学院,江苏 南京 210000
由于自体血管(由同一受体的血管用于血管移植材料) 的有限可用性,以及非自体血管(人工制成的血管移植材料) 的生长能力不足,组织工程血管越来越受到重视。文中构建了一种磷铵两性离子改性的血管脱细胞支架附以高度生物相容的骨髓源内皮祖细胞为内层的新型血管移植材料。通过一种简便的方法——共沉淀法改性血管脱细胞支架,评价其体外血小板粘附实验、溶血实验、复钙实验和细胞毒性等相关指标。磷铵两性离子改性后抗凝血活性提高,可以有效地促使类似于天然血管腔表面凹凸结构的脱细胞支架表面内皮祖细胞的附着。改性后的脱细胞支架具有与天然血管相似的力学性能,在体外可以有效地构建内皮化。研究结果为血管脱细胞支架通过改性实现体外抗血栓和内皮化方面进行了初步探索。
磷铵两性离子,脱细胞支架,内皮化
目前我国心血管疾病逐年增多,虽然人工血管在外周动脉闭塞治疗上为患者解决了很多问题[1],但是移植物容易引起血栓形成、钙化和新生内膜[2]。尤其小直径 (<6 mm) 血管移植旁路手术中的增生严重,从而导致手术失败[3]。尽管目前使用各种方法对血管脱细胞支架表面进行一定的修饰,但是由于细胞结构的缺乏还难以具备正常血管的生物活性或分泌功能[4],因此长期通畅率低的现状仍未克服[5]。如何增强抗血栓能力和抑制内膜增生是临床血管移植面临的挑战。
血管组织工程学的发展为解决上述难题提供了新的研究途径和解决方案[6]。由于脱细胞血管支架具备非常低的免疫源性,并且可以模拟自然状态,那么在跟细胞相互的作用过程中将为其提供非常适宜生长的环境,这是一般材料所不具备的特点[7]。除了能提供细胞附着的架构支持外,还可以提供相应的生物线索,例如细胞粘附的位置[8]。去细胞化的细胞外基质是最接近自然状态的支架,结合了独特的微观和宏观结构。去细胞化的过程保持了结构的完整性,可以确保血管构架完整。由于这种多功能结构还具备诱导细胞分化和成熟的功能,因此可能成为生物支架制备的理想载体。尽管血管脱细胞支架取得了一定的成功,但是种子细胞种植脱细胞支架尚不理想,仍存在很多问题不能直接应用于临床[9]。
具备抗凝血功能的生物材料的研究是目前研究的难点和热点之一,也激发了相关工作者的研究热情[10-12]。材料学方面的研究发现磷铵两性离子 (Ammonium phosphate zwitterions,APZ) 具有明显的抗凝和抑制血小板聚集的功能,是一种由疏水的非极性长碳链的羟基和亲水的极性偶极离子构成的磷酰胆碱类化合物[13],特殊的分子构成特点使其形成类磷脂双分子层结构,相关的研究表明特殊的结构是抗凝和抗血小板特点的主要因素[14]。基于以上考虑,以血管脱细胞支架为载体,APZ改性脱细胞支架后通过生物反应器将其内皮化培养构建成组织工程血管,检验其各项性能,以此实现一种新型的具备适宜内皮化、抗凝的组织工程血管,并最终应用于临床。假设改性后的脱细胞支架能具备很好的生物相容性等功能,那么将为实现新型血管移植替代品的研发打下基础,以解决目前临床所面临的困难。
1 材料与方法
1.1 材料
猪的颈动脉是从南京大学附属鼓楼医院实验动物房新鲜猪尸体上解剖而来;实验所需要的1% Triton X-100购自华美生物工程公司;十二烷基硫酸钠购自阿拉丁试剂有限公司;磷酸盐缓冲液 (PBS) 购自北京科学技术有限公司;HE染色试剂盒、多聚赖氨酸溶液和柠檬酸钠缓冲溶液购自江苏凯基生物技术股份有限公司;人骨髓来源内皮祖细胞购自上海康朗生物科技有限公司。主要仪器:冷冻干燥机购自北京博医康实验仪器有限公司;Instron 5544力学检测仪购自美国 Instron公司;JC2000C接触角测量仪购自上海中晨数字技术设备有限公司;紫外可见分光光度计Lambda17购自美国PE公司;电热扶风干燥箱购自上海圣欣科学仪器有限公司;扫描电子显微镜购自日本电子株式会社;倒置显微镜购自日本Olympus公司。
1.2 方法
1.2.1 制备血管脱细胞支架
具体步骤:1) 新鲜解剖的猪颈动脉在无菌的条件下浸入低温生理盐水中反复清洗,更换生理盐水,直到生理盐水清澈透明;2) 清洗彻底的血管放入1% Triton X-100和0.5%十二烷基硫酸钠混合溶液中并在室温条件下予以充分浸泡48 h;3) 浸泡后的血管取出后用PBS溶液反复清洗,清洗干净后继续浸泡于PBS溶液中维持30 d,放于低温冰箱中每天换液2次;4) 在真空冷冻干燥箱(−75 ℃) 中冷冻干燥30 min,即制得血管脱细胞支架。
1.2.2 APZ改性血管脱细胞支架的制备
1) 将APZ溶解在50 mL的乙醇中并超声30 min,使APZ的溶解能够充分均匀。2) 将冻干后的血管脱细胞支架浸润在PBS中30 min,取出后平放在一次性表面皿中。3) 上述材料稍干后,采用共沉降法将APZ溶液均匀地放在脱细胞支架的内外表面使其充分接触。4) 将未作处理的血管脱细胞支架定义为对照组1,将APZ改性的脱细胞支架作为对照组2。
1.2.3 APZ改性血管脱细胞支架的物理性能检测
1) 形态学观察:改性后的脱细胞支架表面形态通过扫描电镜来观察,观察前对样本进行干燥和喷金处理。
2) 缝合撕裂强度的测定:将样品裁剪为 5 mm×6 mm的矩形,厚度达0.25 mm。浸泡24 h后的待测试的样品一端固定于测试仪,另一端则通过6-0Prolene线穿过样品后连接于生物力学测试仪。调整两端间距离为2 cm,以6 mm/min的速度牵拉两端直至样品完全断裂。读取断裂时的数值,将获取的样品缝合撕裂强度数值和正常血管的缝合撕裂强度做对比。
3) 亲水性测定:使用接触角测量仪 (JC2000C)对改性脱细胞支架的液体接触角进行测量,对样本的不同位置进行6次测量,取其平均值。
1.2.4 血小板粘附实验检测
采用pH为7.4的PBS清洗脱细胞支架、改性脱细胞支架及人造血管后浸泡大约30 min,取出后放置超净台内进行充分干燥。取1 mL富血小板的浸没样品到24孔板中,振荡时间约1 h,PBS冲洗数次之后用2.5%的戊二醛溶液进行固定,固定时间为30 min,然后再用PBS清洗干净样品,用50%、60%、70%、80%、90%和100%的乙醇溶液进行逐级脱水后放置超净台待其自然晾干。喷金后用QUANTA-200扫描电镜对材料表面进行拍照。
1.2.5 体外溶血实验检测
含柠檬酸钠抗凝剂的8 mL成人全血和10 mL浓度为0.9% NaCl水溶液进行混合稀释。浸泡过PBS的脱细胞支架、改性脱细胞支架和人造血管分别放入10 mL 0.9% NaCl溶液中,在恒温37 ℃条件下维持30 min,加入稀释过的血液200 μL后充分摇匀,继续37 ℃恒温1 h,1 000 r/min离心10 min后取上清液,加入96孔板,用酶标仪 (BioTek Synergy2) 测定吸光度值 (值),波长调整为545 nm。蒸馏水10 mL加稀释血液0.2 mL作为对照组;0.9 % NaCl水溶液10 mL加稀释血液0.2 mL作为阴性对照。平行试验3组后取平均值。溶血率计算公式如下:

其中,D为阴性对照吸光度;D为阳性对照吸光度;D为试验样品吸光度。
1.2.6 体外复钙实验检测
将脱细胞支架、改性脱细胞支架和人造血管分别置于PBS中浸泡后放置于96孔板中,然后将0.025 mol/L CaCl2溶液和贫血小板血浆 (Platelet-poor plasma,PPP) 各0.1 mL分别加入到96孔板中,使用酶标仪 (BioTek synergy2) 测量值,波长选择为405 nm。0.1 mL的0.025 mol/L CaCl2溶液加0.1 mL的血浆作为对照组。实验平行进行3次,最后取其平均值。
1.2.7 MTT法测体外细胞毒性
将脱细胞支架、改性的脱细胞支架以及人造血管剪成3 mm×3 mm的正方形备用。培养满瓶的人EPCs去除培养液后加入0.25%的胰蛋白酶进行消化、吹打、离心。将人EPCs加入新培养液后稀释成1×104cell/孔细胞悬浮液,采用96孔板进行实验,按照100 μL/孔的量培养一段时间,使细胞增殖80%–90%左右再进行下一步实验。空白对照组、阴性对照组和试验样品组每组接种6孔,在放置于培养箱内 (37 ℃,5% CO2) 24 h和72 h后弃去培养液。空白对照组采用MTT液,阴性对照采用细胞培养液,试验组加入材料浸取液。96孔板中加20 μL (5 mg/mL) 的MTT溶液染色4 h后去除孔内液体,每孔再加入150 μL的二甲基亚砜 (DMSO) 溶液,在室温下充分振荡约10 min,用酶标仪在490 nm处测量吸光度值 (),反复测量3次取平均值。材料的毒性程度可以通过RGR值的转换直观地表现出来,见表1。

表1 细胞毒性分级标准
具体公式为:

式中,D为阴性对照吸光度;D为空白对照吸光度;D为试验样品吸光度。
1.2.8 骨髓源内皮祖细胞 (Endothelial progenitor cells,EPCs) 培养构建内皮化
培养瓶经过高压蒸汽灭菌放入超净台,输送管道用75%乙醇灌注在超净台内消毒过夜,整个系统在超净台内进行组装完成,并向组装循环系统内注入无菌PBS液用来冲洗掉残留的乙醇。将改性后的血管脱细胞支架置于培养系统中,一端进行结扎,另一端则与外界连接管相连;取细胞密度达到1×106/mL的EPCs细胞悬液1 mL,注入改性的脱细胞支架内,于37 ℃、5% CO2的环境下培养6 h后翻转90°,按相同方法再次注入EPCs悬液;反复操作6次,注入细胞量约6×106,在饱和湿度的培养箱中继续静止孵育4 h后开启蠕动泵,以1 mL/min的速度培养7 d。改性血管脱细胞支架血管内皮化检测:分别培养1 d和7 d后,取出支架,行HE检测和vWF特异性染色,观察EPCs在血管内生长。
2 结果与分析
2.1 APZ改性脱细胞血管支架的物理性能测定
通过扫描电镜观察发现APZ改性脱细胞血管支架表面形态为纳米纤维结构,排列无序。APZ改性脱细胞血管支架的大体外观图见图1,图2为SEM表面形态结构图,而图3为支架的HE 染色。
软件分析SEM图像,APZ改性脱细胞血管支架的纳米纤维直径分布在62–80 nm,平均为 (73.5±6.1) nm。与脱细胞支架和猪颈动脉并无明显的不同。
APZ改性脱细胞支架抵抗缝线撕裂力的能力可以通过测量其缝合撕裂强度得出 (表2)。APZ改性脱细胞支架的缝合撕裂强度为 (4.4±0.6) N,强度要明显好于单纯脱细胞支架,与猪颈动脉相仿。
评估磷铵两性离子改性脱细胞血管支架亲水性可以通过测量支架膜表面的静态水接触角,得出APZ改性脱细胞血管支架具有较大的水接触角,其表面表现为疏水性 (图4,表2)。明显要优于脱细胞支架和猪颈动脉。
进行绿色建筑设计,就一定要选用科学节能的建筑材料,对于高层民用建筑来讲,设计者要注重材料的环保与节能性,尽量使用可以循环的材料,避免使用质量低劣、污染较高的材料,更不得采用国家和地方禁止和限制使用的建筑材料及制品。可以充分利用本地材料以及自然材料,这样可以降低运费与资金,节省资源。另外,还可以回收一些废弃物,可以对其中还有利用价值的材料进行重复利用,从而达到节能的效果。在具体设计时,可以简化建筑的造型,且无大量装饰性构件,只要将建筑设计得美观大方即可,结构形式可以选择混凝土结构、钢结构等强度质量较高的结构体系进行设计。
2.2 血小板粘附
SEM图5A为未改性的脱细胞支架,存在大量的血小板粘附,并且能够看出血小板变形后伸出了伪足。SEM图5B为人造血管血小板粘附实验,可以看出少量的血小板粘附。SEM图5C为APZ改性的脱细胞支架表面图像,未见明显的血小板粘附。由上述3张血小板粘附SEM图可以看出,经过APZ改性得到的脱细胞支架材料可以抵抗血小板粘附,从而减少血小板对异体的排斥作用,是可以有效地提高材料的血液相容性。

图1 APZ改性脱细胞血管支架大体观

图2 APZ改性脱细胞血管支架SEM图
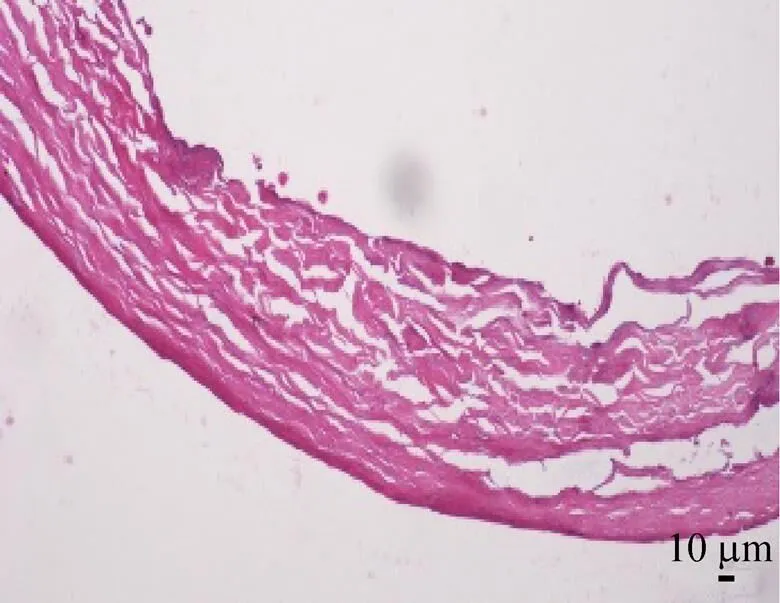
图3 APZ改性脱细胞血管支架HE染色

图4 APZ改性脱细胞血管支架接触角(1S和10S)

表2 APZ改性脱细胞支架的生物学性能
APZ modified acellular vs. Acellular scaffold; APZ modified acellular vs. Porcine carotid artery (*<0.01; ns: no significance.).

图5 血小板粘附扫描电子显微镜图(×2 000)
2.3 溶血实验
表3是脱细胞支架、人造血管和改性脱细胞支架的溶血试验结果。根据表3的数据分析,APZ改性脱细胞支架材料的溶血率仅为0.6%,具有良好的血液相容性。生物医用材料要求溶血率应小于5%,从数据上可以看出改性的脱细胞支架非常符合生物医用材料的要求。
2.4 复钙实验
内源性凝血系统功能往往通过血浆复钙实验来评价。血浆中去除血小板后加入Ca2+使可溶性的纤维蛋白原转化成可溶性纤维蛋白,而可溶性纤维蛋白则交联成不溶物形成血栓。血液相容性越好则血浆凝固时间越长。记录1/2max作为复钙化凝血时间以此来评价凝血功能。
脱细胞支架、APZ改性脱细胞支架和人造血管的复钙时间分别为10.2 min、18.1 min和15.9 min。APZ改性血管脱细胞支架材料复钙时间比脱细胞支架和人造血管延长。可以得出APZ改性血管脱细胞支架材料延长了可溶性的纤维蛋白原转化为可溶性纤维蛋白的时间,这也说明APZ改性脱细胞支架可以提高血液相容性。

表3 脱细胞支架的溶血试验结果
2.5 MTT法测体外细胞毒性
APZ改性脱细胞支架和对照组1、2的细胞经过24 h和72 h的相对增殖率见表4。从表中可以看出无论是APZ改性脱细胞支架还是对照组其细胞毒性分级都为1级即无细胞毒性,表现了很好的细胞相容性。但APZ改性后的脱细胞支架72 h后细胞增殖率为93.4%,而对照组1、2分别为77.6%和75.7%,说明APZ改性后的脱细胞支架细胞增殖率明显得到了提高。表明经APZ表面改性后的脱细胞支架表现出更好的细胞相容性。
2.6 骨髓源内皮祖细胞可以在APZ改性脱细胞血管支架上成功内皮化
组织工程血管培养过程中,第1天时可见少量细胞附着在改性脱细胞支架表面,HE染色可见有深染的细胞存在(图6A),表明细胞在第1天即可附着生长。第7天可见改性脱细胞支架表面大量细胞附着,可见细胞沿血管壁表面呈多层排列状态生长(图6B),行组织切片HE染色可见大量细胞均匀地生长在改性脱细胞支架外层,细胞排列紧密。vWF是EPCs的特异性抗原,不论是在早期还是中期均有较高的表达。第1天时vWF免疫组化未见明显特异性染色(图6C),在第7天时vWF免疫组化呈现明显的特异性染色,考虑附着的细胞为EPCs,可以看出细胞大量生长,呈现多层排列状态(图6D)。通过循环灌注装置的培养可以将EPCs种植在APZ改性脱细胞血管支架上,在7 d时可以观察到EPCs成功分布于血管壁,紧密贴附,生长良好。

表4 细胞毒性分析

3 讨论
组织工程目前在治疗血管疾病研究方面,主要是通过手术将工程血管材料直接代替病变的血管。自体血管毕竟是有限的,小部分患者移植的血管为自体血管,而大部分患者使用的为各种人工血管。目前临床上所使用的大口径人工血管尽管近期通畅率高但是远期通常率较差,而小口径人工血管近期通畅率则比较低,限制了临床应用[22]。血栓形成和不能有效地内皮化而导致的内膜增生是影响通畅率的主要因素[23]。临床急需解决抗血栓抑制内膜增生的问题,这一方向的研究引发了血管组织工程学的进一步发展。为了改善材料的表面生物特性,又发展了各种表面接枝及修饰技术[24-25],通过组织工程材料的改性,可以明显提高细胞对工程材料的黏附和生长,以此来增加抗血栓和促进内皮化的实现。
细胞外基质参与生物体的新陈代谢,有着重要的功能,不仅维持着组织的结构而且连接组织中的实质细胞,还直接对实质细胞的形态、转型以及分裂增殖起到一定的影响。最符合生物要求以及能够模拟体内细胞外环境的生物材料应当是具备细胞外基质结构的脱细胞支架材料[26-27],即去除了实质细胞保留了相对完整的细胞外骨架结构。脱细胞支架材料本身不仅具备接近天然血管的强度,而且其中的胶原纤维有利于内皮细胞的附着和提供了必要的生长环境;其中弹力纤维保留了血管的舒张和收缩功能,这两种纤维结构的完整性为进一步的细胞种植起到了非常重要的作用。由于脱细胞支架去除了细胞的抗原性,极大地降低了免疫反应,避免了移植物的急性炎症和免疫排斥剧烈反应的发生[28]。国内外相关动物实验表明脱细胞支架材料具备很好的应用前景:3个月以上通畅率相当高,可高达80%–100%;实验阶段未观察到明显的瘤样扩张、钙化及局部感染情况的发生;具有种子细胞覆盖和三维生长的外环境[29-30]。
APZ构建到医用材料表面已被证实具有很好的抗凝血和生物相容性特点[31],但尚未有应用到脱细胞支架的研究。将磷铵两性离子共沉淀到脱细胞支架上,溶血实验和复钙化凝血时间实验表明APZ改性得到的脱细胞支架材料具有良好的血液相容性。通过体外细胞毒性实验表明改性的脱细胞支架具有较低的细胞毒性,完全符合生物材料的医用要求。改性后的脱细胞支架材料在尺寸、制备方法、稳定性和相容性方面具备生物新型材料的特点,具有相当广阔的应用前景。血小板粘附实验表明改性后的脱细胞支架表面无明显的血小板聚集,血小板基本无明显变形,有呈单个粘附的孤立血小板存在,具备很好的血液相容性。细胞毒性实验表明改性后的脱细胞支架无细胞毒性,具有非常好的细胞相容性;而各项物理特征检测也表明改性后的脱细胞支架在力学性能和亲水性方面要远高于未改性前。以上实验数据表明了改性后的脱细胞支架具备生物相容性高、抗凝能力强、力学性质好等特性。
理想的血管替代材料不仅要具备良好的机械性能,而且也要非常好的柔软度和韧性;内皮细胞可根据温度和血流的变化有相应的舒缩反应,并能根据外部环境的变化和生物体的需要分泌生物活性物质,以便保持血管长期通畅而不形成血栓[32-33]。因此对于血管替代材料应该具有完整的内皮细胞结构[34],从而达到长期的通畅目的[35]。
内皮祖细胞 (EPCs) 在血管新生过程中起着相当重要的作用,是血管内皮细胞的干细胞[36]。近十年的研究发现表明,成熟血管内皮细胞移植后不能整合进血管发生部位,即不能参与血管的修复与重塑。正常人外周血中存在着微量的EPCs分化的成熟内皮细胞[37],EPCs诱导分化成内皮细胞符合生理。离体扩增培养法主要从骨髓、脐带血以及成人外周血中收集EPCs,是获取EPCs的主要来源。应用EPCs构建组织工程血管目前已成为研究的热点,在体内外实验中都已证实EPCs具有血管内皮细胞的分化潜能,虽然尚未在临床上成功模拟血管组织诱导,但是EPCs的分化潜能已得到了充分的肯定,其分化潜力在不断开发中[38-40]。骨髓中获取EPCs更为方便,为APZ改性血管脱细胞支架材料内皮化创造了有利条件。
构建血管组织工程支架的最终目标是构建出具备生物功能的可供移植的血管组织。通过EPCs体外培养种植于APZ改性脱细胞支架获得成功,表明该APZ改性血管脱细胞支架与人EPCs有良好的生物相容性,此部分研究为进一步构建和验证组织工程血管提供了实验基础。
以上研究表明,通过血管脱细胞支架的APZ改性,可以保持原有血管的物理性质,增加了疏水功能,成功构建了骨髓源EPCs内皮化,具备了移植的条件。主要得出了以下结论:1) APZ改性得到的脱细胞支架材料未见血小板粘附,保留了抗血栓的特性。说明APZ将减少血小板对异体的排斥反应,从而提高了材料的血液相容性。2) APZ改性得到的脱细胞支架材料的溶血率明显小于生物医用材料要求的5%,表明改性后的材料本身具有良好的血液相容性。3) APZ改性血管脱细胞支架材料延长了可溶性的纤维蛋白原转化为可溶性纤维蛋白的时间,表现出更好的血液相容性。4) 经APZ表面改性的脱细胞支架无细胞毒性,表现出很好的细胞相容性。5) APZ改性血管脱细胞支架抵抗缝线缝合的撕裂力和天然动脉相仿,增加了疏水功能。6) 通过培养装置成功实现了人骨髓源EPCs内皮化,为最终临床应用奠定了实验基础。
[1] Daniel S, Luke R. Long chronic total occlusions: revascularization strategies. Semin Intervent Rad, 2018, 35(5): 469–476.
[2] Mi HY, Jing X, Li ZT, et al. Fabrication and modification of wavy multicomponent vascular grafts with biomimetic mechanical properties, antithrombogenicity, and enhanced endothelial cell affinity. J Biomed Mater Res Part B Appl Biomater, 2019: 4973–4981.
[3] Zhang Y, Li XS, Guex AG, et al. A compliant and biomimetic three-layered vascular graft for small blood vessels. Biofabrication, 2017, 9(2): 025010.
[4] Saberianpour S, Heidarzadeh M, Geranmayeh MH, et al. Tissue engineering strategies for the induction of angiogenesis using biomaterials. J Biol Eng, 2018, 12: 36.
[5] Thottappillil N, Nair PD. Scaffolds in vascular regeneration: current status. Vasc Health Risk Manag, 2015, 11: 79–91.
[6] Adipurnama I, Yang MC, Ciach T, et al. Surface modification and endothelialization of polyurethane for vascular tissue engineering applications: a review. Biomater Sci, 2016, 5(1): 22–37.
[7] Barabaschi GD, Manoharan V, Li Q, et al. Engineering pre-vascularized scaffolds for bone regeneration. Adv Exp Med Biol, 2015, 881: 79–94.
[8] Boccafoschi F, Botta M, Fusaro L, et al. Decellularized biological matrices: an interesting approach for cardiovascular tissue repair and regeneration. J Tissue Eng Regen Med, 2017, 11(5): 1648–1657.
[9] Ren XK, Feng YK, Guo JT, et al. Correction: Surface modification and endothelialization of biomaterials as potential scaffolds for vascular tissue engineering applications. Chem Soc Rev, 2015, 44(15): 5745.
[10] Liu RH, Ong CS, Fukunishi T, et al. Review of vascular graft studies in large animal models. Tissue Eng Part B Rev, 2018, 24(2): 133–143.
[11] Porzionato A, Sfriso MM, Pontini A, et al. Development of small-diameter vascular grafts through decellularization of human blood vessels. J BiomaterTiss Eng, 2017, 7(2): 101–110.
[12] An J, Chen S, Gao J, et al. Construction and evaluation of nitric oxide generating vascular graft material loaded with organoselenium catalyst via layer-by-layer self-assembly. Sci China Life Sci, 2015, 58(8): 765–772.
[13] Jin C, Jiang YL, Han QR, et al. Polysulfones with covalently-attached zwitterionic phosphorylcholine structure for improving blood compatibility. Acta Polym Sin, 2015(3): 306–311 (in Chinese).金灿, 江玉亮, 韩巧荣, 等. 聚砜共价键合磷铵两性离子的结构修饰及其血液相容性的研究. 高分子学报, 2015(3): 306–311.
[14] Qian T. Synthesis and properties of new anticoagulant materials modified by ammonium phosphate amphoteric ions[D]. Nanjing: Nanjing Normal University 2011 (in Chinese).钱涛. 磷铵类两性离子修饰的新型抗凝血材料的合成与性质研究[D]. 南京: 南京师范大学, 2011.
[15] McKee RA, Wingert RA. Repopulating decellularized kidney scaffolds: an avenue fororgan generation. Materials (Basel), 2016, 9(3): 190.
[16] Dunn A, Talovic M, Patel K, et al. Biomaterial and stem cell-based strategies for skeletal muscle regeneration. J Orthop Res, 2019: 275–308.
[17] Wilczek P, Paulina G, Karolina J, et al. Biomechanical and morphological stability of acellular scaffolds for tissue-engineered heart valves depends on different storage conditions. J Mater Sci Mater Med, 2018, 29: 106.
[18] Roelofs LAJ, De Jonge PKJD, Oosterwijk E, et al. Bladder regeneration using multiple acellular scaffolds with growth factors in a bladder. Tissue Eng Part A, 2018, 24(1/2): 11–20.
[19] Starnecker F, König F, Hagl C, et al. Tissue-engineering acellular scaffolds-The significant influence of physical and procedural decellularization factors. J Biomed Mater Res Part B Appl Biomater, 2018, 106(1): 153–162.
[20] Zhang J, Liu C, Feng FL, et al. A PC-PU nanoparticle/PU/decellularized scaffold composite vascular patch: Synergistically optimized overall performance promotes endothelialization. Colloids Surf B Biointerfaces, 2017, 160: 192–200.
[21] Zhang J, Wang Y, Liu C, et al. Polyurethane/polyurethane nanoparticle-modified expanded poly(tetrafluoroethylene) vascular patches promote endothelialization. J Biomed Mater Res Part A, 2018, 106(8): 2131–2140.
[22] Pashneh-Tala S, MacNeil S, Claeyssens F. The tissue-engineered vascular graft-past, present, and future. Tissue Eng Part B Rev, 2015, 22(1): 68–100.
[23] Best C, Tara S, Wiet M, et al. Deconstructing the tissue engineered vascular graft: evaluating scaffold pre-wetting, conditioned media incubation, and determining the optimal mononuclear cell source. Acs Biomater Sci Eng, 2017, 3(9): 1972–1979.
[24] Krawiec JT, Liao HT, Kwan LL, et al. Evaluation of the stromal vascular fraction of adipose tissue as the basis for a stem cell-based tissue-engineered vascular graft. J Vasc Surg, 2017, 66(3): 883–890.
[25] Onwuka E, Best C, Sawyer A, et al. The role of myeloid cell-derived PDGF-B in neotissue formation in a tissue-engineered vascular graft. Regen Med, 2017, 12(3): 249–261.
[26] Hu D, Zhang DY, Liu B, et al. Optimization of preparation of rat kidney decellularized scaffold by combining freeze-thawing with perfusion. Chin J Biotech, 2019, 35(2): 307–318 (in Chinese). 胡东, 张德迎, 刘博, 等. 冻融联合灌注法优化大鼠肾脏脱细胞支架的制备. 生物工程学报, 2019, 35(2): 307–318.
[27] Xu LC, Guo YB, Huang Y, et al. Constructing heparin-modified pancreatic decellularized scaffold to improve its re-endothelialization. J Biomater Appl, 2018, 32(8): 1063–1070.
[28] Liu WY, Lin SG, Zhuo RY, et al. Xenogeneic decellularized scaffold: a novel platform for ovary regeneration. Tissue Eng Part C Methods, 2017, 23(2): 61–71.
[29] Liang DH, Hsiao BS, Chu B. Functional electrospun nanofibrous scaffolds for biomedical applications. Adv Drug Deliv Rev, 2007, 59(14): 1392–1412.
[30] Kajbafzadeh AM, Khorramirouz R, Kameli SM, et al. Three-year efficacy and patency follow-up of decellularized human internal mammary artery as a novel vascular graft in animal models. J Thorac Cardiovasc Surg, 2018, 157(4): 1494–1502.
[31] Wang Y. Computer simulation of the interaction between protein and polyurethane modified by amphoteric structure of ammonium phosphate[D]. Nanjing: Nanjing Normal University, 2010 (in Chinese).王颖. 磷铵两性离子结构表面修饰的聚氨酯材料与蛋白质相互作用的计算机模拟[D]. 南京: 南京师范大学, 2010.
[32] Ardila DC, Liou JJ, Maestas D, et al. Surface modification of electrospun scaffolds for endothelialization of tissue-engineered vascular grafts using human cord blood-derived endothelial cells. J Clin Med, 2019, 8(2):185.
[33] Gao QD, Zhu XL, Xiang JX, et al. Strategies to choose scaffold materials for tissue engineering. Chin J Biotech, 2016, 32(2): 172–184 (in Chinese).高庆东, 祝旭龙, 向俊西, 等. 基于组织工程研究的可降解支架材料选择策略. 生物工程学报, 2016, 32(2): 172–184.
[34] Askari F, Solouk A, Shafieian M, et al. Stem cells for tissue engineered vascular bypass grafts. Artif Cells Nanomed Biotechnol, 2017, 45(5): 999–1010.
[35] Peng G, Yao DY, Niu YM, et al. Surface modification of multiple bioactive peptides to improve endothelialization of vascular grafts. Macromol Biosci, 2019, 19(5): 5187–5195.
[36] Machado LSG, Oliveira ACD, Semedo-Kuriki P, et al. Endothelial progenitor cells and vascular endothelial growth factor in patients with Takayasu's arteritis. Adv Rheumatol, 2018, 58: 24.
[37] Smadja DM, Cornet A, Emmerich J, et al. Endothelial progenitor cells: characterization,expansion, and prospects for autologous cell therapy. Cell Biol Toxicol, 2007, 23(4): 223–239.
[38] Tal R, Dong DR, Shaikh S, et al. Bone marrow-derived endothelial progenitor cells contribute to vasculogenesis of pregnant mouse uterus. Biol Reprod, 2019, 100(5): 65–93.
[39] Jia YC, Zhu Y, Qiu S, et al. Exosomes secreted by endothelial progenitor cells accelerate bone regeneration during distraction osteogenesis by stimulating angiogenesis. Stem Cell Res Ther, 2019, 10: 12.
[40] Keighron C, Lyons CJ, Creane M, et al. Recent advances in endothelial progenitor cells toward their use in clinical translation. Front Med (Lausanne), 2018, 5: 354.
Acellular vascular scaffolds modified by ammonium phosphate zwitterionscan effectively resist thrombosis and promote endothelialization
Su Feng, Zhipeng Chen, Cheng Liu, and Tong Qiao
Drum Tower Clinical Medicine College, Nanjing Medical University, Nanjing 210000, Jiangsu, China
Due to limited availability of autologous blood vessels (blood vessels from the same recipient used for vascular transplantation materials) and inadequate growth ability of non-autologous blood vessels (artificial blood vessel transplantation materials), more and more attention has been paid to tissue engineering blood vessels. In this study, we constructed an ammonium phosphate zwitterion modified acellular vascular scaffold with highly biocompatible bone marrow-derived endothelial progenitor cells as the inner layer of a new vascular transplantation material. The vascular acellular scaffolds were modified by a simple method—co-precipitation method.The platelet adhesion test, hemolysis test, recalcification test and cytotoxicity of acellular vascular scaffoldswere evaluated. Ammonium phosphate zwitterions modified endothelial progenitor cells on the surface of acellular scaffolds with concave and convex structure on the surface of natural vascular lumen can be effectively promoted by improving anticoagulant activity. Modified acellular scaffolds have similar mechanical properties to natural blood vessels and can effectively construct endothelialization. The results of this study provide a preliminary exploration for the modification of vascular acellular scaffolds to achieve anti-thrombosis and endothelialization.
ammonium phosphate zwitterions, acellular scaffolds, endothelialization
February 17, 2019;
April 28, 2019
National Natural Science Foundation of China (No. 81370387).
Tong Qiao. Tel: +86-25-83106666; E-mail: qiaotongmail@nju.edu.cn
冯苏, 陈志鹏, 刘澄, 等. 磷铵两性离子改性血管脱细胞支架可以有效体外抗血栓和内皮化. 生物工程学报, 2019, 35(9): 1750–1760.
Feng S, Chen ZP, Liu C, et al. Acellular vascular scaffolds modified by ammonium phosphate zwitterions can effectively resist thrombosis and promote endothelialization. Chin J Biotech, 2019, 35(9): 1750–1760.
国家自然科学基金 (No. 81370387) 资助。
(本文责编 陈宏宇)

