基于SSR标记的MCID法鉴定中国自主选育的葡萄品种
魏新科,樊秀彩,王晨,刘崇怀*
(1. 南京农业大学园艺学院/江苏省果树品种改良与种苗繁育工程中心,江苏南京 210095;2. 中国农业科学院郑州果树所,河南郑州 450009)
葡萄属于葡萄科(Vitaceae)葡萄属(Vitis),是多年生落叶木质藤本植物[1],按用途可分为鲜食品种、酿酒品种以及砧木品种等。由于其具有极高的经济价值和社会效益,在世界范围内有大面积栽培,是占据重要地位的果树之一。葡萄栽培历史悠久,种类丰富,近年来,随着科学技术的发展,葡萄育种进程加快,品种间基因交流更加频繁,种类日益繁多。许多葡萄品种在植物学性状上非常相似,传统的形态学品种鉴定方式难以达到理想的鉴别效果。生化标记容易受环境、气候影响,可靠性低[2]。SSR分子标记能够直接显示出DNA分子水平上的差异,不受环境等因素的影响,具有多态性高、共显性、操作简便快捷、结果稳定等优点,被广泛应用于生物群体遗传结构分析、基因鉴定、生物多态性分析等方面[3-4]。
人们通常利用分子标记结果绘制DNA指纹图谱,或者通过软件生成种质指纹图谱后进行聚类分析,绘制聚类树状图表示种质之间的遗传关系,判断其遗传距离,但针对品种鉴定方面提供的信息不够直观。为了将DNA指纹转化成区分不同种质的有效信息,张晓莹等[5]提出了基于DNA标记的人工绘制植物品种鉴别图(Manual Cultivar Identification Diagrm,MCID)方法应用于品种鉴定,最先应用在葡萄品种鉴定上。MCID法是在利用引物进行PCR扩增后,分析同一对引物扩增出的不同品种的电泳条带,条带相同的分为一组,区分条带特殊的品种,标记各引物及条带从而得到不同引物扩增出的不同品种的条带鉴定图。
MCID法可以将DNA标记得到的遗传信息转换为更加直观,便于参考的鉴定图。本研究利用9对SSR引物进行PCR扩增,根据同一种引物下不同葡萄品种DNA序列长度的多态性采用MCID方法对中国自主选育的308个葡萄品种进行鉴定。同时对这些品种进行了遗传多样性分析,以期为我国葡萄品种鉴定、品种保护提供理论依据和参考价值。
1 材料与方法
1.1 材料
供试材料主要来自中国农业科学院郑州果树研究所国家葡萄种质资源圃和张家港市神园葡萄科技有限公司,共308份葡萄种质材料(表1)。于2019年4月取植株顶端的幼嫩叶片,暂存于冰盒中带回实验室,之后液氮冻样保存于-80 ℃冰箱中。
1.2 DNA提取和检测
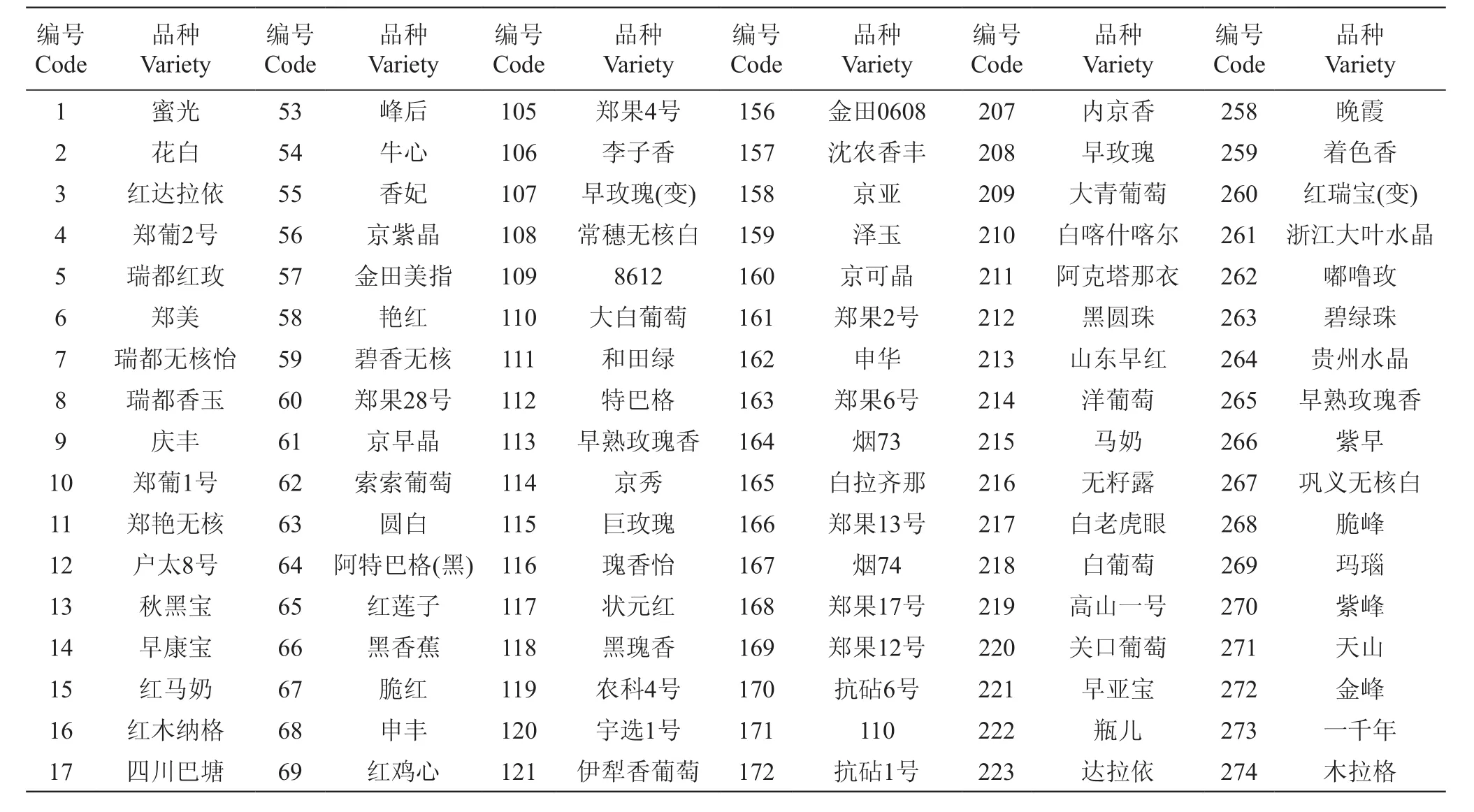
表1 308份供试葡萄种质资源Table 1 308 grape germplasms resource in this research
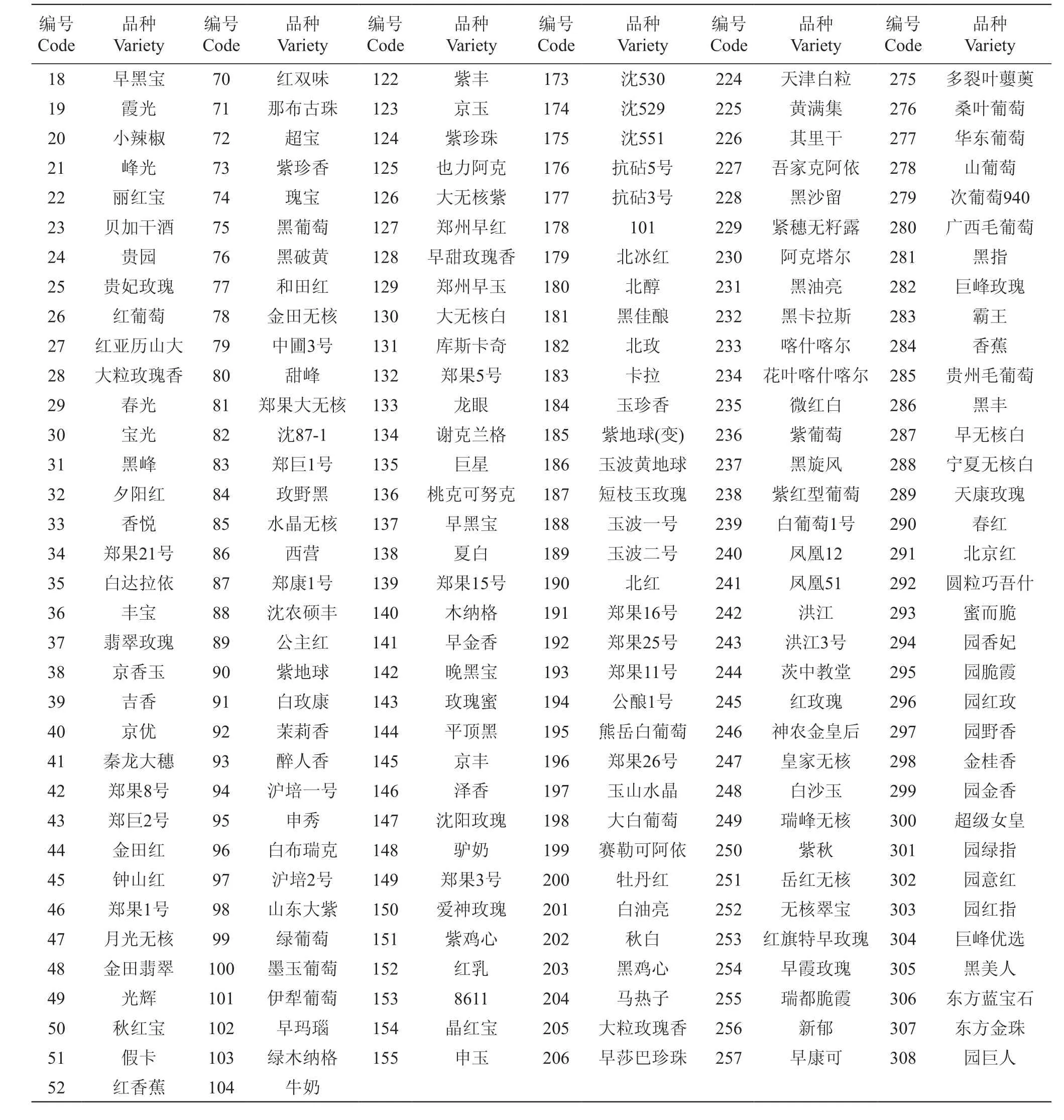
续表1 Continued table 1
使用北京诺贝莱生物科技有限公司生产的提取植物基因组DNA试剂盒,参考说明书提取308个葡萄品种的DNA。利用1%的琼脂糖凝胶对已提取的DNA进行检测。将含有DNA条带的琼脂糖凝胶放在自动成像系统中的紫外光照下观察并拍照。利用Nano Drop1000超微量分光光度计检测DNA样品的浓度、OD260/OD280等参数,将质量较好的DNA样品稀释至50 ng/μL,放入-20 ℃冰箱保存备用。
1.3 引物选择及PCR扩增
研究参照国际葡萄品种目录数据库(Vitis Internationl Variety Catalogue, VIVC, http://www.vivc.de/)公布的9对葡萄国际通用引物进行筛选分析,引物序列由通用生物公司合成。各引物序列如下:
采用如下比例的25 μL PCR反应体系:12.5 μL的Master Mix,1 μL的DNA模板和9.5 μL的双蒸水,上下游引物各1 μL。PCR反应程序为:98 ℃预变性3 min;98 ℃变性10 s,50~60 ℃退火10 s,72 ℃延伸30 s,共35个循环;最后72 ℃延伸2 min,结束后4 ℃保存。

表2 引物序列信息Table 2 Information of primer sequences
1.4 PCR产物电泳检测
SSR-PCR产物用8%的非变性聚丙烯酰胺凝胶(PAGE)电泳检测,电泳结束后取出胶片用去离子水清洗,之后用0.1%硝酸银溶液震荡染色5 min,然后用去离子水漂洗1次,加入1.5% NaOH 500 mL+0.4% 甲醛溶液进行显色反应,显色时长视情况而定,至条带显示清晰即可,显色后用去离子水漂洗一次,取出胶片拍照。
1.5 数据统计与分析
采用0,1统计法对PCR产物扩增结果进行统计,区分不同引物扩增出的各品种特异条带。在电泳图上选取一个条带长度,将在同一分子量上,有特征条带的记为1,没有条带的记为0,构建0/1矩阵。根据9对引物对308个葡萄品种的扩增结果所构建的0/1矩阵,利用NTSYSpc Version 2.10e软件计算两两品种间的遗传相似系数,并根据遗传相似系数,利用MEGA 7软件,采用UPGMA法对308份葡萄品种资源进行聚类分析,后期使用FigTree 1.3对聚类图进行修饰。
1.6 人工绘制植物品种鉴定图
得到聚丙烯酰胺凝胶电泳的结果后,首先选择任意一对引物的电泳图,在电泳图上选取几个清晰的条带位置,统计各片段长度处的条带多态性,将在该处有条带的品种归为一类,无条带的品种归为另一类。在每一大类中的品种可以继续通过其他引物进行区分,每一大类都可以继续分为几小组,直到所有品种被鉴别区分出来。之后,根据分组的情况,人工绘制植物品种鉴别图,将每一步用到的引物及多态性谱带大小标注到树形鉴别图的相应位置上[6-8]。人工绘制的植物品种鉴别图是基于PCR扩增后的谱带形态统计出的结果,以引物作为节点,以特征谱带的有无作为分类的依据,在每个节点后是该引物对不同品种的区分结果,包括区分出的类别或者是直接区分出来的单个品种[9]。
2 结果与分析
2.1 DNA的提取结果
本研究利用植物基因组DNA试剂盒提取葡萄DNA,部分葡萄品种的DNA电泳结果如图1,DNA片段较为完整,没有发生明显的降解,条带较为清晰,根据Nano Drop1000超微量分光光度计检测结果显示,DNA浓度在48~200 ng/μL,OD260/OD280值在1.85~2.1,大部分品种在1.9~2.0,总体上DNA质量较好,纯度满足要求,可以用于后续的扩增、鉴定等工作。
2.2 聚丙烯酰胺凝胶电泳结果
聚丙烯酰胺凝胶电泳与琼脂糖凝胶电泳相比,可以区分相差个位数碱基的片段,试验结果更加精确。图2为其中3对引物VVS2、VVMD5、VVMD27对部分品种的扩增条带结果,大部分条带清晰可见,靠近两侧的条带容易出现倾斜,原因可能是灌胶时没有保持水平或者等待胶凝固时两侧的板子夹得不严。

图1 52个葡萄品种基因组DNA琼脂糖凝胶电泳图Figure 1 Genomic DNA agarose gel electrophoresis map of 52 grape varieties
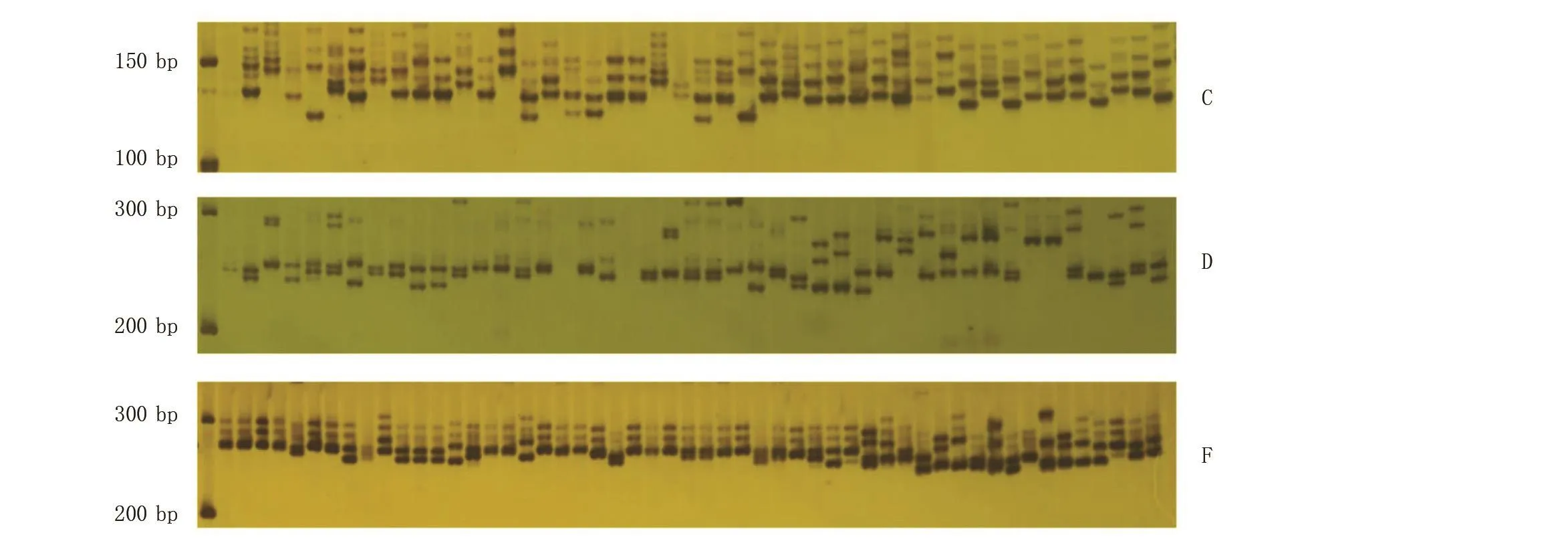
图2 引物VVS2(C)、VVMD5(D)、VVMD27(F)对部分品种扩增结果Figure 2 Primer VVS2(C), primer VVMD5(D), primer VVMD27(F) amplification results for some varieties
2.3 308个葡萄品种遗传多样性分析
根据9对引物对308个葡萄品种的扩增结果所构建的0/1矩阵,利用NTSYSpc Version 2.10e软件计算两两品种间的遗传相似系数,并根据遗传相似系数,利用MEGA 7软件,采用UPGMA法对308份葡萄品种资源进行聚类分析,后期使用FigTree 1.3对聚类图(图3)进行修饰。
聚类结果表明:308个葡萄品种共分为9类,其中有4个大类(A、B、E、F)和5个小类(C、D、G、H、I)。
A类包含47个葡萄品种,几乎全部是鲜食品种,占该组材料的95.7%。A类又可分为两个部分。第一部分含有16个品种,其中主要是江苏省张家港市神园葡萄科技有限公司培育的,如‘园金香’‘园香妃’‘园红指’‘园绿指’‘园野香’等13个鲜食葡萄品种。第二部分31个品种主要为欧亚种,包括:‘墨玉’‘木纳格’‘库斯卡奇’3个新疆地方品种,以及‘郑美’和‘金田美指’,这两个品种的亲本之一均为‘美人指’。‘翡翠玫瑰’‘贵妃玫瑰’和‘京紫晶’因都含有‘葡萄园皇后’血缘,因此也被聚合到了一起。
B类中包括40个品种,全部为鲜食品种。其中,巨峰系品种大多聚在这一类,共占17.5%。例如:‘贵园’‘峰光’‘户太8号’‘夕阳红’‘香悦’等。此外,由郑州果树研究所选育的‘郑葡1号’‘郑葡2号’因亲本相同聚在了一起;从‘紫珍香’自交后代中选出的优良品种‘沈农硕丰’和其亲本直接聚在了一起。
E类共有51个品种。其中包含3个野生种:‘桑叶葡萄’‘华东葡萄’‘山葡萄’,这3个种直接聚类在了一起;含有‘玫瑰香’血缘的9个品种‘京秀’‘早熟玫瑰香’‘大粒玫瑰香’‘艳红’‘玛瑙’‘泽玉’‘爱神玫瑰’‘泽香’‘红香蕉’聚类在这一组,占该组材料的17.6%。山西果树研究所以‘瑰宝’为母本育成的‘晚黑宝’和‘秋红宝’聚在了一起。
F类包含49个品种,其中包括22个中国地方品种,占该类材料的44.9%。材料中43.1%的地方品种聚集在本类中。‘瓶儿’‘关口葡萄’‘早亚宝’‘白葡萄’‘无籽露’‘白老虎眼’‘马热子’7个新疆地方品种聚集在一起。该类中还包括我国的7个酿酒品种,如‘北醇’‘北玫’‘熊岳白’‘黑圆珠’等。
C、D、G、H、I五个小类,各包含21、25、25、24、26个品种。C类中‘沈530’‘沈529’‘沈551’三个砧木品种直接聚集在一起;同为欧美种的‘黑香蕉’和‘红双味’因亲本之一都为‘葡萄园皇后’所以聚在一起。D类中含有1份蘡薁葡萄,即‘多裂叶蘡薁’;‘那布古珠’‘黑破黄’‘木拉格’同为地方品种聚在一起;‘伊犁香葡萄’和‘白沙玉’同为新疆地方品种聚在一起。G类含有两份刺葡萄,即‘紫秋’和‘刺葡萄940’;‘郑果25号’和‘公酿1号’同为酿酒品种,聚集在一起。该试验中大部分无核品种,如‘巩义无核白’‘无核翠宝’‘岳红无核’‘紧穗无籽’‘皇家无核’都聚在H类中。I类中包含9个地方品种,如‘伊犁葡萄’‘微红白’‘阿克塔那衣’‘马奶’‘赛勒可阿依’‘白油亮’等,占该类的34%;‘早霞玫瑰’与‘金田0608’都以‘秋黑’做亲本,聚在了一起。
通过对308份我国自主选育的葡萄品种进行聚类分析可以看出,欧亚种葡萄与欧美种葡萄没有明显区分开来,说明两者亲缘关系较近。聚类结果表明同一育种单位培育且遗传关系较近的品种大多会聚集在一起。例如,由郑州果树研究所选育的‘郑葡1号’‘郑葡2号’因亲本相同聚在了一起;由山西果树研究所以‘瑰宝’为母本育成的‘晚黑宝’和‘秋红宝’聚在了一起。不同用途的葡萄品种,大多也会分类,例如B类全部是鲜食品种,砧木品种大多聚集在C类,酿酒品种多大聚集在F类。由于所选材料品种较多,遗传背景较为复杂,部分同一种属类型的品种未能划分为同一亚类当中,这需要进一步研究探讨。
近年来,随着我国葡萄育种进程的加快,国内品种间以及与国际品种基因交流频繁,导致了葡萄遗传背景变得狭窄,因此拓展育种基础以及寻找更多的野生资源势在必行。本研究应用SSR标记从分子水平上反映了我国自主选育的葡萄种质资源的亲缘关系,为我国葡萄育种研究提供了一定的参考依据。
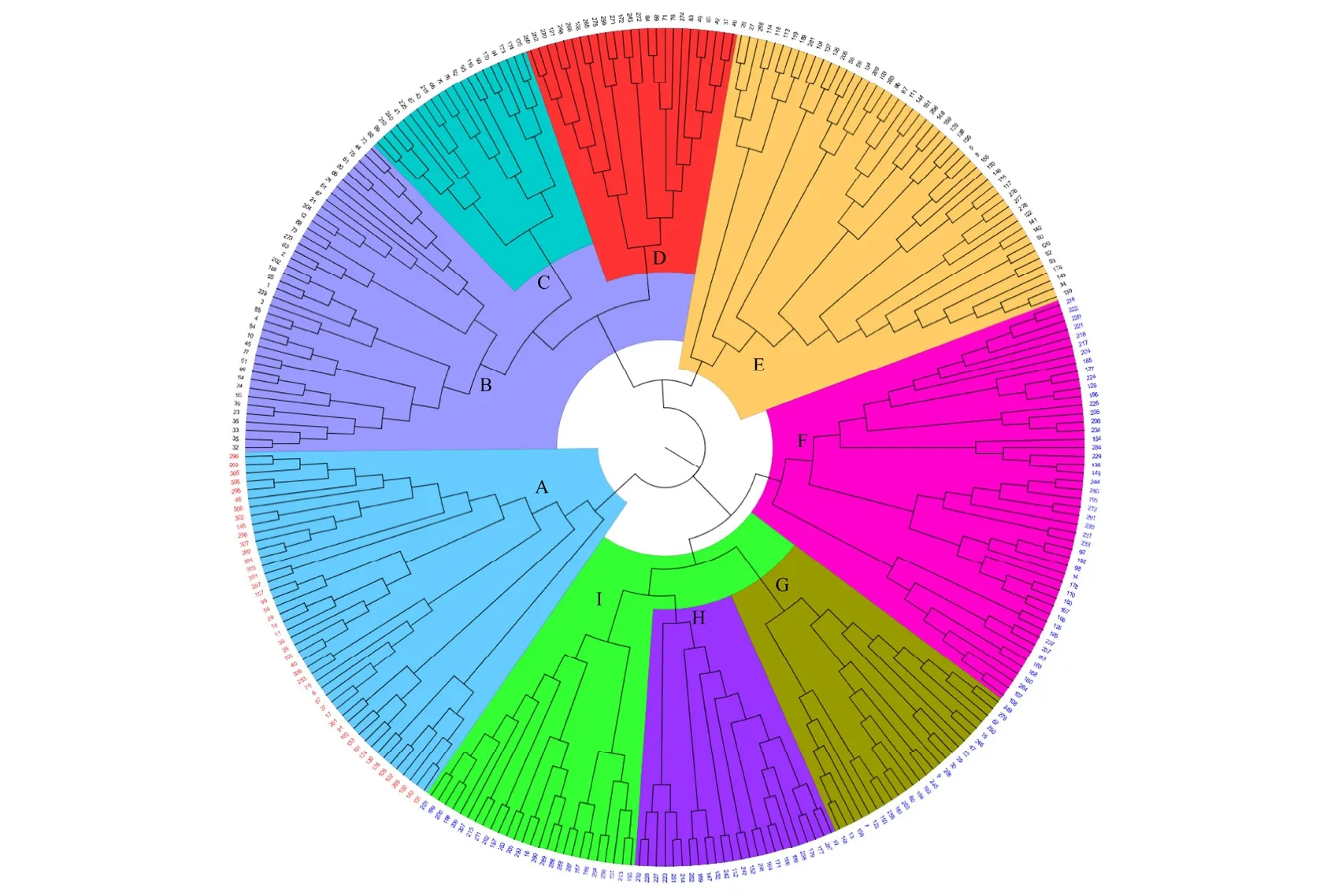
图3 基于SSR标记的308份葡萄种质聚类分析图Figure 3 Dendrogram of 308 grape cultivars based on SSR markers
2.4 308个葡萄品种鉴定分析
应用基于SSR分子标记的人工绘制植物品种鉴别图法(MCID)对中国自主选育的308个葡萄品种进行鉴定。结合9对国际通用引物的聚丙烯酰胺凝胶电泳图将308个中国自育葡萄品种鉴别区分开来。为了使图像更加清晰明了,用对应的数字编号代替葡萄品种名称。
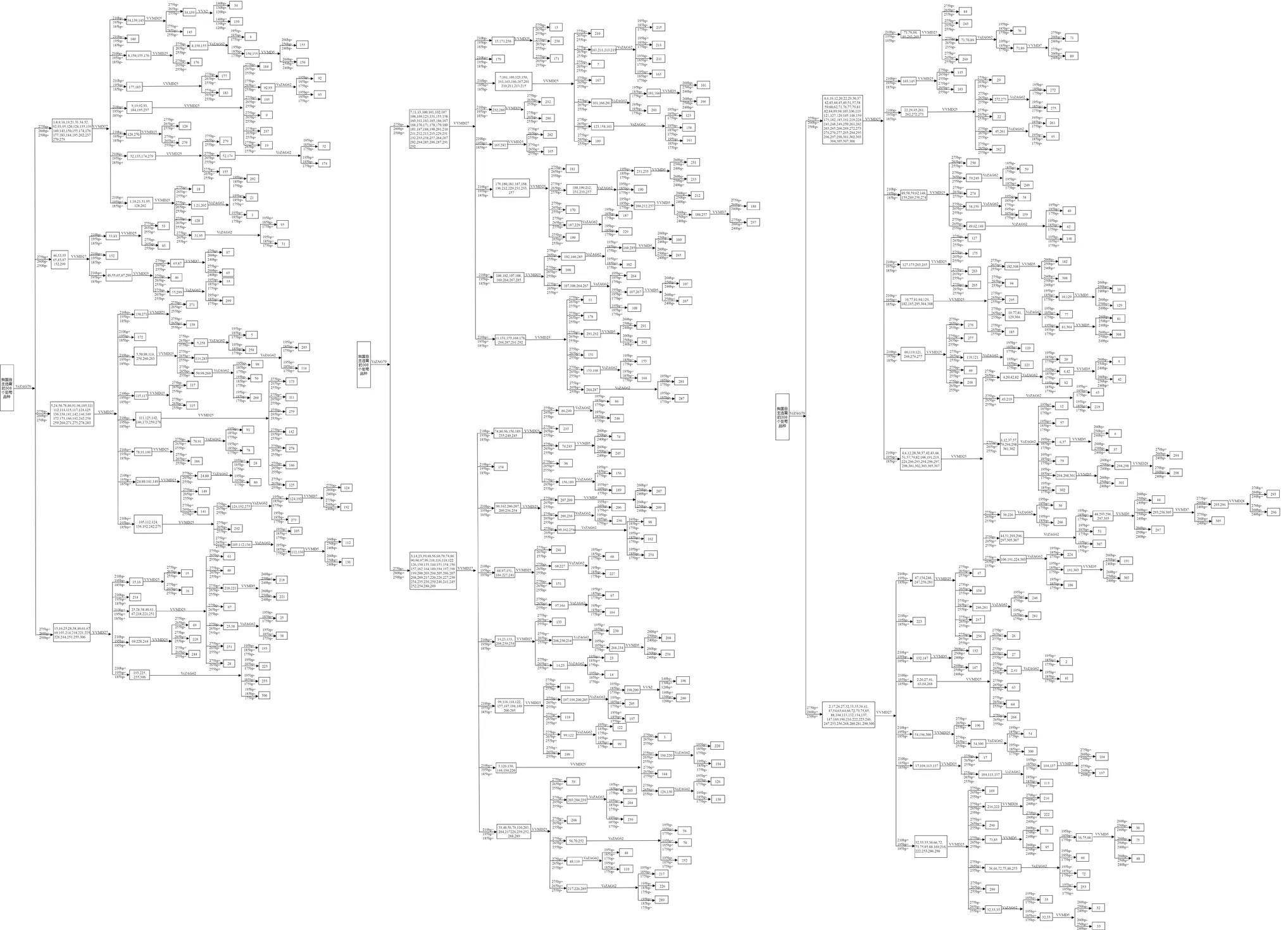
图4 308个中国自主选育的葡萄品种CID图Figure 4 CID of 308 grape varieties independently selected in China
首先依据引物VrZAG79的聚丙烯酰胺凝胶电泳图上长度为275 bp、260 bp、250 bp的3条条带将308个葡萄品种分为8大组,有特征条带用(+)表示,无特征性条带用(-)表示。第一组是275 bp(-)、260 bp(-)和250 bp(-),共包括30个品种;第二组是275 bp(+)、260 bp(-)和250 bp(-),共包括8个品种,数目最少;第三组是275 bp(-)、260 bp(+)和250 bp(-),包括33个品种;第四组是275 bp(+)、260 bp(-)和250 bp(+),包括19个品种;第五组是275 bp(-)、260 bp(-)和250 bp(+),共包括50个品种;第六组是275 bp(-)、260 bp(+)和250 bp(+),包括57个品种;第七组是275 bp(+)、260 bp(+)和250 bp(-),共包括72个品种,品种数目最多;第八组是275 bp(+)、260 bp(+)和250 bp(+),共包括39个品种。
通过引物VrZAG79将308个品种分为8组之后,继续利用更多的引物分别鉴定8个组的所有品种。以第8组的39个品种为例,首先利用引物VVMD27的特征条带210 bp、195 bp、185 bp可以将39个品种分为7个小组,带型为210 bp(-)、195 bp(-)、185 bp(-)的为8-1组,包括编号为47、134、246、247、256、281在内的共6个品种;带型为210 bp(-)、195 bp(+)、185 bp(-)的为8-2组,包括编号为2、26、27、41、63、64、268在内的7个品种;带型为210 bp(-)、195 bp(-)、185 bp(+)的为8-3组,只包含223号品种‘达拉依’,所以该品种被鉴别出来;带型为210 bp(+)、195 bp(+)、185 bp(-)的为8-4组,包括编号为54、196、300在内的3个品种;带型为210 bp(-)、195 bp(+)、185 bp(+)的为8-5组,包括编号为17、104、113、137在内的4个品种;带型为210 bp(+)、195 bp(-)、185 bp(+)的为8-6组,包括编号为132、147在内的2个品种;带型为210 bp(+)、195 bp(+)、185 bp(+)的为8-7组,包括其余的16个品种。在利用引物VVMD25扩增的大小为275 bp、265 bp、255 bp的条带对8-1、8-2、8-4、8-5、8-6、8-7进行进一步鉴定。8-1组中带型为275 bp(+)、265 bp(-)、255 bp(-)的247号品种‘皇家无核’被鉴别出来;带型为275 bp(+)、265 bp(-)、255 bp(+)的256号品种‘新郁’被鉴别出来;带型为275 bp(-)、265 bp(+)、255 bp(-)的134号品种‘谢克兰格’被鉴别出来;带型为275 bp(-)、265 bp(+)、255 bp(+)的47号品种‘月光无核’被鉴别出来;246、281号品种被分配到275 bp(+)、265 bp(+)、255 bp(-)带型中,未能鉴别出来,记为8-1-1组。之后利用第四对引物VrZAG62扩增的长度为195 bp、185 bp、175 bp的条带对8-1-1组进行分析,发现246号品种‘沈农金皇后’带型为195 bp(+)、185 bp(+)、175 bp(-),281号品种‘黑指’带型为195 bp(+)、185 bp(+)、175 bp(-),成功鉴别出来。
其他7大组按照此方法依次鉴定,最多利用8对引物就可以区分所有品种。最后,根据所有引物及相应谱带信息绘制我国自主选育的308个葡萄品种的MCID鉴定图(图4)。MCID图如同化学元素周期表用于元素信息查阅一样直观清晰,简单明了,所获得的葡萄CID图谱可以提供鉴别这些品种所需要的引物以及依据的多态性谱带,具有高度的可行性与实用性。具体使用方法如下:①通过CID图谱确定待检测品种所需要的引物以及多态性条带;②利用筛选的引物进行PCR扩增;③通过分析待检测品种PCR扩增的多态性条带将其鉴别出来。例如:区分‘郑果5号’(132),‘沈阳玫瑰’(147)和‘达拉依’(223)3个品种时,首先在MCID上可以看到3个品种最先分支的引物为VVMD27,多态性条带为210 bp、195 bp、185 bp。该引物将3个品种区分为两组,‘达拉依’带型为210 bp(-)、195 bp(-)、185 bp(+)直接鉴别出来。‘沈阳玫瑰’和‘郑果5号’带型相同,都为210 bp(+)、195 bp(-)、185 bp(+)。之后在利用VVMD5引物和260 bp条带即可将‘郑果5号’和‘沈阳玫瑰’区分开,这样3个品种就全部鉴别出来。
3 讨论与结论
中国是世界上葡萄遗传资源最丰富的起源中心之一,丰富的种质资源为葡萄领域研究提供了众多机会,同时也蕴藏了很多的挑战。随着葡萄在我国的种植面积不断扩大和下游产业的发展,对葡萄的引种、品种鉴定工作提出了更高更丰富的要求[10]。传统的品种鉴定方式限制因素太多,越来越无法满足鉴定要求。DNA分子标记技术的发展使这些问题迎刃而解;与第一代DNA分子标记相比,SSR标记具有多态性高、重复性好、操作简便快捷等优点,在国内外研究中应用广泛[11]。Lefort等[12]使用SSR分子标记,采用11对SSR引物对50个希腊葡萄品种(包括鲜食和酿酒品种)进行了品种鉴定和遗传特性的研究。Riaz等[13]于2008年首次使用SSR分子标记技术分析北美‘麝香葡萄’栽培及杂交品种,研究使用14对SSR标记对57个葡萄品种进行鉴定并绘制了指纹图谱,通过比较亲本和子代的共享等位基因,验证了已发表品种的育种记录。2015年Mihaljević等[14]分析了克罗地亚和黑山(欧洲东南部)的284个地方葡萄品种,共使用9对SSR引物,发现了25个之前未曾报道过的基因型,并将得到的数据与欧洲数据库以及其他已报道的相关研究结果进行比对,发现了一些新的同名异物和同物异名品种。樊秀彩等[15]筛选出7对能扩增出父本特异条带的引物,用SSR分子标记结合形态学分析的方法,对山葡萄和河岸葡萄种间杂交后代进行鉴定,结果表明,杂交后代中有161株是真杂种,后代中还产生了新条带,因此认为SSR标记可有效地对葡萄属种间杂种进行鉴定,从而创新葡萄种质资源。
同DNA指纹图谱和聚类分析相比,MCID法可以将DNA标记得到的遗传信息转换为更加直观、更方便参考的鉴定图,具有很强的操作性和很高的参考价值。在本研究之前,MCID法已经被用于其他园艺植物的鉴定,如基于SSR 标记的MCID法鉴定花梅品种[16]和利用基于RAPD标记的MCID法鉴定枇杷[17]、萝卜[18]等,这些研究都表明了MCID法在鉴定品种上的可行性。
本研究利用9对SSR引物进行PCR扩增,根据同一种引物下不同葡萄品种DNA序列长度的多态性来人工绘制植物品种鉴别图(MCID)对中国自主选育的308个葡萄品种进行鉴定。结果表明,最多利用8对引物就可以区分所有品种,同时对这些品种进行了遗传多样性分析,以期为我国葡萄品种鉴定、品种保护提供理论依据和参考价值。本研究涉及了我国自主选育的绝大部分葡萄品种,仍有少量品种没有形成准确可靠的CID图,将我国自育品种遗传信息汇总并制作CID图可以为我国育种者提供更加直观的信息,对我国育成具有自主知识产权的世界性优良品种有推动作用。此外,许多国外培育的优良葡萄品种均可绘制CID图,将世界范围内的优良种质整合到一起,建立起一个以MCID法制成的葡萄品种鉴定信息库,使分子标记技术更加有效地服务于育种工作,更好地利用现有品种资源开发新品种、新品系,同时还可以应用于种质资源管理和品种保护工作中,对葡萄产业可持续性发展有积极的意义。

