氮添加对贝加尔针茅草原土壤细菌群落结构的影响
刘红梅,杨殿林*,张海芳,赵建宁,王慧,张乃琴
(1.农业农村部环境保护科研监测所,农业农村部产地环境污染防控重点实验室,天津市农业环境与农产品安全重点实验室,天津300191;2.德州学院,生态与园林建筑学院,山东 德州253023)
近几十年来,由于化石燃料燃烧,化肥施用等人类活动,大气氮沉降呈现急剧增加趋势[1],导致了一系列生态环境问题。氮沉降增加会降低植物多样性[2]、降低微生物生物量碳氮比[3],改变土壤微生物群落结构[4-5],影响微生物介导的碳氮循环过程[6],从而导致生态系统稳定性降低[7]。我国草地面积占全国国土面积的41.7%,在全球碳氮循环和气候变化响应中发挥重要作用。
氮元素是干旱和半干旱草原土壤微生物生长繁殖的主要限制因子之一[8]。氮沉降增加会缓解草原生产中氮的限制,提高土壤中有效态氮含量,从而增加草原生产力。但过多的氮输入会增加土壤酸化和硝态氮淋溶的危险,导致生态系统功能退化或丧失。氮沉降或氮添加引起北方温带草原地上植物群落组成、多样性、优势植物光合特征、叶片功能特性改变[9-10],影响土壤化学性质和微生物学特性[11]以及增加温室气体排放[12-13]。土壤细菌是土壤微生物的重要组成部分,在土壤有机质分解、养分转化等生态过程中有着不可或缺的地位[14]。土壤细菌群落结构及多样性变化是表征土壤质量变化的重要指标[15]。因此研究氮沉降增加对土壤细菌群落的影响具有重要意义。一些研究表明氮添加会影响土壤细菌优势菌群丰度,改变土壤细菌群落结构[16]。另一些研究表明,短期施氮不会对土壤细菌群落产生显著影响,但高氮处理会显著改变敏感菌群相对丰度,富营养型细菌丰度增加,而贫营养型类群丰度降低[17-19]。由于氮添加量、氮添加时间和研究对象不同,土壤细菌群落对氮沉降或氮添加响应不同。
贝加尔针茅(Stipabaicalensis)草原是亚洲中部草原区所特有的草原群系,在我国畜牧业生产中占有重要地位。气候模拟研究表明,中国北方草原氮沉降将会持续增加[20]。本研究以贝加尔针茅草原为研究对象,施氮模拟氮沉降增加,利用Illumina Miseq高通量测序技术,探讨不同氮添加水平下土壤细菌多样性、群落结构组成变化及其与土壤化学性质的关系,为有效应对氮沉降增加并提高草原生态系统功能提供理论依据。
1 材料与方法
1.1 试验地概况
试验区域概况、试验开始前土壤理化性质及试验设计见参考文献[11]。试验地位于内蒙古自治区贝加尔针茅草原(48°27′-48°35′ N,119°35′-119°41′ E)。海拔760~770 m,年均降水量为328.7 mm,年均气温-1.6 ℃。植被类型为贝加尔针茅草甸草原,优势植物种类主要为贝加尔针茅和羊草(Leymuschinensis)。共有植物66种,分属21科49属。土壤类型为暗栗钙土。
1.2 样地设置与样品采集
于2010年6月开始模拟氮沉降的氮添加试验。设8个外源氮添加处理水平,依次为:对照N0,低氮添加(15、30、50 kg N·hm-2·yr-1)分别记为N15、N30和N50,高氮添加(100、150、200、300 kg N·hm-2·yr-1)分别记为N100、N150、N200和N300。于每年6月中旬和7月中旬分两次进行氮添加,氮肥为NH4NO3,将其溶于水后均匀喷洒在各小区内。小区面积8 m×8 m,小区间设2 m隔离带,4次重复,重复间设5 m隔离带。
于2015年8月中旬采集土壤样品。按照S型取样法在每个小区选取10个点,用土钻取0~10 cm土层土壤样品混合均匀。去除植物根系、石砾等杂物,装入无菌封口袋,放入冰盒中带回实验室。过2 mm筛后,将其分成两份,一份于-20 ℃低温保存,用于DNA提取和土壤速效养分分析,另一份土样于室内自然风干后,用于土壤化学指标测定。
1.3 土壤化学指标测定
采用玻璃电极法(土水质量比1.0∶2.5)测定土壤pH,采用重铬酸钾外加热法测定土壤总有机碳(organic carbon),采用凯氏定氮法测定土壤全氮(total nitrogen),采用钼锑抗比色法测定土壤全磷(total phosphorus),采用2 mol·L-1氯化钾溶液提取-流动分析仪(AA3,德国)测定土壤硝态氮(nitrage nitrogen, NO3--N)和铵态氮(ammonia nitrogen, NH4+-N),采用碳酸氢钠提取-钼锑抗比色法测定土壤速效磷(available phosphorus)。上述测定方法参照鲍士旦[21]《土壤农化分析》第三版。
1.4 土壤细菌16S rDNA克隆文库构建和Illumina测序
采用Power Soil®DNA Isolation Kit试剂盒提取土壤总DNA,提取步骤按试剂盒说明书进行。提取后的土壤总DNA用1%琼脂糖凝胶电泳进行检测,使用超微量分光光度计(NanoDrop2000,德国)进行质检。采用Qubit 2.0 DNA检测试剂盒对提取的DNA进行精确定量,以确定PCR反应加入的DNA量。选择细菌V3~V4区的16S rDNA序列进行PCR扩增。扩增引物序列为336F:5′-GTACTCCTACGGGAGGCAGCA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′。使用带barcode的特异引物,区分个体样本。PCR扩增体系为:10×Pyrobest Buffer 5 μL,dNTPs (2.5 mmol·L-1)4 μL,引物F(10 μmol·L-1)2 μL,引物R(10 μmol·L-1)2 μL,Pyrobest DNA Polymerase(2.5 U·μL-1)0.3 μL,DNA模板30 ng,加去离子水到50 μL。反应条件为:95 ℃预变性,5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s进行25个循环;72 ℃延长10 min。扩增反应完成后,对PCR产物进行琼脂糖凝胶电泳,采用上海生工琼脂糖回收试剂盒(cat:SK8131)进行DNA回收。使用Qubit 2.0荧光定量系统测定回收产物浓度,将等摩尔浓度的扩增子汇集到一起,混合均匀后进行测序。测序由北京奥维森基因科技有限公司完成,采用Illumina Miseq测序平台进行Paired-end高通量测序。每个土壤样品3个生物学重复。
1.5 数据分析
下机数据经过Trimmomatic、Readfq(vertion 6.0)和Flash(version 1.2.10)软件预处理,去除低质量reads,然后根据双末端测序读长(PE reads)之间的重叠(overlap)关系将成对的reads拼接成一条序列。去除tags两端的barcode序列及引物序列,去除嵌合体及其短序列等后得到高质量的clean tags,拼接过滤后的clean tags,在0.97相似度下利用QIIME软件将其聚类为用于物种分类的操作分类单元(operational taxonomic units, OTU),统计各样品OTU中的丰度信息。对比GreenGenes数据库,对每个OTU进行物种注释。应用QIIME(version 1.7.0)计算样品的多样性指标。Alpha多样性是对单个样品物种多样性的分析,基于OTU的结果,计算Chao1指数、观测值指数(observed species)、谱系多样性指数(phylogenetic diversity, PD whole tree)和香农指数(Shannon)来进行生物多样性分析。Observed species、PD whole tree和Chao1指数反映样品中群落的丰度,其值越大表明群落物种的丰富度越高。Shannon指数表示细菌群落多样性程度,其值越大,表明群落多样性越高。采用主成分分析(principal component analysis, PCA)和非度量多维尺度分析(nonmetric multidimensional scaling, NMDS)分析不同氮添加水平处理与对照间细菌群落组成的差异性。采用单因素方差分析(one-way ANOVA)分析不同氮添加处理之间的土壤化学性质、细菌丰度和多样性指数差异,采用Pearson相关性分析土壤细菌多样性指数、优势类群与土壤化学因子之间的相关性。
2 结果与分析
2.1 土壤化学性质变化
连续6年不同氮添加处理条件下,土壤化学性质变化见表1。低氮添加(N15、N30和N50)处理下土壤有机碳、硝态氮含量与N0相比无显著差异(P>0.05);高氮添加(N150、N200和N300)处理下土壤有机碳含量显著高于N0;高氮添加(N100、N150、N200和N300)处理下土壤硝态氮和速效磷含量显著高于N0。N30、N50、N100、N150、N200和N300的土壤pH均显著低于N0(P<0.05)。N15、N30、N50、N100、N150和N200处理的C/N与N0相比无显著差异(P>0.05),N300则显著高于N0(P<0.05)。土壤全氮含量和N/P在不同氮添加处理间无显著差异(P>0.05)。
2.2 不同氮添加处理对Alpha多样性指数的影响
通过Miseq高通量测序共得到有效序列1036564条,质量控制后得到优质序列919775条,每个处理OTU数为18264~27426。不同氮添加处理下土壤细菌Alpha多样性指数变化见表2。7个氮添加处理的Chao1、Observed species、PD whole tree和Shannon指数与对照相比无显著差异。N15、N50、N100和N150处理的Chao1和Observed species指数显著高于N300。
土壤细菌Alpha多样性与土壤化学因子的相关性分析结果见表3。Observed species与土壤有机碳含量呈显著负相关关系(P<0.05)。Chao1、Observed species、PD whole tree和Shannon指数均与全氮含量呈极显著正相关关系(P<0.01);Chao1与全磷含量呈显著正相关关系(P<0.05),Observed species、PD whole tree和Shannon指数与全磷含量呈极显著正相关关系(P<0.01)。表明影响土壤Alpha多样性指数的主要土壤环境因子是土壤全氮和全磷含量。
注:同行不同字母表示处理间差异显著(P<0.05)。
Note: Different small letters in the same line mean significant difference at 0.05 level among treatments.

表2 不同氮添加处理条件下土壤细菌群落Alpha多样性指数Table 2 Alpha diversity index of soil bacterial community under different nitrogen addition treatments
注:同列不同字母表示处理间差异显著(P<0.05)。
Note: Different small letters in the same column mean significant difference at 0.05 level among treatments.
2.3 不同氮添加处理土壤细菌群落结构和组成
各个样品在门分类水平上具有较高的多样性,在群落中占主导的细菌门类有酸杆菌门(Acidobacteria)(19.01%~38.31%),变形菌门(Proteobacteria)(6.64%~17.11%),放线菌门(Actinobacteria)(5.07%~16.06%),疣微菌门(Verrucomicrobia)(3.57%~7.40%),绿弯菌门(Chloroflexi)(3.38%~8.42%)和芽单胞菌门(Gemmatimonadetes)(0.87%~1.81%)(图1)。N50、N100和N300的酸杆菌门相对丰度显著低于N0。N30、N50、N100、N150、N200和N300的疣微菌门相对丰度显著低于N0。N30、N50、N100和N150的芽单胞菌门相对丰度显著高于N0。7个氮添加处理的绿弯菌门相对丰度均显著低于N0。
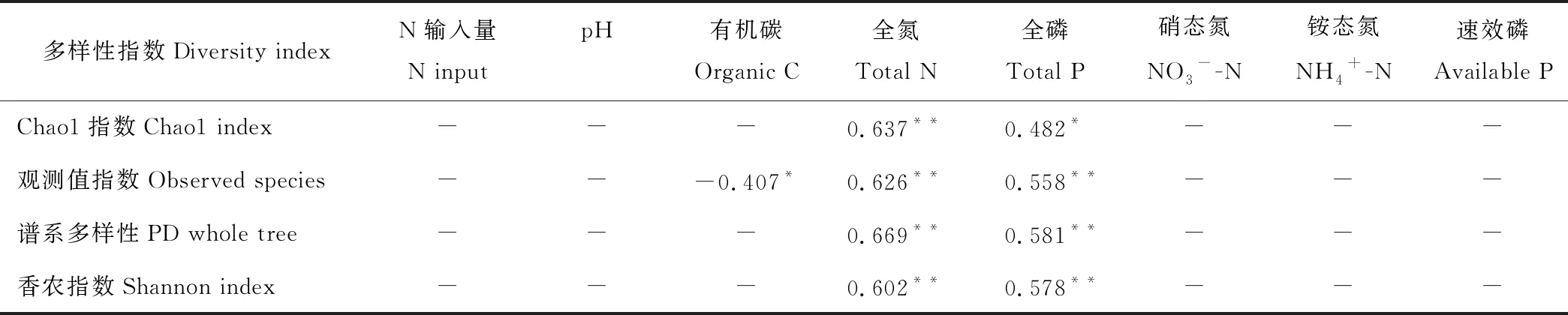
表3 土壤Alpha多样性指数与土壤化学因子的相关性Table 3 Correlation analysis between soil bacterial Alpha diversity index and soil chemical properties
注:“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01),“-”表示无显著相关(P≥0.05)。下同。
Note:*indicates correlation is significant at 0.05 level, ** indicates correlation is significant at 0.01 level, “-” indicates no significant correlation. The same below.

图1 不同氮添加处理下土壤细菌门类相对丰度变化Fig.1 Relative abundances of the dominant bacterial phylum for different nitrogen addition treatments
不同氮添加处理之间有显著差异的OTUs丰度的PCA如图2所示,前两个主成分分别占细菌群落变异的36.97%和12.52%。高氮添加(N150、N200、N300)位于主成分1右侧,而N0、N100与低氮添加(N15、N30和N50)位于主成分1左侧。说明高氮添加有显著差异OTUs丰度组成相似,而N0、N15、N30、N50与N100有显著差异OUTs丰度组成相似。非度量多维尺度分析常用于比较不同样本组之间的差异,样品点的分布代表了样本与样本之间的相似度程度。基于各氮添加处理差异OTUs丰度的NMDS结果,可以发现7个氮添加处理差异OTUs与对照处理差别显著,且高氮添加处理与低氮添加、对照和N100处理处于不同排序区(图3)。表明高氮添加对土壤细菌群落产生了显著影响。

图2 不同氮添加处理之间有显著差异的细菌OTUs丰度的PCA分析 Fig.2 Principal component analysis (PCA) of pyrosequencing bacterial OTUs abundance with significant differences among different nitrogen addition treatments

图3 基于差异OTUs丰度的NMDS分析Fig.3 Nonmetric multidimensional scaling (NMDS) analysis based on the major different OTUs abundance
2.4 土壤细菌主要类群相对丰度与土壤化学性质的相关性
优势细菌门和土壤环境因子相关性分析结果见表4。酸杆菌门与氮输入量和硝态氮含量呈显著负相关(P<0.05),与铵态氮含量呈极显著负相关(P<0.01),与土壤pH值呈极显著正相关(P<0.01)。变形菌门与土壤pH和全磷含量呈显著负相关(P<0.05)。疣微菌门与氮输入量、有机碳和硝态氮含量呈极显著负相关(P<0.01),与土壤C/N呈显著负相关(P<0.05),与土壤pH和全磷含量呈极显著正相关(P<0.01)。绿弯菌门与土壤pH和全磷含量呈极显著正相关(P<0.01),与氮输入量和硝态氮含量呈极显著负相关(P<0.01),与土壤有机碳、速效磷和N/P呈显著负相关(P<0.05)。土壤pH与酸杆菌门、疣微菌门和绿弯菌门呈极显著正相关(P<0.01),与变形菌门呈显著负相关(P<0.05)(图4),说明氮添加通过改变土壤pH而影响了土壤细菌群落结构。

表4 土壤细菌主要类群相对丰度与土壤化学性质的相关性Table 4 Correlation analysis between the relative abundance of soil bacterial groups and soil chemical properties
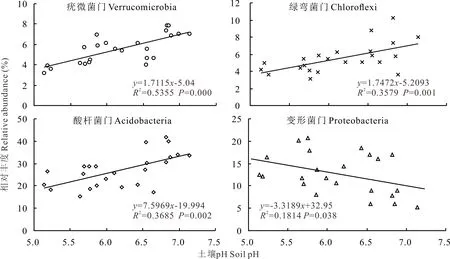
图4 土壤细菌主要类群相对丰度与土壤pH的相关性Fig.4 Correlations between soil dominant bacterial phylum and soil pH
3 讨论
3.1 土壤细菌多样性对氮添加响应的综合分析
多样性指数是表征土壤微生物群落丰富度和多样性的重要指标,多样性指数越高表明土壤微生物群落丰富度和多样性越高[22]。杨山等[23]对我国北方温带典型草原和郝亚群等[17]对中亚热带杉木林(Cunninghamialanceolata)氮添加试验表明,短期氮添加对土壤细菌丰富度指数和多样性指数未产生显著影响。本研究表明,随着氮添加水平的升高,细菌丰富度指数和多样性指数总体上表现为先升高后降低的趋势,但与对照相比无显著差异。连续6年氮添加对细菌Alpha多样性指数未产生显著性影响。高氮添加处理(300 kg N·hm-2·yr-1)时土壤细菌Alpha多样性指数均低于对照,有降低趋势。Freitag等[24]研究表明,过量无机氮素添加不利于提高草地土壤细菌α多样性。前人研究认为,低氮添加缓解了细菌生长的氮限制,细菌丰度和种类增加,而高浓度氮添加反而会抑制土壤细菌多样性[25-26]。本研究结果与这一研究结论一致。这可能是因为本研究模拟氮沉降所用肥料为NH4NO3,NH4+在氧化成亚硝酸盐过程中释放出H+,引起土壤酸化,从而使不耐酸细菌物种繁殖缓慢,物种多样性下降;也有可能是高氮添加导致土壤中可利用性氮素含量增多,导致喜氮微生物生长迅速[27]。本研究中,土壤细菌Alpha多样性与土壤化学因子的相关性分析结果表明,土壤全氮和全磷含量是影响土壤细菌群落Alpha多样性重要因素。
3.2 土壤细菌群落结构对氮添加响应的综合分析
氮素是干旱和半干旱草原生态系统限制因子之一,氮沉降增加会影响土壤微生物生长和繁殖以及细菌丰度和多样性变化。本研究对细菌群落种群的相对丰度分析表明,随着氮添加水平的升高,细菌门类相对丰度表现出不同的变化趋势。高氮添加提高了放线菌门和变形菌门相对丰度,前人研究认为放线菌和变形菌门属于富营养型细菌,在高氮环境中生长繁殖速度快[25,28],本研究结果与此一致。酸杆菌门和疣微菌门相对丰度随着氮添加量增加而降低。其可能原因是其属于寡营养类群,这类微生物类群具有较低的生长速度和较难降解物质能力。Fierer等[28]研究表明,疣微菌门更适合养分含量较低的土壤条件,这符合微生物氮矿化假说,即在高氮环境中微生物利用较难降解碳源的能力降低[29]。高氮添加处理中,寡营养类群微生物与富营养类群相比有较低的竞争力。氮添加对土壤细菌群落结构的影响与氮添加水平有关。Zeng等[25]对温带草原氮添加试验发现,氮添加大于120 kg N·hm-2·yr-1显著影响土壤细菌群落结构。本研究中,氮添加大于150 kg N·hm-2·yr-1显著影响贝加尔针茅草原土壤细菌群落结构。
土壤细菌生长受土壤环境因子的影响[30],其中土壤酸碱程度对土壤细菌群落的影响最为显著[31]。本研究优势菌群与土壤化学性质相关分析表明(表4),土壤pH值是影响土壤细菌群落的主要因素,这与前人研究一致[25, 32-33]。Wang等[34]在亚热带森林氮添加试验表明,氮添加150 kg N·hm-2·yr-1显著降低土壤pH,且土壤细菌群落组成与土壤pH呈负相关。前人研究认为,土壤酸化对细菌群落的生态选择和不同细菌群落在酸性条件下压力下的适应性进化,是土壤酸化导致土壤细菌群落改变的机制[35]。疣微菌门在高氮添加处理中具有较低相对丰度,且该类群相对丰度与土壤有机碳、硝态氮和C/N呈显著负相关。土壤硝态氮含量与酸杆菌门、疣微菌门和绿弯菌门呈显著负相关。土壤铵态氮含量与放线菌门、芽单胞菌门和酸杆菌门均有显著相关性。推测在本研究区细菌优势菌群的相对丰度变化也受到了养分有效性的驱动。Yang等[36]研究也表明土壤化学性质包括土壤pH、无机氮含量等是影响土壤细菌群落结构的土壤环境因素。原因可能是氮添加导致草地植物群落组成发生变化[9],而植物凋落物分解和根系分泌物影响土壤细菌生长条件,如土壤pH、容重、速效氮、可溶性碳等土壤理化因子不同,导致土壤细菌可获取的营养物质和所处的环境不同,土壤中适宜生长的细菌群落也不同。
4 结论
1)连续6年氮添加未显著改变贝加尔针茅草原土壤细菌Alpha多样性。土壤全氮和全磷含量是影响土壤细菌群落Alpha多样性的重要因素。
2)细菌群落结构与组成受氮添加水平的影响。15~100 kg N·hm-2·yr-1氮添加未显著改变贝加尔针茅草原土壤细菌群落结构,150 kg N·hm-2·yr-1以上氮添加显著改变土壤细菌群落结构。

