泛素结合酶2S在恶性黑素瘤中的表达及其对黑素瘤细胞生物学行为的影响
马阳阳 王平 胡文婷 徐永平 张小燕 黎钊 虞闻仲 朱蒙燕 许爱娥
1浙江中医药大学,杭州310009;2杭州市第三人民医院皮肤科310009;3浙江省义乌市皮肤病医院皮肤科322000
泛素化是一种翻译后修饰,在细胞周期、增殖及凋亡中发挥重要作用,它将泛素与泛素-蛋白酶体系统结合,泛素-蛋白酶体系统由3种酶即泛素活化酶、泛素结合酶2(UBE2)和泛素连接酶组成[1]。作为一种泛素结合酶,UBE2S又称E2-EPF UCP,具有高度保守的150个氨基酸核心结构,与泛素连接酶后期促进复合物(APC/C)结合,拉长靶蛋白上的泛素链,促使底物降解,其异常调控参与炎症因子核因子κB与转化生长因子β(TGF-β)、促有丝分裂生长因子和缺氧诱导因子(HIF)的信号转导,驱动多种肿瘤细胞的增殖、迁移和转移[2-3]。既往研究显示,UBE2S在多种疾病中表达上调,包括宫颈癌、口腔鳞状细胞癌(OSCC)、乳腺癌及转移性结肠癌等恶性肿瘤,并与肿瘤生长、G2/M期阻滞密切相关[3-4]。然而,有关UBE2S在恶性黑素瘤(MM)中的研究报道极少,其作用机制尚不清楚。我们通过检测UBE2S在MM组织中的表达,了解其与肿瘤分期(化)的相关性,并通过研究UBE2S对MM细胞功能及侵袭性的影响,探讨其对MM预后评估的价值,为筛选MM分子治疗的新靶点提供理论依据。
材料与方法
一、主要材料
黑素瘤细胞株(A375、MUM-2B及MUM-2C)、293T细胞及慢病毒表达载体由上海吉凯公司提供,DMEM培养基(美国Corning公司),胎牛血清(美国Ausbian公司),MM及正常组织芯片+标记点(西安艾丽娜生物科技有限公司,货号ME2082c),兔抗UBE2S抗体(美国Sigma公司),辣根过氧化物酶标记的兔抗人IgG抗体(美国Sigma公司),兔抗N-钙黏蛋白抗体(美国CST公司),鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Santa-Cruz公司),Vulcan fast red chromogen kit2染色液(美国Concord公司),Trizol试剂(上海普飞生物技术有限公司),M-MLV反转录试剂盒及Caspase-Glo®3/7 Assay试剂盒(美国Promega公司),SYBR premix ex tap PCR试剂盒(日本TaKaRa公司),凋亡检测试剂盒(美国eBioscience公司),碘化丙锭(美国Sigma公司),流式细胞仪(美国Millipore公司),Transwell试剂盒及侵袭检测试剂盒(美国Corning公司),荧光显微镜(上海蔡康光学仪器有限公司)。
二、实验方法
1.免疫组化检测MM组织中UBE2S基因的表达:MM及非瘤组织芯片共208例,包括原发性MM 128例、转移性MM 64例、非瘤组织16例(瘤旁组织及正常表皮组织各8例)。将组织芯片进行免疫组化检测,用柠檬酸钠缓冲液(pH6.0)在微波炉中进行抗原修复20 min,用10%血清封闭30 min;加入一抗(兔抗UBE2S抗体1∶100)孵育过夜,Tris-HCl缓冲盐溶液(TBS)冲洗;加入二抗(兔抗人IgG抗体)孵育60 min,TBS冲洗。用Vulcan fast red chromogen kit2染色试剂按照说明书染色。染色结果判定标准:①按染色强度评分,分为0~34个等级;②按染色阳性率评分:阴性为0,1%~25%为1,26%~50%为2,51%~75%为3,76%~100%为4。按染色强度和染色阳性率乘积值分组,≤6分为抗体低表达组,>6分为抗体高表达组。
2.实时定量PCR检测黑素瘤细胞株中UBE2S mRNA相对表达水平:使用Trizol试剂分别提取A375、MUM-2B及MUM-2C细胞株总RNA,分别取2μg样本使用M-MLV反转录试剂盒按照标准流程将RNA反转录成cDNA,使用SYBR premix ex tap PCR试剂盒按说明书扩增目的基因。由上海吉凯基因化学技术有限公司设计和合成引物。UBE2S正向引物5′-GTGCTCAAGAGGGACTGGACG-3′,反向引物5′-GCAGACTCGGGGTTAGGGTG-3′,片段大小为92 bp。GAPDH正向引物5′-TGACTTCAAC AGCGACACCCA-3′,反向引物5′-CACCCTGTTGTA GCCAAA-3′,片段大小为121 bp。采用两步法反应,条件为95℃30 s;95℃5 s,60℃30 s,共40个循环。以GAPDH作为内参照基因,以2-△△Ct表示UBE2S相对表达水平,其中△Ct=目的基因Ct值-GAPDH基因Ct值,△△Ct=各样品△Ct值-对照组△Ct值。
3.UBE2S基因shRNA慢病毒感染A375及MUM-2B细胞:用病毒包装辅助质粒(上海吉凯公司)与携带目标序列miRNA的GV115质粒共同转染293T细胞,48 h后收集细胞培养上清液进行慢病毒的浓缩与纯化。将A375及MUM-2B细胞分别分为两组,干扰组使用含有UBE2S RNA干扰序列(5′-ACATCATCCGCCTGGTGTA-3′)的慢病毒转染,对照组使用含有对照序列(5′-TTCTCCGAACGT GTCACGT-3′)的慢病毒转染,72 h后,荧光显微镜检测绿色荧光蛋白的表达情况,荧光率达70%~80%时收集细胞,实时定量PCR检测UBE2S mRNA相对表达水平,方法同前。
4.各组细胞中caspase3/7的表达检测:将经过上述处理的A375及MUM-2B细胞计数并按照1×104细胞/孔加入96孔板中。使用Caspase-Glo®3/7 Assay试剂盒按照说明书检测细胞中caspase3/7的表达。
5.流式细胞仪检测细胞凋亡与周期情况:将经过上述处理的A375、MUM-2B细胞在6孔板中传代培养至覆盖率为80%,胰酶消化,1 300 r/min(离心半径为20 cm)离心5 min后,向部分细胞中加入10μl膜联蛋白V-别藻蓝蛋白在室温下染色15 min,另一部分加入0.7 ml碘化丙锭染色液使上机时细胞通过率为300~800个/s,采用流式细胞仪检测细胞凋亡与周期情况。
6.Transwell法分析细胞迁移及侵袭能力:将干扰组与对照组A375细胞按8×104/孔接种,分别取细胞悬浮液100μl加入Transwell小室上室,下室加600μl 30%胎牛血清培养基。37℃培养16 h后使用Giemsa染色液染色转移细胞2~3 min后观察并拍照。每个Transwell小室随机选取3个200×视野进行细胞计数。
取侵袭试剂盒上室铺Matrigel基质加入细胞悬浮液500μl,下室加750μl 30%胎牛血清培养基,37℃培养16 h后染色3~5 min,每个小室随机选取3个200×视野进行细胞计数。
7.Western印迹法检测N-钙黏蛋白的表达:取干扰组与对照组A375细胞用PBS洗涤,冰上裂解10~15 min后超声破碎细胞,取上清液用BCA法测定蛋白浓度,经浓度标化后进行Western印迹检测。取20μg总蛋白,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,将蛋白转移到聚偏二氟乙烯膜上室温下封闭1 h。加入一抗兔抗N-钙黏蛋白(1∶500),以鼠抗GAPDH(1∶2 000)为内参照,室温孵育1 h,用TBST洗涤聚偏二氟乙烯膜后加入对应的N-钙黏蛋白标记的兔抗人IgG二抗(1∶2 000)室温孵育2 h。洗膜后采用Pierce™ECL Western Blotting Substrate试剂盒(美国Thermo公司)进行X光显影,并按说明书要求进行X线胶片处理。
8.统计学分析:所有实验重复3次以上。使用SPSS 22.0软件分析。符合正态分布的计量资料用±s表示,组间比较采用独立样本t检验,计数资料采用卡方检验。非正态分布的数据采用Mann-WhitneyU检验。用Spearman秩相关系数评估UBE2S表达与肿瘤分期的相关性。P<0.05认为差异有统计学意义。
结 果
一、UBE2S在MM组织中的表达
免疫组化检测显示,UBE2S在MM及非瘤组织细胞的细胞质中均有表达。192例MM组织中,98例(51.0%)高表达UBE2S;16例非瘤组织中未见高表达,高表达率差异有统计学意义(χ2=11.905,P<0.01)。UBE2S在不同T分期的瘤组织中表达水平差异有统计学意义(χ2=4.110,P=0.044)。Spearman秩相关分析提示该基因在瘤组织中的表达水平与患者的T分期呈负相关(斯皮尔曼相关系数ρ=-0.210,P=0.043)。见表1、图1。
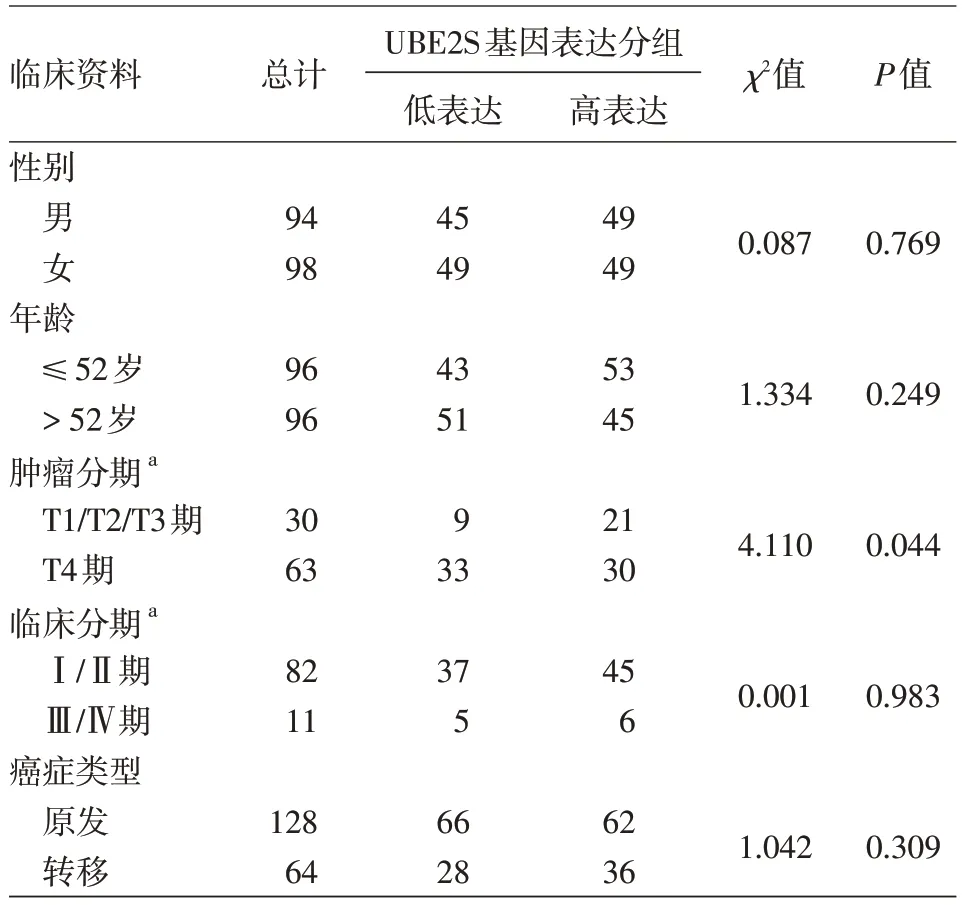
表1 泛素结合酶2S(UBE2S)在恶性黑素瘤组织中的表达水平与临床资料的相关性分析(例)
二、A375、MUM-2B、MUM-2C细胞株UBE2S mRNA相对表达水平
A375、MUM-2B、MUM-2C细 胞 内UBE2S mRNA相对表达量分别为5.96±0.12、8.91±0.06、5.25±0.15,表达丰度都较高,不同细胞之间UBE2S mRNA表达差异有统计学意义(F=817.228,P<0.01),以MUM-2B细胞株表达量最高,其后依次为A375、MUM-2C细胞株,选择A375及MUM-2B细胞株进行shRNA慢病毒感染。
三、shRNA转染效率及对UBE2S mRNA表达的影响
将shRNA转染的4组细胞培养72 h后,随机选5个视野计算转染效率在80%以上,细胞状态正常。实时定量PCR检测显示,干扰组及对照组A375细胞UBE2S mRNA相对表达量分别为0.312±0.005、1.001±0.042,两组间差异有统计学意义(t=-28.052,P=0.001);干扰组及对照组MUM-2B细胞UBE2S mRNA相对表达量分别为0.548±0.083、1.002±0.072,两组间差异亦有统计学意义(t=-7.188,P=0.002)。
四、敲减UBE2S基因对黑素瘤细胞凋亡及细胞周期的影响
感染3 d后,干扰组与对照组A375细胞caspase3/7活性分别为14 522.7±138.25与7 351.7±693.18,干扰组显著高于对照组(t=17.572,P<0.01);干扰组较对照组MUM-2B细胞caspase3/7活性亦明显增加(分别为17 276.3±178.959、12 442.3±290.294,t=24.552,P<0.01)。与对照组A375及MUM-2B细胞相比,干扰组A375及MUM-2B细胞凋亡率显著增加(均P<0.01)。与对照组A375细胞相比,干扰组细胞G1期细胞比例明显增多(P<0.01),而S期细胞明显减少(P<0.01),G2/M期细胞无明显变化(P>0.05).与对照组MUM-2B相比,干扰组MUM-2B细胞G1期(P<0.01)、G2/M期(P<0.01)比例明显增多,S期细胞比例明显减少(P<0.01)。见图2、表2。

图3 敲减泛素结合酶2S基因对A375细胞迁移、侵袭的影响(×200)
表2 敲减泛素结合酶2S基因对A375细胞及MUM-2B细胞凋亡率与周期分布的影响(%,±s)
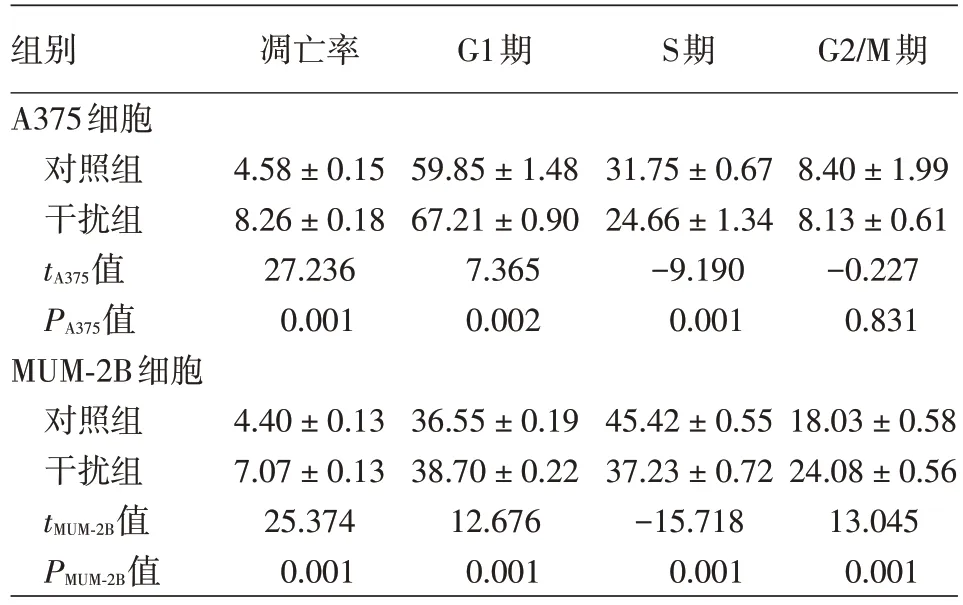
表2 敲减泛素结合酶2S基因对A375细胞及MUM-2B细胞凋亡率与周期分布的影响(%,±s)
注:n=3
组别A375细胞对照组干扰组t A375值P A375值MUM-2B细胞对照组干扰组t MUM-2B值P MUM-2B值凋亡率G1期S期G2/M期4.58±0.15 8.26±0.18 27.236 0.001 59.85±1.48 67.21±0.90 7.365 0.002 31.75±0.67 24.66±1.34-9.190 0.001 8.40±1.99 8.13±0.61-0.227 0.831 4.40±0.13 7.07±0.13 25.374 0.001 36.55±0.19 38.70±0.22 12.676 0.001 45.42±0.55 37.23±0.72-15.718 0.001 18.03±0.58 24.08±0.56 13.045 0.001
五、敲减UBE2S基因对A375细胞迁移、侵袭能力及N-钙黏蛋白表达的影响
见图3。Transwell实验显示,对照组和干扰组A375细胞每200×视野转移细胞数分别为260±9.3、51±3.7,干扰组A375细胞迁移能力显著降低(t=-35.727,P<0.05)。侵袭小室实验显示,对照组和干扰组A375细胞透过Matrigel基质的细胞数分别为109±0.8、26±0.7,干扰组细胞侵袭能力显著降低(t=-125.000,P<0.01)。Western印迹检测显示,A375细胞敲减UBE2S基因后,N-钙黏蛋白表达下调(图4)。

图4 敲减泛素结合酶2S对A375细胞N-钙黏蛋白表达的影响
讨 论
与普通免疫组化切片相比,组织芯片技术可以大规模、高通量、标准化地在基因组、转录组和蛋白质组水平进行研究,在肿瘤相关基因研究中发挥重要作用[5]。我们使用MM及非瘤组织芯片进行免疫组化检测,并且结合临床资料进行判读。本研究表明,UBE2S在MM组织中明显高表达,而瘤旁组织及正常对照组织低表达,提示UBE2S可能与MM的恶性生物学行为有关,可作为MM的免疫标志之一。UBE2S在OSCC中的表达水平与肿瘤分期呈正相关[4]。本研究显示,UBE2S在T1/T2/T3期MM中呈高表达,而T4期表达水平却明显下降,提示黑素瘤细胞可能具有不同于其他恶性肿瘤的细胞分化特征,也反映了MM显著的异质性。
本研究结果显示,UBE2S在A375、MUM-2B、MUM-2C细胞中表达丰度都为高,以MUM-2B表达量最高,其次为A375、MUM-2C。而且,敲减UBE2S基因后,黑素瘤细胞凋亡水平明显增高,细胞迁移及侵袭能力显著降低,证实UBE2S对MM细胞生物学功能的影响。UBE2S过表达被报道与OSCC[4]、肾癌[6]及食管癌[7]的细胞增殖、侵袭及转移能力上调有关,但敲减UBE2S基因对宫颈癌及乳腺癌细胞增殖无明显影响[8-9]。Yoshimura等[4]报道敲减OSCC细胞UBE2S基因,可通过促进P21降解抑制G2/M期细胞增殖。而Tedesco等[9]报道在乳腺肿瘤中,UBE2S常与细胞周期G2/M期的基因共同表达。本研究显示,敲减UBE2S基因的黑素瘤细胞阻滞于G1/S期,进一步表明UBE2S在不同来源肿瘤中的功能差异。
UBE2S参与Von Hippel-Lindau泛素(VHL)的蛋白酶体降解,VHL介导HIF1α的泛素化降解,HIF刺激原癌发生和促分裂生长因子相关基因表达[10]。UBE2S与HIF1α在胰腺癌、黏液性结肠癌、乳腺癌中过度表达,而VHL表达下调[9-10]。UBE2S在转移性皮肤癌CAKI细胞和人黑素瘤C8161细胞中表达上调,通过HIF1α和血管内皮生长因子(VEGF)的转录调节VHL降解,促进细胞增殖[10]。研究发现,UBE2S可能通过调节VHL/HIF1α—TGF-β1通路来诱导上皮细胞-间充质转化(EMT)过程[7,11]。EMT是一种由上皮向间充质细胞型转变的生物学过程,是肿瘤侵袭过程中的关键环节,该过程降低肿瘤转移中细胞黏附并促进细胞脱落[12-13]。在此过程中,黏附分子N-钙黏蛋白表达上调,上皮细胞失去极性,形成有利于恶性肿瘤转移的迁移、侵袭和抗凋亡特性[13]。本研究显示,敲减UBE2S基因后,A375细胞中N-钙黏蛋白表达下调,提示UBE2S可能通过调控EMT过程中的N-钙黏蛋白促进MM细胞转移。
综上所述,我们发现,UBE2S在MM组织中高表达且与患者肿瘤分期呈负相关,敲减UBE2S基因后MM细胞迁移、侵袭和EMT过程受到抑制,细胞凋亡率增高,细胞周期阻滞于G1/S期,提示UBE2S可能作为关键驱动基因影响MM的发展和预后,为筛选MM分子治疗的靶点提供了部分理论基础,但具体机制和应用价值尚需进一步研究。
利益冲突所有作者均声明不存在利益冲突

