水氮耦合对葡萄叶片快速荧光诱导动力学特性的影响*
黄琴琴,杨再强,2**,李佳帅,李佳佳,郑芊彤,丁宇晖
水氮耦合对葡萄叶片快速荧光诱导动力学特性的影响*
黄琴琴1,杨再强1,2**,李佳帅1,李佳佳1,郑芊彤1,丁宇晖1
(1.南京信息工程大学气象灾害预报预警与评估协同创新中心,南京 210044;2.江苏省农业气象重点实验室,南京 210044)
以葡萄品种“红提”为试材进行土壤水分和氮素水平双因素控制实验,土壤水分设置为田间持水量的70%~80%(W1)、60%~70%(W2)、50%~60%(W3)和30%~40%(W4)共4个水平,氮素设计1.5N(25.5g·m−2,N1)、1N(17g·m−2,N2)、0.5N(8.5g·m−2,N3)和0N(0g·m−2,N4)4个水平。其中以W1、N2为对照(CK),分别在葡萄苗期的前、中、后期测定叶片快速荧光诱导动力学特性,以了解设施葡萄水肥需求规律。结果表明:(1)葡萄叶片苗期不同观测阶段快速荧光诱导动力学变化曲线在不同水分、氮素、水氮耦合处理下基本相似,但是随着土壤水分和氮素水平的降低,不同特征点位置(OJIP)存在明显差异,水分和氮素水平越高,葡萄叶片最大荧光值越大。(2)随着土壤含水量的降低,葡萄苗期叶片在不同时期PSⅡ反应中心能量配比存在明显的不同,与对照组CK相比,吸收的光能被反应中心捕获的量子产额(ΦPo)、激子被反应中心捕获后,用于推动电子传递链中超过QA的其它电子受体的激子占用于推动QA还原激子的比率(ψo)、反应中心吸收的光能用于电子传递的量子产额(ΦEo)均受到抑制,用于热耗散的量子比率(ΦDo)得到促进;随着施氮量的降低,ΦPo、ψo、ΦEo出现不同程度的升高,ΦDo则呈下降趋势;在各水氮耦合处理中,W1N3处理下ΦPo最大,W2N4处理下ψo和ΦEo得到显著提升,CK处理下ΦDo值最高。(3)单位活性反应中心吸收的光能(ABS/RC)、捕获的用于还原QA的能量(TRo/RC)、耗散的能量(DIo/RC)随着土壤含水量的减少而升高,而土壤含水量越低,单位反应中心捕获的用于电子传递的能量(ETo/RC)值越小;与CK相比,N1、N3、N4处理的PSⅡ反应中心活性参数均得到促进;W1N3处理下ABS/RC和DIo/RC最高,W3N2处理下TRo/RC最大,ETo/RC在W2N4处理下得到显著促进。(4)PSⅡ最大光化学效率(Fv/Fm)随着土壤水分的减少而逐渐降低。土壤含水量越少,PSⅡ潜在光化学活性(Fv/Fo)越低;W2N3处理下可变荧光值最高,W1N3处理下Fv/Fm和Fv/Fo最大。
葡萄;胁迫;水氮耦合;快速荧光;水肥比
葡萄(L.)为葡萄科葡萄属木质藤本植物,是世界最古老的果树树种之一。中国是世界上葡萄栽培面积较大的国家之一,葡萄栽培历史悠久,品种繁多。葡萄栽培与加工已成为许多地区的支柱性产业[1],截至2014年,中国葡萄栽培总面积超过80万hm2,位居世界第一[2]。国际葡萄与葡萄酒组织(OIV)统计数据显示,2017年中国葡萄酒产量居世界第7位,为10.8亿L;葡萄酒销量为17.9亿L,居全球第5位[3]。近年来,随着全球气候变暖的加剧,中国农业气象干旱呈现多发频发的态势,季节性的水分亏缺不仅对葡萄生长发育造成了严重影响,同时也降低了葡萄产量和品质。当前葡萄高产优质的另一项重要农业措施是合理施用氮肥[4],氮肥过量或过低均不利于营养器官的生长[5]。因此,如何解决水分亏缺条件下肥料合理施用问题,充分发挥水氮耦合效应,最大限度提高水分利用效率,并在不增加施肥量的情况下获得最大的经济效益,已成为当前葡萄栽培过程中亟待解决的关键问题[6]。
目前,国内外学者针对不同水氮水平及其耦合效应对葡萄影响机理等方面开展了广泛深入的研究。关于水分亏缺对葡萄叶片光合速率和果实品质的影响,Zhu等[7−8]研究发现在60%~75%的土壤水分下,可溶性糖、原花青素和白藜芦醇含量最高,此外,维生素C含量在40%~55%的水分下最大。在葡萄着色期高土壤水分条件下的光合特性优于低土壤水分条件下。Hamdi等[9−10]研究发现,土壤水分亏缺会降低葡萄叶片氧化酶活性,在田间持水量为50%~60%的条件下,葡萄叶片中氧化酶活性最低,但在土壤中施加20g·m−2的氮素后,氧化酶活性有显著升高趋势。关于水氮耦合对葡萄叶片光合及产量变化的影响研究发现,土壤水分亏缺会导致葡萄叶片气孔导度、蒸腾速率及光合速率明显下降,而施氮量的增加能消减这种下降趋势[11−12]。周兴本等[13]研究水分胁迫下不同肥料配比对无核白鸡心葡萄叶片叶面积、叶绿素含量、光合速率及氮代谢相关酶活性的影响时发现,水肥配比适宜能明显提高葡萄叶片叶面积指数和光合速率,在中轻度水分胁迫条件下,适当增施钾肥能明显提高硝酸还原酶、谷氨酰胺合成酶与谷丙转氨酶活性,提高氮肥转化效率。以往研究多集中在水分胁迫或水肥耦合对葡萄叶片酶活性、气孔导率、果实产量及品质等报道,而有关葡萄幼苗期不同水氮处理对叶片荧光动力学特性、能量分配比率以及葡萄叶片PSⅡ反应中心参数活性等内在机理方面鲜有报道。
因此,本研究以“红提”为试验材料,系统开展水分、氮素以及水氮耦合对葡萄苗期叶片荧光动力学特性的影响,进一步分析促进葡萄光合能力的最佳水氮耦合配比,以期为指导果农科学水肥管理,增加收益提供一定的科学依据。
1 材料与方法
1.1 试验地概况
实验于2017年6月−2018年1月在南京信息工程大学农业气象试验站进行。该试验地位于北纬32°03'、东经118°51'。处于长江以北地区,海拔约22m,属亚热带季风气候,多年平均降水量约1100mm,多年平均气温15.6℃。试验地土壤理化性质如表1所示。
1.2 试验方法与设计
选取的葡萄品种为“红提”(L.),树龄为1a。待植株叶片超过15叶后选取长势一致的幼苗定植于4个长8m,宽1m,深1m的土壤箱内,每个土壤箱内为同一水分处理。利用PE塑料薄膜将每个土壤箱分成4个区域,设置4个施氮梯度。以喷灌水量和施氮量为决策变量,采用二因子四水平全面试验设计,共设16个处理,重复3次,随机区组排列。分别在葡萄幼苗移栽后的Ⅰ期(10~20d)、Ⅱ期(20~30d)、Ⅲ期(30~40d)进行快速荧光动力学特性的测量。各处理严格按照高产地精细管理,及时控制和防治病、虫、草害。具体试验方案见表2。氮肥选用纯氮素,在葡萄幼苗期随水喷灌。
表1 供试土壤基本理化性质
Table 1 Physico-chemical properties of tested soil

表2 水氮耦合试验方案设计
Table 2 Design of water-nitrogen coupling experiment scheme
1.3 测定方法
分别于葡萄幼苗移栽后的Ⅰ期、Ⅱ期、Ⅲ期内的第5日9:30−11:30用Pocket PEA植物效率仪测定系统对各处理下的葡萄冠层叶片的叶绿素荧光参数进行测定。用暗适应夹夹住选定的叶片充分暗适应30min后,将分析探头置于叶夹上,打开叶夹遮光片,使叶片暴露于饱和脉冲光(3000μmol·m−2·s−1)下1s后,首先测定暗适应叶绿素荧光参数,再打开活化光(1500μmol·m−2·s−1)活化20min,测定光适应下的相应参数。测定项目包括快速荧光诱导动力学曲线、初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)和PSⅡ潜在活性(Fv/Fo),并测定葡萄叶片能量分配比率、PSⅡ反应中心活性参数和叶片荧光参数。从O点到P点的荧光上升过程称为快速叶绿素荧光诱导动力学曲线,主要反映了PSⅡ的原初光化学反应及光合机构电子传递状态等过程的变化。初始荧光产量,也称基础荧光,是PSⅡ反应中心(经过充分暗适应以后)处于完全开放状态时的初始荧光产量。一般认为,这部分荧光是天线中的激发能在尚未被反应中心捕获之前,由天线叶绿素发出的。当反应中心失活或者遭到破坏时,Fo上升。最大荧光产量(Fm),是PSⅡ反应中心完全关闭时的荧光产量,通常叶片经暗适应20min后测得。PSⅡ最大光化学效率(Fv/Fm)是暗适应下PSⅡ反应中心完全开放时的最大光化学效率,反映PSⅡ反应中心最大光能转换效率。Fv/Fo代表PSⅡ潜在光化学活性,与有活性的反应中心的数量成正比关系。每个处理随机选取3片生长正常、无病虫害的功能叶进行测定,取平均值。
1.4 数据分析
数据均取各重复平均值,采用Microsoft Excel 2010和SPSS 23.0软件进行数据处理、分析和制图。各处理差异显著性进行Duncan多重比较(P<0.05)。
2 结果与分析
2.1 土壤含水率对葡萄叶片快速荧光特性的影响
2.1.1 快速荧光诱导动力学曲线形态
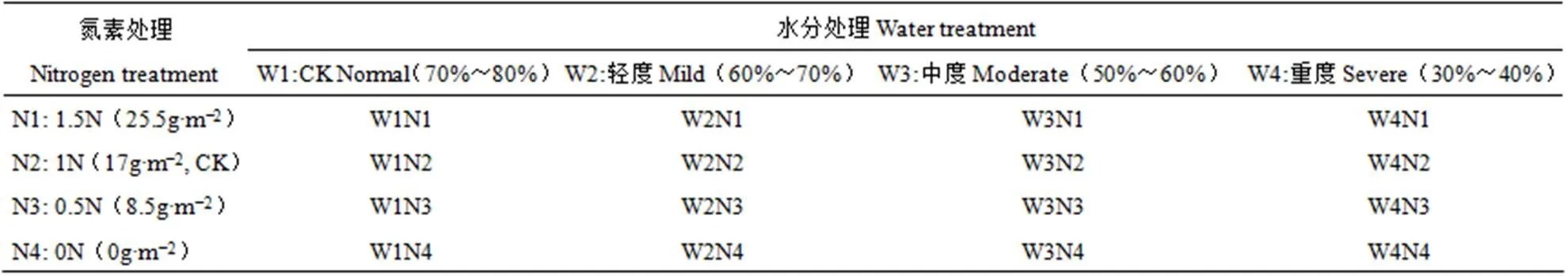
快速荧光诱导动力学曲线(OJIP)可以反映大量关于PSⅡ(光系统Ⅱ)反应中心原初光化学反应的信息。植物叶片生理生态的变化信息通过荧光参数反映到OJIP曲线上,因此通过观测OJIP曲线能够反映水氮环境对葡萄叶片生理状态的影响。由图1可以看出,在保持含氮量正常情况下(1N,17g·m−2处理),各水分处理(CK、W2、W3和W4)中,3个生育时期所测OJIP曲线的变化形态保持一致,但不同时期观测曲线上各特征点(O、J、I、P)的位置略有差异。图中显示,各处理曲线在O点处的荧光值差异不大,后逐渐加大,到J、I、P点开始出现明显差异,而且从不同时段所测曲线对比也可看出,随着处理时间的延长,各处理叶片荧光值也发生了不同程度的变化。在移栽后10~20d(Ⅰ期)、20~30d(Ⅱ期),W2处理(土壤水分为田间持水量的60%~70%)的荧光值最大,其曲线在最上端位置,最大荧光值分别为20990、17270,最下端位置为W4处理,最大荧光值为15783、11868,除CK(土壤水分为田间持水量的70%~80%)外,土壤水分含量越低其OJIP曲线位置亦越低。第Ⅲ期(移栽后30~40d)观测时,CK处理的荧光值急剧上升,基本在曲线的最上方,其最大荧光值上升到20424。其它水分亏缺处理中叶片荧光值均呈现下降趋势,尤以W3处理降幅最大,土壤水分含量越少其曲线位置越低。W2、W3、W4处理最大荧光值分别降至17463、10389、10387。说明在保证正常氮素供应情况下,在葡萄苗的生长发育前期,适当的水分胁迫有利于葡萄的生长发育,而随着胁迫时间的延长,水分缺失会对葡萄苗的生长产生不利影响。在设置的土壤含水量范围内,在葡萄苗的生长发育前期,轻度和中度水分胁迫(W2、W3),特别是W2水分处理最有利于葡萄生长发育,而到了后期,含水量越低,快速荧光诱导动力学曲线越低,说明水分缺失不利于葡萄的生长发育。
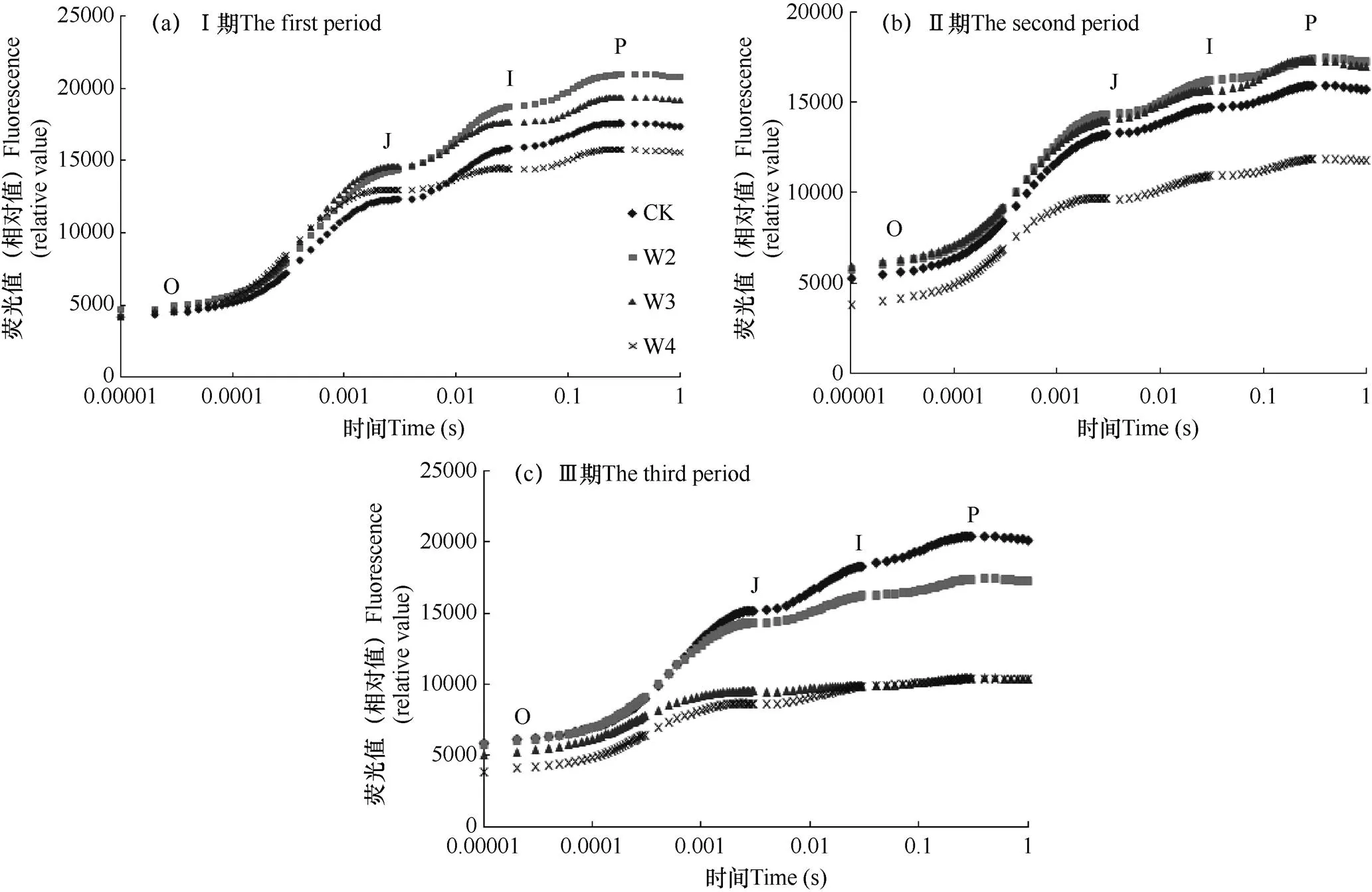
图1 不同土壤水分条件下葡萄叶片在3个观测时段的快速叶绿素荧光诱导动力学曲线
注:CK、W2、W3、W4分别表示土壤含水率为田间持水量的70%~80%、60%~70%、50%~60%、30%~40%的处理。Ⅰ期、Ⅱ期和Ⅲ期分别为移栽后10~20d、20~30d和30~40d。O点表示PSⅡ作用中心完全开放时,即所有电子受体处于最大程度氧化时的荧光,称为初始荧光;J点表示PSⅡ的电子受体QA第一次处于瞬时最大程度还原态时的荧光;I点反映了PQ库的异质性,即快还原型PQ库和慢还原型PQ库的大小;P点表示PSⅡ的电子受体处于最大程度还原态时的荧光,称为最大荧光。下同。
Note : CK, W2, W3, W4 represent that the soil water content is 70%−80%, 60%−70%, 50%−60% and 30%−40%, respectively. The first period, the second period and the third period were 10−20 days, 20−30 days and 30−40 days after transplanting, respectively. Point O indicates the fluorescence when the center of action of PSII is completely open, that is, when all electron acceptors are in maximum oxidation, be called initial fluorescence. Point J indicates the fluorescence of the electron acceptor QA of PSII when it is in the transient maximum reduction state for the first time. Point I reflects the heterogeneity of the PQ library, i.e. the size of the fast-reduction PQ library and the slow-reduction PQ library. Point P indicates the fluorescence of the electron acceptor of PSII when it is in the most reduced state, and be called maximum fluorescence. The same as below.
2.1.2 PSⅡ反应中心能量分配比率
ΦPo反映了吸收的光能被反应中心捕获的量子产额,其实际意义上与Fv/Fm相同。由图2a可知,Ⅰ、Ⅱ期的ΦPo在CK处理最高并均随失水程度的加深而呈现下降的趋势,Ⅰ、Ⅱ期的ΦPo在W4处理下与同期W1(CK)相比,分别降低了8.3%、10.0%。Ⅲ期的ΦPo则呈现先上升后下降的变化规律,并在W2处理最高,比同期W1增加了3.2%;W3处理比同期W2处理有所降低,但差异不显著。由此说明,随着失水程度的增加,叶片吸收的光能被反应中心捕获的概率在Ⅰ、Ⅱ期逐渐降低,在Ⅲ期先上升后逐渐下降。
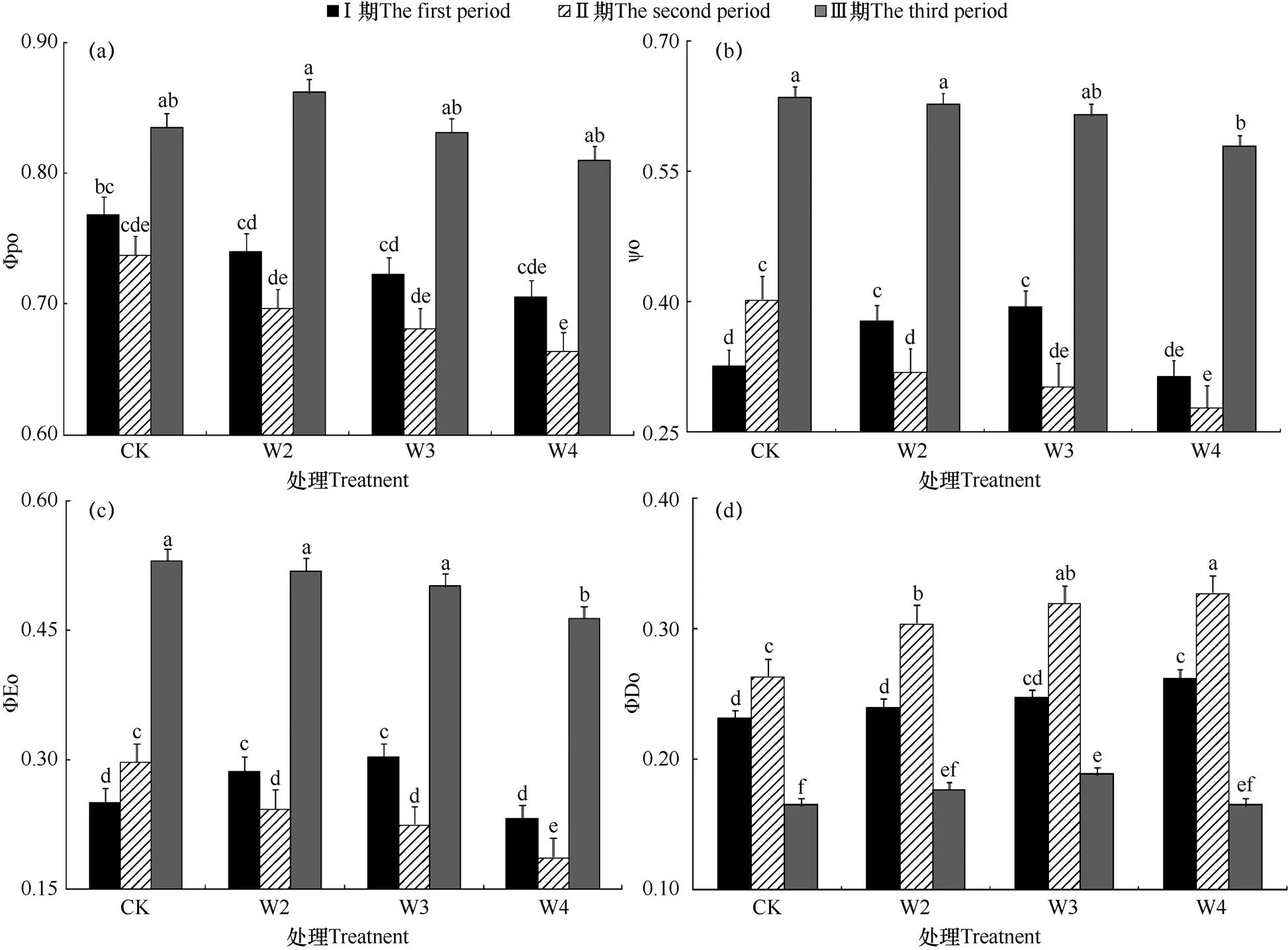
图2 不同土壤含水量条件下葡萄叶片ΦPo、Ψo、ΦEo和ΦDo的变化
注:同时期小写字母表示不同水分处理间在0.05水平上的差异显著性。下同。
Note : Different letters in the same period indicated significance of P<0.05 by Duncan’s significant test. The same as below.
ψo反映了激子被反应中心捕获后,用于推动电子传递链中超过QA的其它电子受体的激子占用于推动QA还原激子的比率。由图2b可知,ψo在Ⅰ期呈W1-W3处理依次升高的趋势,W2和W3与W1的差异均达显著水平;W4处理各期ψo均显著低于同期W3处理。ψo在Ⅱ、Ⅲ期从W1到W4处理逐渐降低,但各处理与W1的差异不显著。由此说明,随着失水程度的增加,电子传递到电子传递链中QA至下游的电子受体的概率在前期逐渐升高,中后期逐渐降低。
ΦEo反映了反应中心吸收的光能用于电子传递的量子产额。由图2c可知,随着失水程度的加强,ΦEo在Ⅱ、Ⅲ期逐渐降低,并与W1的差异均达显著水平,而在Ⅰ期表现出先上升后下降的趋势。ΦEo在第Ⅰ期以W3处理最高,并与W2处理差异不显著,而与W1、W4处理差异显著。由此说明,当水分减少时,反应中心吸收的光能将电子传递到电子传递链中超过QA的其它电子受体的概率逐渐降低。
ΦDo反映了用于热耗散的量子比率。图2d显示,ΦDo在Ⅰ、Ⅱ期均随着失水程度的增强呈现依次上升的变化规律;而在Ⅲ期则呈现先上升后下降的趋势。其中,W4处理在Ⅰ、Ⅱ期与W1处理差异均达显著水平;Ⅲ期以W3处理最高,虽然W4处理的ΦDo比W3处理有所降低,但两处理间差异不显著。可见,在失水条件下葡萄叶片吸收的光能用于热耗散的比率增多。
2.1.3 PSⅡ反应中心活性参数
通过快速荧光诱导动力学曲线OJIP可以分析出PSⅡ反应中心的活性,具体体现在4个活性参数,即单位活性反应中心吸收的光能(ABS/RC)、捕获的用于还原QA的能量(TRo/RC)、捕获的用于电子传递的能量(ETo/RC)和耗散的能量(DIo/RC)。
单位活性反应中心吸收的光能(ABS/RC)在各时期的各水分处理下,随着施水量的减少而依次升高;虽然W3相比于W2有所下降,但同时期两处理间差异不显著。W4处理比CK处理各时期的ABS/RC值分别提高49.5%、32.6%、31.2%。由此说明,随着土壤含水量的降低叶片活性反应中心吸收的光能逐渐增加(图3a)。
图3 不同土壤含水率条件下ABS/RC、TRo/RC、ETo/RC和DIo/RC的变化
随着施水量的减少,单位活性反应中心捕获的用于还原QA的能量(TRo/RC)在Ⅰ、Ⅱ、Ⅲ期总体呈现升高的趋势(图3b)。虽然W3处理比W2处理在Ⅱ期表现出降低的趋势,但显著高于同期CK处理。W4处理比CK处理各时期的TRo/RC值分别提高82.6%、30.6%、28.3%,说明水分减少会使捕获的用于还原QA的能量升高特别是在W2处理下。
单位反应中心捕获的用于电子传递的能量(ETo/RC)在Ⅰ期的各处理下,随着施水量的减少呈现先降低后升高的趋势,而在Ⅱ、Ⅲ期逐渐降低(图3c)。其中在Ⅰ期以W3处理下最低,比同期的W1降低了26.4%;在Ⅱ期以W4处理下最低,与其它处理差异显著。在Ⅲ期各处理下ETo/RC值均显著高于Ⅱ期,虽在W4处理下最低,但与同期其它各处理无显著差异。
Ⅰ、Ⅱ、Ⅲ期的单位活性反应中心耗散的能量(DIo/RC)均随着施水量的减少而呈现逐渐升高的变化趋势(图3d)。其中,Ⅰ期的DIo/RC在W2、W3、W4处理下分别比同期CK显著升高43.8%、51.9%、81.2%;Ⅱ期的DIo/RC在各水分胁迫处理下均与CK差异显著,但各胁迫处理之间差异不显著。Ⅲ期的DIo/RC在W2、W3处理下与W1差异不显著,W4处理下显著高于CK。说明在葡萄苗的生长发育前期,土壤含水量减少会使单位反应中心耗散的能量升高。
2.1.4 葡萄叶片荧光参数
Fv为可变荧光,反映了PSⅡ的电子传递最大潜力。不同的水分处理对葡萄叶片Fv影响显著。由表3可见,在移栽后10~20d(Ⅰ期),CK处理的荧光值最大,最小值出现在W4处理,土壤水分含量越少的处理其Fv值越小。在移栽后20~30d(Ⅱ期),CK的Fv值急剧下降为4个处理中的最低值,其它处理虽也呈现下降趋势,但均高于CK处理。移栽后30~40d(Ⅲ期)观测时,各处理的Fv值均急剧上升,特别是W2处理,为各处理中的最大值,并且除W2外,水分越少的处理中Fv值越低,说明土壤含水量越少葡萄叶片可变荧光值越低。
Fv/Fm是指开放的PSⅡ反应中心捕获激发能的效率,即最大光化学效率。由表3可知,Ⅰ期CK处理的Fv/Fm值最大,最小值为W4处理。随着土壤含水量的减少,Fv/Fm值逐渐减少。Ⅱ期各处理Fv/Fm值均显著下降,CK处理的下降幅度较小,仍为各处理中的最大值。最小值为W3处理,但CK与W3处理差异不显著。说明不同水分处理对葡萄苗生长前期最大光化学效率影响不大。Ⅲ期各处理Fv/Fm值比前两期高,CK处理的Fv/Fm值最大,但各处理间差异不显著。说明在葡萄苗的生长后期,伴随着葡萄叶片叶面积指数的增长,最大光化学效率会逐渐增加。不同水分条件处理之间Fv/Fm值差异不显著,说明水分条件对葡萄叶片最大光化学效率的影响不显著。
Fv/Fo代表PSⅡ潜在光化学活性,与有活性的反应中心的数量成正比关系。表3显示,Ⅰ、Ⅱ期的最大值均为CK处理,最低值为W4处理。土壤水分含量越少Fv/Fo值越低。Ⅲ期各处理的Fv/Fo值急剧上升,特别是W2处理上升为各处理中的最大值。说明在葡萄苗生长前期,水分缺乏不利于PSⅡ潜在光化学活性的升高,而后期轻度水分胁迫条件(W2)下葡萄叶片PSⅡ潜在光化学活性较大。
表3 不同土壤含水率对葡萄叶片荧光参数的影响
Table 3 Effects of different soil moisture on fluorescence parameters of grape leaves

2.2 含氮量对葡萄叶片快速荧光特性的影响
2.2.1 快速荧光诱导动力学曲线形态
由图4可以看出,在保持土壤含水量正常情况下(W1,70%~80%水分处理),各氮素处理(N1、CK、N3和N4)中在葡萄叶片3个生育时期所测OJIP曲线的变化形态保持一致。与水分处理的变化趋势相似,随着施氮量的减少,不同氮素处理的曲线在各点的差异逐渐增大。不同时期各点荧光值的差异显著。在移栽后10~20d(Ⅰ期),N3处理的荧光值最大,曲线位于最上端,其最大荧光值为20412,最下端为CK处理,其最大荧光值为17601。Ⅱ期各处理较Ⅰ期荧光值有所下降,N1处理却有上升趋势,基本处在曲线的最上方,最大荧光值上升到19640,除N4外,氮素越少的处理曲线位置越高。Ⅲ期CK处理的荧光值急剧上升至20418,处于曲线的最上方。其它氮素处理中荧光值均有下降趋势,N1、N3和N4处理分别降至14408、13482和12341。说明正常水分供应条件下,在葡萄苗的生长发育前期,适当的氮素亏缺特别是N3处理(0.5N,8.5g·m−2)有利于苗的发育,在中期却需要较多的氮素为苗的发育提供营养,N1处理(1.5N,25.5g·m−2)更有利于苗的生长发育。后期标准化施氮(CK,17g·m−2)的荧光值最高,氮素富集和亏缺都不利于葡萄苗的生长。
2.2.2 PSⅡ反应中心能量分配比率
由图5a可知,Ⅰ期ΦPo以N3处理最高,CK处理下最低,但各处理之间差异不显著。Ⅱ期各处理间的ΦPo值均有所下降特别是N3处理。N1处理下降幅度最小,为Ⅱ期各处理间的最大值,CK下降至各处理中的最低值。Ⅲ期各处理相较于Ⅱ期均有大幅度提升,N3处理上升幅度最大,为各处理中的最大值,CK处理最低。说明在葡萄苗生长发育前期和后期,适当的氮素亏缺(N3,0.5N,8.5g·m−2)下叶片吸收的光能被反应中心捕获的概率反而提升,而在中期则需要较多的氮素(N1,1.5N,25.5g·m−2)提供反应中心捕获光能的能量。

图4 不同氮素条件下葡萄叶片在3个观测时段的快速叶绿素荧光诱导动力学曲线
注:N1、CK、N3、N4分别为1.5N(25.5g·m−2)、1N(17g·m−2)、0.5N(8.5g·m−2)、0N(0g·m−2)施氮处理。下同。
Note : N1,CK,N3 and N4 represented 1.5N(25.5g·m−2),1N(17g·m−2),0.5N(8.5g·m−2) and 0N(0g·m−2), respectively. The same as below.
Ψo在Ⅰ期呈现随着氮素处理的升高而增大的趋势。由图5b可知,Ⅱ期除N1处理显著上升外其它各处理均显著下降,特别是N3处理下降幅度最大,为各处理中最低。Ⅲ期较Ⅰ、Ⅱ期各处理均有大幅提升,Ψo除CK有轻微下降外其它处理随着氮素水平的增加而逐渐增大。说明在葡萄苗的生长前期,氮素胁迫可使电子传递到电子传递链中QA-下游的电子受体的概率逐渐升高,中期各处理Ψo均有所下降,而通过施加过量的氮素可使Ψo不减反增。后期Ψo大幅提升而适当的氮素富集和胁迫处理均有利于Ψo增大。
由图5c可看出,ΦEo在Ⅰ期随着氮素处理的减少呈现逐渐增加的趋势。Ⅱ期除N1处理显著上升外其它各处理均显著下降,特别是N3处理下降幅度最大,为各处理最低。Ⅲ期较Ⅰ、Ⅱ期各处理均有大幅度提升,ΦEo除CK有轻微下降外,其它处理随着氮素水平的递减而逐渐增大。说明在葡萄苗的生长前期,氮素胁迫可使反应中心吸收的光能将电子传递到电子传递链中超过QA的其它电子受体的概率逐渐升高,在中期ΦEo各处理下均有所下降,而施加过量氮素处理下ΦEo不减反增。后期ΦEo大幅提升说明适当的氮素富集和胁迫处理均有利于ΦEo增大。
ΦDo在Ⅰ期以N4处理最大,各处理间ΦDo差异不显著。由图5d看出,Ⅱ期较Ⅰ期显著上升,N1处理上升幅度最小,为各处理中最低。在Ⅱ期随着氮素施入的减少ΦDo呈现先上升后下降的趋势,以CK处理最大。Ⅲ期各处理ΦDo值急剧下降,特别是N3处理下降为最低值,各处理间差异不显著。说明在葡萄苗的生长前期和后期,氮素对葡萄叶片用于热耗散的量子比率影响不显著,在中期氮素富集和轻度胁迫都可提高葡萄叶片用于热耗散的量子比率。

图5 不同氮素条件下ΦPo、Ψo、ΦEo和ΦDo的变化
2.2.3 PSⅡ反应中心活性参数
由图6a、图6b看出,活性反应中心吸收的光能ABS/RC和单位反应中心捕获的用于还原QA的能量TRo/RC在Ⅰ期随着施氮量的减少呈现先上升后下降的趋势,以CK处理最高,N1处理最低。Ⅱ期各处理均急剧上升,特别是N3处理上升为Ⅱ期的最大值,ABS/RC和TRo/RC在N1−N3处理随着施氮量的减少逐渐增大,N4处理急剧下降,与N3处理差异显著。Ⅲ期各处理相较于Ⅱ期ABS/RC和TRo/RC急剧下降,CK下降幅度最小,为Ⅲ期的最大值,随着施氮量的减少,ABS/RC和TRo/RC先上升后下降。说明在葡萄苗的生长发育前期,标准施氮量(CK)有利于反应中心捕获光能,氮素富集和缺乏都不利于这一机制。在中期中度氮素胁迫(N3)可使反应中心吸收的光能和单位反应中心捕获的用于还原QA的能量增加。在后期两者总体下降幅度较大,标准施氮处理下降幅度较小,说明标准施氮可缓解这一现象。
ETo/RC在Ⅰ期随着施氮量的减少而逐渐降低。由图6c看出,Ⅱ期N1−N3随着施氮量的减少ETo/RC逐渐降低,到N4处理却显著上升为Ⅱ期的最大值,N3下降幅度最大,为Ⅱ期最小值。Ⅲ期除N1处理外,其它各处理均显著上升,特别是N3处理上升幅度最大,为各处理最大值。ETo/RC随着施氮量的减少呈现先上升后下降的趋势,N1处理最低。说明在葡萄苗的生长发育前期施较多的氮肥会使单位反应中心捕获的用于电子传递的能量ETo/RC增多,中期氮素严重缺乏(N4)却可使ETo/RC的比率增大,后期除氮素富集外其它处理均可使ETo/RC增加。
图6d显示,DIo/RC在各时期各处理下差异显著,Ⅰ期虽然各处理间差异不大,但随着施氮量的减少呈现先下降后上升的趋势,N1处理下DIo/RC最大,N3处理下最小。Ⅱ期除N1处理外,其它各处理DIo/RC均急剧上升并随着施氮量的减少呈现先上升后下降的趋势,N3处理上升幅度最大,为Ⅱ期最大值,N1处理上升幅度最小,为Ⅱ期最小值。Ⅲ期各处理DIo/RC均大幅下降,且各处理间差异不显著。说明在葡萄苗生长发育前期,施较多氮素使单位反应中心耗散掉的能量DIo/RC增加,而中期氮素缺乏却会使DIo/RC大幅度上升,特别是N3处理下上升幅度最大,在后期氮肥对葡萄叶片单位反应中心耗散掉的能量影响不显著。

图6 不同氮素条件下ABS/RC、TRo/RC、ETo/RC和DIo/RC的变化
2.2.4 葡萄叶片荧光参数
不同氮素条件对葡萄叶片荧光参数的影响如表4所示,由表可知,在不同氮素水平下,可变荧光值总体在Ⅲ期表现最大。Ⅰ期在N1处理下Fv值表现最高。Ⅱ、Ⅲ期均以CK处理下可变荧光值最高。可变荧光最大值出现在Ⅲ期的CK处理,高达24178。
不同N素处理Fv/Fm值变化规律与不同水分处理下类似。在Ⅰ期以N3处理最高,Ⅱ期的最大值为N1处理,且各处理间差异不显著。Ⅱ期各处理值均比Ⅰ期低。Ⅲ期相比于Ⅱ期有所上升,最大值为N3处理,但是各处理间差异不显著。
在不同氮素水平下,Fv/Fo值在Ⅰ期的最大值出现在N3处理,最低值为N4处理,且两者差异显著。Ⅱ期以N1处理的Fv/Fo值最高,且与其它三种处理差异达到显著水平,最低值为CK处理。Ⅲ期的最大值也出现在N3处理,但与其它处理差异不显著。说明在葡萄叶片生长后期,随着叶面积指数的增大,不同水平的N素处理对叶片的可变荧光值影响不大。
2.3 水氮耦合对葡萄冠层叶片快速荧光特性的影响
2.3.1 快速荧光诱导动力学曲线
如图7所示,在移栽后10~20d(Ⅰ期)、20~30d(Ⅱ期)以W1N1的荧光值最大,曲线在最上端位置,最大荧光值Ⅰ期为24667,Ⅱ期为19640,最下端位置为W4N3处理,其Ⅰ期最大荧光值为13415,Ⅱ期为13647。Ⅱ期各处理较Ⅰ期除W4N3处理外均呈显著下降趋势,以W4N1处理降幅最大,下降28.6%。Ⅲ期(移栽后30~40d)观测时,CK处理的荧光值急剧上升,基本在曲线的最上端,其最大荧光值为20424。除W2N2、W2N4、W3N4和W4N3处理有较显著上升外,其它各处理均显著下降,以W4N2处理为最低,其最大荧光值为10386。说明在葡萄苗生长发育前、中期,充足的水分和氮素条件耦合(W1N1)有利于葡萄的生长发育,水分和氮素条件缺乏(W4N3)可能会抑制苗的生长。在后期,葡萄苗最适宜在标准量的水氮耦合条件(CK)下生长发育。
2.3.2 PSⅡ反应中心能量分配比率
由图8可见,ΦPo、ψo和ΦEo在Ⅲ期总体高于Ⅰ期和Ⅱ期,Ⅱ期值最低。各处理在同一时期的差异不显著,但在不同时期各处理间差异显著。其中代表不同时期的三条折线之间分布趋势均匀。说明不同水氮耦合处理对ΦPo、ψo和ΦEo的影响不大,随着叶面积指数的增大,在葡萄苗生长发育的各个时期ΦPo、ψo和ΦEo会有显著差异。
用于热耗散的量子比率ΦDo的变化趋势在不同时期差异显著,以Ⅱ期最高,Ⅲ期最低。最高值为Ⅱ期的CK处理,达到0.33,最低值为Ⅲ期的W4N1处理,ΦDo值为0.16。说明用于热耗散的量子比率在葡萄苗期有明显的分期变化,在苗生长前期和中期ΦDo随着叶片生长而增大,而到了后期又会呈现大幅下降的趋势(图8d)。
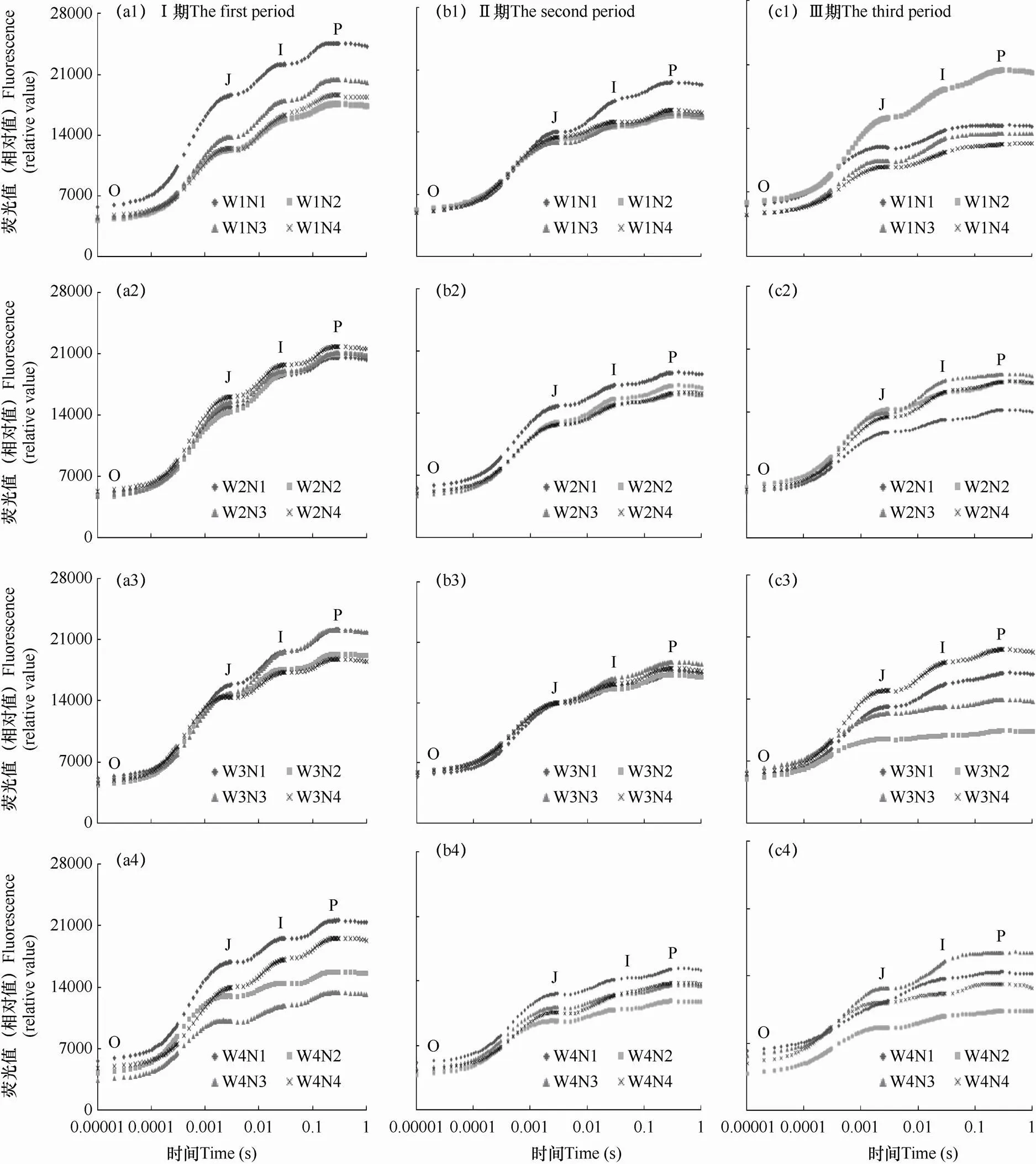
图7 各时期水氮耦合条件葡萄叶片快速叶绿素荧光诱导动力学曲线的变化
注:a1−a4为移栽后10~20d(Ⅰ期),b1−b4为移栽后20~30d(Ⅱ期),c1−c4为移栽后30~40d(Ⅲ期)。
Note : a1−a4 are 10−20 days after transplanting (the first period), b1−b4 are 20−30 days after transplanting (the second period), and c1−c4 are 30−40 days after transplanting (the third period).
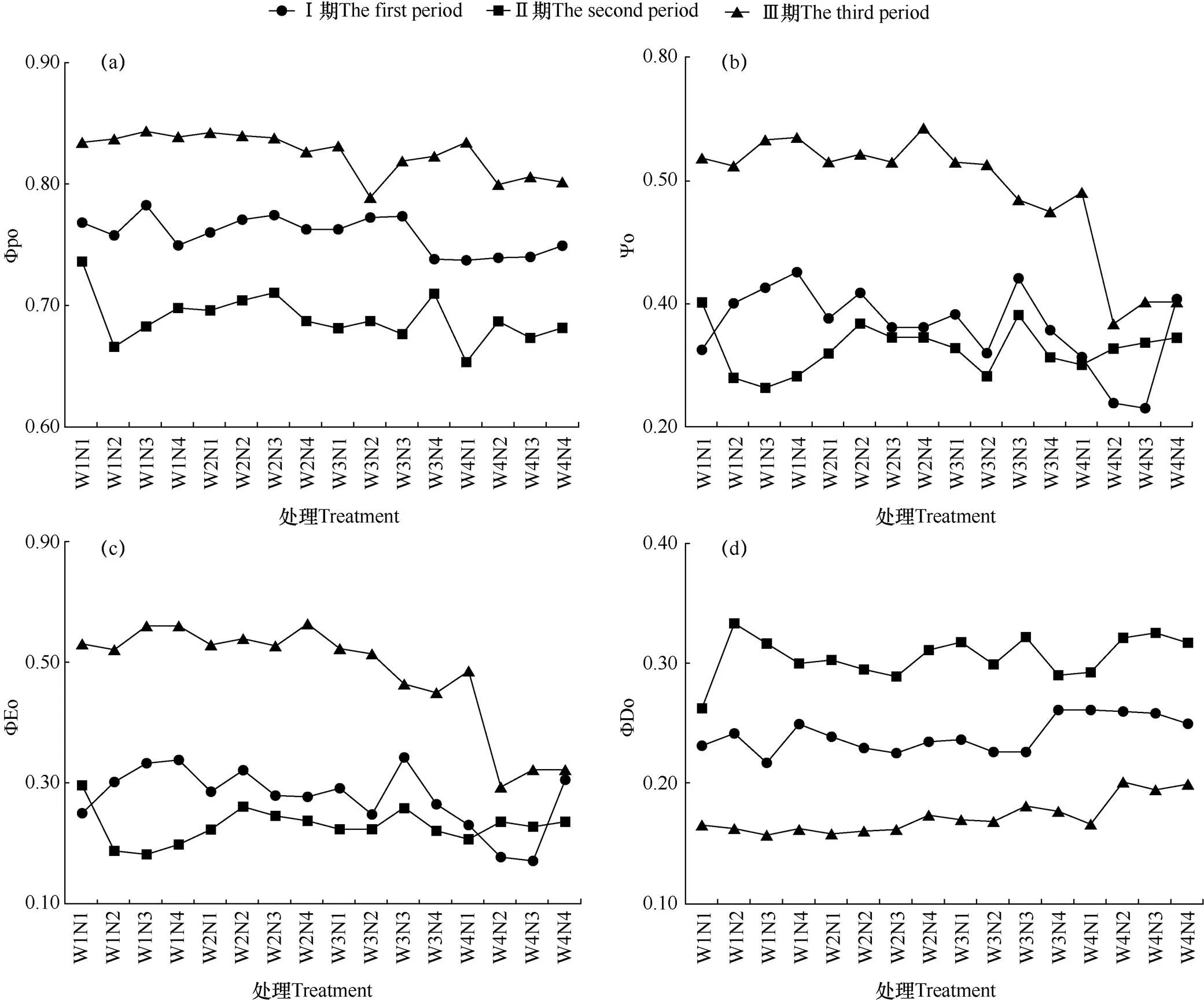
图8 各时期不同水氮耦合条件下葡萄叶片能量分配比率的变化
2.3.3 PSⅡ反应中心活性参数
由图9a、b、d可见,ABS/RC、TRo/RC和DIo/RC在不同的水氮耦合处理下,以Ⅲ期各处理最低,Ⅱ期总体最高,各处理在同一时期的差异不显著,但在不同时期各处理间差异显著。说明不同水氮耦合处理对ABS/RC、TRo/RC和DIo/RC的影响不显著,在葡萄苗生长发育的中期ABS/RC、TRo/RC和DIo/RC会随着氮素的稀释而下降,后期随着叶面积指数的增大而升高。
从图9c看出,ETo/RC在各时期的各处理下,在W4N2之前的所有处理中,总体呈现Ⅲ期最高,Ⅰ期和Ⅱ期ETo/RC值大小分布差异不显著,但在W4N2、W4N3和W4N4处理下,Ⅲ期ETo/RC值大幅度下降后低于Ⅱ期。说明除W4N1处理外,W4与其它氮素处理耦合在后期均不利于葡萄苗的发育。最高值出现在Ⅲ期的W2N4处理,达到0.69。最低为Ⅰ期的W4N4处理,ETo/RC值为0.34。说明在葡萄苗的生长前期,缺水缺氮不利于生长,中期在W3N3处理下ETo/RC值显著升高,说明在中度缺水条件下施加0.5N(8.5g·m−2)有利于电子传递的效率增加。后期水分充足条件下不施加氮素也有利于捕获的用于电子传递的能量升高,说明在水分充足条件下不施加氮素在一定程度上可以提高电子传递效率。
2.3.4 葡萄叶片荧光参数
表5展现了葡萄叶片荧光参数不同水氮耦合处理下在同一时期的差异。由表可见,Fv在Ⅰ期的最大值出现在W1N1处理,达到19005,最低值为W4N3处理,Fv值为12076,同期最低值比最高值降低了36.5%。Ⅱ期Fv值总体比Ⅰ期低,最高值出现在W3N4处理,达到13588,最低值为W4N3处理,Fv值为7952。同期最低值比最高值降低41.5%。Ⅲ期总体比Ⅰ、Ⅱ期高。W2N3为Ⅲ期的最高值,达到25884。最低值为W3N3处理,Fv值为18134。最低值比最高值降低了29.9%。说明较高水分和氮素水平耦合条件下可提高葡萄苗期叶片的可变荧光值。
Fv/Fm在Ⅲ期值也总体高于Ⅰ、Ⅱ期。Ⅰ期总体值在0.7以上,最高值为W1N3处理,达到0.793。W4N1处理为Ⅰ期的最低值,Fv/Fm值为0.718。不同水氮耦合处理对葡萄叶片生长发育前期叶片最大光化学效率影响不显著。在同一处理下Ⅱ期Fv/Fm值总体比Ⅰ期低。最高值为W4N1处理,达到0.740,比最低值高11.1%。最低值为CK处理,Fv/Fm值为0.666。Ⅲ期Fv/Fm值除W4N2和W4N4处理,其它处理Fv/Fm值均保持在0.8以上。0.875为W1N3处理下Ⅲ期的最高值,最低值为W4N2处理,最大光化学效率为0.769。最高值比最低值大13.8%。说明水分充足氮素缺乏(W1N3)或者氮素充足水分缺乏条件(W4N1)都可提高葡萄叶片苗期的最大光化学效率。
Fv/Fo在不同时期的处理差异显著,Ⅲ期远高于Ⅰ、Ⅱ期。Ⅰ期最高值出现在W2N3处理,Ⅱ期最高值为W1N1处理,Ⅲ期W1N3处理达到5.40,为3个时期的最大值。可见在葡萄苗的生长前期水分和氮素轻度缺乏有利于可变荧光值升高,中期较高的水分和氮素条件耦合可使可变荧光值升高到最大,后期水分充足氮素缺乏条件可提高葡萄叶片PSⅡ潜在光化学活性。

图9 各时期不同水氮耦合条件对葡萄叶片PSⅡ反应中心活性参数的影响
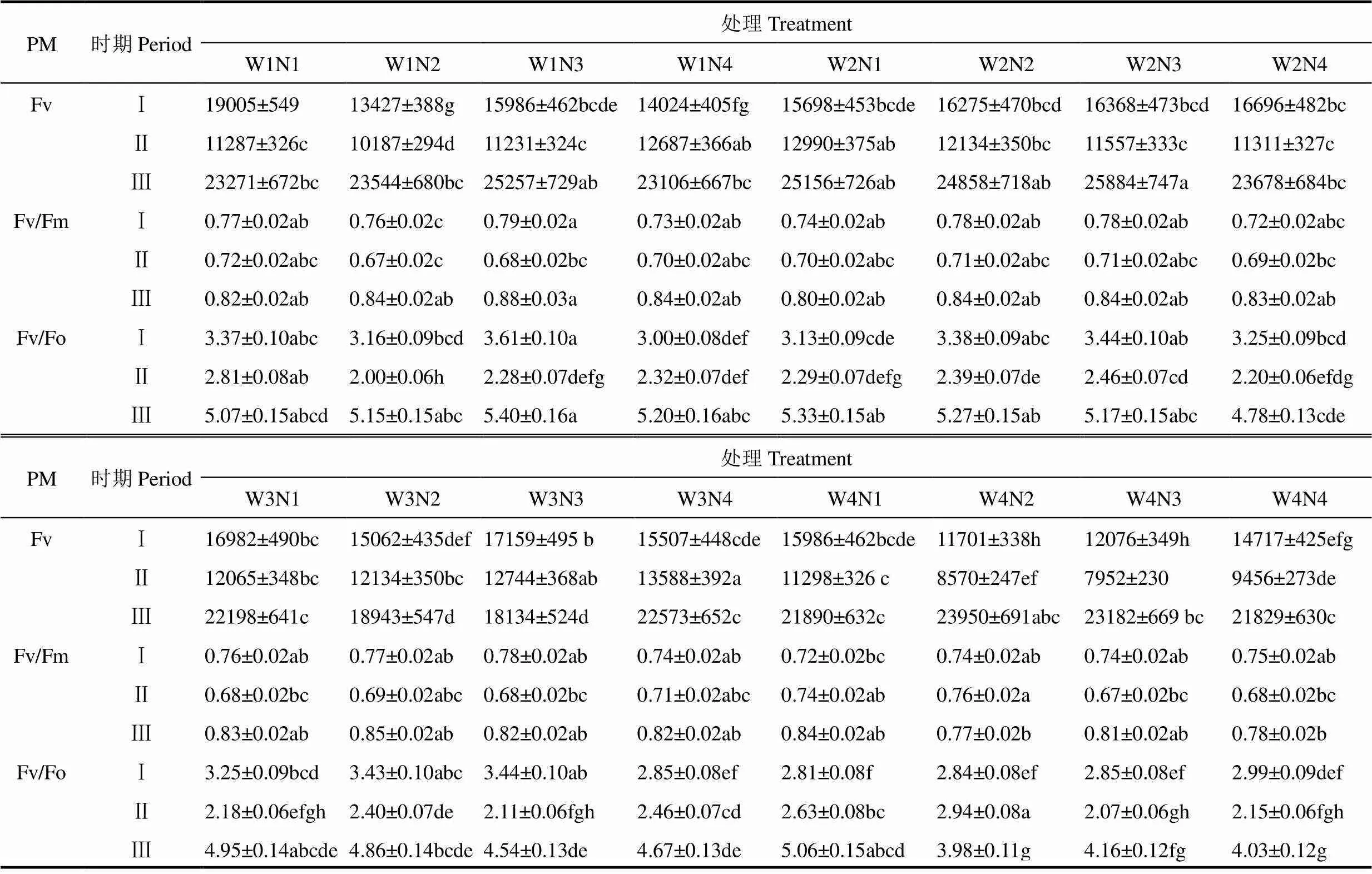
表5 水氮耦合处理对葡萄叶片荧光参数(PM)的影响
3 结论与讨论
3.1 结论
水和肥是农业生产中投入最大的两大主要环境因素,二者既相互促进又相互制约,只有在水分和养分合理投入、协调供应的情况下,才能产生明显的协同互作效果,表现出大于两因子的耦合效应,起到增产效果[14−15]。
(1)典型的快速叶绿素荧光动力学曲线在荧光上升阶段有O、J、I、P相,对应光化学反应阶段[16],水分、氮素和水氮耦合对植物叶片叶绿素荧光曲线的改变主要体现在对QA的影响上。曲线P点处的荧光为最大荧光值,表明PSⅡ的电子受体处于最大程度还原态时的荧光[17−18]。本研究中,在水分胁迫下,葡萄叶片在不同的生长时期,其荧光动力学曲线P点荧光强度有所差异,基本表现为CK>W2> W3>W4,表明在较低的相对湿度条件下,电子在PSⅡ受体侧的还原受到阻碍。氮素处理则在葡萄叶片移栽后30~40d,以CK处理下P点荧光强度达到最大,N1处理下最低,说明氮素富集和缺乏在一定程度上抑制电子在PSⅡ受体侧的还原过程。在水氮耦合情况下,设施葡萄冠层叶片快速荧光诱导动力学曲线特征基本相似,W1N1处理与W1N2处理的荧光值为3个时期的最大值,而W4N3和W4N2处理为最低值,说明水分和氮素富集的处理有利于PSⅡ的电子受体处于还原态。
(2)ΦPo、ψo、ΦEo和ΦDo是与植物能量分配比率相关的荧光参数。本实验中水分和氮素胁迫下,随着胁迫程度的增加,ΦPo、ψo、ΦE有所升高,而ΦDo有所下降,表明葡萄叶片在不同胁迫条件下调整了能量在PSⅡ反应中心的分配比率,即提高了用于电子传递的量子比率,降低了用于热耗散的量子比率。这可能也是葡萄苗期叶片在水分和氮素胁迫下的一种适应性调节机制,在水氮耦合协同作用下,葡萄苗期叶片能量分配比率相关的荧光参数表现与单因子胁迫稍有差异,在水氮均处于重度胁迫下,ΦPo、ψo、ΦE升高程度明显高于轻度胁迫,而ΦDo呈现明显相反的趋势,表明在适宜的水氮耦合协同互作下,葡萄叶片电子传递的量子比例明显高于用于热耗散的量子比例。ABS/RC、TRO/RC、ETO/RC和DIO/RC在一定程度下反映了在QA可还原的状态时单位PSⅡ反应中心的活性。ABS/RC是衡量天线色素大小比例的重要指标,当该值和TRO/RC均减小时,说明天线色素尺寸显著减小[19]。本试验在水分和氮素处理下,葡萄苗期各阶段叶片ABS/RC和TRO/RC均下降,说明天线色素吸收和捕获的光能减少,从而导致用于电子传递的能量较少,水氮耦合情况下,在葡萄苗期生长前中后期均表现为先增加后减小的趋势,天线色素尺寸呈现先增加后显著减小的趋势。
(3)Fv/Fm值下降是植物光系统受到光抑制的重要指标[20]。本试验研究结果表明,与对照组CK相比,Ⅰ、Ⅱ、Ⅲ期葡萄苗期叶片在纯水分和纯氮素胁迫处理下,Fv/Fm值均有不同程度的下降,这可能与植物在外部环境胁迫下D1蛋白的净损失和光合器官的损伤有关,也可能与PSⅡ对所吸收光能的分配有关[21−22]。Jiang等[23]研究发现,当植物受到重度水氮胁迫时,D1蛋白的降解明显加剧,造成受体库明显减少。
3.2 讨论
综上可知,水分和氮素的单因子胁迫作用,一定程度上降低葡萄苗期叶片电子在PSⅡ受体侧的传递能力,限制PSⅡ的QB和PQ被还原的能力;而在适宜的水氮耦合协同作用下,葡萄苗期叶片电子的传递效率和还原能力明显提高,葡萄叶片天线色素含量的明显增加,所吸收和捕获的光能及电子传递的能量都随之增加,这是由于水氮耦合的相互协同在一定程度上提高了氮素的转运效率,氮素可以促进植物生根,植株通过生长状态良好的健壮根系吸收土壤中的水肥,促进植株生长,进一步促进光合作用的进行和叶绿素的合成,形成良性循环。在受到水分和氮素胁迫后一些参数出现比CK更高的情况,这可能与植物具有一定的抗逆性有关,即葡萄在受到环境胁迫下,植株的生长没有受到伤害,对相应的环境胁迫产生一定抵抗能力,并且出现比标准条件下荧光值更高的情况,这与繆颖[24]的研究结果一致。本研究中水分和氮素胁迫下PSⅡ反应中心的能量分配比率和活性参数在不同时期均表现出一定的抗逆特性。
本研究以葡萄品种“红提”为试材,系统研究了水氮耦合对葡萄叶片快速荧光诱导动力学特性的影响,可为葡萄苗期叶片生长阶段的肥水管理提供一定的科学依据,但实验结果是否适合其它葡萄品种,还有待进一步研究。另一方面,本实验仅考虑了设施葡萄苗期水分、氮素和水氮耦合效应,水氮耦合对葡萄植株其它发育阶段的生理响应机制有待进一步研究。
[1] 樊新平,辛平,王玉龙.河西走廊绿洲灌区优质酿酒葡萄高效栽培技术[J].甘肃农业科技,2014,(5):66-68.
Fan X P,Xin P,Wang Y L.High-efficiency cultivation techniques of high-quality wine grapes in Oasis irrigation district[J].Gansu Agricultural Science and Technology,2014,(5):66-68.(in Chinese)
[2] OIV.Global state of conditions report:developments and trends[R/OL]. http://www.oiv.int/en/oiv-life/global-state-of-conditions-report-developments-and-trends-april-2018,2018-04-23.
[3] 穆维松,高阳,王秀娟,等.我国设施葡萄生产的成本收益比较研究[J].中外葡萄与葡萄酒,2014,(3):20-24.
Mu W S,Gao Y,Wang X J,et al.Comparative cost-benefit analysis on grape protected cultivation[J]. Sino-Overseas Grapevine & Wine,2014,(3):20-24.(in Chinese)
[4] 贺普超.提高我国葡萄产量和品质的主要途径与方法[J].果树科学,1995,(4):264-268.
He P C.The main ways and methods to improve the yield and quality of grapes in China[J].Journal of Fruit Science,1995,(4):264-268.(in Chinese)
[5] 李淑玲,何尚仁,杨建国,等.葡萄营养与施肥[J].北方园艺,2000,(3):19-20.
Li S L,He S R,Yang J G,et al.Grape nutrition and fertilization[J].Northern Gardening,2000,(3):19-20.(in Chinese)
[6] 杨祖斌.葡萄种植中水肥一体化技术的运用分析[J].南方农业,2018,12(6):20-22.
Yang Z B.Application analysis of water and fertilizer integration technology in grape planting[J].South China Agriculture,2018,12(6):20-22.(in Chinese)
[7] Zhu S M,LiangY L,Gao D K.Study of soil respiration and fruit quality of table grape(L.)in response to different soil water content in a greenhouse[J].Communications in Soil Science and Plant Analysis,2018,49(21):2689-2699.
[8] Adeyemi O,Grove L,Peets S.Dynamic modeling of the baseline temperatures for computation of the crop water stress index(CWSI) of a greenhouse cultivated lettuce crop[J].Computers and Electr-Onics in Agriculture,2018,153:102-114.
[9] Hamdi I,Kooli S,Elkhadraoui A,et al.Experimental study and numerical modeling for drying grapes under solar greenhouse[J].Renewable Energy,2018,127:936-946.
[10]Mohseni P,Borghei A M,Khanali M.Coupled life cycle assessment and data development analysis for mitigation of environmental impacts and enhancement of energy in grape production[J].Journal of Cleaner Production,2018,197:937-947.
[11]马奇梅,张芮,成自勇,等.不同生育期亏缺灌溉对酿酒葡萄生长及耗水特性的影响[J].灌溉排水学报,2017,36(4):21-25.
Ma Q M,Zhang R,Cheng Z Y,et,al.Impact of water deficits in different growing stages on growth and water consumption of grape[J].Journal of Irrigation and Drainage,2017,36(4):21-25.(in Chinese)
[12]何岸镕,安进强,张芮,等.不同生育期水分调亏对设施延后栽培葡萄叶片保护系统及产量品质的影响[J].水土保持学报,2016,30(3):196-201.
He A R,An J Q,Zhang R,et,al.Effects of water deficit on leaf protecting system and quality yield of delayed grape cultivation during different growth stage[J].Journal of Soil and Water Conservation,2016,30(3):196-201.(in Chinese)
[13]周兴本,王世光,郭修武,等.水分胁迫下肥料配比对葡萄光合速率与氮代谢的影响[J].干旱地区农业研究,2015,33(1):28-36.
Zhou X B,Wang S G,Guo X W,et,al.Effects of fertilizer ratio on the photosynthetic rate and the nitrogen metabolism of grape under water stress[J].Agricultural Research in the Arid Areas,2015,33(1):28-36.(in Chinese)
[14]王敏,张胜全,方保停,等.氮肥运筹对限水灌溉冬小麦产量及氮素利用的影响[J].中国农学通报,2007,23(7): 349-353.
Wang M,Zhang S Q,Fang B T,et al.Effect of nitrogen applications on grain yield and nitrogen use efficiency of winter wheat in limited water supply[J].Chinese Agricultural Science Bulletin,2007,23(7):349-353.(in Chinese)
[15]于亚军,李军,贾志宽,等.旱作农田水肥耦合研究进展[J].干旱地区农业研究,2005,23(3):220-224.
Yu Y J,Li J,Jia Z K,et al.Research progress of water and fertilizer coupling on dry land[J].Agricultural Research in the Arid Areas,2005,23(3):220-224.(in Chinese)
[16]Strasser R J,Stryvastava A,Govindgee.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].Photochemistry and Photobiology,1995,61:32-42.
[17]Lazard.The polyphonic chlorophylls a fluoresence rise measured under high intensity of exciting light[J].Functional Plant Biology,2006,33:9-30.
[18]Strasser R J,Stryvastava A,Tsimilli-Michael M.The fluoresence transient as a tool to characterize and screen photosynthetic samples[A].Yunusm P U,Mohabty P.Probing photosynthesis:mechganism,regulation and adaptation[C].London:Taylor and Francis Press,2000:445-483.
[19]Brestic M,Zivcak M,Kalajih M,et al.PhotosystemⅡthermostability in situ:environmentally induced acclimation and genotype specific reactions inL[J].Plant Physiology and Biochemistry,2012,57:93-105.
[20]汪炳良,徐敏,史庆华,等.高温胁迫对对早熟花椰菜叶片抗氧化系统和叶绿素及其荧光参数的影响[J].中国农业科学,2004,37(8):1245-1250.
Wang B L,Xu M,Shi Q H,et al.Effects of high temperature stress on antioxidant systems,chlorophyll and chlorophyll fluorescence parameters in early cauliflower leaves[J].Scientia Agricultura Sinica,2004,37(8):1245-1250.(in Chinese)
[21]宋婷,张谧,高吉喜,等.快速叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].生物学杂志,2011,28(6):81-86.
Song T,Zhang M,Gao J X,et al.Fast chlorophyll fluorescence kinetics and its application in plant physiology research[J].Journal of Biology,2011,28(6):81-86.(in Chinese)
[22]贾浩,郝建博,曹洪波,等.遮荫对“保佳红”桃树叶片快速叶绿素荧光诱导动力学曲线的影响[J].西北植物学报,2015,35(9):1861-1867.
Jia H,Hao J B,Cao H B,et al.Effects of shading on fast chlorophyll fluorescenceinduction dynamics of “Baojiahong”peach leaves[J].Acta Bot.Boreal.-Occident.Sin.,2015,35(9):1861-1867.(in Chinese)
[23]Jiang C D,Jiang G M,Wang X Z,et al.Increased photosynthetic activities and thermostability of photosystemⅡwith leaf development of elm seedlings()probed by the fast fluorescence rise OJIP[J].Environmental and Experimental Botany,2006,58:261-268.
[24]繆颖.植物抗逆性的获得与信息传导[J].植物生理学通讯,2011,(16):42-46.
Miu Y.Acquisition and information transduction of plant stress resistance[J].Plant Physiology Communication,2011,(16):42-46.(in Chinese)
Effect of Water and Nitrogen Coupling on Rapid Fluorescence Induction Kinetics Characteristics of Facility Grape Leaves
HUANG Qin-qin1, YANG Zai-qiang1,2, LI Jia-shuai1, LI Jia-jia1, ZHENG Qian-tong1, DING Yu-hui1
(1.Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters, Nanjing University of Information Science & Technology, Nanjing 210044, China; 2.Jiangsu Provincial Key Laboratory of Agrometeorology, Nanjing 210044)
The two-factor control experiment of soil moisture and nitrogen level was carried out with grape variety “Hongti” as test material. Soil water content was set at four levels: 70%−80%(W1), 60%−70%(W2), 50%−60%(W3) and 30%−40%(W4). Nitrogen was designed at four levels: 1.5N (25.5g·m−2, N1), 1N (17g·m−2, N2), 0.5N (8.5g·m−2, N3) and 0N (0g·m−2, N4), in which W1 and N2 were used as control (CK), the dynamic characteristics of fast fluorescence induction in grape leaves were measured in the first period, the second period and the third period of growth and the development of grape seedlings to understand the water and fertilizer requirements of protected grape. The results showed: (1) the coupling curves of different water, nitrogen and water-nitrogen coupling in the different observation stages of grape seedlings were similar, but with the decrease of soil moisture and nitrogen levels, different feature points(OJIP) there were significant differences, the higher the water and nitrogen levels, the greater the maximum fluorescence value of the grape leaves. (2) With the decreased of soil water content, the energy ratios of PSII reaction centers in grape leaves at different seedling stages were significantly different, compared with CK control group, quantum yield of absorbed light captured by reaction center(ΦPo), when the excition is captured by the reaction center, the ratio of excition occupied by other electron acceptors over QA in the driving electron transfer chain to excition(ψo) and quantum yields of light energy absorbed by reaction centers for electron transfer(ΦEo) were all inhibited, quantum ratio for heat dissipation(Do) was promoted. With the decreased of nitrogen application rate, ΦPo, ψo and ΦEo increased in different degrees, and ΦDo showed a downward trend. In each water-nitrogen coupling treatment, ΦPo was the largest under W1N3 treatment, and ψo and ΦEo were significantly improved under W2N4 treatment. The ΦDo value was highest under CK processing. (3) Light energy absorbed by the unit active reaction center(ABS/RC), energy recovered by the unit reaction center for reducing QA(TRo/RC), the energy dissipated by the unit reaction center(DIo/RC) increased as the soil water content decreased, while the lower the soil water content, the smaller the energy value captured by the unit reaction center for electron transfer(ETo/RC); compared with CK, the activity parameters of PSII reaction center treated by N1, N3 and N4 were all promoted; ABS/RC and DIo/RC were the highest under W1N3 treatment, TRo/RC was the largest under W3N2 treatment, and ETo/RC was significant promoted under W2N4 treatment. (4) The maximum photochemical efficiency (Fv/Fm) of PSII gradually decreases with the decrease of soil moisture. The lower the soil water content, the lower the potential photochemical activity (Fv/Fo) of PSII; the highest variable fluorescence value under W2N3 treatment,the largest Fv/Fm and Fv/Fo value under W1N3 treatment.
Grape; Stress; Water and nitrogen coupling; Rapid fluorescence; Ratio of water to fertilizer
10.3969/j.issn.1000-6362.2019.09.002
黄琴琴,杨再强,李佳帅,等.水氮耦合对葡萄叶片快速荧光诱导动力学特性的影响[J].中国农业气象,2019,40(9):557-573
2019−02−11
。E-mail:yzq@nuist.edu.cn
江苏省科技支撑项目(BE2015693)
黄琴琴(1995−),女,硕士生,研究方向为设施农业气象灾害。E-mail:1510141893@qq.com

