中华绒螯蟹肝胰腺坏死综合征病因及其肝胰腺菌群的初步研究
朱志杨,沈 辉,万夕和,任 乾,蒋 葛,范贤平,乔 毅,甄晓然,3
(1.南京师范大学海洋科学与工程学院,南京 210023;2.江苏省海洋水产研究所,江苏南通 226007;3.上海海洋大学水产与生命学院,上海 201306)
中华绒螯蟹(Eriocheirsinensis)又称河蟹,是我国重要的水产养殖经济品种。随着养殖规模的不断扩大,河蟹发生的病害问题日渐凸显,其中颤抖病、腹水病和细菌性烂鳃病等疾病对河蟹养殖业造成了巨大的经济损失。2015年,一种新型病症-肝胰腺坏死综合征(hepatopancreatic necrosis syndrome,HPNS)被首次报道[1],该病发病区域由江苏北部逐渐蔓延至江苏南部、安徽、湖北等地[2],一般发生在成蟹的第2、3、4次蜕壳期,病蟹肝胰腺呈灰白色[3],发病剧烈时肝胰腺坏死并伴有大量死亡,据不完全估计已造成经济损失数亿元[4],因此受到河蟹养殖业和学术界的广泛关注。
目前,关于HPNS病因的研究报道主要集中在环境胁迫[1]、种质退化[5]、病毒感染及微孢子虫感染等方面[4,6]。宋学宏[7]和朱健明等[8]研究认为水体中高pH胁迫和低氧胁迫引发河蟹肝胰腺白化,继而在细菌的继发感染下恶化形成HPNS;杨宗英等[1,9]研究并验证了水质毒害因子胁迫引发河蟹HPNS早期的肝胰腺白化;杨先乐[10]研究认为苗种质量下降是引发HPNS的根本原因;崔龙波等[6]研究认为病毒、微孢子虫以及细菌等多种病原微生物引发HPNS;Ding等[4]研究发现微孢子虫可引发HPNS早期等肝胰腺白化现象。然而引起HPNS的病因尚未明确,已有研究发现,白斑综合征病毒(White spot syndrome virus,WSSV)、传染性皮下及造血组织坏死病毒(Infectious hypodermal & haematopoietic necrosis virus,IHHNV)的感染可改变甲壳动物肝胰腺、消化道等器官的微生物群落结构,影响其生理功能,并对组织和细胞的形态结构产生损伤,甚至引发河蟹肝胰腺白化[11-14]。与HPNS在发病初期出现不同程度的肝胰腺白化现象较为一致[1]。
本研究的前期工作中,对不同规格的河蟹进行了病原筛查,发现样品中检出较高比例的河蟹个体携带WSSV、IHHNV或同时携带IHHNV-WSSV,部分个体还具有HPNS症状(尚未发表)。在本研究中,利用变性梯度凝胶电泳(DGGE)技术对健康蟹、肝胰腺坏死综合征病蟹、WSSV感染蟹、IHHNV感染蟹以及IHHNV-WSSV共感染蟹的肝胰腺菌群结构进行研究,探索其肝胰腺菌群相似性,以期初步探究河蟹肝胰腺菌群结构与河蟹HPNS的关系,病原感染与HPNS的关联,从而揭示病原感染、肝胰腺菌群结构变化以及HPNS之间的相互关系,为今后河蟹HPNS的进一步研究、诊断和防治提供参考依据。
1 材料与方法
1.1 材料
河蟹样品于2017年7月采自江苏省泰州市兴化某养殖场,其中健康蟹7只,WSSV感染蟹7只、IHHNV感染蟹5只,IHHNV-WSSV共感染蟹9只,肝胰腺坏死综合征病蟹2只,样品基本情况详见表1。所有样品均采于同一养殖池塘。样品低温冷藏,快速运至实验室后,对肝胰腺进行无菌取样,根据体表观察和解剖学观察结果判定健康状况,其中“Healthy”表示健康蟹,“W”表示WSSV感染蟹;“I”表示IHHNV感染蟹;“DWI”表示IHHNV-WSSV共感染蟹 ;“HPNS”表示肝胰腺坏死综合征病蟹。
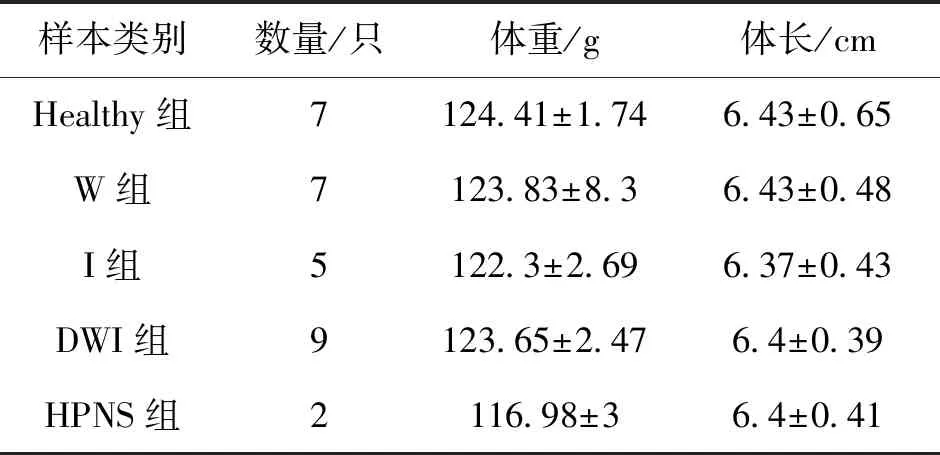
表1 样品基本情况表Tab.1 Basic information of sample crabs
1.2 方法
1.2.1 病原筛查
1.2.1.1 DNA提取
取100 mg肝胰腺组织样品充分研磨后,按照上海博彩生物科技有限公司3S DNA Isolation Kit V2.2试剂盒的操作步骤提取基因组DNA,-20 ℃保存。Healthy组、W组、I组、DWI组中各随机选取3份DNA,与HPNS组的2份DNA,进行后续的PCR-DGGE基因指纹图谱构建与分析。
1.2.1.2 病原PCR检测
以DNA为模板,通过聚合酶链式反应(PCR),对WSSV、IHHNV和中华绒螯蟹螺原体(Spiroplasmaeriocheiris)等常规病原进行筛查,参考检测方法、引物及扩增条件详见表2。

表2 病原检测的引物序列Tab.2 Primers used in the pathogen detection
1.2.2 16S rDNA的PCR-DGGE基因指纹图谱构建与分析
1.2.2.1 16S rDNA片段的PCR扩增
根据病原检测结果,以随机挑取的Healthy组、W组、I组、DWI组中的各3份DNA和HPNS组的2份DNA为模板,PCR扩增16S rDNA片段,参考方法、引物及扩增条件详见表2。PCR产物经1%琼脂糖凝胶电泳检测,电压160 V,电泳时间45 min。
1.2.2.2 16S rDNA V3区片段的PCR扩增
以16S rDNA片段的PCR产物为模板,PCR扩增16S rDNA V3区片段,参考方法、引物及扩增条件详见表3。
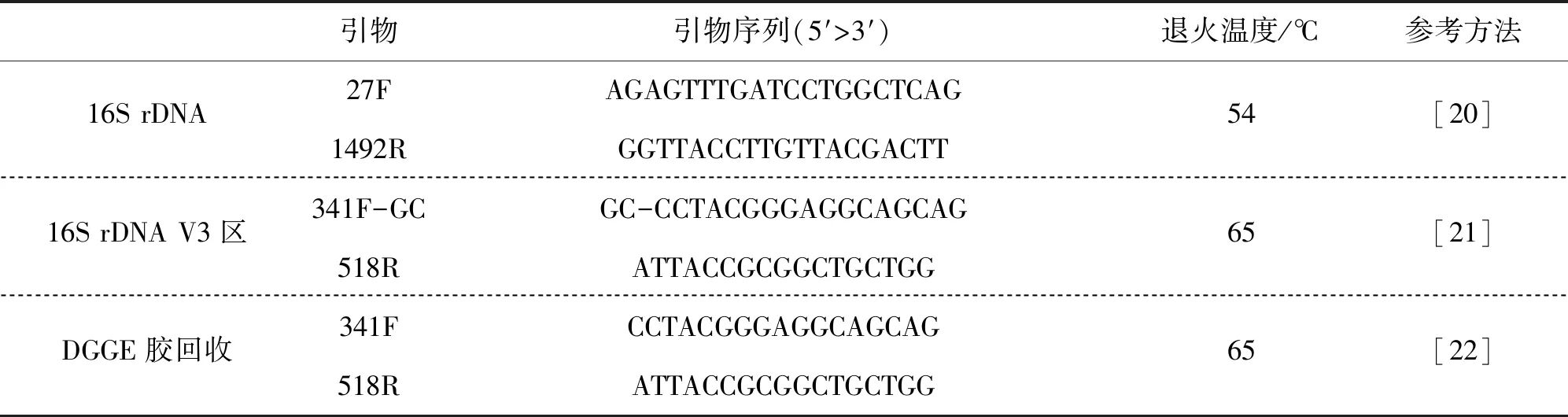
表3 16S rDNA V3区基因扩增的引物序列Tab.3 Primers used in the PCR of 16S rDNA V3 area
1.2.2.3 DGGE成像与分析
16S rDNA V3区的PCR产物经Bio.Rad电泳仪分析,DGGE的聚丙烯酰胺胶浓度为8%(w/v),变性梯度为40%~60%,DGGE电泳程序按文献进行[22]。电泳结束后凝胶以SYBR? Gold Nucleic Acid Gel Stain染色,DGGE图谱采用Quantity One软件分析指纹图谱,以非加权组算术平均法(Unweighted pair-group method with arithmetic means,UPMEGA)进行相似性聚类分析并构建系统进化树。多样性分析采用Shannon-Wiener指数H’,计算方法为:
H’=-∑(ni/N)lg(ni/N)
式中ni是第i条带的光密度值,N是一个泳道所有条带的光密度之和。在对所有条带进行高斯建模的基础上,以条带光密度曲线下面积值作为物种的相对丰度。
1.2.2.4 DGGE条带的序列分析
将DGGE凝胶进行DNA回收,于100 μL TE缓冲液中过夜保存;以上清液作为DNA模板进行PCR扩增,扩增引物及扩增条件详见表3。纯化后的PCR产物与pMD18-T载体连接,并转化DH5α感受态细胞,每份样品挑3份阳性克隆送至上海生工公司进行测序,测序结果在NCBI上进行比对,以其中同源性最高的序列确定为参照菌株,相似性≥97%的序列视为同一序列型。数据的处理和主成份分析采用Excel和SPSS软件,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同患病河蟹的症状
不同组蟹的健康状况以及病原检测结果如表4和图1所示, Healthy组蟹、W组蟹以及I组蟹的体质状况、摄食情况以及肝胰腺外观均正常,但病原检测结果存在差异,Healthy组蟹未感染病原,W组和I组蟹分别出现WSSV感染、IHHNV感染;DWI组蟹虽未出现肝胰腺病变,但活力稍弱,病原检测显示IHHNV-WSSV共感染;HPNS组蟹的体质状况减弱,停止摄食,解剖学观察显示肝胰腺白化,病原检测显示IHHNV-WSSV共感染。

表4 不同样品蟹的健康状况及病原测试结果Tab.4 Health status and pathogenic test results of different sample crabs
注:“-”表示未感染病原,“W+”表示感染WSSV病原,“I+”表示感染IHHNV病原。

图1 不同组样品蟹对比图Fig.1 Comparison of different sample crabsa:Healthy组;b:W组;c:I组;d:DWI组;e:HPNS组
2.2 PCR-DGGE指纹图谱与肝胰腺菌群差异
不同实验组的肝胰腺菌群指纹图谱如图2所示,处于不同位置的条带数为28条,各实验组的DGGE条带在数量、位置和条带亮度上存在差异,I组条带数最多(平均14条),Healthy组次之(平均13条),W组和DWI组再次之(平均11条),HPNS组最少(平均8条)。各实验组间的条带数量表现出除I组以外,W组、DWI组、HPNS组与Healthy组相比,肝胰腺菌群中条带数量出现不同程度的降低。
各实验组Shannon-Wiener指数计算结果显示,Healthy组的肝胰腺菌群多样性最高(为2.521 5),HPNS组最低(为1.96)。W组(多样性指数为2.304 5)、I组(多样性指数为2.266 6)、DWI组(多样性指数为2.310 4)以及HPNS组与Healthy组相比,均出现肝胰腺菌群多样性指数降低。

图2 实验组河蟹肝胰腺的DGGE指纹图谱Fig.2 Bacterial DGGE profile of hepatopancreas from experimental crabs
UPMEGA相似性聚类结果如图3所示。一支HPNS个体的肝胰腺菌群与一支DWI个体最先聚类(相似度0.83),再与HPNS另一个体聚类(相似度0.74),随后依次与DWI组(相似度0.72)、I组(相似度0.69)、W组(相似度0.62)聚类,最后与Healthy组聚类(相似度0.56)。
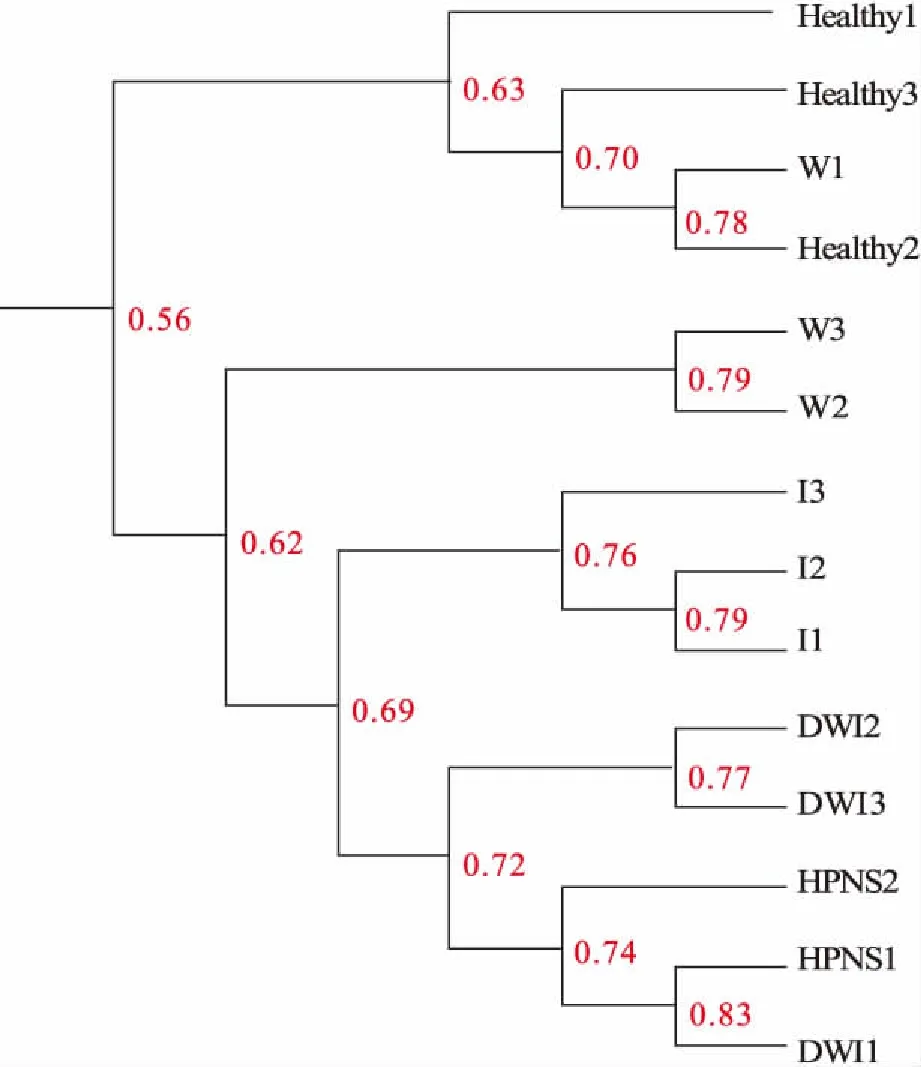
图3 实验组河蟹肝胰腺菌群的UPMEGA相似性聚类分析Fig.3 UPMEGA cluster analysis of hepatopancreas microflora from experimental crabs
2.3 DGGE图谱差异条带测序结果分析
DNA条带的测序结果显示,28条DNA胶回收条带属于4个门21个菌属,具体测序结果见表5。各实验组在门水平上的肝胰腺菌群组成及其相对丰度如图4所示。河蟹肝胰腺菌群主要分为四类,拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)。5个实验组间在门水平上,菌群的相对丰度变化总体未显示出差异性,与Healthy组相比,仅见Ⅰ组中变形菌门的相对丰度显著增加;HPNS组中厚壁菌门的相对丰度显著减少。
各实验组在属水平上的肝胰腺菌群组成及其相对丰度如图5所示。除各实验组均以沉积小杆菌属(Sediminibacterium)为首要优势菌属外,Healthy组中的其它优势菌属依次为气单胞菌属、颗粒链球菌属(Granulicatella)、慢生根瘤菌属(Bradyrhizobium);W组中的其它优势菌属依次为慢生根瘤菌属、气单胞菌属、红球菌属(Rhodococcus);I组中的其它优势菌属依次为慢生根瘤菌属、气单胞菌属、颗粒链球菌属;DWI组中的其它优势菌属依次为气单胞菌属、慢生根瘤菌属、红球菌属;HPNS组中的其它优势菌属依次为气单胞菌属、红球菌属、希瓦氏菌属(Shewanella)。
部分菌属的相对丰度变化显示(详见图5),慢生根瘤菌属仅在HPNS组中未出现;鞘氨醇单胞菌属(Sphingomonas)和鞘氨醇杆菌属(Sphingobacterium)的相对丰度依次在Healthy组、W组、I组、DWI组、HPNS组中逐渐降低甚至消失(P>0.05);气单胞菌属在各实验组中均存在,依次在Healthy组、W组、I组、DWI组、HPNS组中呈上升趋势(P>0.05);假单胞菌属的相对丰度依次在Healthy组、W组、DWI组、I组中呈上升趋势(P>0.05);希瓦氏菌属仅出现在HPNS组和DWI组中。

表5 DGGE代表条带序列比对结果Tab.5 Result of sequence aligement of band in DGGE

图4 不同实验组在门水平上的相对丰度Fig.4 Comparision of relative abundance at the bacteria phylum levels among different experimental groups

图5 不同实验组在属水平上的相对丰度Fig.5 Comparision of relative abundance at the bacteria genus levels among different experimental groups
3 讨论
本研究发现,HPNS组肝胰腺菌群的一支与DWI组中的一支最先聚类(相似度0.83),继而HPNS组与DWI组聚类(相似度0.72),与Healthy组的肝胰腺菌群结构相似度最低(相似度0.56),表明HPNS病蟹的肝胰腺菌群结构与IHHNV-WSSV共感染蟹的肝胰腺菌群结构较为一致,而与Healthy蟹之间的肝胰腺菌群结构存在差异。因此,从微生物菌群结构相似性及菌群结构的变化结果来看,DWI组随着时间的推移,可能会发展成为HPNS组,河蟹HPNS与WSSV-IHHNV共感染可能存在一定的关联。
近年来,河蟹感染WSSV并出现批量死亡的报道日渐增多[6,23,24]。孙婷等[12]发现WSSV感染可引发河蟹肝胰腺白化,与河蟹HPNS在发病初期出现的肝胰腺白化现象较为一致[1],且相关报道发现,在HPNS病蟹体内检出较高含量的WSSV[25]。本研究发现HPNS组的河蟹出现肝胰腺白化,并携带WSSV,与上述的研究结果较为一致,表明WSSV与HPNS的发生可能存在一定关联。IHHNV的报道主要集中在对虾的生理代谢和生长方面[14],当IHHNV-WSSV共感染时会加剧对虾肝胰腺和肌肉组织的损伤[26]。目前,已有美青蟹(Callinectesarcuatus)、绒螯近方蟹(Hemigrapsuspenicillatus)、颗粒新厚蟹(Neohelicegranulate)感染携带IHHNV的报道,但未见明显病理性变化[27,28]。IHHNV大规模感染河蟹的研究尚未见报道,但在本研究前期流行病学调查中,IHHNV在不同规格河蟹中均具有一定的阳性检出率。虾蟹混养模式下的克氏原鳌虾(Procambarusclarkii)中IHHNV感染率很高[29],河蟹感染IHHNV有可能来自于宿主克氏原鳌虾。由此初步推论,IHHNV-WSSV共感染与河蟹HPNS也许具有一定的相关性,其相关模拟实验还需进一步开展和佐证。
目前,关于河蟹体内菌群的研究主要集中在肠道菌群上,研究发现河蟹肠道中优势菌群为变形菌门、拟杆菌门、放线菌门、厚壁菌门和疣微菌门(Verrucomicrobia)[30,31]。而针对河蟹肝胰腺菌群的研究较少,Shen等[3]对健康蟹及肝胰腺坏死综合征病蟹的肝胰腺微生物菌群进行研究发现,健康河蟹肝胰腺的优势菌群为拟杆菌门、厚壁菌门、变形菌门、放线菌门;在HPNS发病过程中,病蟹肝胰腺菌群多样性降低,优势菌群结构发生变化,其中柔膜菌门(Tenericutes)和放线菌门的比例明显增加,拟杆菌门细菌的数量急剧减少,导致病蟹肝胰腺中脂肪和纤维素代谢异常,营养物质吸收受到抑制。本研究同样发现,与Healthy组相比,HPNS组肝胰腺菌群多样性降低,放线菌门的比例显著增加。表明病蟹肝胰腺菌群结构发生一定程度的改变,继而影响其免疫、消化功能[32]。此外,本研究进一步发现,在属水平上,HPNS组、W组、I组、DWI组与Healthy组相比,气单胞菌属、假单胞菌属等致病菌属的相对丰度增加,而鞘氨醇单胞菌属、鞘氨醇杆菌属等有益菌属的相对丰度下降甚至消失,本研究结果不仅进一步从属水平反映出HPNS病蟹的肝胰腺菌群发生变化,其正常生理功能下降,而且表明了病原感染可能与肝胰腺菌群中致病菌和有益菌丰度的变化存在一定的关联。在相对丰度发生变化的致病菌属中,气单胞菌和假单胞菌产生的毒力因子可破坏宿主的凝血系统和免疫防御系统,造成广泛的组织损伤[33-35]。Ding等[13]研究发现河蟹肠道菌群中气单胞菌和假单胞菌的丰度在WSSV感染下显著增加,崔龙波等[6]也研究发现HPNS病蟹肝胰腺中存在着病毒感染所特有的嗜酸性包涵体和大量以气单胞菌为主的细菌。本研究结果与Ding等[13]和崔龙波等[6]的研究结果较为一致,表明病原感染可能引发肝胰腺中致病菌的增殖,继而对肝胰腺产生损伤。在相对丰度发生变化的有益菌属中,鞘氨醇单胞菌属和鞘氨醇杆菌属多数含有类胡萝卜素类物质[36-39],具有较强的代谢能力和对贫营养环境的耐受力[40]。杨宗英等[1]研究发现类胡萝卜素的大量消耗可能引发河蟹肝胰腺白化。因此,本研究结果初步表明病原感染可引发河蟹肝胰腺菌群中鞘氨醇单胞菌属和鞘氨醇杆菌属的减少,可能引发宿主肝胰腺中类胡萝卜素含量降低,导致宿主的代谢能力和对贫营养环境的耐受力减弱,进而引发肝胰腺白化。
此外,本研究还发现,仅HPNS组未出现慢生根瘤菌,慢生根瘤菌主要来源于豆科植物[41],豆科植物是河蟹饲料的重要原料[42],慢生根瘤菌可能作为饵料形式短时间存在于河蟹体内。在HPNS组中未发现慢生根瘤菌,表明HPNS组蟹已经长时间未摄食,继而检测不到慢生根瘤菌,但在其余4组中,慢生根瘤菌为优势菌,表明其余4组仍处于正常摄食状态,这在本研究前期流行病学调查发现的HPNS组蟹停止摄食活动中得到证实。病蟹由于长期未摄食而处于饥饿状态。有研究者在实验室条件下,对河蟹进行饥饿实验,实验进行90 d后,河蟹肝胰腺指数明显降低[43]。结合本研究结果,可初步推测在养殖条件下,由于IHHNV-WSSV共感染,导致肝胰腺正常的生理功能下降,继而停止了摄食行为,从而逐渐发展形成HPNS。
本文结合肝胰腺菌群多样性和聚类分析、病蟹生理学特征、IHHNV-WSSV共感染引发的河蟹肝胰腺菌群在属水平上的变化以及菌属变化可能产生的病理学影响,初步推论HPNS的发生可能与IHHNV-WSSV共感染存在一定的关联, IHHNV-WSSV共感染可能引发肝胰腺正常的生理功能下降,继而停止了摄食行为,从而逐渐发展形成HPNS初期的肝胰腺白化现象。

