团头鲂NOS2基因的克隆和组织表达分析
王玉青,邬长松,马洁乐,陈会杰,刘小玲
(华中农业大学水产学院水生动物医学系,湖北省水生动物病害防控工程技术研究中心,水产养殖国家级实验教学示范中心,武汉 430070)
一氧化氮合酶(nitric oxide synthase,NOS)是一氧化氮(nitric oxide,NO)合成的关键酶,具有催化L-精氨酸氧化生成L-瓜氨酸和一氧化氮的功能。根据NOS的来源及催化特性的不同,可将其分为神经型NOS(neuronal nitric oxide synthase,nNOS或NOS1)、诱导型NOS(inducible nitric oxide synthase,iNOS或NOS2)和内皮型NOS(endothelial nitric oxide synthase,eNOS或NOS3)三种亚型[1-3]。1989年,NOS2被首次报道[4],目前普遍认为,NOS2主要存在于巨噬细胞中,也存在于肥大细胞、中性粒细胞、神经小胶质细胞、血管内皮细胞和各种肿瘤细胞内。NOS2是二聚体,每一个亚基都含有两个区域,一个区域是包含亚铁血红素和四氢生物蝶呤的氧化区,另一个区域是结合FAD、FMN和NADPH的还原区。当生物体受到细菌等外界因素或内源性炎症细胞因子,如白细胞介素1(IL-1)、肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)的刺激后,NOS2被诱导表达,随后催化合成大量的NO,产生的NO可参与多种免疫调节过程,具有杀菌、抗病毒和抗寄生虫等多种免疫效应[5]。
团头鲂(Megalobramaamblycephala),俗称武昌鱼,我国特有的淡水鲤科鱼类。近年来细菌病的暴发,导致大量的团头鲂死亡,从而给团头鲂养殖业造成极大损失。嗜水气单胞菌(Aeromonashydrophila)是公认的感染鱼类的重要病原菌,属于弧菌科气单胞菌属,是典型的人畜鱼共患病病原[6]。2010年,田甜等[7]报道嗜水气单胞菌可引起团头鲂急性出血性败血症。细菌性败血症对养殖鱼类危害最重,暴发传播的速度极快,患病鱼死亡率很高[8]。在败血症过程中,致炎因子和内毒素可引起多种细胞和组织中NOS2的表达,从而产生大量的NO,过量的NO会造成细胞和组织损伤。
刘立等[9]研究证明,壳寡糖(chtiosanoligosaccharide,COS)和脂多糖(lipopolysaccharide,LPS)可以激活团头鲂的巨噬细胞,上调NOS2的表达,增加NOS2的酶活,提高活性氮的表达水平。然而,病原菌感染团头鲂时NOS2基因的组织表达水平及调控机制尚不清楚。因此,本实验克隆了团头鲂NOS2基因的全长cDNA序列,应用实时荧光定量PCR技术分析了嗜水气单胞菌感染团头鲂后NOS2基因在肝脏、脾脏、头肾和肠中的表达变化,旨在探究NOS2在团头鲂个体免疫中发挥的作用,为后续研究其在细菌感染后的免疫调控机制奠定基础。
1 材料和方法
1.1 实验材料
本研究所用团头鲂体重为400 g左右,购自湖北百荣水产良种有限公司,于华中农业大学水产基地淡水循环养殖系统中暂养两周,待供试鱼适应环境,并确认无疾病症状后,用于实验。实验期间水温控制在25~26 ℃,水源为充分曝气的自来水,使用充气泵24 h不间断充氧,每天分两次投喂(8∶00,17∶00),每次投喂相当于鱼体重1.5%的人工配合饲料(武汉海大饲料有限公司生产)。
病原:供试菌株为笔者所在研究室保存的嗜水气单胞菌(AhJ-1株系),该株系为南京农业大学惠赠。将菌株接种在LB液体培养基(1 L培养液中,含酵母提取物5 g,氯化钠10 g,蛋白胨10 g,调节pH至7.4)中,28 ℃条件下培养过夜培养,离心收集细菌,磷酸盐平衡盐溶液(PBS)洗涤三次,调整菌液浓度为3×107CFU/mL,作为攻毒菌液备用。
1.2 实验方法
1.2.1 总RNA的提取
解剖3尾健康团头鲂,取头肾30~50 mg,根据总RNA提取试剂盒RNAiso Plus (TAKARA)的操作说明,提取总RNA。用微量核酸测定仪NanoDrop 2000测定RNA的纯度及浓度。使用反转录试剂按照既定步骤反转录得到cDNA (PrimeScriptTMRT reagent Kit with gDNA Eraser,TAKARA)。
1.2.2 团头鲂NOS2基因cDNA片段的克隆
根据草鱼NOS2基因的序列设计引物,扩增团头鲂的中间序列,根据中间序列设计特异性引物,以团头鲂头肾cDNA为模板,按照Takara公司的3′-Full RACE Core Set with PrimeScriptTM RTase和5′-Full RACE Kit with TAP试剂盒,扩增NOS2基因的3′和5′端,将PCR产物与pMD18-T载体连接,转化到感受态细胞DH5α(全式金,北京)中,选取阳性克隆的菌液送北京六合华大基因科技股份有限公司进行测序。
1.2.3 生物信息学分析
用DNASTAR软件对测序后获得的序列进行拼接,得到NOS2的cDNA全长。采用在线BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对NOS2的cDNA全长进行同源性检索。使用ExPASy网站(https://www.expasy.org/)在线预测氨基酸序列并且分析氨基酸序列的分子质量、等电点和功能结合位点。使用clustalX软件进行多重序列比较,同时用MEGA6.0(Neighbor-Joining,NJ法)构建进化树。
1.2.4 嗜水气单胞菌感染团头鲂后NOS2基因的表达变化
鱼体感染和取样参照Liu等[10]的方法并稍加改动,选取健康的团头鲂50尾,随机分为2组,实验组注射100 μL上述菌液,对照组注射等量的PBS。在注射后0、3、6、12、24、48、72 h取样,每个时间点每组随机选取3尾活鱼,抽取血液后,解剖分离出30~50 mg左右的肝脏、脾脏、头肾和肠,分别放入加有1 mL预冷Trizol的1.5 mL的EP管中,冻存于-80 ℃冰箱。所有样品取完后,提取总RNA,反转录得到cDNA。使用荧光定量PCR对NOS2基因进行表达分析。反应程序:预变性95 ℃ 10 min,1个循环;95 ℃ 10 s,60 ℃ 1 min,40个循环;溶解曲线从65 ℃到95 ℃。qPCR反应在罗氏480荧光定量PCR仪上进行,每个待测样品设定3组重复,以NOS2基因mRNA在不同组织中的表达量与β-actin的表达量进行对比,作NOS2基因的相对表达量的分析,相对定量分析采用2-ΔΔCT法[11]。为了方便观察NOS2基因在不同时间点的相对表达量,本实验将0h的NOS2的相对表达量的值设定为1。用SPSS16.0软件进行实验数据的统计处理,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 团头鲂NOS2基因cDNA全长及序列特征
PCR扩增得到的产物经过纯化、连接、转化和测序之后,得到的序列经过DNAstar软件拼接,除去重叠序列和接头序列,最后得到团头鲂NOS2的cDNA全长(所用引物见表1)。使用在线BLAST对获得的序列和已报道的NOS2序列进行同源性分析,该序列与草鱼和斑马鱼的NOS2序列全长相似性大于80%,说明得到的序列为团头鲂NOS2。核苷酸序列已提交至GenBank数据库,序列登录号为KJ668755。团头鲂NOS2的cDNA序列全长4 215 bp,5′非编码区为197 bp,3′非编码区为775 bp,开放阅读框为3 243 bp,编码1 080个氨基酸,预测分子质量约为122.51 kW,理论等电点为7.36。使用clustalX软件对团头鲂、草鱼、斑马鱼、墨西哥脂鲤和虹鳟的序列进行多重序列比对,使用ExPASy网站在线分析其功能结合位点。如图1所示,参与比对的序列N-末端都具有Heme、BH4和CAM结合位点,C-末端都具有FMN、FAD和NADPH结合位点,这些区域在硬骨鱼类中高度保守。

表1 本实验所用引物Tab.1 Primers used in these experiments

图1 团头鲂NOS2的氨基酸序列比对Fig.1 Multiple alignment of the NOS2 amino acid sequencesNOS2的保守一致序列用彩色阴影标示,缺失的氨基酸残基用破折号表示,下划线标示辅因子的结合位点
2.2 团头鲂NOS2基因系统进化分析
为了得到团头鲂NOS2的进化信息,从NCBI数据库中选取33个NOS2的蛋白序列,将其进行BLAST分析。用MEGA 6.0(Neighbor-Joining,NJ法)对33个NOS2的蛋白序列构建系统发育树如图2所示。脊椎动物的NOS分成NOS1、NOS2、NOS3三个分支,其中NOS1和NOS3与无脊椎动物的NOS的亲缘关系更近。团头鲂与草鱼、斑马鱼、鲤和金鱼聚为鲤形目的一簇,其中团头鲂的NOS2与草鱼的NOS2亲缘关系最近。9个鱼类的NOS2组成了硬骨鱼类的分支,同时与哺乳类、鸟类和爬行类聚为脊椎动物NOS2分支。

图2 团头鲂NOS2和其它动物的NJ分子进化树Fig.2 NJ-phylogenetic tree of the NOS2 gene constructed by using amino acid sequences团头鲂NOS2用▲标出。节点处数值为自展置信值,自展重复1 000次,进化树分析所用蛋白见表2
2.3 团头鲂NOS2基因在嗜水气单胞菌感染后的表达变化
团头鲂感染嗜水气单胞菌至72 h,各组团头鲂均无死亡。不同组织NOS2的表达水平如图3所示,在肝脏组织中,NOS2在感染后3 h表达量极显著上调,出现峰值,12 h显著下调,随后显著上调,并且在48 h出现第二个峰值。在脾脏组织中,NOS2在感染后3 h表达量极显著上调,出现峰值,6 h显著下调,其余时间点极显著下调表达。在头肾组织中,NOS2在注射后3 h表达量达到最高,出现峰值,12 h恢复到注射前水平,在其余时间点表达量均是极显著上调。在肠道组织中,NOS2在3 h极显著下调表达,6 h显著上调表达,24 h显著下调表达。
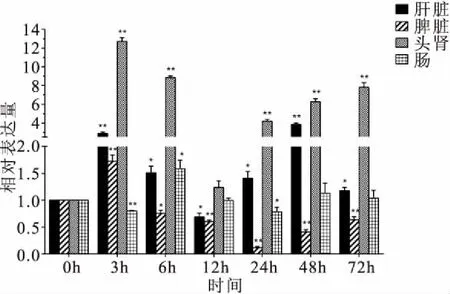
图3 嗜水气单胞菌感染后,团头鲂肝脏、脾脏、头肾和肠中NOS2在mRNA水平的表达变化Fig.3 Changes of relative mRNA expression levels of the NOS2 in the liver,spleen,head-kidney and intestine of M.amblycephala after challenged with A.hydrophila
3 讨论
本研究通过同源克隆和RACE技术获得团头鲂NOS2的cDNA全长,预测蛋白分子量为122.51 KW,等电点7.36。氨基酸序列同源性比对结果表明,团头鲂的NOS2与草鱼的NOS2和斑马鱼的NOS2b的相似度较高。氨基酸序列分析表明,NOS2的N-末端都具有Heme、BH4和CAM结合位点,C-末端都具有FMN、FAD和NADPH结合位点,与汪新艳等[12]在草鱼上的研究结果一致。进化分析表明,团头鲂的NOS2在进化关系上与草鱼的NOS2最接近,与硬骨鱼类的NOS2聚为一支,共同构成脊椎动物的NOS2分支,说明不同种属的NOS2的异构体具有高度的同源性;团头鲂NOS2与脊椎动物NOS1和NOS3以及无脊椎动物NOS的进化关系较远,进一步证实我们克隆的基因是NOS2。
在病原菌刺激时,不同物种、不同组织的NOS2表达变化存在差异[13-14]。本研究用实时荧光定量PCR检测了嗜水气单胞菌感染团头鲂后NOS2在肝脏、头肾、脾脏和肠道的表达变化。在肝脏中,NOS2在感染早期表达量极显著上调,12 h显著下调,随后显著上调。然而,Yao等[15]研究发现,凡纳滨对虾注射LPS后,NOS基因在肝胰腺中表达量显著降低,可能是不同物种间的免疫系统存在差异性。肝脏参与鱼类的非特异性免疫反应,在细菌脂多糖、细胞因子等的诱导下,肝细胞、库普弗细胞和贮脂细胞转录表达NOS2[16]。温振才[17]用嗜水气单胞菌刺激鲤鱼后检测的NOS2组织表达情况表明,NOS2在头肾中的表达量最高。本实验检测嗜水气单胞菌刺激的团头鲂的组织表达情况表明,NOS2在头肾中亦被大量诱导表达。头肾是鱼类重要的免疫器官,当受到外来病原体感染时,头肾中的免疫细胞如粒细胞、巨噬细胞、淋巴细胞发生增殖分化,大量表达NOS2,进而产生大量NO来对抗入侵的微生物[18-19]。在脾脏中NOS2在3 h上调表达,其余时间点表达量均显著下调。郭建等[20]采用捕食应激模式,发现大鼠脾脏NOS2活性程度与动物心理应激程度密切相关,应激过程中NOS2活性增加,应激后期NOS2的活性又逐渐降低。因此推测脾脏NOS2早期的上调表达可能是团头鲂对嗜水气单胞菌产生的应激反应。在肠道组织中NOS2基因除了在6 h有微弱的上调表达之外,总体呈现下调表达趋势。对大鼠肠道的研究表明,NOS2的表达水平与肠道病理损伤指数呈显著正相关关系;调节NOS2活性,减少NO生成量,可减轻肠组织损伤[21-22]。以上结果为探究NOS2在团头鲂个体免疫反应中的作用提供了一定的理论基础。
NOS2可以催化产生大量的NO,NO具有杀菌、抗肿瘤等防御作用,过量表达NO则加剧炎症反应,造成机体组织损伤,因此研究NOS2在先天性免疫反应中的作用则显得极其重要。本实验室前期工作已经证实团头鲂TLR2参与抗嗜水气单胞菌的免疫反应[23],Toll样受体识别微生物的组分后被激活,活化NF-κB等转录因子,随后转录因子激活NOS2的启动子,诱导NOS2表达[24-25]。对于团头鲂,NOS2的表达同TLR2-NF-κB是否存在联系尚不清楚,其分子机制仍需要进一步探索。目前对NOS2基因的研究多是在离体细胞水平[9,26],而对个体水平中NOS2基因的表达调控及功能研究较少。本研究检测了嗜水气单胞菌感染团头鲂后其不同组织NOS2基因的表达水平及变化趋势,为研究NOS2在团头鲂抵御嗜水气单胞菌感染过程中的功能提供基础数据。

