基于UPLC-Q-TOF/MS技术的血栓心脉宁片入血成分分析
谭静,林红强,刘云鹤,王涵,董庆海,吴福林,朱继忠,刘传贵,李平亚,刘金平,刘俊丽※
(1.吉林大学药学院天然药物研究中心,长春 130021;2.吉林华康药业股份有限公司,吉林 敦化 133700)
血栓心脉宁片(Xueshuan Xinmaining Tablet,XXT)具活血散瘀、芳香开窍之功效,收载于中国药典(2015年版)一部[1-3]。临床上用于心绞痛、冠心病及脑血栓等属血瘀证者[4-7]。研究表明XXT 抗血瘀的作用靶点多种多样,通过下调F13a1、Car1 及Tbxa2r等基因来改善血液流变学[8];上调Keap1、GCLM、HMOX1、NQO1 及Nrf2 等信号通路的蛋白表达来发挥抗血管内皮细胞氧化损伤活性[9];调控花生四烯酸及脂类代谢和类固醇激素生物合成等内源性代谢物通路抑制血瘀形成[3]等。但目前,XXT 的药效物质基础研究稍显薄弱,化学成分研究主要集中在指纹图谱的建立及含量测定等方面[10-11],已明确28 种成分;2015版药典中规定了XXT 中的阿魏酸、芦丁和丹酚酸B等5 种成分的最低含量和测定方法[1]。明磊等[12]运用UPLC-ESI-MS/MS 和 GC-MS 技术从 XXT 中共鉴定出丹参酮类、人参皂苷类及蟾酥甾二烯类等47 个非挥发性成分和龙脑、异龙脑等36 个挥发性成分。谭静等[13]基于多元统计分析方法,应用UPLC-Q-TOF/MS 技术与UNIFI 天然产物分析平台相结合,在XXT 中鉴定出三萜皂苷类、菲醌类、蟾蜍甾二烯类和甾体类及其他结构类型的化合物共187 种化学成分。但尚未见有关XXT 入血成分的定性分析报道。
中药血清药物化学是综合多种研究技术和方法来研究口服给予中药后的血清样本,从血清中提取分离并鉴定血中移行成分,研究其与传统药效作用的相关性,阐释中药药效物质基础及其代谢情况和体内动态的领域[14-15]。中药化学成分复杂,经口服给药后,其有效成分需进入血液并由血液转运至作用靶点才能发挥药效。因此,药物的血中移行成分与其在体内的直接发挥药效的物质紧密相关[16]。药物入血后,血清中的移行成分主要是由入血原型成分和药物在人体内的代谢产物以及机体产生的应激性成分组成。目前,UPLC-Q-TOF/MS 凭借其快速、灵敏、高分辨的优势,不仅适用于多组分快速检测,还能够对复杂基质中的组分准确定性,从而成为中药复方体内、外成分分析的首选方法[17-18]。
本研究拟采用液质联用技术,并结合多元统计分析,对灌胃给予XXT 的血瘀大鼠血清样本进行分析,辨识其血中成分,为全面系统地阐明该中药大品种药效物质基础提供数据支持。
1 实验材料
1.1 药物与试剂
XXT(吉林华康药业有限公司,批号:180404),灌胃前配制成0.14 g/mL 的溶液;肾上腺素(天津药业集团有限公司,批号:1811281);亮氨酸-脑啡肽〔Sigma公司(美国)〕;分析纯乙醚(天津天泰精细化学品有限公司,批号:20181210);质谱级乙腈和甲酸钠〔Fisher Chemical 公司(中国,上海)〕;用水为纯化去离子水。
1.2 仪器
Q-TOF/MS 四级杆飞行时间质谱仪(Xevo G2-XS)、样本管理器及ACQUITY UPLC 二元泵(美国Waters 公司);氮吹仪(DCY-12S,青岛海科仪器有限公司);冷冻干燥仪(FDU-1200,东京理化器械株式会社);飞鸽超离速离心机(TGL-16 aR,上海安亭科学仪器厂)。
1.3 动物
SPF 级雄性Wistar 大鼠〔合格证号:SCXK(吉)-2018-003〕,体重200±20 g,购自长春市亿斯实验动物技术有限责任公司,在温度 22 ± 4℃、相对湿度40%~60%的环境下适应性饲养1 周,每隔12 h 明-暗交替循环,自由采食、饮水。
2 实验方法
2.1 色谱条件
色谱柱:ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7um);柱温:30 ℃;流动相:A 和 B 分别为0.1%甲酸-水溶液与0.1%甲酸-乙腈溶液(v/v);梯度洗脱条件:0~2 min10%B,2~26 min 10%~90%B,26~28 min 90%B,28.0~28.1min 90%~10%B,28.1~30.0 min 10%B;自动进样器位温度:15 ℃;进样体积:5uL;流速:0.4 mL/min。
2.2 质谱条件
MSEcontinuum模式下,扫描范围为m/z100~1500。优化的仪器参数如下:在ESI+和ESI-模式下,毛细管电压和锥孔电压分别为3.0 kV 和40 V;氩气流量0.15 mL/min;温度为120 ℃时,锥孔气流量为50 L/h;温度为300 ℃时,脱溶剂流量为600 L/h;质量的准确测定是以 100 ng/mL 的亮氨酸-脑啡肽(ESI+:m/z 556.277 1,ESI-:m/z 555.261 5)溶液为校正标准液(Lock Spray TM),流量为15uL/min,并使用甲酸钠对仪器进行校正。
2.3 血清样本的处理
取雄性Wistar大鼠32 只,在经过适应性饲养1 周后,按性别体重随机分为空白组(Black group,B)、模型组(Model group,M)、空白给药组(Black drug group,BD)和模型给药组(Model drug group,MD),每组8只,其中,BD 和MD 组以上述剂量每天灌胃给药1 次,B和M组给予等剂量生理盐水,连续8d,每次给药30min后将 M 和 MD 组大鼠置于冰水(0~1 ℃)中 5 min,末次给药30 min 后,M 和MD 组大鼠皮下注射0.1%肾上腺素(1 mg/kg)2 次,首次剂量为 1 mg/kg,末次剂量减为0.5 mg/kg,间隔4 h,间隔时间内将各组实验鼠冰水浴5 min,以建立急性血瘀模型[19]。造模2 h 后BD和MD 组再次给药,给药1 h 后,采用乙醚对实验鼠进行麻醉,分别于 0.5、1.5、2.5、3.5 h 眼丛后静脉取血各约0.5 mL,血液样本3 000 r/min 离心15 min,取上清液,后将每只大鼠4 个时间点的血清合并,取500uL加入4 倍量甲醇进行沉淀处理,涡旋3 min,混匀液10 000 r/min 低温(4 ℃以下)离心 10 min,吸取上清,冷冻干燥。所得残渣用0.2 mL 甲醇复溶,涡旋混匀,10 000 r/min 低温离心10 min,取上清,备用。与此同时,将每个样本吸取15uL,混合后得质量控制 QC(Quality control)样本,在进样前、进样中及进样后各进一针QC 样本,以对系统的稳定性进行评估[20]。
2.4 数据处理
采用 MarkerLynx XS 4.1 软件(Waters,Manchester,UK)对血清样本的UPLC-Q-TOF/MSE 数据进行峰检测、色谱峰提取、去褶合、校准、同位素消除、数据缩减及归一化等分析,保留时间为0~30 min,质量为100~1 500 u,质量公差为0.10,标记强度阈值为2 000,最小强度为5%,保留时间窗为0.20,质量窗为0.10,噪声消除水平为6。所得数据通过主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA),获得VIP 值和OPLS-DA/S-plot图,发现能够代表组间差异的潜在的标记物。采用R2Y 和Q2两个参数来评价模型,模型的拟合度和可预测度分别用R2Y 和Q2 表示,这两个参数的大小能够反映模型的可靠性与准确性。所得数据通过 PCA 和 OPLS-DA 分析,获得 VIP 值和OPLS-DA/S-plot图,发现能够代表组间差异的血中移行成分。
3 结果
3.1 XXT及生物样本色谱图的建立与分析
对B、BD、M 和MD 组大鼠血清样本进行定性分析。XXT 中所含的各单体成分在30 min 内得到较好的分离,4 种血清样本的正、负离子模式下的基峰总离子流图见图1。结果显示,血清中所含有的内源性物质检测良好,但因其质谱响应值高于XXT 体内成分,存在干扰明显,在所采集的血清色谱图中难以直观上发现 XXT 的体内成分。故在此基础上结合 PCA 和OPLS-DA 检测与鉴定XXT 的入血成分。
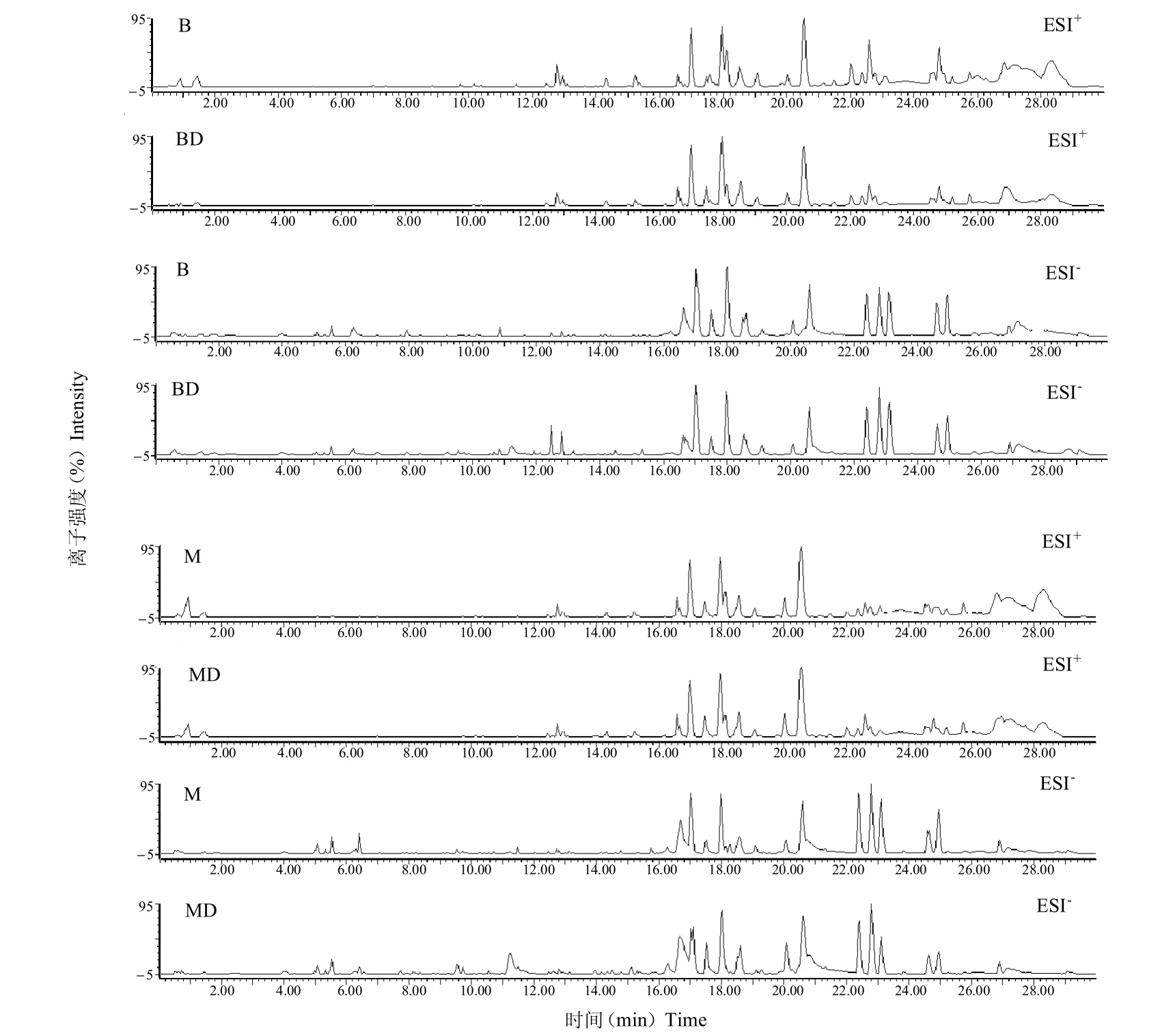
图1 XXT 的给药血清在ESI+和ESI-模式下的基峰离子流图Fig.1 The base peak intensity chromatograms in serum of XXT in ESI+mode and ESI-mode
3.2 多元统计分析
采用Markerlynx XS 4.1 软件导入通过UPLC-QTOF/MS 采集的原始数据文件,进行加入分组信息的PLS-DA分析。结果PLS-DA模型呈现出较好组间差异。
PCA 载荷图中的每个点代表一个样本。正、负离子模式下的健康大鼠和病理大鼠即B、BD、M 和MD大鼠灌胃给予XXT后的血清代谢轮廓PCA载荷图见图2。从图2中可以看出,4 个组别的大鼠血清样本被明显地分为4 个区域,说明各样本存在显著差异。QC样本聚集,说明系统稳定性良好。正、负离子模式下的健康大鼠和病理大鼠灌胃给予XXT 血清代谢轮廓的OPLS-DA 载荷图以及OPLS-DA/S-plots 图分别见图3、4和图5、6。在 M 和 MD 组的 OPLS-DA 得分图中,可明显观察到因血清样本被分成2 个离散群,分别为M组(得分矩阵左侧)和MD组(XXT,得分矩阵右侧),说明M 与MD 组血清相比存在差异显著的成分。

图2 B、BD、M 和 MD 组大鼠血清代谢轮廓 PCA 图Fig.2 PCA plots of serum metabolic profiles in B、BD、M and MD group rats
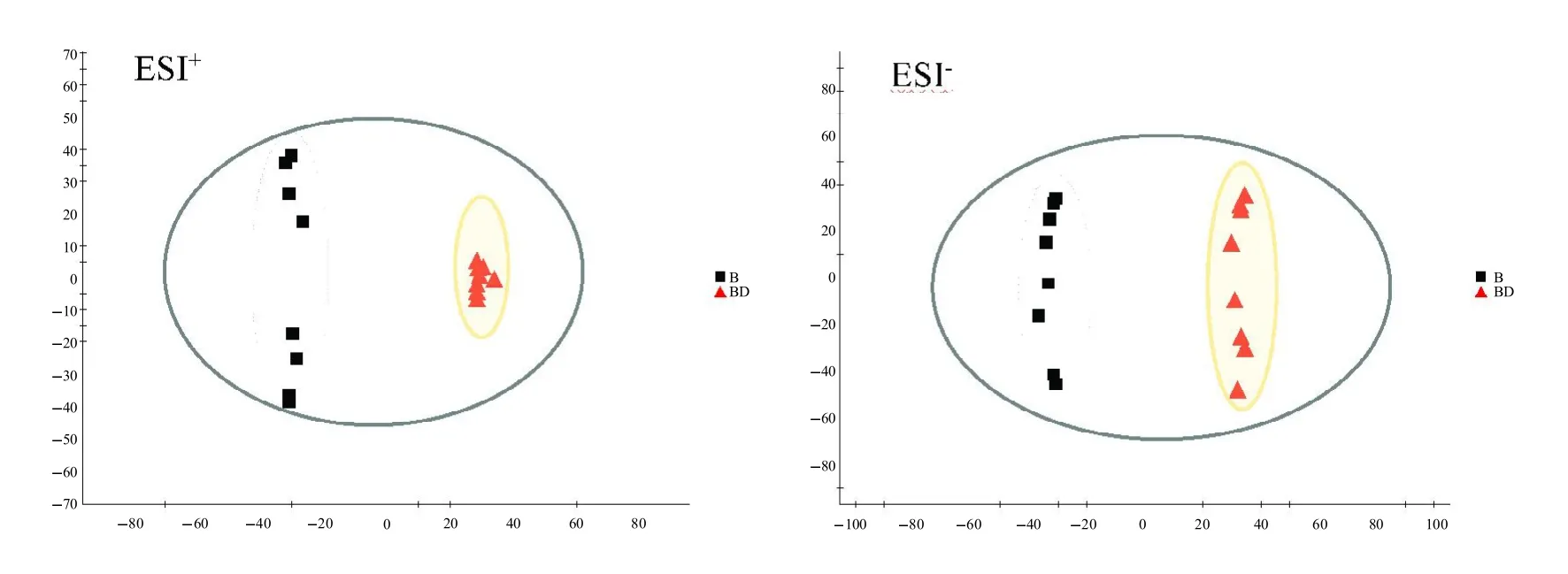
图3 B 和BD 组大鼠的血清代谢谱OPLS-DA 载荷图Fig.3 OPLS-DA load map of serum metabolic profiles in B and BD group rats

图4 B 和BD 组大鼠血清代谢谱OPLS-DA/S-plots 载荷图Fig.4 Serum metabolic profiles S-plots loading map in B and BD group rats

图5 M、MD 组大鼠的血清代谢谱OPLS-DA 载荷图Fig.5 OPLS-DA load map of serum metabolic profiles in M and MD group rats
以 VIP 即某个变量对模型分类的贡献程度为依据,对变量进行筛选,认为VIP>1.0 且经T 检验后P<0.05 的代谢物是具有差异性的代谢物,后经一级、二级高分辨质谱数据分析,并结合XXT图谱与对照品及参考文献中的质谱数据进行比对,在血瘀大鼠中共鉴定出28 个入血原型成分及3 个代谢产物。
3.3 XXT中吸收入血原型成分的鉴定
在筛选出的离子峰中,认为既存在于XXT中,又存在于给药血清中的成分是血中移行成分[21]。通过比对各质谱数据信息,选取VIP>1.0 且经T 检验P<0.05 的代谢物,在给药血清中分析并鉴定出28 个血中移行成分。
3.4 代谢产物的鉴定
3.4.1 代谢产物M1 保留时间为5.13 min 时,存在m/z 617.054 4 峰,推测为[M-H]峰,以 m/z 617.054 4 为母离子进行MS/MS 扫描,产生3 个主要碎片离子,m/z 583.068 9 和m/z 573.150 6 分别是由母离子丢失2 分子H2O 和 1 分子HCOOH 产生的[M-H-2H2O]和[MH-HCOOH]峰;母离子丢失1 分子H2O和1 分子-SO3形成m/z 519.092 7[M-H-H2O-SO3]峰;m/z 421.136 2是由母离子丢失1 分子 C9H9O5产生[M-H-C9H9O5]峰;与原型成分丹酚酸B 的分子结构及碎片裂解规律[22]基本一致,故推测M1 分子式为C27H22O15S,属酚酸类,其代谢途径推测为丹酚酸B 在体内发生硫酸化反应,其二级质谱图见图7。

图7 ESI-模式下代谢产物M1 的二级质谱图Fig.7 Secondary mass spectrum of Metabolite M1 in ESI-
3.4.2 代谢产物M2 在保留时间11.32 min 时,出现m/z 981.547 3 的峰,推测为[M-H]峰,以 m/z 981.547 3为母离子进行MS/MS 扫描,产生4 个主要碎片离子,m/z 683.487 9 是由母离子丢失1 分子葡萄糖和1 分子阿拉伯糖形成的[M-H-Ara(f)-Glu]峰,继而分别丢失2 分子 H2O 和1 分子 SO3形成 m/z661.333 9 [MH-2H2O-Ara(f)-Glu]峰和m/z 621.369 1 [M-H-SO3-Ara(f)-Glu]峰,m/z 459.384 5 由m/z 621.369 1 继续丢失1 分子葡萄糖形成的[M-H-SO3-Ara(f)-2Glu]峰,为原人参二醇皂苷元的特征离子峰,与原型成分人参皂苷Rc 的分子结构及碎片裂解规律[23]相比,除引入1分子 SO3外,分子量相差178,可能最先脱掉1 分子葡萄糖,故推测M2 分子式为C47H82O19S,属三萜皂苷类,其代谢途径推测为人参皂苷Rc 在体内先发生葡萄糖醛酸化,再进行硫酸化反应,,其二级质谱图见图8。

图8 ESI-模式下代谢产物M2 的二级质谱图Fig.8 Secondary mass spectrum of Metabolite M2 in ESI-
3.4.3 代谢产物M3 在保留时间23.25 min 时,出现m/z 469.230 1 的峰,推测为[M-H]峰,以 m/z 469.230 1为母离子进行MS/MS 扫描,产生4 个主要碎片离子,m/z 451.241 5 和m/z 425.284 5 分别由母离子丢失1分子 H2O 和1 分子 HCOOH 得到 [M-H-H2O]峰和[M-H-HCOOH]峰;m/z 389.271 4 由母离子脱去 1 分子 SO3产生[M-H-SO3]峰;母离子脱去1 分子 SO3、-CH3和1 分子 C8H14O2及2 个H形成碎片离子峰m/z 227.307 2[M-H-2H-CH3-SO3-C8H14O2]峰,与原型成分胆酸的分子结构及碎片裂解规律[24]相比,除引入 SO3、脱1 分子H2外,分子量相差18,因此猜测先脱水,故推测M3 分子式为C24H38O7S,属于甾体类成分,其代谢途径推测为胆酸在体内先脱水,然后经氧化再发生硫酸化反应,二级质谱图见图9。
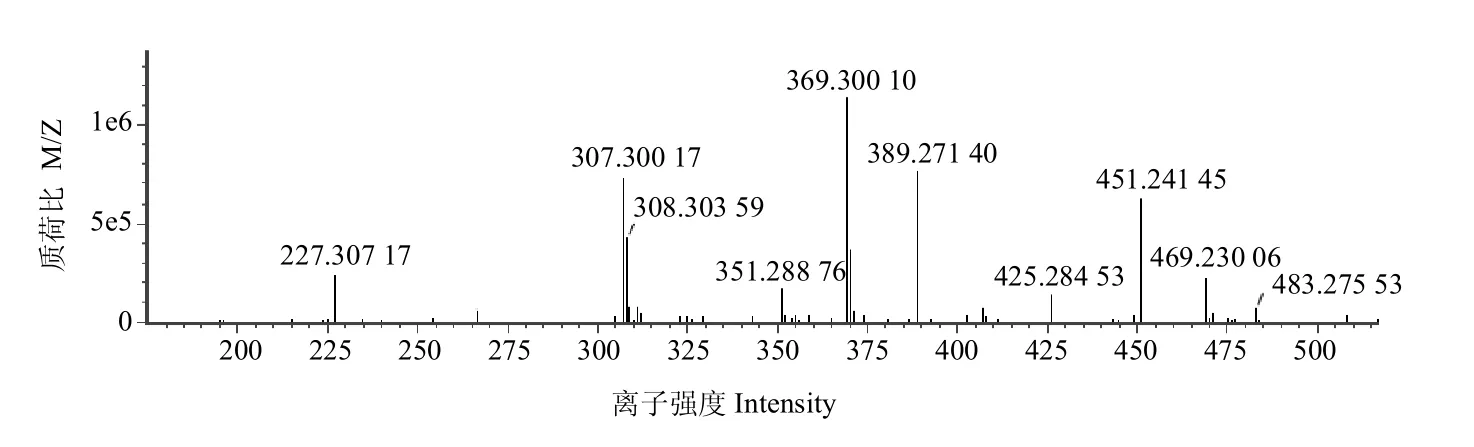
图9 ESI-模式下代谢产物M3 的二级质谱图Fig.9 Secondary mass spectrum of Metabolite M3 in ESI-
4 讨论
中药传统的口服给药方式决定了只有吸收入血的成分才能发挥药效作用[25]。血清成分分析存在含量较低、组分复杂、分离较难,生物个体差异较大的特点,因此本实验运用中药血清药物化学研究方法,将多变量统计分析技术与基于UPLC-Q-TOF/MS提供的高选择性、高灵敏度、高分离度及高质量精度质谱数据相结合,研究灌胃给予XXT后在健康大鼠和血瘀模型大鼠体内的血中移行成分。
中药血清药物化学研究大多集中对正常动物入血成分的分析,但目前研究发现,正常与病理状态下的动物对同种中药的吸收利用存在明显差异[26-27]。因此,本实验将Wistar 大鼠随机分为B、BD、M 和MD 组进行血中移行成分分析。
本实验前期建立XXT化学成分的UPLC-Q-TOF/MS 分析,明确了XXT 的体外化学成分,在此基础上,对比分析模型组血清、给药组血清和XXT 的70%甲醇提取液从中获得对应化合物的提取总基峰离子图,然后与入血成分分析比对,快速分离并初步鉴定出健康大鼠入血原型成分14 个、血瘀模型大鼠入血成分28个,其中共有成分12 个。血瘀模型大鼠的入血成分以菲醌、三萜皂苷及甾体类为主要,其中多种成分来源于多味药材,进一步说明XXT抗血瘀活性是多味药材共同作用的结果。从血瘀模型大鼠发现的血中移行成分中可能为XXT 的体内直接作用物质。
5 结论
本研究采用UPLC-Q/TOF-MS结合多元统计分析的方法,辨识了灌胃给予XXT后大鼠体内的血中移行成分。通过基于血清色谱图,结合PCA、OPLS-DA 分析,并比对各质谱数据信息,在健康组和血瘀组大鼠的给药血清中分别鉴定出14、28 个血中移行成分,其中共有成分12 个。二者的血中移行成分存在一定差异。从血瘀病理鼠的血中移行成分中发现了人参皂苷Rd、隐丹参酮、二氢丹参酮I、胆酸、牛磺去氧胆酸、冬青素A 及洋川芎内酯H 等含量较高的成分,而在健康鼠血清中未检测出,推测这几种成分与抗血瘀药效紧密相关。在后续研究中,将进一步对各成分与各作用靶点进行关联性研究,为XXT进一步开发和临床合理应用提供了数据支持。

