lncRNAs在糖尿病大鼠肺纤维化中的作用机制及利拉鲁肽对其防治作用
周蕾 张雅中 房辉 秦江媛
(唐山市工人医院内分泌二科,河北 唐山 063000)
近年来,糖尿病(DM)肺纤维化越来越受到重视。DM肺纤维化的患者存在肺弥散功能障碍及通气功能障碍〔1〕。长链非编码(lnc)RNAs参与多种器官纤维化的生物学过程,在DM肺纤维化的发病过程中起重要的调控作用〔2〕。异常表达的 lncRNAs可能成为新的治疗靶点。本实验通过观察lncRNAs在DM大鼠肺组织的表达及利拉鲁肽的干预作用,研究lncRNAs在DM肺纤维化中的发生作用及利拉鲁肽对其新的作用机制。
1 材料与方法
1.1实验动物 选用6~8周龄健康SPF(无特定病原体动物)级Sprague-Dawley(SD)雄性大鼠60只,体重(BW)180~220 g,由河北联合大学附属医院实验动物中心提供(使用证明编号:MY06DXK07)。
1.2主要实验试剂及仪器 利拉鲁肽注射液(北京诺和诺德(中国)制药有限公司),链脲佐菌素(STZ,美国Sigma公司),兔抗大鼠转化生长因子(TGF)-β1多克隆抗体、兔抗大鼠Wnt3a多克隆抗体、兔抗大鼠β-catenin多克隆抗体、SABC试剂盒、二氨基联苯胺(DAB)显色试剂盒(美国Abcam公司),逆转录试剂盒(美国Invitrogen公司),血糖仪及血糖检测试纸条(德国罗氏公司)。
1.3动物分组与处理 取雄性 SD大鼠(河北联合大学实验动物中心)50只。其中40只腹腔单次注射STZ 60 mg/kg诱导建立DM模型,对照(NC)组腹腔注射等量上述枸橼酸缓冲液,72 h后尾静脉采血测定空腹血糖(FPG),FPG≥16.7 mmol/L视为造模成功,将造模成功的30只大鼠随机分为DM组、DM+利拉鲁肽低剂量组〔400 μg/(kg ·d),DM+LL组〕、DM+利拉鲁肽高剂量组〔800 μg/(kg·d),DM+HL组〕,治疗8 w(腹腔注射利拉鲁肽0.225 μg/g体重,2 次 /d)〔3〕。
1.4标本收集与处理 在禁食12 h后,取大鼠尾末梢毛细血管全血测定FPG;天平称重大鼠BW,均为1次/w。杀检前1天空腹尾静脉取血测定糖化血红蛋白(HbA1c)、动脉取血测定氧分压(PaO2)、血氧饱和度(SaO2)及二氧化碳分压(PaCO2)。麻醉大鼠取肺组织,标记后放置-80℃保存。
1.5免疫组化染色 按照SP试剂盒说明检测各组TGF-β1、Wnt3a、β-catenin蛋白表达情况。免疫组化染色后半定量分析采用 Imag proplus5.0 图像分析系统进行光密度分析,棕黄色颗粒为阳性信号。
1.6RT-PCR法检测lncRNAs-H19 mRNA表达 取新鲜冰冻组织,重量约100 mg,按照Trizol一步法提取RNA,测定RNA浓度和纯度。取等量RNA逆转录得到cDNA,进行扩增。
1.7统计学方法 采用SPSS17.0软件进行单因素方差分析。
2 结 果
2.1各组FPG、HbA1c、BW及血气比较 与NC组比较,DM组FPG、HbA1c、BW差异有统计学意义(P<0.05)。DM+LL、DM+HL组FPG及HbA1c水平显著低于DM组,PaO2及SaO2显著高于DM组,PaCO2显著低于DM组(P<0.05),且DM+HL组血糖降低效果更明显,见表1。
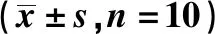
表1 各组血糖、HbA1c、BW及血气比较
与NC组比较:1)P<0.05;与DM组比较:2)P<0.05;与DM+LL组比较:3)P<0.05
2.2肺组织病理学变化 苏木素-伊红(HE)染色显示,与NC组比较,DM组肺组织结构紊乱,肺泡间质及毛细血管基底膜增厚,部分肺泡腔萎缩甚至塌陷。见图1。
2.3免疫组化结果 TGF-β1、Wnt3a、β-catenin在肺间质中呈间断不连续分布表达于肺间质及血管上皮细胞核周围的胞质。DM组TGF-β1、Wnt3a、β-catenin表达的平均光密度值显著高于NC组(P<0.01),DM+LL、DM+HL组显著低于DM组(P<0.01),DM+HL组显著低于DM+LL组(P<0.01),见表2,图2。
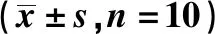
表2 各组TGF-β1、Wnt3a、β-catenin比较
与NC组比较:1)P<0.01;与DM组比较:2)P<0.01;与DM+LL组比较:3)P<0.01

图2 各组免疫组化检测TGF-β1、Wnt3a、β-catenin在肺组织中的表达(免疫组化,×40)
2.4lncRNAs-H19在各组肺组织中mRNA表达比较 与NC组相比较,lncRNAs-H19 mRNA的表达在DM组增高2.95倍;与DM组比较,DM+LL组下降1.21倍,DM+HL组下降2.0倍,差异有统计学意义(P<0.05),见图3。
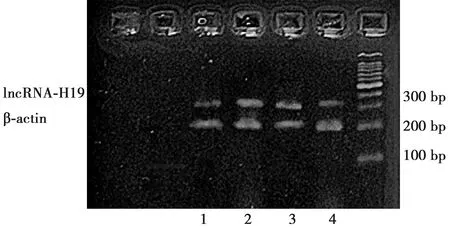
1~4:NC组、DM组、DM+LL组、DM+HL组图3 各组肺组织中lncRNAs-H19 mRNA表达
3 讨 论
血糖代谢在不同组织和器官有不同且复杂的生物化学过程,研究表明,DM肺纤维化是DM慢性并发症中另一个重要的组织病变〔4〕。而lncRNAs在高糖环境下发挥关键作用〔5〕,研究证实lncRNAs参与了众多病理生理学过程,如细胞分化与个体发育、肿瘤的发生与迁移及器官与组织纤维化等〔6,7〕。lncRNAs-H19是最先被报道的lncRNAs 之一〔8〕,高浓度H19在器官和组织纤维化的形成中发挥了重要作用。lncRNA-H19能够通过调控TGF-β蛋白的表达来影响其下游相关信号传导通路的相关表达。TGF-β1是各个器官和组织中最重要的致纤维化因子〔9,10〕。
Wnt信号通路是一条含有高度保守的碱基序列的信号通路,由 Wnt 相关蛋白及下游的靶基因组成。研究显示,抑制 Wnt/β-catenin 信号通路可降低肺纤维化的发生发展〔11〕。Wnt蛋白是细胞中重要的调控者,Wnt3a是Wnt蛋白家族一员,主要通过旁分泌、 自分泌方式释放于胞外,并结合细胞表面受体,激活下游信号产生级联效应〔12〕。
本研究通过基因和蛋白水平验证,DM肺纤维化可能与lncRNAs-H19过度表达有关。同时DM大鼠肺组织TGF-β1、Wnt、β-catenin蛋白活性增加,提示lncRNAs-H19的过多表达激活TGF-β1上调 Wnt/βcatenin 信号通路增加了DM肺组织纤维化的进程。而经过利拉鲁肽治疗后,lncRNAs-H19表达量下降,继之通过TGF-β1下调 Wnt/βcatenin 信号通路,并随治疗浓度的增大效果更为显著。
综上,DM大鼠肺组织中异常表达的 lncRNAs可能是导致DM肺纤维化的重要途径,而利拉鲁肽能降低其表达,且呈浓度依赖性。

