补肾益肝活血方含药血清对ERK/p38MAPK信号通路的影响
许骏 谢林
(南京中医药大学附属省中西结合医院骨伤科,江苏 南京 210000)
骨关节炎(OA)属于中医学痹证的范畴,好发于老年人,以软骨退变和关节周围骨质增生、细胞外基质(ECM)代谢失调为主要的病理特征,软骨变性是OA的最基本病理改变,临床上表现为关节的疼痛、僵硬、肥大及功能活动受限等〔1〕。临床上应用补肾益肝活血方治疗OA疗效显著,取得良好临床效果,并通过实验探讨了该方对软骨细胞凋亡、骨髓基质细胞(BMSCs)分化的影响,发现补肾益肝活血方有抑制软骨细胞凋亡的作用,其含药血清能有效诱导BMSCs成软骨细胞分化,其作用机制很可能与细胞外信号调节激酶(ERK)和丝裂原活化蛋白激酶(MAPKs)存在相关联系。本研究旨在分析补肾益肝活血方对OA ERK/p38MAPKs信号通路产生的影响,探究OA发生机制及OA治疗中的机制。
1 材料与方法
1.1实验材料
1.1.1实验动物 选取健康的、成年SPF级雌性SD大鼠,重量185~230 g,实验用动物全部由南京中医药大学研究所提供。为了使这些大鼠适应周围环境,纳入本实验的所有SD大鼠均于实验前1 w放置在实验室内,饲养员进行常规的分笼饲养。实验室基本指标:保持自然光照,良好的通风,室内温度要求控制在18.5~23.0℃,湿度控制在40%~70%。实验研究期间,所有大鼠进食标准颗粒词料,并可以自由地饮用自来水,术前8 h禁食水。
1.1.2主要试剂、仪器与药品 胎牛血清(FBS,Gibco公司);DMEM低糖培养基(Hyclone公司);双抗混合液(100 U/ml青霉素、100 μg/ml链霉素),10%胰蛋白酶、0.2%Ⅱ型胶原酶(Sigma 公司);逆转录试剂盒(Fermentas 公司);引物合成(上海生工生物工程公司);磷酸化-丝裂原活化蛋白激酶p38抗体(Anti-p-p38α,Thr180/Tyr182)一抗(Millipore 公司);p38一抗(Millipore 公司)。二氧化碳培养箱、荧光倒置显微镜、流式细胞仪、酶标仪、滤器、无菌操作台和高速离心机。补肾益肝活血方由骨碎补15 g、丹参10 g、没药10 g及怀牛膝10 g组成,实验所用药物由南京中医药大学附属省中西结合医院药剂科提供。
1.2实验动物分组 40只雌性 SD 大鼠随机分为 4组,即对照组、低剂量组、中剂量组、高剂量组,每组各 10只。
1.3补肾益肝活血方含药血清的制备 根据人和动物间按体表面积折算的等效剂量比率表换算,给药组给予补肾益肝活血方3.2 g/(kg·d)灌胃,对照组则给予等量的生理盐水灌胃。各组每12 h灌胃给药1次,连续灌胃 5 d。并在最后一次灌胃前禁食,末次灌药3 h后,麻醉SD大鼠,行腹主动脉采血,静置于温度预调在4℃的冰箱4 h后,离心机设置2 500 r/min的转速,离心25 min,分离离心所得血清,将同组实验动物分离所得到的血清予以混合,并在56℃水浴箱内,灭活30 min,抽滤、除菌后分装,-20℃保存备用。
1.4软骨细胞体外培养与鉴定
1.4.1软骨细胞分离、原代培养 软骨细胞分离步骤:①选取12只新生SD乳大鼠(48 h内)行脱颈法处死,浸泡75%乙醇5 min,放在无菌手术台上;②用眼科剪和镊子分离大鼠肋骨处的软骨,分离以后,放入活力碘伏内浸泡3 min;③准备好培养皿,将浸泡好的软骨转移至超净台,将残余软组织剔除,转移至新的培养皿内,磷酸盐缓冲液(PBS)洗2遍,弃上清。软骨细胞原代培养步骤:①第一次酶解:将清洗干净的软骨转移到中号培养皿内,加入10倍体积的0.2%Ⅱ型胶原酶;②用眼科剪将软骨块剪至1 mm以内的小块,使用移液器,将其充分混匀,使细胞分散后放置于二氧化碳培养箱中,培养温度设为37℃,5%二氧化碳,在饱和湿度的条件下培养24 h;③软骨块消化至80%,取细胞悬液于离心管,1 000 r/min离心5 min,弃去上清液,加入8 ml完全培养基,细胞计数后以104接种于培养皿;④第二次酶解:培养达24 h后换液,此后每48 h换液一次,细胞传代前使用倒置显微镜观察,当细胞面积达80%以上时,用10%的胰蛋白酶消化后进行细胞传代。
1.4.2软骨细胞的鉴定 (1) 细胞形态观察:每天在显微镜下对细胞的生长情况进行观察,使用胰蛋白酶将细胞消化为悬液以后取出50 ml,使用细胞计数板进行计数后记录,在1 w以内不传代。(2)甲苯胺蓝染色:软骨细胞内的多聚糖可被甲苯胺特异性的染色,因此软骨细胞的鉴定通常都使用甲苯胺蓝染色。首先,将培养好的软骨细胞用蒸馏水冲洗3~5遍,并将软骨细胞浸泡在1.5 ml的甲苯胺蓝染液内,浸泡3 min,再用蒸馏水清洗3次,最后使用无水乙醇对其进行脱水作用,光镜下观察并拍照。(3)免疫组织化学染色:将体外培养的软骨细胞接种在盖玻片上,连续培养7 d后取出,首先,使用PBS将盖玻片清洗轻轻冲洗3次后,使用4%多聚甲醛处理30 min,按照链霉亲和素-生物素复合物(SABC)法说明进行Ⅱ型胶原酶的染色,对照组使用PBS替代一抗。
现场还有一块示范田,将南京农业大学的多项技术进行了集成应用,包括智能化育秧、秸秆绿色综合利用、机插—施肥—除草一体化、大田精确定量绿色智慧管理等技术,基本实现了全程机械化、绿色化、智能化生产,一个“智慧农场”的雏形已清晰可见。
1.5退变软骨细胞模型的建立及含药血清干预 当培养的软骨细胞传至第2代时,予软骨细胞10 ng/ml的白细胞介素(IL)-1β 诱导获得退变的软骨细胞;持续 24 h 的诱导退变以后,弃去培养液,换成4 种不同的培养体系分别进行培养。
1.6酶联免疫吸附试验(ELISA)检测各组上清中IL-1β、肿瘤坏死因子(TNF)-α的表达情况 细胞培养的上清液使用ELISA试剂盒检测IL-1β的水平,严格根据说明书上面的操作步骤进行,即分步骤进行包板、洗板、加样品、密封室温摇床孵育等过程。
1.7Western印迹法检测含药血清干预后退变软骨细胞中磷酸化(p)-ERK1/ERK2、p-p38MAPKs 及基质金属蛋白酶(MMP)-3蛋白表达
1.7.12 h含药血清干预结束后,退变软骨细胞中总蛋白的提取 ①首先,用RIPA裂解液中和苯甲基磺酰氟(PMSF)(100 mmol/L),按100∶1的比例混匀,置于冰上备用。②弃去经IL-1β诱导退变的软骨细胞得培养液,加入预冷的PBS,漂洗2次,去除PBS,向每一个培养瓶中加入RIPA裂解液,混和均匀,放置在冰上30 min。③待软骨细胞充分裂解后,使用细胞利刀将细胞刮下来,转移至预冷的 EP管中,12 000 r/min,4℃离心10 min。④将上清液转移至预冷的新 EP管中,预留10 μl用于蛋白浓度测定。⑤每根 EP管中蛋白上清与蛋白定量缓冲液按4∶1的比例混匀,置于100℃加温机中加热5 min使蛋白质变性、分装,-80℃保存备用。
1.7.2Western印迹法检测蛋白表达 (1)配胶:按照表1的反应物和12%分离胶及5%浓缩胶的液体量进行配胶。(2)灌胶:预先将玻板洗涤干净,并安装好备用,确认没有漏水,进行灌胶,首先将12%的分离胶灌入玻璃板,然后使用正丁醇将分离胶的上层压成一平面。等到分离胶凝固了,把正丁醇倒掉,用蒸馏水冲洗干净,同时再用滤纸把胶面顶层残留的蒸馏水洗净,最后把浓缩胶灌入,与此同时,迅速地插入梳子,使其在室温下凝固。
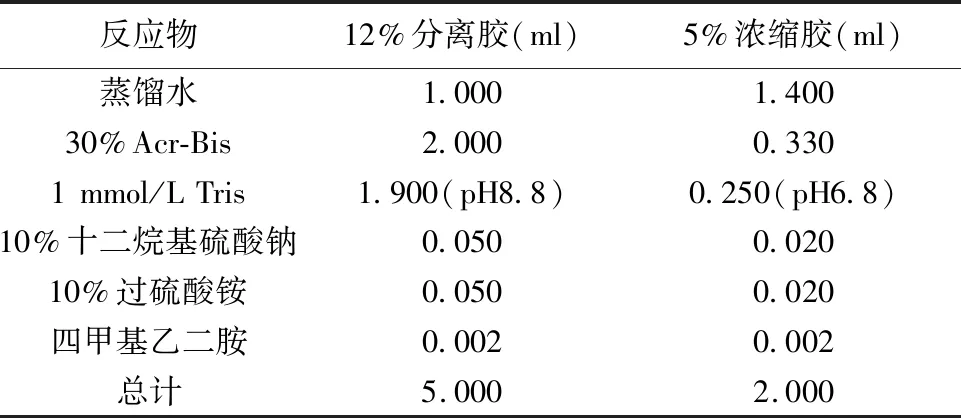
表1 分离胶和浓缩胶的配制
(3) 加样:往每一个孔内加样的量相同,都是40 μg的蛋白,每孔上样量蛋白浓度为40 μg,依次把待测样品上样,在胶左侧加入5 μl的蛋白 Marker。(4)电泳:让浓缩胶在80 V的电压下进行电泳,当染料跑至分离胶的时候,可以将电压改为100 V,也可以不改,电泳继续进行。(5)检测蛋白:①电泳过后,取下一块胶,转移到一个盛有考马斯亮蓝(CBB)的容器内,注意切勿将其弄碎或破损;②摇床染色,时间为20 min,染色完毕,收回染色液;③运用脱色液进行脱色,脱至蛋白条带清晰可见,然后用双蒸馏水冲洗,3~5次为宜,最后CBB染色。(6) 转膜:①预处理:先将聚偏二氟乙烯(PVDF)膜浸泡在无水甲醇中,保持10 min,提前剪好转膜所需的海绵和滤纸,并将其与浸泡过的PVDF膜一同放入内装转膜缓冲液的托盘中,再次浸泡15 min;②转膜:按照顺序依次放好,将电转夹夹好,并将电转夹插进装满转膜缓冲液的电泳槽内,电泳槽置于盛有冰块的泡沫塑料盒内,在100 V电压下进行转膜55 min;③封闭:当转膜完毕后,取出PVDF膜,浸泡于封闭液中,闭封于室温下2 h;④一抗孵育:将PVDF膜放入一抗稀释液(CyclinD1,1∶400;CDK4,1∶400;pRb,1∶500;p16,1∶600),4℃摇床孵育过夜;⑤二抗孵育:次日一早将PVDF膜取出,冲洗10 min×3次。最后再把膜放入二抗稀释液中,孵育1 h,冲洗10 min×3次。 (7)成像与结果分析:参照电化学发光(ECL)试剂盒的说明书,按 A液:B液为1∶1,置于1.5 ml的 EP管内充分混合均匀,将其滴在膜的蛋白面,室温下放置1 min。凝胶成像仪下显影、拍照。并用分析凝胶图像的相应软件分析不同种蛋白的表达量及与内参的比值。
1.8统计学分析 采用SPSS13.0进行t检验、单因素方差分析。
2 结 果

图1 倒置显微镜下接种后不同阶段大鼠软骨细胞的形态变化(×100)
72 h 时,软骨细胞大部分贴壁,分裂增殖速度增快。培养的软骨细胞胞质较丰富,可见清晰的胞核,有 1~2个核仁(图1B);约 4 d左右汇合成单层铺满整个培养皿底面(图1C);传代后生长速度加快,约4 d左右便开始传代,细胞周围可见具有折光性的ECM,细胞长成一片,呈“铺路石”状外观( 图 1D) ;当传代传至第5代时,细胞的形态逐渐有所变化,部分变为长梭形,同时也会出现形态不规则的细胞(图1E);当软骨细胞培养至第 7 代以后,绝大部分细胞呈梭形,生长速度减慢,传代周期亦延长(图1F)。
2.2软骨细胞的鉴定结果 甲苯胺蓝染色后可见细胞核呈深蓝色,有 1~2 个核仁,胞质呈淡蓝色,细胞外基质着浅蓝色,见图2。软骨细胞的胞质经异硫氰酸荧光素(FITC)染色后发出鲜亮的绿色荧光,呈强阳性,细胞核区域没有着色。细胞核经4',6-二脒基-2-苯基吲哚(DAPI)染色后激发出蓝色荧光。从图3可以看出,几乎全部细胞表达了 Ⅱ型胶原,进一步证明本实验得到了纯度很高的软骨细胞。

图2 甲苯胺蓝染色(×100)
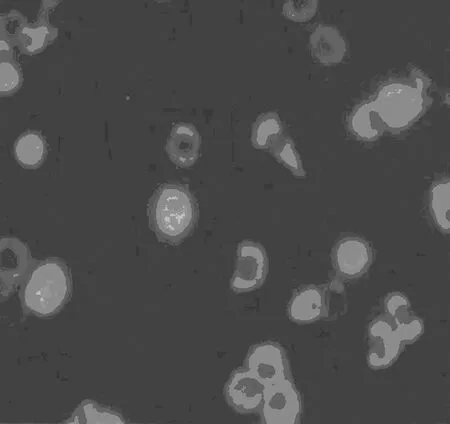
图3 Ⅱ型胶原免疫荧光染色(×100)
2.3软骨细胞的生长曲线 1~3代软骨细胞生长速度相差不大,当传至第4代以后,细胞增殖速度变慢。 MTT比色法显示,第2代软骨细胞的生长曲线近似“ S ”形。第1~3天处于生长潜伏期,第4~8天软骨细胞呈对数生长,约在第9~10天达到平台期,至第11天开始出现生长抑制,见图4。

图4 第2代软骨细胞的生长曲线
2.4补肾益肝方对IL-1β、TNF-α表达的影响 低、中、高剂量组IL-1β、TNF-α表达水平均显著低于对照组(P<0.05,P<0.01)。见表2。

表2 补肾益肝活血方对软骨细胞IL-1β、TNF-α表达的影响
与对照组比较:1)P<0.05,2)P<0.01;表3同
2.5补肾益肝方对软骨细胞ERK、p38MAPK表达的影响 低、中、高剂量组ERK、p38MAPK与对照组比较差异均有统计学意义(P<0.05,P<0.01)。见表3。

表3 补肾益肝活血方对软骨细胞ERK、p38MAPK表达的影响
3 讨 论
OA是一种退行性变的疾病,好发于老年人,据统计,我国40岁以上人群原发性OA患病率为46.3%〔2〕。OA的特征性改变是软骨的退变和关节周围骨质的增生,实验室表现为进行性的关节软骨破坏和骨赘的形成,软骨变性是OA的最基本病理改变〔3,4〕。OA可同时伴有不同程度的滑膜炎症,最终可以出现关节的疼痛、僵硬、肥大及功能活动等受到限制〔5,6〕。关节软骨的退变与破坏是OA 最主要的病理环节,软骨组织内只有一种细胞成分,就是软骨细胞,而软骨细胞在体内不增殖〔7,8〕。为了本研究的进一步进行,本研究采用体外实验的实验方法,用SD雌性大鼠肋骨的软骨细胞进行体外细胞培养。
软骨细胞在维持关节软骨的正常结构和功能方面发挥重要的作用,当软骨细胞受到外力或TNF、表皮细胞生长因子(EGF)及IL-1等促炎细胞因子刺激后,便会通过细胞内的ERK1/2、p38MAPK等信号转导通路,把信号传递给各种细胞内的转录因子,并通过对酪氨酸和苏氨酸双位点磷酸化、酶与酶之间互相作用或通过MAPK在受体结合部位相互影响的能力激活MAPKs通路〔9,10〕,从而影响MMPs的表达,最终导致关节软骨细胞肥大和ECM代谢失调〔11,12〕。有研究提出〔13〕IL-1参与了OA ECM丢失的全过程,并通过实验证明,向实验动物模型的关节内注射IL-1并检测蛋白多糖,IL-1可以诱导蛋白多糖的丢失,表明IL-1受体阻滞剂可使动物模型OA软骨的破坏得到延缓,证实了IL-1在OA发生发展过程中的功能。克隆并纯化后IL-1可以诱导MMP的表达、能够促使分解代谢等因子还有其他炎症因子等的表达,这也是IL-1作用于软骨细胞致使OA发生发展的机制所在〔14〕。前列腺素(PG)E2具有刺激Ⅱ型胶原基因表达而抑制Ⅰ型胶原基因表达的作用,研究发现,当IL-1刺激软骨细胞导致Ⅱ型胶原基因表达被抑制、Ⅰ型胶原的生成被上调,PGE2的生成则会增加,这正是机体的负反馈机制的体现〔15〕。研究表明,IL-1能够协同抑瘤素(OS)M刺激软骨细胞产生蛋白多糖酶和MMPs〔16〕。因此,本研究运用IL-1β诱导软骨细胞,建立退变的软骨细胞模型。
关于p38MAPK及其信号转导通路的研究,研究证实,p38MAPK信号转导通路是软骨细胞退化及关节软骨破坏过程当中主要的信号传导途径之一〔17〕。第一,软骨细胞退变中 IL-1β 激活了p38MAPK信号通路〔18〕;第二,p38MAPK信号通路参与了MMPs 过度表达,进而加剧了软骨细胞的退变,如Roth等〔19〕研究结果表明 OA 患者关节液中MMP-3 过表达,应用 p38MAPK 信号通路阻滞剂后可以显著降低 MMP-3 的表达;第三,该信号转导通路参与了关节软骨细胞凋亡〔20〕。
近年来,关于单味中药及中药经方、中药复方治疗OA的实验研究逐渐成为研究热点,同时中药治疗OA的疗效较为确切。研究发现,中医药治疗OA的机制较为复杂,涉及细胞内信号转导的各个环节,包括抑制细胞因子的释放、抑制软骨细胞的凋亡、促软骨细胞的增殖、抑制NO合成、下调MMPs水平,使关节软骨的代谢恢复平衡〔21〕。补肾益肝活血方治疗肋骨关节炎,取得良好临床效果。前期实验研究发现,补肾益肝活血方能够诱导BMSCs成软骨细胞分化,参与软骨细胞增殖和凋亡的信号转导,推测其作用机制很可能与MMP-3和纤维蛋白样细胞外基质蛋白(EFEMP)-1这两个激酶存在一定的联系。
中医认为,OA属中医“痹证”、“伤筋”范畴,由于汗出当风,或涉水冒寒,或居处潮湿,致使风、寒、湿等邪气痹组经脉,阻滞经络、气血的运行,属本虚标实证,以肝肾不足,精血亏损为本,而外来的风、寒、湿邪气及痰、瘀等病理产物为标。
痹证在临床治疗中,常见的有如下三个证型:①风寒湿痹;②风湿热痹;③痰瘀痹阻及久痹正虚。当痹证病程日久者,可出现痰瘀痹阻气血不足及肝肾亏虚。补肾益肝活血方中骨碎补入肝、肾经,具有补肝强肾,有治本之功,是为君药,;丹参,活血化瘀,消肿除胀,是为臣药;没药,活血散瘀、消肿止痛,是为佐药;怀牛膝,活血化瘀,同时补肝肾、强筋骨,引药下行,是为佐药,全方共奏补肾益肝、活血化瘀、消肿止痛之功。
补肾益肝活血方主要针对OA肝肾亏虚、风寒湿痹阻的共性病机,具有补益肝肾,蠲痹止痛之功效,临床疗效确切。前期研究发现该方有抑制软骨细胞凋亡的作用,其含药血清能有效诱导BMSCs分化成软骨细胞,其作用机制与MMP-3的表达存在相关性。研究表明,MMP-3的表达是由ERK1/2 和P38MAPK信号通路介导〔22~24〕。
综上,本研究结果表明补肾益肝活血方可通过调节ERK、p38 MAPK的表达,使退化的软骨细胞恢复正常。

