传染性法氏囊病病毒结构的冷冻电镜初步分析
苗苗,徐彩煌,黄子惠,张小东,张兴*,吴永平*
(1.浙江大学医学院生物物理系,杭州 310058;2.浙江大学医学院附属邵逸夫医院病理科,杭州 310058;3.浙江大学冷冻电镜中心,杭州 310058;4.浙江农林大学动物科技学院,杭州 311300)
传染性法氏囊病(infectious bursal disease,IBD)已遍布全球各地的养禽地区[1]。传染性法氏囊病病毒(infectious bursal disease virus,IBDV)是IBD的病原,导致机体产生免疫抑制[2-3]。IBDV属于双RNA病毒科,禽双RNA病毒属,其基因组由A、B双链RNA(double-stranded RNA,dsRNA)节段组成,全长约6.0 kbp,其中A节段(约3.2 kbp)含有2个部分折叠的开放阅读框(open reading frame,ORF):大ORF编码一个110 kDa的多聚蛋白前体(pVP2-VP4-VP3),可自行加工成为2个结构蛋白VP2、VP3及一个丝氨酸蛋白酶VP4;小ORF编码一个17 kDa的非结构蛋白VP5。VP2是病毒的主要保护性抗原和主要结构蛋白,与中和抗体的诱导和识别、病毒粒子毒力的变异、细胞凋亡的诱导、抗原漂移和细胞嗜性有很大的关系[4]。VP3是一个多功能蛋白,其作用主要包括:1)在病毒装配过程中作为支架蛋白和招募病毒蛋白VP1进入病毒粒子;2)与病毒基因组RNA作用;3)调节VP1的活性;4)抗细胞凋亡[5]。VP5蛋白不是病毒复制的必需蛋白,但在病毒的传播和发病机制中有重要作用[6-7]。B节段dsRNA(约2.8 kbp)编码一个约90 kDa的VP1蛋白——RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)[8],RdRp与病毒dsRNA结合,负责病毒基因组的转录和复制[9]。
dsRNA病毒的宿主范围广,从细菌到人类,分为7科(呼肠孤病毒科、金色病毒科、囊状噬菌体科、双RNA病毒科、小双RNA病毒科、双分病毒科和全病毒科)。dsRNA病毒基因组包含的RNA片段数目不一,从全病毒科仅包含1个RNA片段到一些轮状病毒中包含12个RNA片段[10]。目前,关于dsRNA病毒内部基因组的组装方式已有报道[11-12]。LUQUE等[13]发现,IBDV颗粒可以包装超过1个完整的基因组,且具有更大基因组拷贝数的IBDV颗粒具有更高的感染率,表明IBDV具有与其他dsRNA病毒完全不同的基因组包装和复制策略。但目前关于IBDV结构的研究主要集中在其蛋白衣壳方面[14-16],仅获得了IBDV衣壳蛋白的晶体结构[9],其基因组在其衣壳内部的包装方式和结构还不清楚。本文通过感染DF-1细胞获取IBDV,利用冷冻电镜三维重构技术获得了中等分辨率的IBDV三维结构。结果表明,IBDV与其他dsRNA病毒如呼肠孤病毒科胞质型多角体病毒(cytoplasmic polyhedrosis virus,CPV)[12]、蓝舌病毒(bluetongue virus,BTV)[17]、轮状病毒(rotavirus,RV)[18]的三维结构明显不同,在IBDV衣壳内部未观察到dsRNA基因组和RNA聚合酶的电子密度,暗示IBDV的dsRNA基因组的包装、转录和复制可能不同于其他dsRNA病毒。该结果可为揭示IBDV的起源进化和致病的分子机制提供结构学信息。
1 材料与方法
1.1 主要实验材料及仪器
IBDV由山东农业大学崔治中教授提供;负染观察在FEI Tecnai G2 Spirit 120 kV透射电子显微镜下进行,冷冻样品检查在FEI Talos F200C 200 kV冷冻电镜下进行,冷冻样品用FEI Vitrobot装置制备,数据收集使用FEI Titan Krios 300 kV低温场发射透射电子显微镜;普通碳支持膜铜网购自北京中镜科仪技术有限公司;碳微阵列支持膜铜网购自德国Quantifoil公司;氧化石墨烯溶液购自美国Sigma-Aldrich公司。
1.2 病毒培养及纯化
首先将IBDV株接种至DF-1细胞上,待出现明显的细胞病变时收获病毒。将收获的2 L IBDV上清液离心(5 000g,4 ℃,30 min),弃细胞碎片,然后加入500 mL 40%的聚乙二醇(polyethylene glycol,PEG)8000到病毒上清液中,于4℃条件下缓慢搅拌过夜,再经过1.6×104g、4 ℃离心1 h,去除上清液,收集IBDV沉淀。将沉淀用20 mmol/L Tris-HCl(pH 7.4)悬浮后吹打混匀,用24%的蔗糖垫在1.05×105g、4℃条件下离心2 h后弃上清液,然后加入400 μL Tris-HCl(pH 7.4),于4℃条件下过夜,接着将病毒沉淀吹打混匀后加至碘克沙醇梯度溶液(10%、20%、30%、40%、55%)中,以2.1×105g、4 ℃离心4 h,最后使用注射器小心抽取出各梯度溶液中的病毒条带,并进行缓冲液置换,于4℃条件下保存。
1.3 间接免疫荧光试验
为检测分离纯化的IBDV颗粒是否完整、是否有感染性,通过间接免疫荧光试验(immunofluorescent assay,IFA)进行观察[6]。试验步骤大致如下:IBDV感染DF-1细胞后48 h,弃细胞培养基;用磷酸盐缓冲液(phosphate buffer solution,PBS)洗2次;加入100 μL等体积丙酮和甲醇的混合液,然后在-20℃条件下放置30 min;PBS清洗3次;用5%脱脂奶在37℃条件下封闭2 h;在抗VP5单抗中于37℃条件下孵育1 h;PBS清洗3次;在用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗鼠IgG(1∶200)中于37 ℃条件下孵育1 h;PBS清洗3次;用10 μg/mL 4’,6-二 脒 基 -2-苯 基 吲 哚(4’,6-diamidino-2-phenylindole,DAPI)于室温条件下染核5 min,然后用PBS清洗3次,在倒置显微镜下观察。
1.4 透射电镜负染色观察
吸取3 μL IBDV样品于普通碳支持膜铜网上,吸附1 min后,用滤纸将表面样品液滴吸干,随即用2%醋酸铀溶液染色3次(染色时间分别为10 s、10 s、1 min),然后用FEI Tecnai G2 Spirit透射电子显微镜观察IBDV的形态结构。
1.5 冷冻样品制备及数据收集
使用FEI Vitrobot快速冷冻IBDV样品的方法如下:将Vitrobot样品室的湿度调至100%,吸取2.5 μL IBDV样品,滴加于铺有氧化石墨烯的Quantifoil(2/2)铜网上,使用Vitrobot滤纸吸7.5 s,除去多余的液体后快速落至液氮冷却的液态乙烷中;之后利用Titan Krios 300 kV电子显微镜和Gatan K2 Summit相机收集数据,放大倍数为1.8×104倍,对应的像素大小为1.634 Å;图像曝光时间6~8 s,总电子剂量≈50 e-/像素。用Motion Corr2矫正图像漂移。原始4K×4K图像经过2×2像素平均后产生2K×2K图像,对应的 像 素 大 小 为 3.268 Å,之 后 使 用 RELION[19]、cryoSPARC[20]等进行图像处理和三维重构,其中图像欠焦和像散用Gctf确定[21],二维及三维分类后,最终选取5 493个病毒颗粒进行取向优化和三维重构。
2 结果
2.1 纯化的IBDV对DF-1细胞的感染
为检测纯化的IBDV是否为完整的病毒颗粒并具有感染性,应用间接IFA方法检测经纯化的IBDV感染的DF-1细胞与抗IBDV VP5单抗的反应性。如图1所示,在感染纯化的IBDV的DF-1细胞上瞬间表达的VP5蛋白与抗VP5单抗发生了特异性反应。该结果表明,纯化的IBDV能够感染DF-1细胞并复制和繁殖。

图1 间接免疫荧光试验检测纯化的IBDV病毒的感染性Fig.1 Infectivity assay of purified IBDV on DF-1 cells detected with indirect immunofluorescent assay
2.2 IBDV冷冻电镜结果
将IBDV样品经冷冻制样后,利用FEI Titan Krios 300 kV低温场发射电子显微镜收集数据。从IBDV的冷冻图像(图2A)中,可以清晰地观察到病毒的外部形态,样品有2种不同状态的病毒颗粒:大多数病毒颗粒为包装dsRNA基因组的完整病毒颗粒,少数为不含dsRNA的空病毒颗粒(图2A箭头所示)。利用cryoSPARC和RELION软件对采集的IBDV冷冻电镜数据处理分析后获得了≈6.6 Å分辨率的IBDV三维结构(图2B~C)。三维结构显示,病毒颗粒直径≈70 nm,病毒衣壳由VP2三聚体构成,同时,VP2形成了五聚体及六聚体2种多聚体形式。IBDV衣壳形成三角形剖分函数T=13的二十面体结构,与以前报道的IBDV结构[14]一致,也与BÖTTCHER等[16]用冷冻电镜做过的分辨率≈20 Å的IBDV的衣壳结构一致。IBDV衣壳由260个VP2三聚体组成,其中20个VP2三聚体位于3次轴上,称为“I3三聚体”,4个VP2三聚体组成一个大的三角形,称为“G4三角形”。“G4三角形”与“I3三聚体”组成了一个非对称单元,其中“I3三聚体”连接3个“G4三角形”组成二十面体的一个平面。将获得的电镜结构与IBDV晶体结构[14]比较,发现两者的大部分蛋白二级结构吻合很好(图2D~F)。
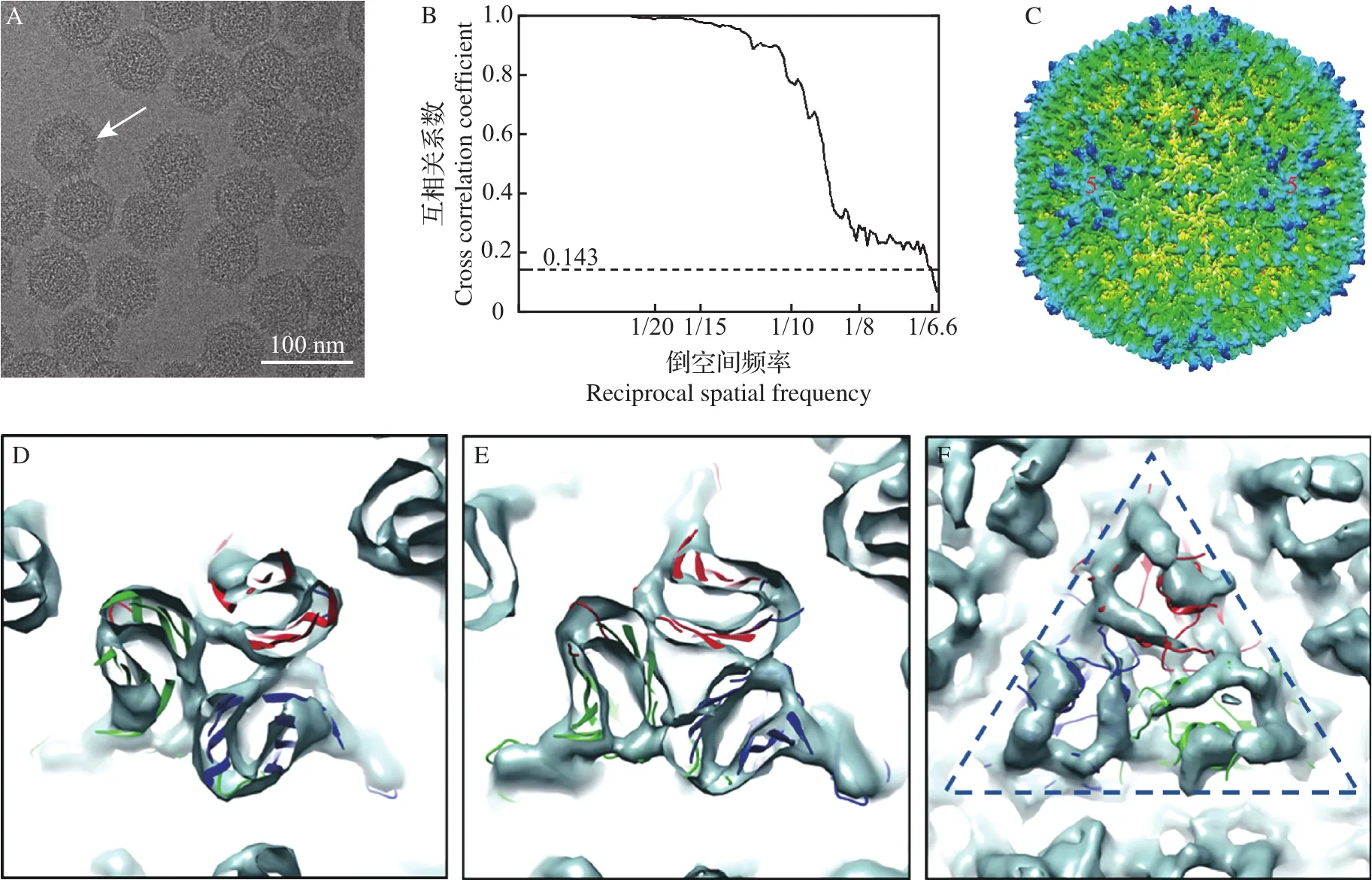
图2IBDV三维重构Fig.2 Three-dimensional reconstruction of IBDV by cryo-EM
2.3 IBDV与其他dsRNA病毒结构的比较
dsRNA病毒的三维结构已被广泛研究,包括衣壳和内部基因组结构。我们通过三维重构获得了生理状态下IBDV的三维结构,与其他已知dsRNA病毒结构如呼肠孤病毒科的胞质型多角体病毒(CPV)[12]、蓝舌病毒(BTV)[17]和轮状病毒(RV)[18]相比,在IBDV内部未观察到典型的≈20 Å的dsRNA特征密度,同时,在衣壳内表面的5次轴附近也没有观察到病毒RNA聚合酶的电子密度(图3A)。而作为对比,在其他3种dsRNA病毒结构内部都可以观察到明显的dsRNA及其聚合酶电子密度(图3B~D)。此外,IBDV的基因组密度也明显不同于其他dsRNA病毒。从表1可以看出:IBDV的衣壳内直径最大,约为54 nm,其他3种病毒为47~52 nm;IBDV基因组总长约为6.0 kbp,其他3种病毒分别为24.7、19.0和18.0 kbp;IBDV基因组密度约为0.072 bp/nm3,其他均约为0.3 bp/nm3,说明IBDV衣壳内基因组密度明显低于其他3个dsRNA病毒。这些差别暗示IBDV病毒在基因组包装、转录复制方面与其他dsRNA病毒不同。
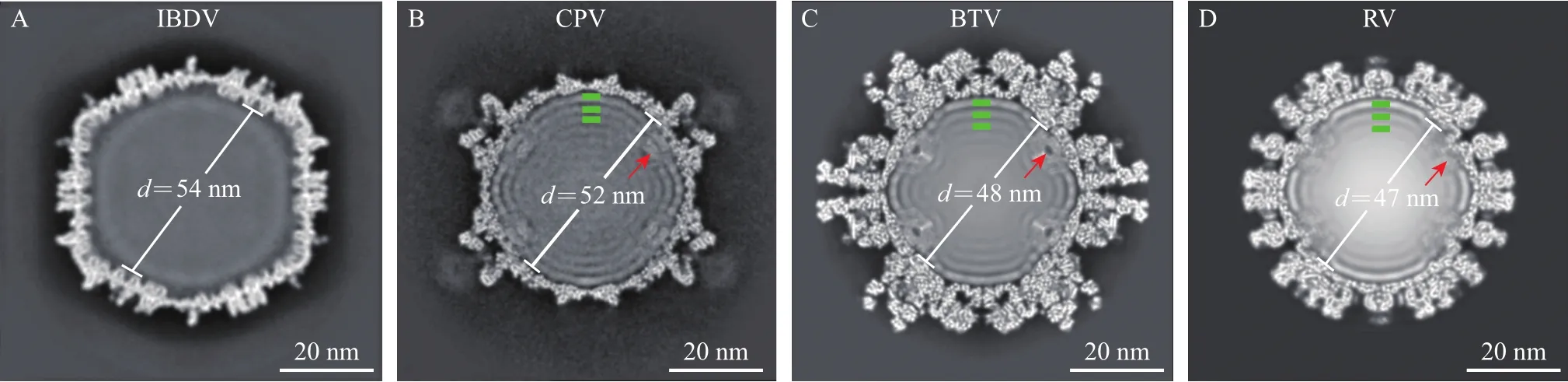
图3IBDV与其他dsRNA病毒内部结构对比Fig.3 Difference between IBDV and three other dsRNAviruses at their central sections
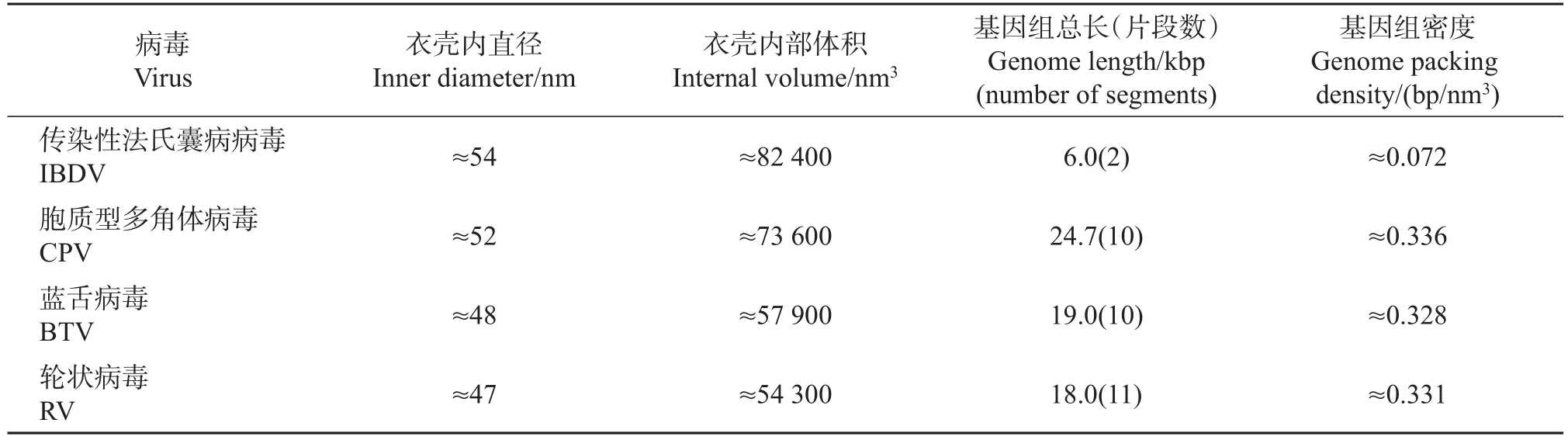
表1IBDV与其他dsRNA病毒的比较Table 1 Comparison between IBDV and three other dsRNAviruses
3 讨论
为了避免病毒dsRNA在细胞质中引起宿主细胞产生抗病毒反应,dsRNA病毒必须把其dsRNA基因组片段保护在其衣壳内部,同时,每个dsRNA片段均包装一个核酸转录酶,并且这个核酸转录酶固定结合在衣壳内表面的5次轴附近。在感染宿主细胞期间,每条dsRNA片段均在病毒衣壳内部高效地独立进行转录复制,互不干扰。如在CPV、BTV和RV病毒衣壳内部分别包装了10、10和11条dsRNA片段和对应的核酸转录酶。但dsRNA病毒基因组片段是如何包装在衣壳内部以保证不同的病毒dsRNA基因组片段的有序转录的,一直是未解之谜。
IBDV病毒基因组比较简单,只有2条不同的dsRNA片段,因此很适合用于解析dsRNA病毒基因组是如何包装的秘密。尽管目前对于IBDV结构的研究已有很多,例如BÖTTCHER等[16]也用冷冻电镜做过IBDV的结构研究,但分辨率仅约为20 Å,同时该研究也没有报道衣壳内部基因组的结构信息,因此,关于IBDV衣壳内部dsRNA的结构信息知之甚少。本研究利用冷冻电镜单颗粒技术,获得了在生理状态下IBDV约6.6 Å分辨率的三维结构。但与其他已知结构的dsRNA病毒相比,在IBDV内部并未观察到特征性的dsRNA电子密度和RNA聚合酶电子密度。该结果可能存在2种原因:一是IBDV衣壳破裂,导致病毒dsRNA和RNA聚合酶从衣壳内部释放出来;二是IBDV基因组dsRNA可能存在与其他dsRNA病毒基因组完全不同的组装方式。由于在数据处理过程中,我们选择的是完整的、内部含有dsRNA基因组的病毒颗粒进行三维重构,同时,我们用纯化的IBDV病毒对DF-1细胞进行感染实验的结果表明,纯化的IBDV能够感染DF-1细胞并复制繁殖,说明纯化的IBDV病毒基因组具有完整性。因此,在IBDV衣壳内部观测不到dsRNA的最可能原因为后者,即IBDV的dsRNA基因组采取了与其他dsRNA病毒基因组完全不同的包装方式。根据LUQUE等[13]的发现,在IBDV内部可包装多于1个基因组拷贝,且基因组拷贝数与病毒的毒力相关。通过与3个dsRNA病毒衣壳内部体积、包装基因组数目及基因组包装密度对比,发现IBDV衣壳内基因组密度明显低于其他3个dsRNA病毒,衣壳内部可包装多个基因组。总之,本结果表明,IBDV基因组采用了与其他dsRNA病毒基因组不同的组装方式,暗示IBDV的起源和进化与其他已知基因结构的dsRNA病毒不同。该结果也说明,使用单颗粒冷冻电镜方法不能解析出IBDV病毒内部的三维结构,需要使用冷冻电子断层三维重构的方法来进行IBDV基因组的结构研究。
致谢 文中的实验数据收集自浙江大学冷冻电镜中心,谨致谢意!

