甲壳素-明胶复合膜性能研究
杨斯乔,李海朝
(青海民族大学化学与化工学院,青海西宁810007)
明胶是一种线形多肽高分子,它是胶原蛋白部分水解的产物,包含有18 种不同的氨基酸和部分三股螺旋结构[1]。由于胶原的水解原有的三股螺旋结构遭到破坏[2],产生了氨基,羟基、羧基等官能团。这些基团的存在会产生极性作用或吸附异性电荷的相互作用,进而产生分子间的范德华力、静电吸引、和氢键,有利于分子的结合[1,3-4]。明胶中含有较多的亲水性氨基酸[5],因此吸水性很强,能达到自身重量的5 倍到10 倍。吸水后会发生膨胀。明胶凝胶具有加热融化、冷却胶凝的可逆性,称之为胶凝性。明胶凝胶熔点接近凝固点,且低于人体正常身体的生理温度[6],因此可做成可食用的食品包装膜,但纯明胶形成的膜质地比较脆、延展性差,存在着较多的缺点[7-9]。
甲壳素是一种可生物降解的天然高分子物质,广泛存在于甲壳动物的外壳、各类昆虫的表皮、软体动物的骨髓及真菌和藻类的细胞壁中[10-11],分子结构为2-乙酰氨基-2-脱氧-D-吡喃葡萄聚糖和2-氨基-2-脱氧-D-吡喃葡萄聚糖以β-1,4 糖苷键连接而成的二元线型聚合物[12],具有一定的抗病毒能力[13]。由于甲壳素具有较高的分子量和较强的分子间氢键作用,因而难在一般溶剂中溶解[10-15]。因此甲壳素分子容易聚集,且不溶于水和其他有机溶剂,但可以溶于强酸强碱。此外甲壳素中的刚性链是通过氢键作用和亲水性、疏水性相互作用平行排列的[15]。天然甲壳素具有高结晶度,存在有 α、β、γ3 种形式[16],β 晶型可以转化为 α 晶型[17-20]。由于甲壳素特有的性质,利用时均会对其进行处理将乙酰基脱去成为壳聚糖加以利用[21-22],还可以通过硫酸改性,在医学上起到抗肿瘤的作用[23]。
可食性膜通过分子间力的相互作用,形成的具有网格结构的膜,能够阻挡一部分的气体和水分的进入,并有一定的力学性能,有利于保持食品保鲜、延长食品在货架上摆放的时间等性能,因此可食性膜,已经成为食品保鲜与包装领域研究的热点[24]。由于明胶有较好的凝胶性、生物相容性、生物可降解性[25]、官能团有利于形成氢键、水溶性较好等特点,因此用来当作制备复合膜的基体,通过添加不同的增强相来改变其性能,如添加魔芋粉[26]、香豆素[27]等。
本文主要以共混的方法制备不同浓度甲壳素-明胶的复合膜,从膜的力学性能和热稳定性以及吸水性等方面进行检测,判断甲壳素作为增强相对基体明胶产生的改变。
1 材料和方法
1.1 材料和试剂
明胶(分析纯)、甲壳素(生物纯,98 %):阿拉丁试剂(上海)有限公司;甘油(分析纯):天津大茂化学试剂厂。
1.2 仪器与设备
IRPrestige21 热分析仪:日本岛津公司;RSY-R2热缩试验仪、XLW 智能电子拉力试验机:济南兰光机电技术有限公司;JCM-6000 BENCHTOP SEM 扫描电镜:日本电子株式会社;XH-50E 数字控温搅拌器:北京祥鹄科技发展有限公司;752N 紫外可见分光光度计:上海仪电分析仪器有限公司;NDJ-8 黏度计:上海方瑞仪器有限公司。
1.3 方法
1.3.1 制备复合膜
取 5 g 明胶加入 70 mL 超纯水,(20±1)℃下泡制30 min 让明胶充分吸收水分,用磁力搅拌器60 ℃,搅拌30 min 速度不宜太快,后加入甘油2 mL,在60 ℃下搅拌30 min,后加入不同质量的甲壳素共混继续搅拌,在60 ℃下搅拌60 min(浓度高时需要用超声波清洗器,除泡40 min),最后将溶液置于自制的聚氯乙烯(polyvinyl chloride,PVC)板上采用流延法制备复合膜,常温20 ℃条件下干燥不少于24 h,用手触摸膜表面并未有湿润感方可揭膜。
1.3.2 扫描电镜(scanning electron microscope,SEM)
用扫描电镜对膜的表面形貌和断面形貌的微观结构进行观察。
1.3.3 抗拉强度测试
按照GB/T 1040.3-2006《塑料拉伸性能的测试》,利用XLW 智能电子拉力试验机进行测试,试样宽度为30 mm,有效长度为100 mm,拉伸速度为200 mm/min,每组试样测试3 次,得到抗拉强度数值取平均值。按照下式进行计算:

式中:σ 为抗拉强度,单位面积上的力,MPa;F 为力值,N;b 为宽度,mm;d 为厚度,mm。
1.3.4 断裂伸长率测试
按照GB/T 1040.3-2006《塑料拉伸性能的测试》,利用XLW 智能电子拉力试验机进行测试,试样宽度为30 mm,有效长度为100 mm,拉伸速度为200 mm/min,每组试样测试3 次,得到断裂伸长率数值取平均值。按照下式进行计算:

式中:ε 为断裂伸长率,%;l1为夹头之间的距离,mm;l0为拉伸长度,mm。
1.3.5 热差式扫描量分析
利用热差式扫描量仪对甲壳素-明胶复合膜进行测试。对不同质量浓度甲壳素-明胶复合膜进行热差式扫描量分析,将样品剪成细小颗粒,称量5 mg~10 mg,设定温度范围为22.4 ℃至200 ℃,升温速率为 10 ℃/min,以Al2O3作空白对照。在以氮气为保护气体的环境中进行试验,记录结果,进行分析。
1.3.6 热缩性测试
按照GB/T 13519-2016《包装用聚乙烯热收缩薄膜》规范,利用RSY-R2 热缩试验仪进行测试,试样尺寸≦140 mm×140 mm,然后将试样放入仪器内进行加热,温度为120 ℃,时间为20 s,取出冷却后用直尺测量,每组试样测试3 次,得到热缩率数值,取平均值。热缩率按照下式进行计算:
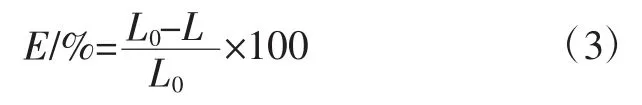
式中:E 为热缩率,%;L0为加热前试样标线长度,mm;L 为加热后试样标线长度,mm。
1.3.7 吸水率测试
将复合膜进行裁剪,规格为20 mm×20 mm,置于干燥箱直至膜表面干燥无水分,用分析天平进行称重,记为m0,然后将其放入蒸馏水中直至吸水完全,用滤纸吸去膜表面水分,称重,记为m1,直至恒重(质量变化在1%以内)。吸水率按照下式计算:

式中:Q 为吸水率,%;m0为干膜重量,g;m1为湿膜重量,g。
1.3.8 紫外可见透光率测试
膜的透光率用752N 型紫外分光光度计,裁剪样品尺寸为10 mm×50 mm,将膜样品贴在比色皿外侧,在400 nm~800 nm 下测试膜的透光率。以空气作为空白对照。
1.3.9 明胶溶液黏度测定
按照GB 6783-2013《食品安全国家标准食品添加剂明胶》规范,将质量比为0 %、0.5 %、1 %、5 %、10%、15%、20%甲壳素与明胶进行共混,混合后的溶液倒入试管中用勃氏黏度计测量其黏度,用0 号转子,在60 ℃下,12 r/min 下测得数据。
2 结果与分析
2.1 不同浓度甲壳素-明胶溶液黏度分析
运用黏度计对甲壳素-明胶溶液的黏度进行测定,结果见图1,甲壳素分子结构式见图2。
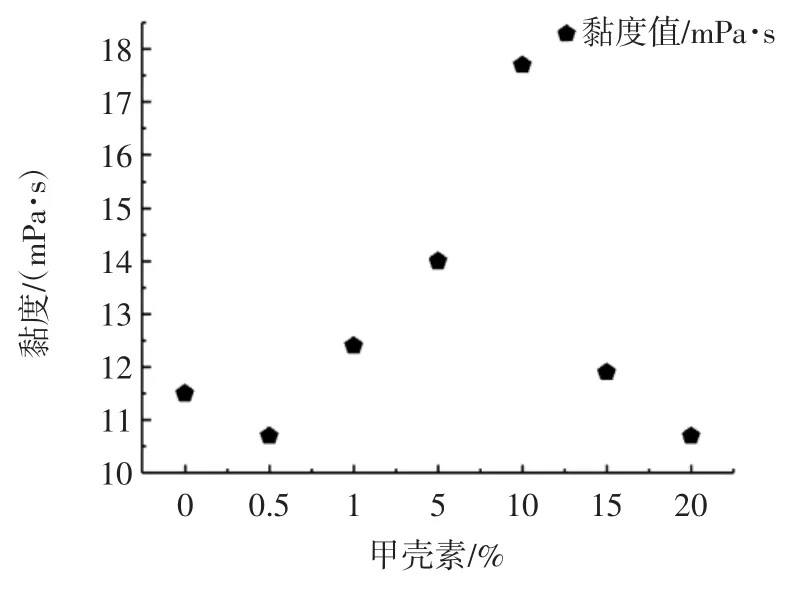
图1 不同含量的甲壳素-明胶溶液黏度变化Fig.1 Solution viscosity with different concentration chitin in gelatin
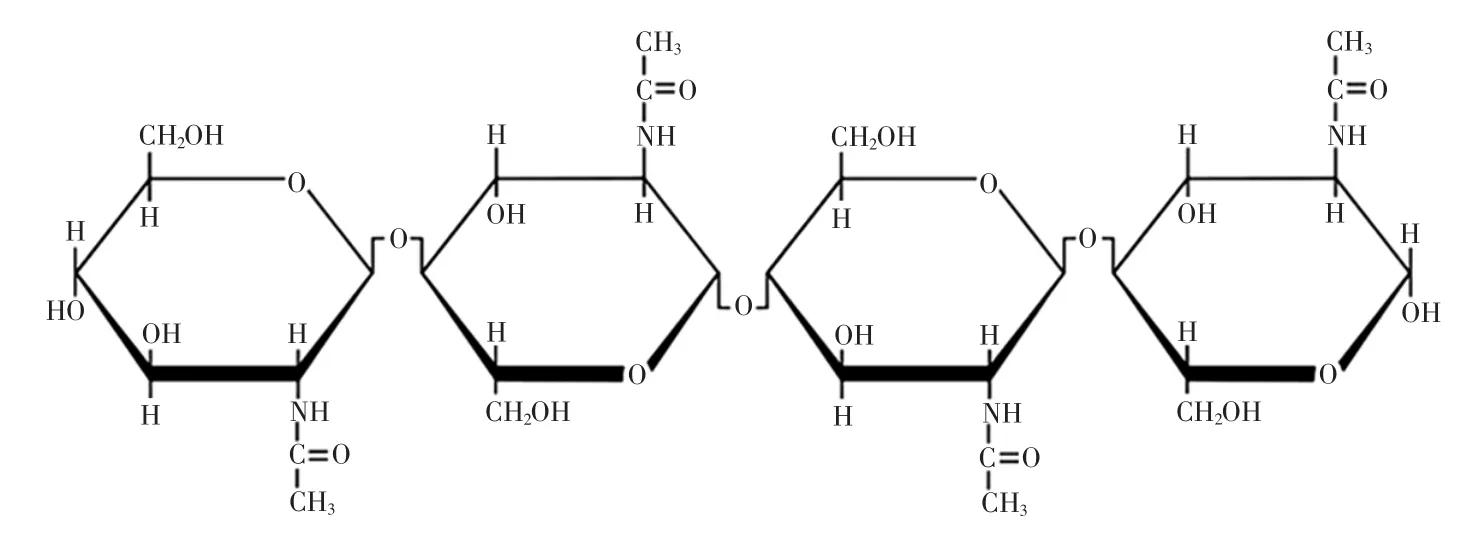
图2 甲壳素分子结构Fig.2 Chitin molecular structure
从图1 中可以看出不同浓度甲壳素黏度的变化,明胶的黏度是影响明胶的成膜性的主要因素,黏度的大小反映了明胶中多肽链的长短和其分子量的大小。明胶多肽链越短,则明胶的网状结构越容易形成,其黏度也就越小[28]。其中溶液中甲壳素含量10%时黏度最大为 17.7 mPa·s,其它各值相差不大均在 10 mPa·s~14 mPa·s 之间。从图1 中可以看出随着加入甲壳素的含量增加,其黏度值呈现出增长的趋势,表明甲壳素破坏了明胶原有的网状结构。由图2 可知,由于甲壳素分子量较大且含有羟基,容易和明胶中的氨基和羟基形成氢键,从而破坏明胶结构使其与甲壳素结合形成较大的分子链,导致其黏度增加。当甲壳含在溶液中含量超过10%(最大黏度值)后,随着甲壳素含量越来越高,明胶与甲壳素分子相互抢夺对方的基团成键,但由于转子转动时的剪切力,使得较大分子链,受到剪切力的影响,破裂变成小分子多肽,黏度降低。甲壳素在溶液中的含量为0.5%时,因为甲壳素的加入量少与明胶形成了分子链结合较好,形成了较为稳定的结构,所以0.5%时黏度最低,对比抗拉强度和断裂伸长率0.5%处的数据,得0.5%力学性能较好。
2.2 不同含量甲壳素-明胶复合膜宏观与微观分析
运用SEM 对甲壳素-明胶复合膜的微观结构进行测定,及复合膜的宏观形貌,结果见图3。

图3 不同含量的甲壳素-明胶复合膜的微观形貌Fig.3 SEM of composite membrane with different concentration chitin in gelatin
从图3 中可以看甲壳素含量为0%、1%和20%时复合膜的SEM 图像,及甲壳素-明胶复合膜的宏观形貌。空白样中甲壳素含量为0%,表面无杂质,基本比较平整;而甲壳素含量为1%时的复合膜有少量杂质的存在,但也比较平整;甲壳素含量为20%时的复合膜有较多的杂质,且不均匀的附着在表面,看出甲壳素含量越高和明胶的相容性越不好。
从宏观图中看出随着甲壳素含量的升高,膜的表面出现的颗粒度的越来越多,这是由于甲壳素是生物大分子其结构本身较为稳定可以与明胶形成氢键,但在明胶基本不溶,掺杂在明胶膜中变现为颗粒,又由于甲壳素的分子间和分子内的力,导致其本身容易聚在一起,所以图中甲壳素含量较高的膜看起来比较粗糙,杂质较多。
2.3 不同含量甲壳素-明胶复合膜抗拉强度分析
运用拉力试验机对甲壳素-明胶复合膜的力学性能进行测定,结果见图4。

图4 不同含量的甲壳素-明胶复合膜的抗拉强度Fig.4 Tensile strength of composite membrane with different concentration chitin in gelatin
从图4 中可以看出甲壳素含量不同时,复合膜的抗拉强度,呈现为波浪状的下降趋势。甲壳素是自然界中唯一带有正电荷的纤维素[29],而明胶中的羧基带有负电荷,所以正负结合会产生一定的结合力;明胶和甲壳素之间形成氢键也会产生一定的结合力。加入甲壳素后抗拉强度整体为12 MPa 到20 MPa 之间,均比空白样强,加入少量(0.5%)甲壳素时,明胶和甲壳素结合较好形成分子间氢键,从而起到了增强抗拉强度的作用;但随着甲壳素含量的过多增加,抗拉强度出现减小,这是由于甲壳素含量增加,明胶与甲壳素结合生成的分子链之间互相抢夺对方的分子成键,使得两者的结合变差,造成了抗拉强度的波浪状减小;含量为20%时又略有增加,这是由于甲壳素含量较多,并且其分子与分子之间容易聚集,聚集在一起分子间结合力较强产生了分子间的刚性[30],因此略有回升。得出0.5%甲壳素含量时复合膜抗拉强度较好,比空白样增强67.4%。
在日常的生活中,使用的膜抗拉强度必须大于3.5 MPa[31],对比所以数据均已超过3.5 MPa,并且甲壳素的加入让其更好。膜的力学性能的强弱与明胶分子间排列结构[32]和结晶结构产生的作用力有关[33],郭开红等[34]海藻酸钠对鲢鱼皮明胶的影响,其抗拉强度是39.62 MPa,加入海藻酸钠(20 %)其抗拉强度达到60 MPa 左右,随着继续添加开始减小。胡熠等[27]研究的香豆素对鱼鳞明胶影响,空白样时抗拉强度时10.58 MPa,加入 0.09(g/100 mL)香豆素时抗拉强度是11.69 MPa,随后随着香豆素的增加开始减小。与本次试验结果相差不大。
2.4 不同含量甲壳素-明胶复合膜断裂伸长率分析
运用拉力试验机对甲壳素-明胶复合膜的力学性能进行测定,结果见图5。
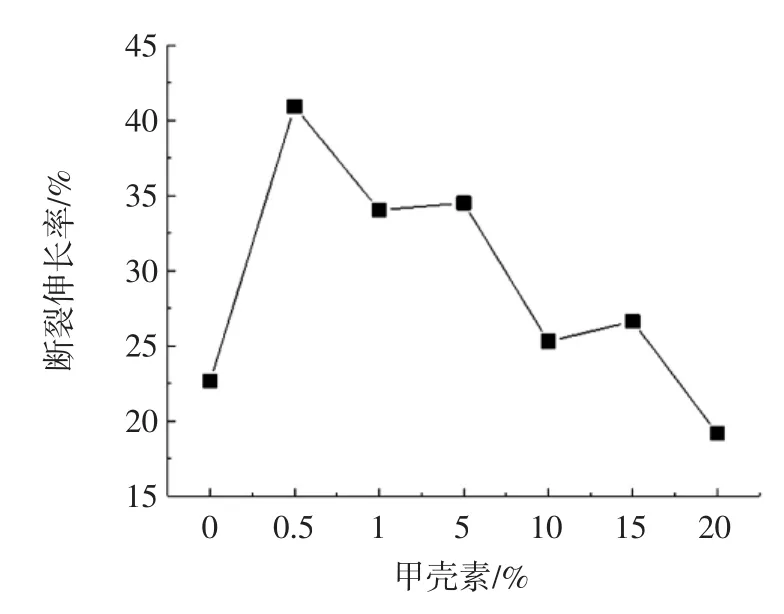
图5 不同含量的甲壳素-明胶复合膜中的断裂伸长率Fig.5 Elongation at break of composite membrane with different concentration chitin in gelatin
从图5 中可以看出甲壳素含量不同时,复合膜的断裂伸长率随着甲壳素加入呈现的是先增加后有起伏的减小趋势,空白样的断裂伸长率较低,在甲壳素含量较少(0.5%)时,断裂伸长率增大,主要是因为形成甲壳素的分子与明胶结构产生氢键,结合较好产生了较稳定的大分子链,但随着甲壳素含量的越来越高,甲壳素之间的分子力增强,容易聚集产生分子间的刚性,使得膜抗拉强度增加但弹性降低。得出0.5%甲壳素含量时,复合膜断裂伸长率最优,比空白样增强80.6%。
郭开红等[34]海藻酸钠对鲢鱼皮明胶的影响,空白样断裂伸长率是2.77%,加入钠溶液(20%)达到4%左右随着继续添加开始减小,与本次试验结果相差不大。
2.5 不同含量甲壳素-明胶复合膜热缩性能分析
运用热塑试验仪对甲壳素-明胶复合膜的热稳定性能进行测定,结果见图6。

图6 不同含量的甲壳素-明胶复合膜中热缩率Fig.6 Thermal shrinkage of composite membrane with different concentration chitin in gelatin
从图6 中可以看出甲壳素含量不同时,复合膜的热缩变化整体的趋势是略有起伏下降的趋势。热缩是在120 ℃环境下加热20 s,热缩性能可视作薄膜中的分子链受热发生解取向[35]。空白样的热缩率最差,受热后影响较大,随着甲壳素的加入,起到抑制复合膜热缩率比例的作用,由于甲壳素的晶体分子结构较为稳定,在此温度下受热较为稳定,掺杂在明胶的结构中在受热时,起到了一定的骨架支撑作用,所以甲壳素含量越多热缩率越小。查阅文献并未找到关于明胶热缩率变化的文献资料。得出加入甲壳素起到对热缩的抑制作用,含量越大抑制越大,空白样热缩为61.75%,20%甲壳素含量的复合膜的热缩为8.25%,减小了7倍。
2.6 不同含量甲壳素-明胶复合膜DSC 分析
运用热差式扫描对甲壳素-明胶复合膜的DSC 进行测定,结果见图7。
从图7 中可以看出甲壳素含量不同时,复合膜的吸热后的变化情况。含量为1%和0.5%基本所呈现的曲线几乎完全重合,DSC 曲线中的峰面积则代表着单位质量的样品发生相态转变所需要吸收或释放的热量,而对吸热反应而言,峰面积越大,相态转变越困难[36]。
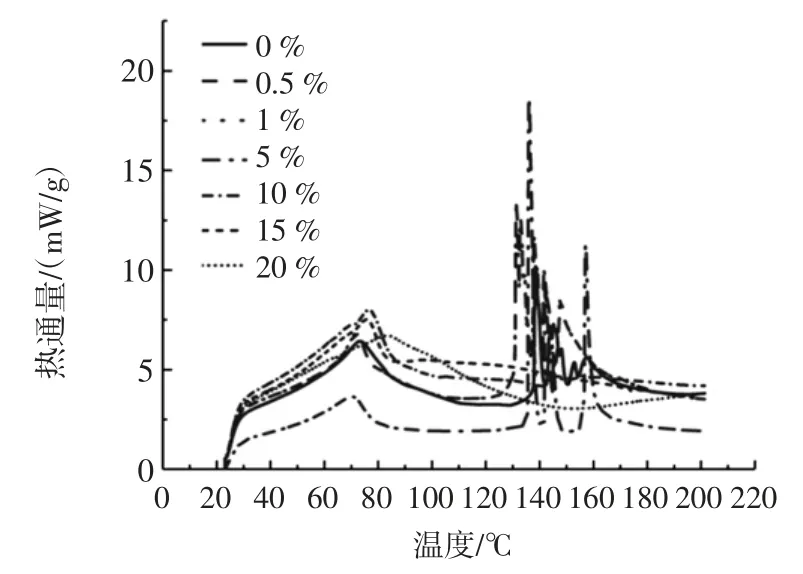
图7 不同含量的甲壳素-明胶复合膜的DSC 图像Fig.7 DSC of composite membrane with different concentration chitin in gelatin
从图中可以看出第一个峰出现时的温度差别不大(70 ℃~80 ℃),尤其是含量为0%、0.5%、1%和 5%时,DSC 曲线基本一致;甲壳含量为10%和15%时也基本一致;其次是甲壳素含量为20%时。由图7 可知含量为10%、15%、20%的热稳定性较好。对比空白样(0%)热稳定性得到改善,第一个峰为复合膜的熔融吸热峰,在这个峰是由于复合膜发生吸热融化,使得复合膜内的水分蒸发除去[37]。甲壳素含量为0%、0.5%、1%和5%时,出现高低不同的尖峰,其温度也较为集中在130 ℃~160 ℃,但含量为10 %~20 %,温度为130 ℃~160 ℃的未出现峰,表明甲壳素含量为0 %、0.5%、1%和5%时复合膜的热稳定性较差,明胶与甲壳素吸热后发生一些反应,出现的尖峰可能是由于分子中的作用力和分子间作用力在受热时发生了改变如明胶分子间的氢键、明胶和甲壳素之间的氢键等吸热现象引起的。从图中可以看出高甲壳素含量的甲壳素-明胶复合膜相态的转变比较困难,并且热稳定性较高,这主要是因为甲壳素在254 ℃开始热解并生成挥发性物质[38],因此甲壳素在20 ℃~220 ℃范围内不会发生热解,所以甲壳素含量越高相态转变就越困难,热稳定性就越高。
2.7 不同含量甲壳素-明胶复合膜吸水性分析
运用天平对甲壳素-明胶复合膜的吸水质量变化进行测定,结果见图8。
图8 不同含量的甲壳素-明胶复合膜的吸水率Fig.8 Water-absorbing of composite membrane with different concentration chitin in gelatin
甲壳素-明胶复合膜的吸水12 h 后图像,见图9。

图9 不同含量的甲壳素-明胶复合膜中吸水后的图像Fig.9 Water-absorbing of composite membrane with different concentration chitin in gelatin picture in the end
从图8 中可以看出,在同一环境下甲壳素含量不同时,复合膜的吸水能力各不相同,但基本的趋势为甲壳素含量越高吸水率越低。开始的1 h 内吸水能力都比较强,随着在水中浸泡的时间越来越长吸水性逐渐变弱,有些复合膜由于浸泡时间过长或发生溶解出现一些裂痕或破裂,甲壳素含量为1%和0%的复合膜在7 h 时还比较完整,但8 h 时破裂以无法将其取出称量,甲壳素含量5%的复合膜在9 h 时破裂无法取出称量。
明胶具有很好的吸水性,吸水后会膨胀变厚,且甲壳素具有较好的吸水保湿性[38],加入甲壳素后其吸水性受到了抑制,甲壳素含量高的膜变厚的程度降低,这是可能由于明胶和甲壳素结合形成氢键后,使的水进入明胶和甲壳素中的结合的减少,使其在水中比较稳定。从图8 中的纯明胶的吸水性最高,加入甲壳素后和明胶形成氢键,抑制了明胶原有的吸水性,在8 h 后吸水性基本趋于稳定,这于刘丹维等[36]研究的氧化甲壳素与明胶膜吸水性相符,随着时间越长吸水变慢,趋势变缓。得出甲壳素-明胶复合膜,在甲壳素含量为20%、15%和0.5%时对水的抑制较好,但只有含量为0.5%最后能保持完整。
2.8 不同含量甲壳素-明胶复合膜的透明度分析
运用紫外分光光度计对甲壳素-明胶复合膜的透光率变化进行测定,结果见图10。
从图10 中可以看出在甲壳素含量不同时,复合膜在400 nm~800 nm 范围内的透光情况。紫外光线会引起脂肪的氧化,可以通过判断复合膜是否对阻隔紫外线起到作用,从而保护复合膜中的食品[40],从图中可以看出甲壳素含量越高对紫外光线的阻挡越强,图3 中宏观的照片对比可以看出来甲壳素含量越高,颗粒的程度越大,其表面的粗糙程度越强,这是因为甲壳素与明胶的相互作用减少膜中有序排列的网络结构,增加对光的散射,使其影响膜的光阻隔性[41-42]。
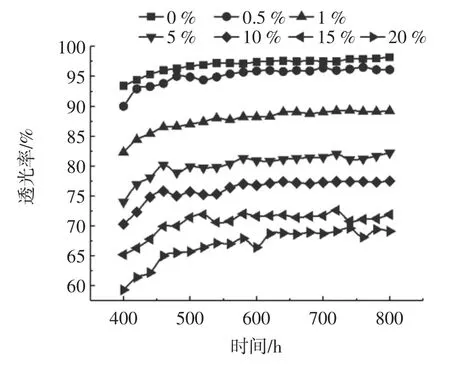
图10 不同含量甲壳素-明胶复合膜的紫外可见分光谱图Fig.10 UV-Vis spectra of composite membrane with different concentration chitin in gelatin
关于对紫外光线的透光情况无国家相关标准,但作为食品包装应该让顾客能够看清楚内部的物品,在阻隔紫外线的同时应该尽可能小的影响顾客观看包装内物品的品相,甲壳素含量为0%和0.5%的复合膜的透明度接近90%[43]。宋琳璐等[5]在明胶中添加桔子精油后、胡熠等[27]在明胶中添加香豆素后、刘永等[44]在明胶中添加黄秋葵多糖后,王竹等[45]在明胶中添加聚乙烯醇后,其复合膜的透光率随添加物的含量增加逐渐减小,其结果与甲壳素/明胶复合膜随着甲壳素含量的增加,透光率逐渐减小相符。
3 结论
对不同甲壳素含量的甲壳素-明胶复合膜进行各项测试,对比各项数据得出甲壳素含量为0.5%的复合膜在抗拉强度、断裂伸长率、黏度值、透光性方面占优,对水的抑制作用最优;甲壳素含量为20%的复合膜阻隔紫外线、黏度值、对水的抑制作用最好、DSC、热缩性方面占优,抗拉强度中等,断裂伸长率较差;相互对比得出0.5%甲壳素含量的复合膜,其各项性能均较好,作为研究食品包装材料时,可优先作为参考。

