海藻酸锌纳米凝胶超声雾化吸入安全性评价*
岳晓月,吴佳蓉,王艳秋,崔元璐
(天津中医药大学中医药研究院,天津 301617)
近年来,纳米药物制剂在基础研究和临床实践中展现出巨大的潜力。纳米凝胶作为一种新型的给药系统,一般是指直径在200 nm以下的水凝胶,其本体是一种三维网状聚合物水凝胶。由于其较大的比表面积更有利于携带药物富聚集于病灶,且能显著提高药物的生物利用度[1-2]。同时,纳米凝胶具有普通凝胶体系具有的稳定性、控释性,有利于降低药物的毒副作用[3-6]。此外,有研究表明纳米凝胶,特别是表面进行聚乙二醇(PEG)化修饰的的纳米凝胶,可减少其被体内免疫系统的吞噬细胞作为异物识别和吞噬,可以降低纳米凝胶体系的免疫原性、增强其载体的稳定性,进而延长药物于体内的滞留时间,具有长循环效果,是药物输送的理想载体[7]。雾化吸入是目前治疗慢性阻塞性肺病、哮喘等呼吸系统疾病的常用给药途径,具有用药剂量小、操作简便、起效快、有效避免肝脏首过效应和不良反应少等优势[8]。海藻酸钠在水溶液中易与二价金属阳离子交联形成凝胶,且具有良好的生物相容性[9-11]。
本研究结合海藻酸钠的结构特点,以氯化锌作为交联剂,采用反相微乳法制备海藻酸锌纳米凝胶(ALG-NPs),后期将作为药物的输送载体,本着严谨的科研态度,有必要对其超声雾化吸入的安全性和可行性进行初步探讨。
1 实验材料
1.1 实验动物 实验动物为健康SPF级BALB/c小鼠,体质量16~18 g,雌雄各半,购于北京维通利华动物实验中心[动物合格证编号:SCXK(京)2016-0006]。实验动物于天津中医药大学实验动物中心饲养,保持自由饮水和进食,环境温度为(24±1)℃,湿度为55%±5%,适应性喂养7 d后进行实验,每只动物仅使用1次。动物实验遵循美国国立卫生研究院(NIH)指导原则和天津中医药大学的伦理委员会规定。
1.2 实验药品与试剂 海藻酸钠(细胞培养级)购自Sigma-Aldrich公司。液体石蜡(分析纯)购自天津市风船化学试剂科技有限公司。司盘(Span)80和吐温(Tween)80购自Sigma-Aldrich公司。氯化锌(分析纯)购自天津北方天医化学试剂厂。溴化钾(光谱纯)购自天津市科密欧化学试剂有限公司。白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)酶联免疫吸附(ELISA)试剂盒购自eBioscience公司。BCA蛋白浓度检测试剂盒购自Thermo公司。
1.3 实验仪器 万分之一精密分析天平,AL204,Mettler-Toledo仪器(上海)有限公司。顶置式电子搅拌器,EURO-STPCV S25,IKA公司。加热型磁力搅拌器,RCT basic,IKA 公司。精密蠕动泵,BT100-2J,保定兰格恒流泵有限公司。冷冻干燥机,FDU-2100,EYELA公司。激光粒径测定仪,Zetasizer Nano-Zs,Malvern公司。透射电子显微镜,H-7650,Hitachi公司。差示扫描量热仪,Jade,Perkin Elemer公司。傅立叶变换红外光谱仪,Thermo公司。超声雾化器,402AI,江苏鱼跃医疗器械股份有限公司。荧光显微镜,DM 4000 B,Leica仪器公司。多功能读板机,Infinite M200,TECAN公司。动物装置:自制不完全封闭有机玻璃箱,20 cm×13 cm×15 cm,箱体两端一端为通气孔,另一端接超声雾化器。
2 实验方法
2.1 ALG-NPs的制备 将多功能真空搅拌器与顶置式搅拌机连接固定,于500 mL三颈瓶中分别加入150 mL液体石蜡、1.05 mL Span 80和 0.45 mL Tween 80,于40℃水浴,500 r/min条件下充分分散30 min作为油相。将搅拌转速调至1 000 r/min,使用蠕动泵将45 mL浓度为0.5%(W/V)海藻酸钠溶液缓慢滴入油相中,控制流速0.75 mL/min,滴加完毕后持续搅拌1 h,使水相与油相充分混匀。使用蠕动泵加入固化剂15 mL(含有0.1%氯化锌的60%乙醇溶液),控制流速0.15 mL/min,搅拌转速为1 000 r/min,滴加完毕后继续搅拌1 h。最后,将圆底烧瓶中液体转移至50 mL离心管中,称质量,3 800 r/min离心10 min,分离水相得到ALG-NPs,液氮速冻并冷冻干燥保存,备用[12]。
2.2 ALG-NPs表征分析
2.2.1 粒径及Zeta电位测试 将制得的ALG-NPs溶液稀释10倍,采用纳米粒度仪测定纳米凝胶的粒径及分布和表面Zeta电位,室温下重复测定3次,结果取平均值。
2.2.2 透射电子显微镜(TEM)分析 取少量ALGNPs,重悬于超纯水中,将悬液滴至铺有碳膜的铜网上,室温晾干,在TEM下观察纳米凝胶的形貌(样品未经任何染色)。
2.2.3 傅立叶变换红外光谱(FT-IR)分析 将干燥的海藻酸钠和ALG-NPs分别与KBr混合压片,以空白KBr片作为对照,在傅里叶变换红外光谱仪上对样品的红外光谱进行测定,设定波数范围为4 000~400 cm-1。
2.2.4 差示扫描量热(DSC)分析 称取干燥的海藻酸钠和ALG-NPs 6~8 mg分别置于密闭铝盘中,以空白铝盘作为对照,在恒定氮气流下(20 mL/min),调节升温速度为10℃/min,升温范围为30~350℃,记录各样品的DSC测定曲线。
2.3 实验分组及给药 BALB/c小鼠,体质量16~18 g,雌雄各半,共48只,随机分为4组,分别为空白对照组(Control)、ALG-NPs低(100 mg/kg)、中(150 mg/kg)、高(200 mg/kg)剂量组。每组按取材时间分为7 d、14 d,2个亚组,每个亚组6只。
将各组实验动物分别放入20 cm×13 cm×15 cm不完全封闭的有机玻璃箱,空白对照组雾化吸入等体积的注射生理盐水,各给药组雾化吸入不同浓度的ALG-NPs,20 min/次,每天连续进行雾化吸入给药。各组小鼠每次雾化吸入后1 h均进行一般情况观察。
2.4 总体外观及行为学评价 每次ALG-NPs超声雾化吸入前及给药后1 h观察小鼠口、鼻部内外的可视范围内有无流血、红肿、溃疡等现象,同时观察ALG-NPs超声雾化吸入后1 h小鼠全身状况及局部刺激症状(如有无咳嗽、哮喘、窒息、呕吐等症状)。
2.5 血清采集及肺组织取材 各组分别于7、14 d末次雾化吸入后1 h取6只小鼠留取生化及肺组织标本。采用摘眼球取血并收集于离心管中,然后于37℃水浴静置30 min后,3 000 r/min,离心15 min,收集上部血清,弃沉淀,-20℃保存用于相关细胞因子的检测。打开胸腔,完整取出小鼠肺部组织并修剪,去除周围组织及气管,滤纸吸去残留血渍,称取肺组织湿质量,计算肺系数:全肺湿质量(g)/体质量(g)×100%。肉眼观察肺脏大小、颜色及表面病变等。即刻取右肺上叶及同部位气管、支气管约0.5 cm小段,放入4%的中性福尔马林中固定,脱水、石蜡包埋、连续切片,厚 4 μm,苏木精-伊红(HE)染色,光镜下进行小鼠肺组织和气管组织病理观察。
2.6 血清及肺组织中IL-6、TNF-α含量测定 按照eBioscience公司IL-6和TNF-α ELISA试剂盒说明书操作,测定血清及肺组织中IL-6和TNF-α的浓度。
2.7 统计学分析 采用Origin Pro 8.0软件进行数据统计分析并做图,实验数据以均数±标准误(Means±SE)表示,组间比较使用单因素方差(One-Way ANOVA)分析,P<0.05为差异有统计学意义。
3 实验结果
3.1 ALG-NPs粒径及Zeta电位 纳米粒的粒径大小及分布是影响粒子分散体系物理稳定性的重要因素,粒径分布通常以多分散性系数(PDI)评价,一般认为PDI<0.3时,表明该纳米粒的粒径分布均匀,大小均一[13]。ALG-NPs所测定的平均粒径为(71.24±2.12)nm,PDI为 0.143±0.04,提示其粒径分布较窄,符合纳米制剂的一般要求。
纳米粒电位测定是纳米粒表面荷电性质与荷电大小的标志,是影响纳米制剂分散性的重要参数,它不仅影响该类制剂的物理稳定性,而且往往影响载药纳米粒的体内分布与体内药物动力学[14]。带负电荷的纳米粒进入体内后可防止纳米粒在血液中凝聚,避免非特异性清除,具有一定的长循环效果。实验中制备的ALG-NPs所测定的平均Zeta电位为(-19.4±0.64)mV,提示其不易发生聚集,带负电荷,可减少与血浆蛋白的结合,提高ALG-NPs在血液中的循环时间。
3.2 ALG-NPs外观及微观结构与形貌 ALGNPs为半透明略带乳光液体,肉眼观察未见不溶性成分或絮凝样聚集物。
ALG-NPs的透射电镜照片如图1所示,可见ALG-NPs形态圆整呈类球形,无粘连,表面光滑,电镜测定的粒径与激光粒径测定仪所测得的结果一致。

图1 ALG-NPs透射电镜照片Fig.1 The TEM microphotographs of ALG-NPs
3.3 FT-IR分析结果 样品的红外光谱谱图如图2所示。海藻酸钠含有大量的羟基,羟基是强极性基团,易与供电子基团(如氨基、羟基、羰基等)形成氢键。随着氢键缔合程度的加强,O-H伸缩振动频率大幅度降低,谱带加宽,强度增加。海藻酸钠分子结构中,羟基主要形成了多缔合体,从而在3 426 cm-1处形成了强而宽的υ(O-H)吸收峰,在1 033 cm-1处为羟基的C-O伸缩振动吸收峰,1 608 cm-1和1 413 cm-1处分别为羧酸根负离子的伸缩振动(υcoo-)和不对称伸缩振动(υascoo-)[15]。ALG-NPs在 3 421 cm-1处为O-H伸缩振动吸收峰υ(O-H),与海藻酸钠O-H伸缩振动吸收峰υ(O-H)相比,其向低波数区移动,分析可能是由于替代钠离子形成ALG-NPs后,海藻酸结构单元与二价锌离子形成配位结构,降低了O-H的键能和氢键的缔合程度;2 925 cm-1、2 855 cm-1处为-CH2亚甲基的不对称伸缩振动峰(υasC-H)和对称伸缩振动峰(υC-H);与海藻酸钠分子中羧基特征峰(1 413 cm-1)相比,ALG-NPs中其吸收峰(1 457 cm-1)发生了红移,分析其可能是由于二价锌离子与海藻酸分子中羧基相互作用的结果。

图 2 ALG-NPs(a)、海藻酸钠(b)的傅里叶变换红外光谱图Fig.2 FT-IR transmission of ALG-NPs(a)and sodium alginate(b)
3.4 DSC分析结果 样品的差示扫描量热图如图3所示。海藻酸钠在120℃附近出现了较宽的吸热峰,此为海藻酸钠内部结合水的失去,在245℃附近有一个尖锐的放热峰,对应着海藻酸钠的热分解[16]。在ALG-NPs谱图中,海藻酸钠在245℃处的放热峰移至250℃附近且其强度明显减弱,这可能是由于海藻酸分子与二价锌离子交联形成ALG-NPs,使分子热稳定性提高。
3.5 小鼠一般状态观察结果 各组小鼠均较活泼,毛发光洁,呼吸平稳,反应敏捷,未出现呼吸急促、精神不振和反应迟钝等现象,且均未出现激惹、饮食饮水减少以及便溏等表现。给药前及给药后1 h各组小鼠口、鼻部外的可视范围内均未出现红肿、流血、异常分泌物、溃疡等现象。与空白对照组比较,ALG-NPs各剂量组小鼠体质量未见明显异常。
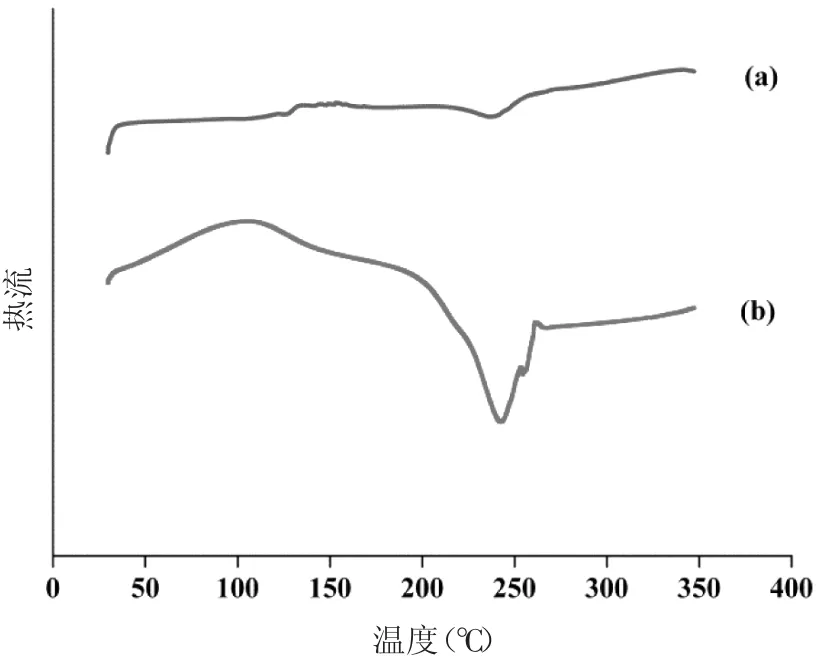
图 3 ALG-NPs(a)、海藻酸钠(b)的差示扫描量热图Fig.3 DSC thermograms of ALG-NPs(a)and sodium alginate(b)
3.6 小鼠肺组织病理解剖观察结果 如图4所示,ALG-NPs经超声雾化吸入7 d后,各组小鼠双肺外观形态无明显差异,均呈淡粉色,表面光滑,触之柔软,弹性好。与给药7 d后的各组小鼠肺组织相比,ALG-NPs经超声雾化吸入14 d的各组小鼠双肺稍皱缩,弹性尚可,但ALG-NPs高剂量组双肺部分区域呈暗红色,有炎症发生。
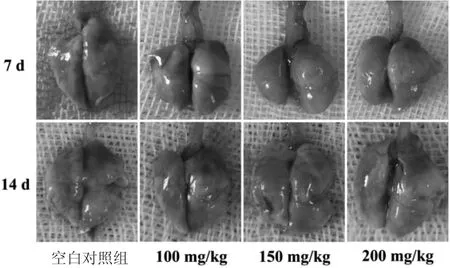
图4 小鼠肺组织病理解剖照片Fig.4 Pathological anatomic photographs of lung tissue in mice
3.7 肺组织及气管显微病理学观察结果 如图5所示,空白对照组小鼠终末支气管及细支气管管腔光滑,上皮完整,肺泡结构清晰,肺泡壁薄且肺泡间隔正常,管壁及肺泡壁无炎性细胞浸润或明显渗出性改变。ALG-NPs经超声雾化吸入7 d后,ALGNPs组小鼠肺组织病理学特征与空白对照组基本一致,未见明显异常改变。ALG-NPs经超声雾化吸入14 d后,ALG-NPs高剂量组肺泡腔及间质偶有炎性细胞浸润,但肺泡结构正常。ALG-NPs低剂量及中剂量组小鼠肺组织病理学特征与空白对照组基本一致。
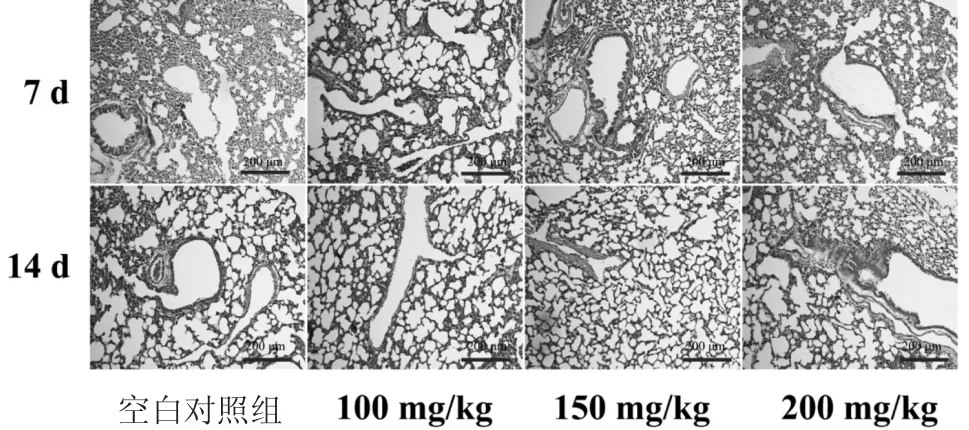
图5 小鼠肺组织显微病理照片(×200,标尺:200 μm)Fig.5 Micropathological photos of the lung tissue in mice(×200,scale bar:200 μm)
如图6所示,空白对照组小鼠气管病理切片显微照片可见气管黏膜清楚分为黏膜层、黏膜下层和外膜层,管腔呈圆形,且未见内陷、闭塞、狭窄、异常增生物或分泌物等。黏膜层由纤毛细胞和杯状细胞组成的纤毛上皮完整覆盖于气管内表面,且未见脱落、缺失等病变。上皮细胞结构完整,黏膜及黏膜下层未见出血、炎性细胞浸润。气管环正常,且未见断裂、缺损等病变,外膜完整。ALG-NPs经超声雾化吸入7 d或14 d后,ALG-NPs各剂量组小鼠气管病理切片显微照片与对正常照组小鼠基本一致,未见明显异常改变。

图6 小鼠气管显微病理照片(×200,标尺:200 μm)Fig.6 Micropathological photos of the trachea in mice(×200,scale bar:200 μm)
3.8 肺系数 急性肺损伤重要的病理标志为肺微血管通透性增加,当肺内液体渗出和吸收的平衡遭到破坏时,常表现为富含炎性介质的液体渗入组织间隙,从而引起肺水肿[17]。肺系数可反映肺水肿、肺纤维化以及肺部感染等情况。因此,测定各组小鼠肺系数考察研究超声雾化吸入ALG-NPs对小鼠肺组织的影响。肺系数结果如图7所示,ALG-NPs经超声雾化吸入7 d或14 d后,与空白对照组相比较,ALG-NPs各剂量组小鼠肺系数差异均无统计学意义(P>0.05),提示在本实验中超声雾化吸入ALG-NPs对小鼠肺组织损伤较小。
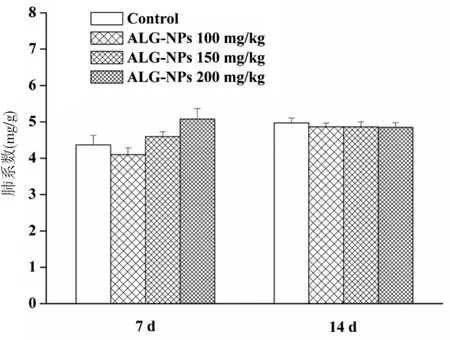
图7 各组小鼠肺系数(n=6)Fig.7 Lung index in each group(n=6)
3.9 血清及肺组织中IL-6、TNF-α含量测定 如图8所示,ALG-NPs经超声雾化吸入7 d后,与空白对照组比较,ALG-NPs各剂量组血清及肺组织匀浆中IL-6水平差异无统计学意义(P>0.05)。ALGNPs经超声雾化吸入14 d后,与空白对照组比较,ALG-NPs高剂量组血清及肺组织匀浆中IL-6水平显著升高(P<0.05 或 P<0.01),提示有炎症发生,与肺组织病理解剖观察结果一致。ALG-NPs低及中剂量组血清及肺组织匀浆中IL-6水平差异无统计学意义(P>0.05)。如图9所示,ALG-NPs经超声雾化吸入7 d或14 d后,与空白对照组比较,ALG-NPs各剂量组血清及肺组织匀浆中TNF-α水平差异均无统计学意义(P>0.05)。
4 讨论
纳米凝胶作为一种新型的给药系统,能借助纳米粒的特殊性质显著提高难溶性药物的溶解度和稳定性,并具有缓释和靶向的特点,是靶向给药的理想载体[18]。海藻酸钠是由直链键合的β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)组成的无规嵌段共聚物,是一种低毒、可生物降解、生物相容性好的常用制药辅料。其中,在药物/蛋白质输送载体的研究中,海藻酸钙凝胶珠或微球已经得到了较高的关注[19-20]。本研究构建了ALG-NPs,以期作为药物的缓释载体通过超声雾化吸入靶向输送至肺,为治疗呼吸系统疾病提供参考。
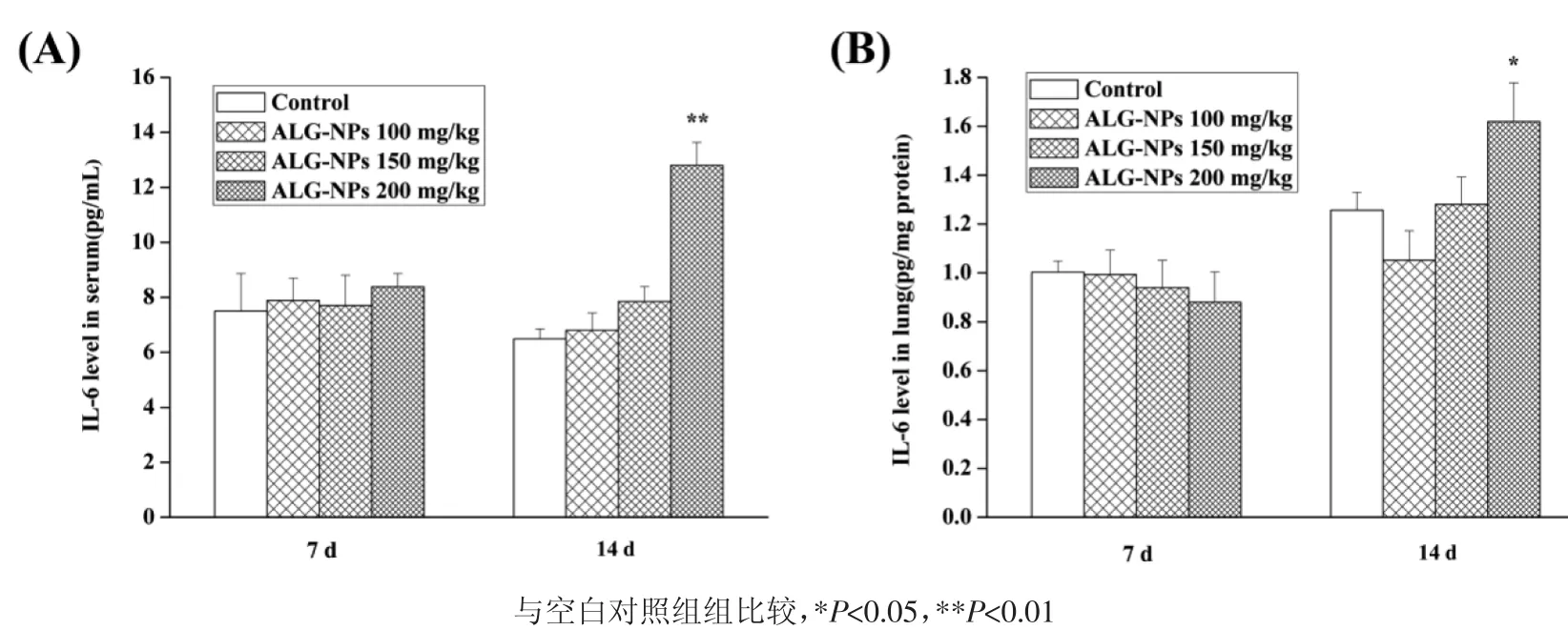
图8 ALG-NPs对小鼠血清(A)及肺组织(B)中IL-6水平的影响(n=6)Fig.8 Effects of ALG-NPs on IL-6 levels in the serum and the lung tissue of mice(n=6)
图9 ALG-NPs对小鼠血清(A)及肺组织(B)中TNF-α水平的影响(n=6)Fig.9 Effects of ALG-NPs on TNF-α levels in the serum and the lung tissue of mice(n=6)
超声雾化吸入是利用超声波产生的能量,使药液于气相中分散,形成直径<5 μm的雾滴,随着自主呼吸使药物直接作用于咽喉、气管、支气管及肺泡等部位[21]。由于肺部具有特有的生理解剖特点,如肺泡表面积巨大(大约100 m2)、毛细血管网丰富、肺泡上皮细胞膜较薄、气血通路狭小等[22],与其他给药途径相比,雾化吸入具有局部药物浓度高、起效迅速、操作简便及不良反应少等优势,符合临床给药需求,提高了患者的顺应性,利于临床的普及与推广[8]。
药物超声雾化吸入对机体的不良反应通常是对呼吸道和肺部的刺激,TNF-α是炎症及应激反应过程中最早出现且最重要的炎性介质之一,同时也是急性肺损伤发病的启动因子,多种原因导致的机体炎症反应及应激状态均会伴随TNF-α的生成和释放[23]。当炎症及应激反应等原因刺激机体时,TNF-α可启动炎症反应,介导单核巨噬细胞、淋巴细胞刺激机体生成和分泌IL-6[24],在血清和局部组织中会出现高表达,IL-6作为重要的炎性介质,与组织的损伤程度成正相关[25]。机体长期(14 d)超声雾化吸入大剂量外源性药物ALG-NPs后,会引起机体血清及局部肺组织匀浆中IL-6水平增高,ALG-NPs高剂量组较为显著,ALG-NPs低、中剂量雾化时对机体刺激性不大。当机体随着刺激频次的增加,机体耐受程度逐渐提高,机体对TNF-α的免疫应答水平逐渐降低,这与文献报道的结果相一致[26]。
以上结果提示,ALG-NPs经超声雾化吸入后,对小鼠肺组织及气道无明显损伤即局部刺激性较小,且于安全剂量范围内(≤150 mg/kg)无任何炎症反应,对于纳米凝胶制剂的基础研究和临床推广具有一定的参考价值。

