有氧运动对肥胖小鼠胃组织Ghrelin和下丘脑GHSR-1a表达的影响
付鹏宇 龚丽景 朱镕鑫,2 魏昊 李松波 胡扬
1 北京体育大学(北京100084)
2 上海体育科学研究所
随着人们饮食结构(高脂饮食)和生活方式(静坐少动)的改变,肥胖发生率逐渐升高[1]。作为多种慢性疾病和代谢综合征的主要危险因素,肥胖及其相关疾病严重威胁着人类的健康[2]。“管住嘴,迈开腿”是目前公认控制肥胖的有效手段,同时也提示我们从消化系统和运动系统入手研究抑制肥胖的生物学机制。
胃促生长素/胃饥饿素(Ghrelin)由主要消化器官胃分泌,具有调节食欲、摄食行为和糖脂代谢的作用,参与多种代谢相关疾病的发生发展过程[3]。Ghrelin 在Ghrelin-O 乙酰基转移酶(Ghrelin O-acyltransferase,Goat)的作用下,变成有功能活性的酰基化Ghrelin,从而与其受体——生长激素促分泌素受体(Growth hormone secretagogue receptor,GHSR)结合,发生生物学效应[4]。GHSR 是一种G 蛋白偶联受体,不同物种间具有强同源性,主要分布于下丘脑,具有两种天然形式(GHSR-1a和GHSR-1b),其中GHSR-1a为7次跨膜的功能受体[5]。Ghrelin-GHSR通路结合Gq蛋白激活磷脂酶C 信号通路,活化蛋白激酶C(protein kinase C,PKC),然后从细胞间释放Ca2+并产生二酰基甘油,激活cAMP/cAMP 反应元件结合蛋白通路[6]。Ghrelin-GHSR通路可激活腺苷5’-单磷酸激活蛋白激酶(Adenosine 5’-monophosphate (AMP)-activated protein kinase,AMPK)以降低细胞内长链脂肪酸水平,在调节食欲和能量消耗方面发挥着重要作用,因此被认为是一种潜在的抗肥胖治疗靶点[7]。
有氧运动作为预防和治疗肥胖的有效手段,如何发挥与消化系统“对话”的作用尚不明确。Ghrelin-GHSR 通路作为沟通消化系统-下丘脑的桥梁,在肥胖机体中具有充当能量代谢“传感器”的重要作用[8]。但尚无运动对该通路影响的研究,且有氧运动对肥胖机体胃组织中Ghrelin 水平的影响也存在争议[3,9-11]。因此,本研究对高脂膳食诱导肥胖小鼠模型施加有氧运动干预,通过检测胃组织Ghrelin、Goat 和下丘脑GHSR-1a 表达水平,结合体重、摄食量和血脂血糖水平,探讨有氧运动通过影响消化系统-下丘脑改善肥胖的可能机制。
1 材料与方法
1.1 实验动物分组及取材
离乳雄性C57BL/6J 小鼠40 只,初始体重为8.3 ±0.2 g(购自北京维通利华实验动物技术有限公司,许可号:SCXK(京)2015-0004,随机分为:普通膳食对照组(NC组,n=8),喂以普通维持饲料;高脂膳食组(HD组,n=32),喂以高脂饲料(Research Diet,D12109C;含脂量40% kcal)。饲喂8周后,将HD组中体重大于NC组平均体重20%的小鼠作为动物肥胖模型,其它体重未达标的动物弃去。建模成功的小鼠随机分为:高脂对照组(HC 组,n=8)和高脂运动组(HE 组,n=8)。HE 组进行4 周,速度12 m/min,1 h/次/天,6 次/周的跑台训练。各组小鼠均自由饮食饮水。每周记录体重和摄食量。在北京体育大学动物实验室完成饲养与训练(温度22℃± 2℃,湿度50%~70%,许可号:SYXK(京)2016-0033。
训练4 周后,禁食12 h(HE 组在最后一次运动24 h后)取材,腹腔注射1%的戊巴比妥钠(40 mg/kg体重)进行麻醉,心脏取血,4000 rpm 离心10 min,收集血清,-20℃保存。取下丘脑和胃底部组织,各组织分成两份,一份放置于RNA保存液,另一份于-80℃保存。
1.2 全自动生化分析仪测试血清TG、CHO和GLU水平
血清甘油三酯(triglyceride,TG)、总胆固醇(cholesterol,CHO)和血糖(glucose,GLU)水平的测试采用全自动生化分析仪(日立7020)(中生北控试剂盒:TG-0220、CHO-0180、GLU-0230)。
1.3 ELISA测试血清总Ghrelin水平
酶联免疫吸附法(ELISA)测试血清总Ghrelin 水平(EZRGRT-91K,Millipore)。
1.4 RT-PCR 测定胃组织Ghrelin、Goat 和下丘脑GHSR-1amRNA相对含量
提取胃和下丘脑总RNA(TaKaRa9767),检测总RNA 浓度(NanoDrop 超微量分光光度仪),逆转录获取cDNA(TaKaRa RR036A)后进行RT-PCR 扩增片段(TaKaRa RR820A),反应条件为95℃变性3 min,循环扩增95℃ 3s→60℃ 20s(循环40 次)。使用Premier 5.0软件设计引物,再由生工生物工程(上海)有限公司合成。Ghrelin上游引物5’-AAAGGAATCCAAGAAGCCACC-3’,下引物5’-GCCTCTTCTGCTTGTCCTCTGT-3’;Goat 上引物GACCCTGGAAACTACCCACA,下引物AGGCAGAGAAGGCAAATGTC;GHSR-1a 上引物5’-TTCGCCATCTGCTTCCCTC-3’,下引物5’-TCTCCGCCACAGCTTCCTC-3’;18S 为内参基因(德国QIAGEN QT01036875),上引物5’-ACACGGACAGGATTGACAGA-3’,下引物5’-GGACATCTAAGGGCATCACAG-3’。采用比较阈值法(△△Ct法)对目的基因的相对表达进行分析。
1.5 WB法测定胃组织Ghrelin、Goat和下丘脑GHSR-1a相对蛋白表达量
RIPA 裂解液提取下丘脑和胃组织总蛋白质,BCA法定量总蛋白质浓度,用蛋白印迹法(Western blotting,WB)检测各蛋白的表达情况。使用预制胶(BoltTM4-12% Bis-Tris Plus Gels,15-well,NW04125,Invitrogen)进行凝胶电泳,转膜硝酸纤维素(Nitrocellulose,NC)膜,3%的牛血清白蛋白(BSA)封闭1h,4°C 分别孵育Anti-Ghrelin(Abcam ab129383)、Anti-Goat(Abcam ab170690)、Anti-GHSR-1a(Abcam ab95250)、内参Tubulin(博奥森bs-4511R)抗体过夜,TBST 洗掉未结合的一抗,后孵育二抗(博奥森bs-0295G-HRP),在NC 膜上均匀滴加化学发光HRP 底物(SuperSignalTMWest Femto Maximum Sensitivity Substrate,34095,Thermo Scientific)后立即用ChemiDocTMXRS+成像系统(Bio-Rad)读取条带信息,使用Image Lab 软件(Version 4.1)进行相对定量分析。
1.6 统计学分析
2 结果
2.1 干预期间小鼠体重变化
各组小鼠初始体重无显著差异(初始体重的平均值为8.3 ± 0.2 g);饲喂8周高脂饲料构建肥胖模型成功后,H组体重极显著高于NC组(P<0.01);运动干预2周(饲喂10 周),HC 组体重仍极显著高于NC 组(P<0.01),而HE组与HC相比无显著性差异;运动干预4周(饲喂12 周),HC 组显著高于NC 组,HE 组较HC 组显著下降(P<0.05),见图1。
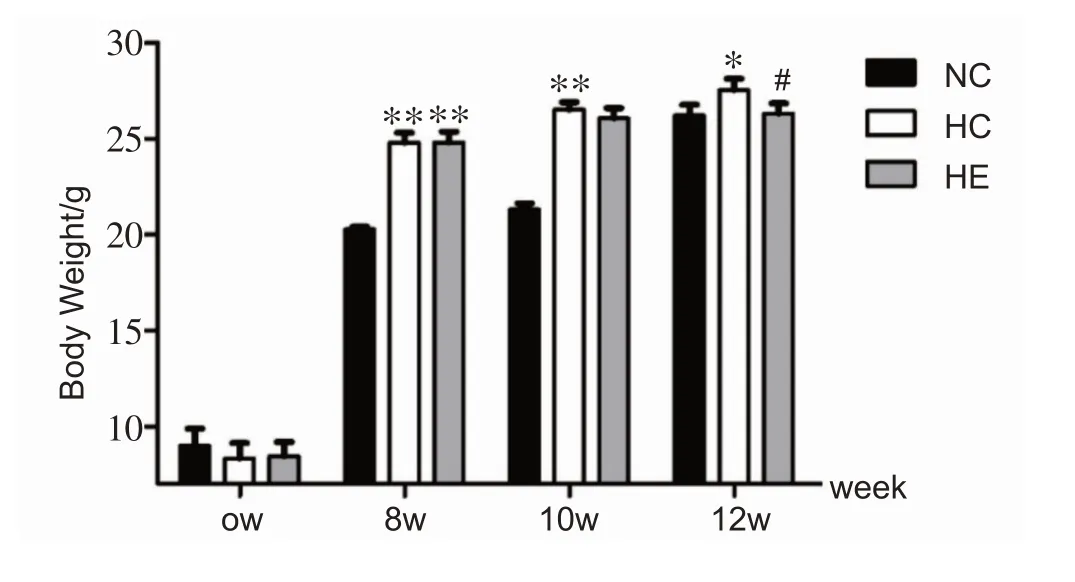
图1 干预期间各组小鼠体重比较
2.2 干预期间小鼠摄食量变化
建模结束后,NC 组饲喂普通饲料,HC 与HE 组持续饲喂高脂饲料。建立肥胖模型前(8 周前),NC 组摄食量(该组所有小鼠单周的摄食总量)较H 组少;运动干预2 周时(饲喂第10 周),NC 组摄食量仍处于最少,HE 组较HC 组降低;运动干预4 周时(饲喂第12 周),NC组摄食量高于HC和HE组,HE组与HC组摄食量接近。见图2。

图2 干预期间各组小鼠摄食量变化
2.3 各组小鼠血清TG、CHO和GLU水平变化
干预4周后,HC组各项血液指标均高于NC组(P<0.05);HE 组血清TG 和CHO 水平较HC 组无显著性差异,GLU水平较HC组下降(P<0.05)。见图3。

图3 各组小鼠血清TG(A)、CHO(B)、GLU(C)水平(n=8)
2.4 各组小鼠血清总Ghrelin水平的变化
干预4 周后,HC 组血清总Ghrelin 水平较NC 组有下降的趋势,HE组较HC组有上升的趋势,但组间无显著性差异。见图4。
2.5 各组小鼠胃组织Ghrelin、Goat 和下丘脑GHSR-1a mRNA的相对表达量
HC 组胃组织Ghrelin、Goat 和下丘脑GHSR-1a mRNA 相对表达量较NC 组均降低(P<0.01);HE 组胃组织Ghrelin 和Goat mRNA 相对表达量较HC 组增加(P<0.05 或P<0.01),HE 组下丘脑GHSR-1a mRNA 相对表达量较HC组有增加趋势,但无显著差异。见图5。
2.6 各组小鼠胃组织Ghrelin、Goat 和下丘脑GHSR-1a的蛋白相对表达量
WB 测试胃组织Ghrelin、Goat 和下丘脑GHSR-1a和的蛋白表达量。与NC 组相比,HC 组胃组织Ghrelin和Goat 蛋白含量无显著差异;HE 组高于HC 组(P<0.05),见图6A。与NC 组相比,HC 组下丘脑GHSR-1a蛋白含量无显著差异;HE组高于HC组(P<0.05),见图6B。
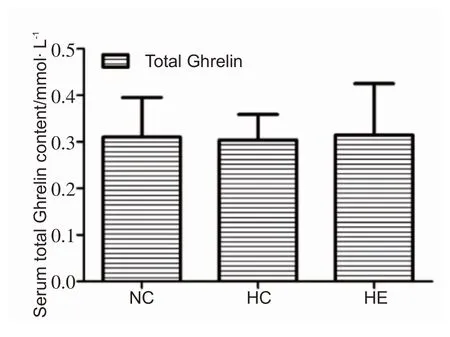
图4 各组小鼠血清总Ghrelin水平(n=8)

图5 各组小鼠胃组织Ghrelin、Goat和下丘脑GHSR-1a mRNA相对表达量(n=8)

图6 各组小鼠胃组织Ghrelin、Goat(A)和下丘脑GHSR-1a(B)的WB条带灰度值和蛋白相对表达量(n=8)
3 讨论
3.1 肥胖机体胃组织Ghrelin-下丘脑GHSR表达变化及作用
Ghrelin 是在胃组织中发现的一种28 个氨基酸的活性肽[12],可在Goat 酰基化的作用下与其受体GHSR-1a发挥调节机体摄食行为和糖脂代谢的作用。
Ghrelin分泌的调节与身体指数和脂肪含量密切相关[13]。伴随着血清Ghrelin 水平的降低,老年大鼠的脂肪量显著高于青年鼠,推测脂肪含量的增加抑制Ghrelin的分泌,从而影响老年鼠的胃肠排空能力[14];另有研究显示肥胖大鼠胃和下丘脑中Ghrelin 含量显著低于正常机体[11,15]。本研究结果显示,肥胖小鼠胃组织Ghrelin mRNA 含量较正常小鼠显著减低,并伴随血液TG、CHO和GLU水平的显著升高。作为一种促食欲激素,Ghrelin可通过血液及迷走神经传递至下丘脑,在弓状核与其受体GHSR-1a 结合,激活下丘脑神经肽Y(neuropeptide Y,NPY)和刺鼠相关蛋白(agouti-related protein,AgRP)神经元,增加摄食行为[16]。肥胖机体Ghrelin 水平下降可能是一种补偿适应机制,作用是降低饥饿感,减少摄食量[8]。在机体糖脂代谢过程中,Ghrelin 在调控胰岛素敏感性,肉碱软脂酰转移酶(Carnitine palmityl transferase,CPT)及NPY/AgRP 神经原功能方面发挥着重要作用[17],其中弓状核AgRP神经元还可通过Ghrelin 调节血糖稳态[18]。外源性非乙酰化Ghrelin(unacylated Ghrelin,UAG)可改善胰岛素敏感性,抑制脂肪的积累[19]。本研究中肥胖机体出现的血脂血糖水平上调可能与机体Ghrelin 下调所导致的糖脂代谢紊乱有关。此外,肥胖会诱发机体处于慢性炎症状态,表现为免疫细胞在脂肪细胞处形成细胞浸润;随着脂肪细胞因子(脂肪细胞数目增加)分泌增多,将更多的促炎因子释放给其它组织器官,全身炎症反应进一步加剧[20]。Ghrelin具有抗炎功效[21],急性低氧暴露使胃炎症因子水平上升,同时胃组织Ghrelin 水平降低;随着低氧暴露时间延长,机体逐渐适应低氧刺激,胃炎症因子水平下降,Ghrelin含量增加[22]。因此,本研究中胃组织Ghrelin 水平的下调可能与肥胖机体的慢性炎症状态有关。
3.2 有氧运动对肥胖机体胃组织Ghrelin-下丘脑GHSR-1a通路的影响
本研究中,肥胖机体虽继续饲喂高脂膳食,但高脂运动组体重和血糖水平较高脂对照组出现显著性下降,伴随着胃组织Ghrelin、Goat 和下丘脑GHSR-1a 蛋白含量的增加。有研究显示有氧运动可通过提高老年大鼠Ghrelin 水平从而提高胃肠道动力,以增强老年机体对营养物质消化吸收能力,降低体重和改善体成分[14]。游泳训练可以显著降低肥胖大鼠体重和内脏脂肪含量,伴随着血清Ghrelin、胃组织Ghrelin mRNA 和蛋白含量的增加,而限食减肥组中Ghrelin 水平则未出现明显变化[15]。
有氧运动通过Ghrelin-GHSR 通路对肥胖机体的影响主要表现在以下几个方面:(1)促进摄食量增加:有氧运动导致的胃组织Ghrelin 表达增加可能与体重下降所致的胃排空和饥饿感有关,而增加的Ghrelin 水平可能又反过来进一步促进食欲,从而引发减肥抵抗,这是运动减重值得注意的问题[15]。但在本研究结果中运动干预后肥胖小鼠的摄食量并未发生显著性变化,运动是否通过Ghrelin-GHSR 通路调节摄食量以发挥控制肥胖的作用还有待于进一步的探索。(2)调节脂代谢:Ghrelin 是重要的连接中枢神经系统与调节能量稳态的外周组织因子,可通过GHSR 依赖性机制调节内脏脂肪的质量,而GHSR 也被认为是脂质代谢和能量消耗的重要调节剂[23]。此外,Ghrelin-GHSR 通路的激活可降低肥胖所致的内脏脂肪细胞中肿瘤坏死因子-α(tumor necrosis factor,TNF-α)诱导的细胞凋亡和自噬,发挥抗炎作用[24]。有氧运动所诱导的Ghrelin 水平升高可刺激下丘脑中AMPK 以抑制脂肪酸(fatty acid,FA)的合成,降低丙二酰辅酶A(Malonyl-CoA)含量,激活CPT 以促进脂代谢[25]。(3)调节糖代谢:运动刺激下交感肾上腺系统的激活可刺激Ghrelin 的释放,同时,运动时胰岛素水平的下降也可导致Ghrelin 的表达增加[26]。胰岛素是Ghrelin分泌的一种强有力的负调节因子[27]。有氧运动诱导的血液中Ghrelin水平的增加与耐力的增长呈正相关,而小鼠敲除GHSR 后,耐力下降、交感肾上腺反应水平降低、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)水平和糖原利用率下降[28]。说明Ghrelin 发挥糖代谢调节作用依赖于受体GHSR,提示Ghrelin-GHSR 通路在有氧运动调控糖代谢中发挥着重要作用。
4 结论
高脂膳食所诱导的肥胖会导致胃组织Ghrelin、Goat 和下丘脑GHSR-1a mRNA 水平的降低及血脂血糖水平的增加;4 周有氧运动干预可提高胃组织Ghrelin、Goat 和下丘脑GHSR-1a 的表达水平,伴随着血脂血糖水平和体重的下降,改善肥胖对机体的不良影响。

