在猪蓝耳病病毒和猪圆环病毒感染猪场利用猪瘟E2 基因工程亚单位疫苗控制猪瘟的案例分析
刘武刚,张海雷,周绪斌,曾容愚
(天康生物股份有限公司,新疆 乌鲁木齐 830001)
猪瘟(CSF)是一种由猪瘟病毒(CSFV)引起的烈性传染病,也是危害我国养猪业的重要疫病。猪瘟病毒是黄病毒科瘟病毒属的一种有囊膜的正股单链RNA 病毒。我国在20 世纪50 年代就研发了猪瘟兔化弱毒活疫苗(C 株)来预防猪瘟的暴发,取得较好的效果。近几年来,由于我国的规模化猪场已经大规模的免疫了猪瘟活疫苗,使得猪瘟的流行特点已经发生了显著的变化,主要以非典型、亚急性、慢性或者隐形感染为主,主要表现为无临床表现的母猪带毒垂直传播及猪群中水平传播。母猪温和型猪瘟临床症状不明显,但是带毒猪会持续性地散毒,通过胎盘把病毒垂直传播给仔猪,使得仔猪在胚胎时期就感染猪瘟病毒,造成其天然免疫耐受,在出生前就感染猪瘟病毒;并且水平传播给没有带毒仔猪从而造成仔猪的发病死亡,这种母猪带毒综合征是目前猪场猪瘟控制不稳定的主要原因[1]。猪瘟兔化弱毒疫苗已被证明可诱导对CSFV 感染产生完全的保护作用,并已广泛用于控制猪的CSF,特别是在高度流行的地区。尽管如此,仍然有一些其他的因素影响现有猪瘟弱毒疫苗的免疫效果,从而导致免疫失败,这些因素包括母源抗体水平[2,3],接种时间[4],接种方案,猪的日龄及与其他病原共感染等情况[5]。
在猪瘟的防控过程中,免疫抑制性疾病一直十分困扰养猪业。猪场尤其是规模化猪场一旦感染免疫抑制性疾病,会很大程度影响猪瘟弱毒疫苗的免疫效果。多项研究表明PRRSV 可能对宿主免疫反应产生负调节作用。感染PRRSV 的猪通常表现为长时间的病毒血症和持续性感染。S. Suradhat 通过试验证实在PRRSV 感染的急性期进行猪瘟免疫可能导致疫苗接种失败。PRRSV 可能是通过在感染初期宿主淋巴组织微环境中IL-10 的增多使体液免疫和细胞免疫功能受损,这也是PRRSV 可以抑制猪瘟免疫效果的原因。PRRSV 感染显著抑制猪瘟疫苗效力的结果值得养猪业高度重视,特别对同时存在猪瘟和猪蓝耳病流行的国家在进行猪瘟免疫时具有很大的启示[6]。
PCV2 是另一种中国猪场常见的免疫抑制性疾病,是引起仔猪断奶后多系统衰竭综合征(PMWS)的主要原因之一。PCV2 感染能降低PRRSV 疫苗的保护效果,可以干扰宿主对猪伪狂犬病的免疫应答。PCV2 介导的淋巴细胞活化干扰降低了体液免疫和CMI 的活化,也与CSFV 中和抗体的产生及抑制CSFV特异性细胞增殖有关。最新的研究显示,如果猪场在接种疫苗前发生PCV2 感染,那么猪场CSFV 的感染压力将显著增加,猪场免疫CSFV疫苗对野毒的防治效果大大降低[7]。
1 猪场和猪群发病的背景
北京某规模化种猪场,存栏2 000 头基础母猪,从2017 年5 月份开始,出现40 ~50 日龄保育猪生产不稳定,发病猪临床表现为发烧,聚堆,被毛粗乱,关节肿大,倒地后四肢划水,消瘦,其中倒地划水的比例占30%,大部分猪存在泪斑,结膜炎。每批猪的发病率在20%~40%,死亡率10%~20%。剖检症状主要表现为肺脏间质性肺炎、腹股沟淋巴结呈大理石样出血、肾脏沟壑加深变形、脾脏出现边缘梗死等症状,详细见图1。
使用猪瘟E2 基因工程亚单位疫苗免疫前,猪场分离血清送实验室进行猪瘟抗体测定,检测结果显示,猪瘟抗体滴度非常低,4 周龄首免后,随着仔猪周龄增加,猪瘟抗体阻断率降低,离散度增大,阳性率降低,甚至到8 周龄,抗体平均阻断率14.5%,离散度64.5%,阳性率0。具体检测结果如图2、图3。
将场内发病猪病料送实验室进行病原检测,猪蓝耳病病毒和猪圆环病毒核酸检测结果为阳性,疑似场内有猪蓝耳病病毒和猪圆环病毒感染。具体检测结果见表1。
2 疫苗试验应用方法
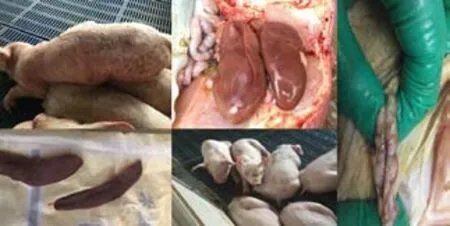
图1 发病猪只临床表现以及解剖临床症状
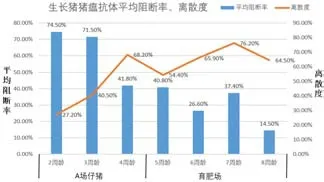
图2 2018 年3 月猪瘟E2 基因工程亚单位疫苗免疫前生长猪猪瘟抗体平均阻断率/离散度
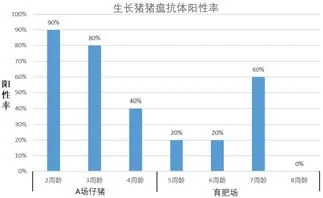
图3 2018 年3 月猪瘟E2 基因工程亚单位疫苗免疫前生长猪猪瘟抗体阳性率

表1 猪瘟病毒、猪蓝耳病病毒、猪伪狂犬病野毒、猪圆环病毒2 型核酸检测结果
试验组分为A/B 两组,并做两个重复,A 组分场进行猪瘟E2 基因工程亚单位疫苗免疫,B 组分场进行猪瘟ST 弱毒疫苗免疫,免疫途径与免疫剂量按照疫苗说明书进行。生长猪对比试验时,A 组分场连续两批次免疫猪瘟E2 基因工程亚单位疫苗,B 组分场免疫猪瘟ST疫苗,按照仔猪猪瘟免疫程序进行,28 日龄第1 次免疫,63 日龄第2 次免疫。种猪群对比试验时,按照种猪群猪瘟普免免疫程序进行,A 组分场全场免疫猪瘟E2 基因工程亚单位疫苗,B 组分场免疫猪瘟ST疫苗。试验猪的饲养管理以及其他疫苗免疫均按本场原有程序进行,试验期间如有明显疾病发生,如严重腹泻,肢体伤残等,均予以淘汰。
3 采血与检测
生长猪每组在首免后4 周进行采血。种猪群每组按胎次免疫后1个月随机抽取35 头采血。利用猪瘟阻断ELISA 抗体检测试剂盒检测猪瘟抗体。
4 判定标准
猪瘟抗体ELISA 检测成立条件:阴性对照的平均OD450应大于0.50。阳性对照的阻断率应大于50%。结果判定标准:如果被检样本的阻断率大于或等于40%,该样本就可以被判为阳性(有CSFV 抗体存在)。如果被检样本的阻断率小于或等于30%,该样本就可以被判为阴性(无抗CSFV 抗体存在)。如果被检样本的阻断率在30%~40%之间,就应在数日后再对该动物进行重测。如果重测结果仍为可疑,就应用血清中和试验方法鉴定。
5 试验结果
1)生长猪方面,同等条件下进行免疫对比,连续2 批。猪蓝耳病病毒感染,猪圆环病毒感染对猪瘟ST 疫苗和猪瘟E2 基因工程亚单位疫苗的影响见图4。试验前,检测生长猪免疫猪瘟ST 疫苗效果见图2和图3,4 周龄首免后,一直检测到8 周龄,平均抗体阻断率逐渐下降,到8 周龄时为14.5%,阳性率为0,虽然对比试验中,首免后4 周,第一批次平均阻断率42.69%,阳性率60%。第二批次平均阻断率33.99%,阳性率44%,比试验前摸底数据有好转,但仍然受猪蓝耳病病毒、猪圆环病毒感染导致抗体不理想。然而,猪瘟E2 基因工程亚单位疫苗免疫组,首免后4 周,第一批次平均阻断率73.68%,阳性率100%。第二批次平均阻断率71.22%,阳性率93%。数据表明,猪瘟E2 基因工程亚单位疫苗受猪蓝耳病病毒、猪圆环病毒感染影响较小,可减少猪只猪瘟的免疫空窗期。
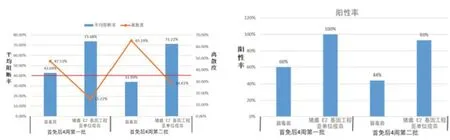
图4 2018 年4 月生长猪猪瘟抗体检测对比
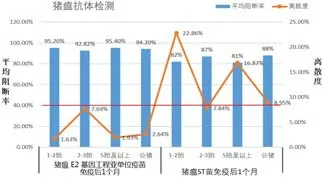
图5 2018 年5月种猪猪瘟抗体检测对比
2)种猪群方面,同等条件下进行免疫对比,猪瘟E2 基因工程亚单位疫苗免后1 个月平均阻断率92.82%~95.40%,离散度≤7.69%,猪瘟ST 苗免疫后1 个月平均阻断率82%~88%,离散度7.84%~22.86%。种猪群使用后对比,平均阻断率有了进一步的提高,离散度有了进一步的降低,总之,猪瘟抗体的免疫效果有了进一步的提升。具体数据如图5。
3)生产成绩提升,从3 月份开始更换猪瘟E2 基因工程亚单位疫苗,全群换苗2 个月后,从5 月份开始,保育阶段仔猪育成率持续保持97%及以上。平均日增重也有了明显增高,最高可达119 g/d,生产成绩有了明显的提升。具体数据如图6。
6 讨论
从20 世纪50 年代中国研发成功举世闻名的猪瘟兔化弱毒疫苗(即C 株),该疫苗被公认为是最有效的猪瘟疫苗,但关于C 株疫苗在机体内的作用机制,仍然还没有完全研究透彻。而S. Suradhat等在2005 年的发表文章中已证明PRRSV 感染可严重影响了猪只对CSFV 抗体反应的诱导[9]。并且Yu-Liang Huang 等的研究表明了PCV2的感染降低了LPC 猪瘟疫苗的免疫效果,不仅可以干扰CSFV 野毒侵入养猪场,而且也增加了CSF 流行区CSF 防治的难度[10]。
如图2 数据显示,感染猪蓝耳病病毒和猪圆环病毒,导致猪瘟弱毒疫苗4 周龄首免后,一直检测到8 周龄,平均抗体阻断率逐渐下降,到8 周龄时为14.5%,阳性率为0,虽然对比试验中,首免后4周,第一批次平均阻断率42.69%,阳性率60%。第二批次平均阻断率33.99%,阳性率44%,比试验前摸底数据有好转,但仍然受猪蓝耳病病毒、猪圆环病毒感染导致抗体不理想(见图4)。这也解释了目前保育、育肥猪群猪瘟抗体水平低下的原因。
猪瘟病毒囊膜糖蛋白E2 是猪瘟病毒的主要的保护性抗原蛋白,单独免疫E2 蛋白即可避免猪感染猪瘟病毒。E2 蛋白上的中和性表位在 CSFV 毒株中相对保守,使得针对E2 蛋白基础上开发的亚单位疫苗不仅广泛地保护猪对抗CSFV 野毒株,而且可以通过检测抗 Ems 的抗体将免疫和感染的猪区分开[8],这就为猪瘟的净化开辟了新的途径。E2 蛋白已被证实是一个有效的可刺激机体产生主要中和抗体的免疫蛋白,并且文中研究结果表明,在猪群受猪蓝耳病病毒、猪圆环病毒2 型感染的情况下,猪瘟E2 基因工程亚单位疫苗免疫并未受到明显干扰,首免后4 周,第一批次平均阻断率73.68%,阳性率100%。第二批次平均阻断率71.22%,阳性率93%(见图4)。
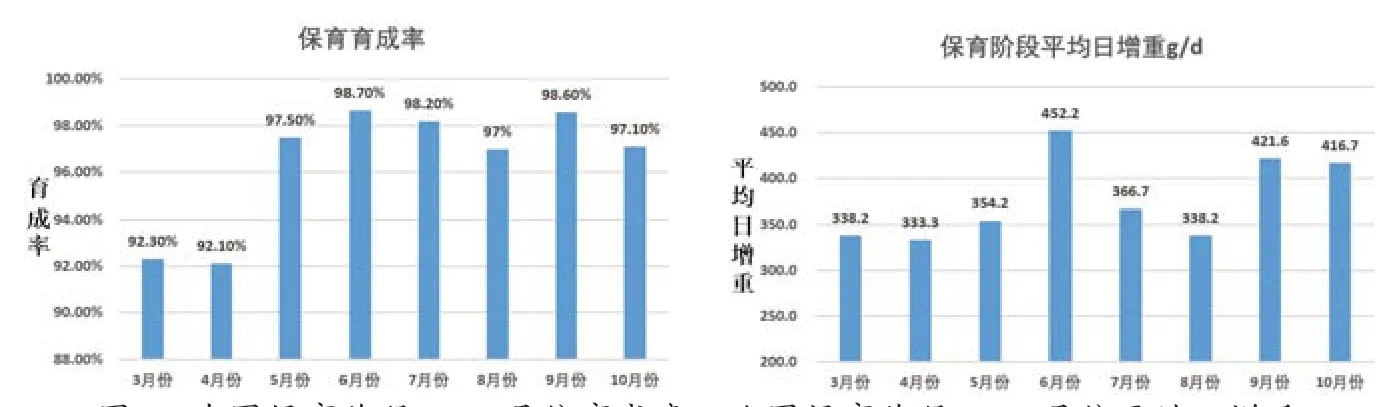
图6 左图保育阶段3-10 月份育成率,右图保育阶段3-10 月份平均日增重
猪瘟E2 基因工程亚单位疫苗免疫效果明显优于猪瘟ST 苗,可以突破免疫抑制的限制,在猪群存在猪蓝耳病和猪圆环病毒病等免疫抑制性疾病的情况下,仍可以稳定提高猪瘟抗体水平,提供有效保护,提升生产成绩,这就为复杂猪病形势下猪瘟的防控提供了新的工具和方法。

