拮抗尖孢镰刀菌的蓝莓菌根真菌的筛选和鉴定
张 雁 袁 泉 刘莉莉 方明明 徐德聪
(合肥师范学院 生命科学学院,安徽 合肥 230601)
蓝莓是杜鹃花科越橘属植物,果实富含营养,是我国新兴的种植项目[1],在我省宣城、怀宁和合肥等地大量种植。蓝莓在栽培中由真菌引起的病害达20多种[2-3],最常见的蓝莓根腐病是蓝莓产量下降的主要原因[4]。尖孢镰刀菌可以导致多种植物病害[5],侵染蓝莓根系时会导致蓝莓根腐病[6]。尖孢镰刀菌从植物根部入侵后,可损害植物的维管束,导致植物根冠腐烂[7-9]及减产或绝产[10]。蓝莓根腐病的传统治疗方法为大量使用农药,不但成本高昂,还会造成严重的环境污染,并导致蓝莓的经济价值下降。而生物防治温和、安全、持久,可有效的避免化学防治的弊端。
菌根真菌可以提高植物的防御能力[11-12],减少相关疾病的发生[13]。蓝莓的根系可以和内生的真菌共生,形成菌根结构[14],这些菌根真菌的菌丝在土壤中可以形成网状结构,可有效的扩大植株根系利用的土壤范围,进而促进蓝莓生长[15]。蓝莓根部的细胞和组织能够被菌根真菌的菌丝体侵染[16],最终可以增强蓝莓的适应性和抗病性,提升蓝莓的产量[17]。因此,本研究从宣城、怀宁和合肥等地的蓝莓根系中分离并鉴定出多种菌根真菌,并从中筛选出多株可以有效拮抗尖孢镰刀菌的蓝莓菌根真菌,对蓝莓根腐病的生物防治中具有重要的应用价值和应用潜力。其中筛选出的拮抗尖孢镰刀菌的棘孢木霉Hfsu02的拮抗能力最强,且可以有效侵染蓝莓根系,具有防治蓝莓根腐病等由尖孢镰刀菌引起的植物病害的应用价值。
1 材料和方法
1.1 培养基与试剂
DNA凝胶回收试剂盒(上海生工),真菌基因组提取试剂盒(上海生工),Taq DNA聚合酶(上海生工),其他化学试剂均为国产分析纯。
PDA培养基:马铃薯200 g,加适量(约500 mL)的去离子水煮熟,捣碎搅拌,用两层纱布进行过滤,取滤液加入葡萄糖20 g,充分混匀并定容至1000 mL。
基础培养基(马丁氏改良):NH4NO35 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,葡萄糖 10 g,微量元素混合液0.1 mL,定容至1000 mL。
培养基灭菌条件为121℃,20 min或115℃,20 min(含糖培养基)。
1.2 蓝莓根系样品采集
2018年4月从安徽宣城、合肥和怀宁地区蓝莓种植园中采集生长年限均为5~6年的蓝莓(奥尼尔品种)的蓝莓根样各5个样品。用灭菌采样袋分装好,24 h内分离菌根真菌。
1.3 菌根侵染率研究
菌根侵染使用优化后的台盼蓝染色法[18]进行测定:无菌条件下,将根段切成1 cm长的根段,无菌水冲洗干净,放入FAA固定液(38%甲醛5 mL+乙酸5 mL+50%酒精90 mL+甘油5 mL)固定15 min,取出后放在10%KOH/NaOH溶液95℃水浴1 h后用无菌蒸馏水冲洗至无色后染色(染液配方:台盼蓝 0.05 g+苯酚 20 g+乳酸 20 mL+甘油 40 mL+蒸馏水20 mL)12 h后用丙三醇(乳酸)中脱色30 min,通过光学显微镜观察,计算侵染率,公式如下:

1.4 蓝莓根系共生菌根真菌分离纯化
将根段剪成1 cm长,用无菌水冲洗干净后采用表1的消毒方法对菌根表面的微生物进行消毒处理。因为不同的菌根真菌对不同的消毒剂的耐受性不同,本研究同时使用两种消毒方法。通过预实验优化,这两种方法均能有效抑制根系表面杂菌。方法一和方法二各采用不同的消毒剂进行两步消毒。每次消毒之后使用无菌水清洗。

表1 蓝莓菌根消毒方法
将不同消毒方法消毒过后的根段,放在PDA平板中30℃培养(一个平板上放置8~10段根段),筛选出不同的菌根真菌。挑取根段内部长出的菌丝体到PDA液体培养基中,在30℃恒温摇床中200 r/min振荡培养,菌液稀释至10-5并用移液枪吸取0.2 mL涂布于PDA平板中,30℃培养至孢子生成,使用孢子滤器分离孢子,稀释后涂布于PDA平板中,重复以上操作,直至获得纯化的单克隆。
1.5 菌根真菌的分子鉴定
使用真菌基因组提取试剂盒 (上海生工)进行总DNA提取,使用通用引物ITS1和ITS4进行PCR扩增ITS的部分序列。引物序列为ITS1,5′TCCGTAGGTGAACCTGCGG3′;ITS4,5′TCCTCCGCTTATTGATATGC3′。PCR 扩增条件:94℃预变性 5 min,循环条件是 94℃变性 30 s,55℃复性30 s,72℃延伸1.5 min,共35个循环,最终72℃延伸10 min。扩增后的ITS序列使用1%的琼脂糖凝胶电泳检测,送生工生物工程(上海)有限公司测序。在NCBI中进行Blast比对,并使用软件MEGA7.0构建系统进化树,确定分离菌株的种属和分类地位。
1.6 拮抗尖孢镰刀菌的菌根真菌的筛选
利用滤纸片扩散法测抑菌效果:取尖孢镰刀菌悬液0.1 mL均匀涂布在PDA培养基中,贴敷上浸过不同菌根真菌(除尖孢镰刀菌外)液体培养悬液10 min的直径为6 mm的滤纸片,用无菌水试片作为空白对照。30℃恒温培养72 h,用十字交叉法测抑菌圈直径。通过初筛筛选出的菌株,采用滤纸片扩散法进一步复筛,重复3次,统计分析结果。
1.7 拮抗尖孢镰刀菌的菌根真菌Hfsu02的形态特征鉴定
吸取100 μL菌根真菌Hfsu02菌液接种于PDA固体培养基上,涂抹均匀。逐日观察菌根真菌Hfsu02的菌落形态特征。取孢子悬液0.1 mL接种在PDA液体培养基中,30℃条件下200 r/min振荡培养48 h,观察形成的菌球的形态特征。
1.8 Hfsu02在基础培养基上的培养特性研究
基础培养基相比较于PDA培养基,成份更加稳定,更适合研究Hfsu02的培养特性。在30 mL液体基础培养基中加入200 μL菌根真菌Hfsu02的孢子悬液,200 r/min的振荡培养48 h,通过称干重法对菌根真菌Hfsu02的最适温度、pH进行测定,然后在最适温度和最适pH条件下测定Hfsu02在基础培养基中的生长曲线。
最适pH的测定:设置的pH梯度为 3、4、5、6、7,每组设置三个平行。温度选用真菌常规培养温度30℃,200 r/min振荡培养48 h,测量培养后菌丝体的干重,统计分析菌根真菌Hfsu02的最适pH。
最适温度的测定:设置的温度梯度为20℃、25℃、30℃和35℃,每个温度设置三个平行,培养基pH调为最适,200 r/min振荡培养48 h,测量培养后菌丝体的干重,统计分析菌根真菌Hfsu02的最适生长温度。
生长曲线测定:在最适pH,最适温度下,200 r/min振荡培养,定时称量30 mL培养基中的菌丝干重,构建棘孢木霉Hfsu02在基础培养基中的生长曲线。
2 结果和分析
2.1 安徽不同地区蓝莓(奥尼尔品种)侵染率与侵染形态观察
将安徽不同蓝莓栽培土壤中的5~6年生奥尼尔品种的根段经台盼蓝染液染色后,置于显微镜下观察,发现不同土壤中的蓝莓根系均有侵染现象(图 1)。
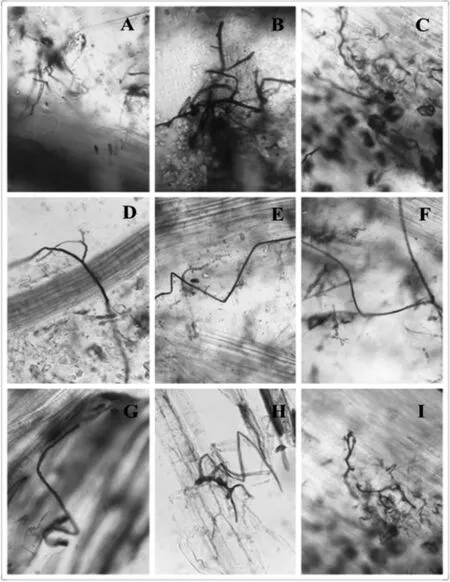
图1 安徽不同地区蓝莓根系菌根侵染显微图(10×40)
其中图1-A、图1-B、图1-C为宣城地区红壤栽培蓝莓根系侵染形态,其菌根真菌既有根外菌丝(图1-A、图1-B),又有胞间贯穿菌丝和胞内菌丝团(图 1-C);图1-D、图1-E、图 1-F为合肥地区改良水稻土栽培蓝莓根系侵染形态,侵染的菌根真菌多为外生菌丝(图 1-D、图 1-E、图1-F);图1-G、图1-H、图1-I为怀宁地区红黄壤栽培蓝莓根系侵染形态,侵染的菌根真菌即有外生菌丝(图1-G、图1-H)又有胞内菌丝团和胞间贯穿菌丝(图 1-I)。
根据观察结果,统计安徽省各地区不同土壤栽培的蓝莓根系菌根真菌侵染率(表2)。

表2 安徽不同地区蓝莓菌根真菌侵染率(%)
2.2 菌根真菌的分离与菌落特征
在安徽宣城地区中红壤栽培的蓝莓根系中纯化出7种形态不同的菌根真菌,在合肥地区改良水稻土栽培的蓝莓根系中纯化出6种菌根真菌,怀宁地区红黄壤中纯化出4种菌根真菌,经鉴定后排除污染菌株,统计菌株及其在PDA培养基上的菌落形态特征(表3)。

表3 安徽不同蓝莓栽培土壤中蓝莓根系真菌菌株形态特征
2.3 菌根真菌分子鉴定
PCR扩增结果显示,筛选出的菌根真菌的ITS序列扩增条带较为清晰,条带长度在500~750 bp,符合预期(图2)。条带纯化后,送上海生工测序。
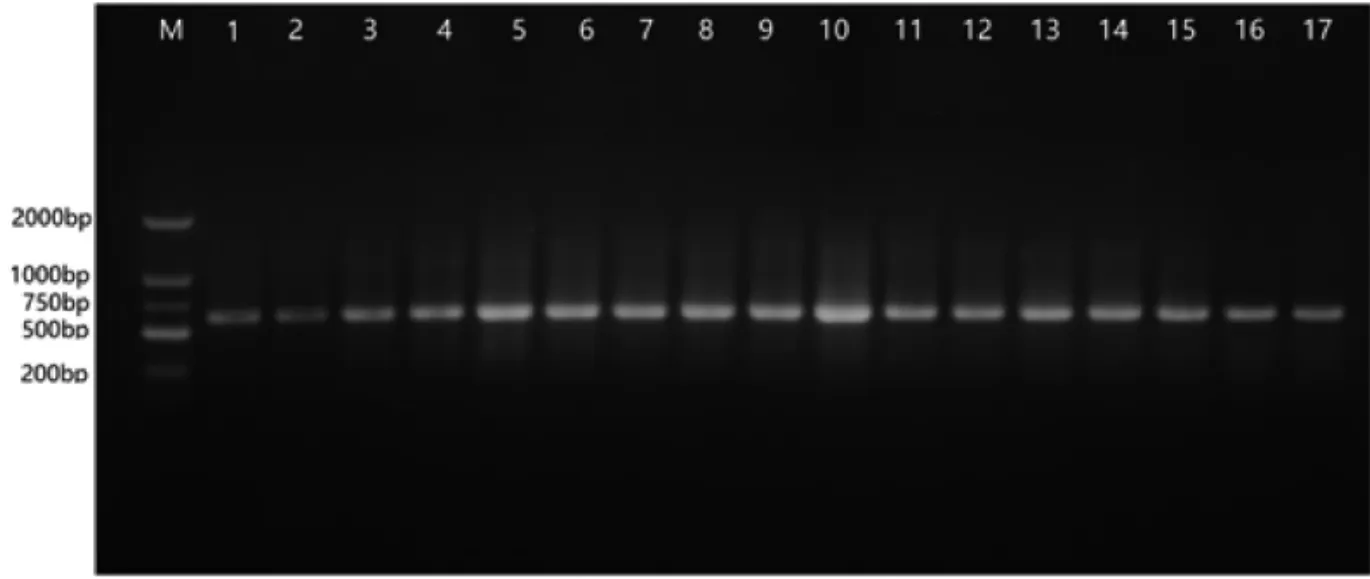
图2 17种蓝莓菌根真菌ITS序列PCR产物电泳图
将测序结果在NCBI数据库进行Blast序列比对,根据比对的结果,选取真菌中和测序鉴定结果相关主要的种属,获取代表种的ITS序列,以Colletotrichumcoccodes和Saccharomyces cerevisiae作为外类群,共47个ITS序列使用邻接法构建系统进化树(图3)。
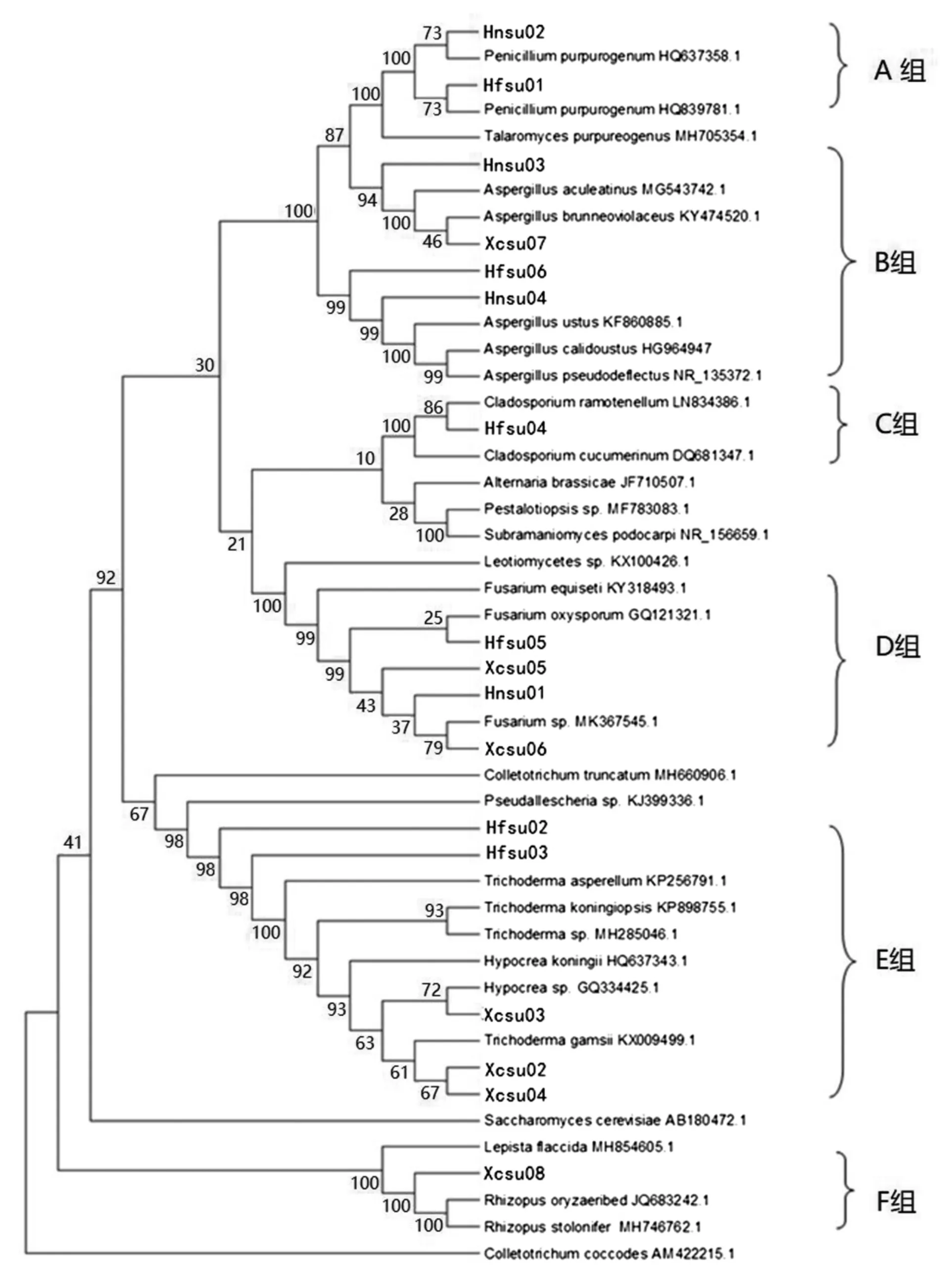
图3 安徽不同地区蓝莓菌根真菌系统进化树(NJ法)
分析地位。经鉴定,从根系分离出的真菌共分属六个属,其中 Xcsu02、Xcsu03、Xcsu04、Hfsu02和Hfsu03和相关菌种聚为E组,为木霉属(Trichoderma),是分离株数最多的优势菌属;Xcsu05、Xcsu06、Hfsu05、Hnsu01 和相关菌种聚为D组,分属于镰刀菌属(Fusarium)显示三地蓝莓均存在不同程度的根腐病感染;Xcsu07、Hnsu04、Hnsu06、Hnsu03和相关菌种聚为B组,分属于曲霉属(Aspergillus);Hfsu01、Hnsu02 和相关菌种聚为 A组,分属于青霉属(Penicillium);Hfsu04和相关菌种聚为C组,分属于枝孢属(Cladosporium);Xcsu08和相关菌种聚为F组,分属于Rhizopus(根霉属)。具体比对鉴定结果见表4。
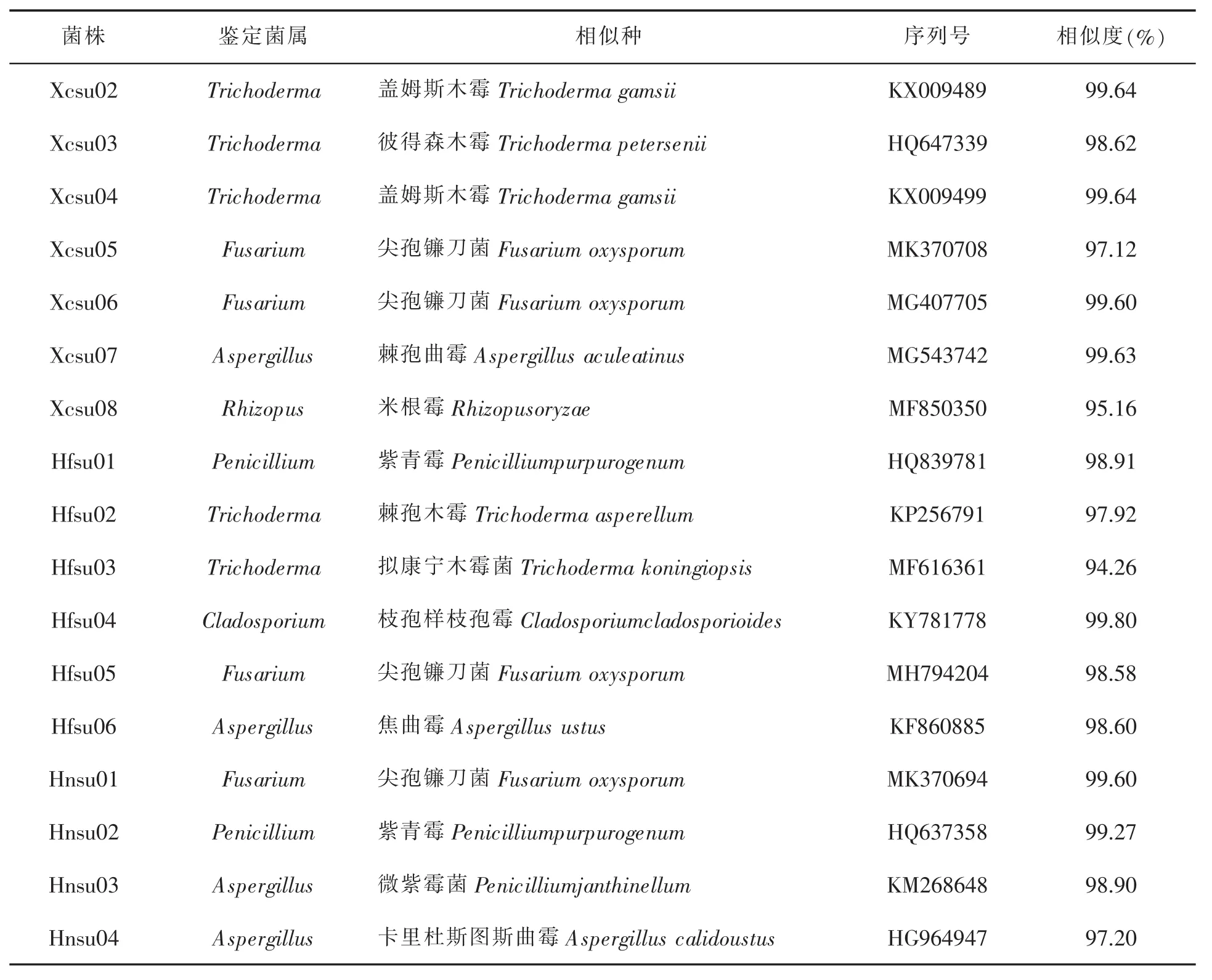
表4 安徽不同地区蓝莓根系菌根真菌分子鉴定结果
在安徽宣城红壤筛选出的7株菌株中,有3株为木霉属,2株为镰刀菌属,1株为曲霉属,1株为根霉属,筛选出的菌株数量最多;在合肥地区所筛的6株菌株中,分属于5个菌属,为青霉属、木霉属、枝孢属、镰刀菌属和曲霉属;在怀宁地区,共筛选出3种菌属,为镰刀菌属,青霉属和曲霉属。由表4可知,木霉属的菌根真菌占所鉴定菌株的29.4%,为优势种。镰刀菌属的真菌侵染,在三个不同地区均有发现,占所筛菌株的23.5%,尤其以宣城为多。曲霉属的菌根真菌同为亚优势种,占所筛菌株的23.5%,而其他的菌属数量则较少。
2.4 拮抗尖孢镰刀菌的菌根真菌的筛选
取蓝莓根系中共筛选出13株菌根真菌 (尖孢镰刀菌除外),基于对尖孢镰刀菌的抑菌圈大小初步筛出6株可有效拮抗的菌根真菌,结果见表5。
将此6株菌株进行三组平行试验,进行后续实验,以无菌水试片作为空白对照。在30℃恒温培养72 h,用十字交叉法测抑菌圈直径(图4)。
观察抑菌圈,统计抑菌圈大小,结果如表6所示。
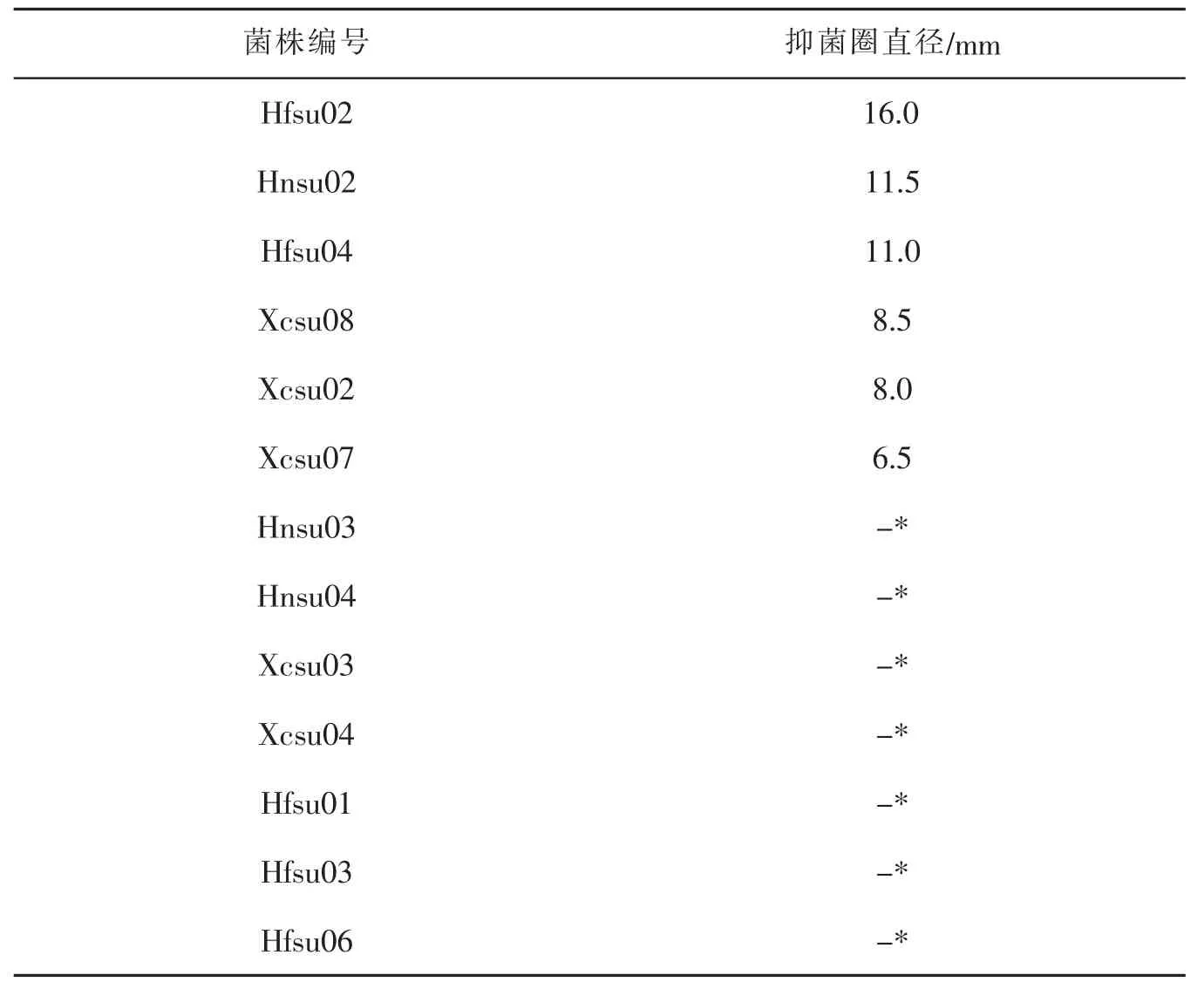
表5 拮抗菌株对尖孢镰刀菌的抑制作用
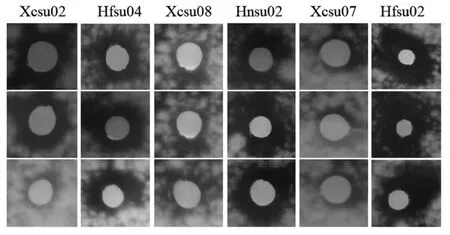
图4 拮抗尖孢镰刀菌的蓝莓菌根真菌的抑菌效果

表6 拮抗菌株对尖孢镰刀菌的抑制作用
从表6和图4可知,这6株初筛的拮抗菌株对尖刀镰刀菌均具有一定的抑菌效果。其中菌株Hfsu02(棘孢木霉)抑菌效果最明显,抑制圈直径达到1.72±0.19 cm,通过SPSS进行方差分析后可知六种拮抗菌拮抗作用差异显著 (f=16.386,p=0.001),Hfsu02的抑菌效果显著性高于其他菌株(p<0.05),因此后续实验选用拮抗菌棘孢木霉Hfsu02进行。
2.5 棘孢木霉Hfsu02的形态特征
棘孢木霉Hfsu02在PDA固体培养基上的菌落形态如图5所示。

图5 不同培养时间下棘孢木霉Hfsu02菌落图片

表7 不同培养时间下棘孢木霉Hfsu02的菌落形态特点
观察不同培养时间的棘孢木霉Hfsu02的菌落变化特点,其形态变化规律统计如表7。
使用PDA培养基液体摇瓶培养时,棘孢木霉Hfsu02菌丝缠绕形成大小不一的菌丝球 (图6),培养24 h后,菌丝球呈米粒般大小,表面光滑,呈白色,菌液无色,呈微浑浊状。培养48 h后,菌丝球体积变大,数量变多,且颜色由白色转变为乳黄色。溶液由透明色转为淡黄色,且溶液变浑浊。显微观察发现,此时溶液由透明色转为淡黄色且浑浊,是因为棘孢木霉Hfsu02在培养48 h小时后,在PDA液体培养基中产生了大量分生孢子。在液体培养时易产孢子,也是棘胞木霉的特征之一,目前棘胞木霉工业上主要也是通过优化液体培养条件来获取大量的孢子悬液[19-20]。因此棘孢木霉Hfsu02也可以通过液体培养来方便的获取大量孢子,便于生产应用。
由图6可以看出,棘孢木霉所产分生孢子为圆球形或卵圆形,颜色淡黄至深绿,大小均一,符合棘孢木霉的特征。

图6 摇瓶培养不同时期棘孢木霉Hfsu02特征
2.6 棘孢木霉在基础培养基上生长特性研究
棘孢木霉Hfsu02最适宜生长的温度、pH使用基础培养基测定。通过单一变量的变化,200 r/min的振荡培养48 h后测量不同培养条件下30 mL培养基中棘孢木霉Hfsu02菌丝体干重,结果见图7。
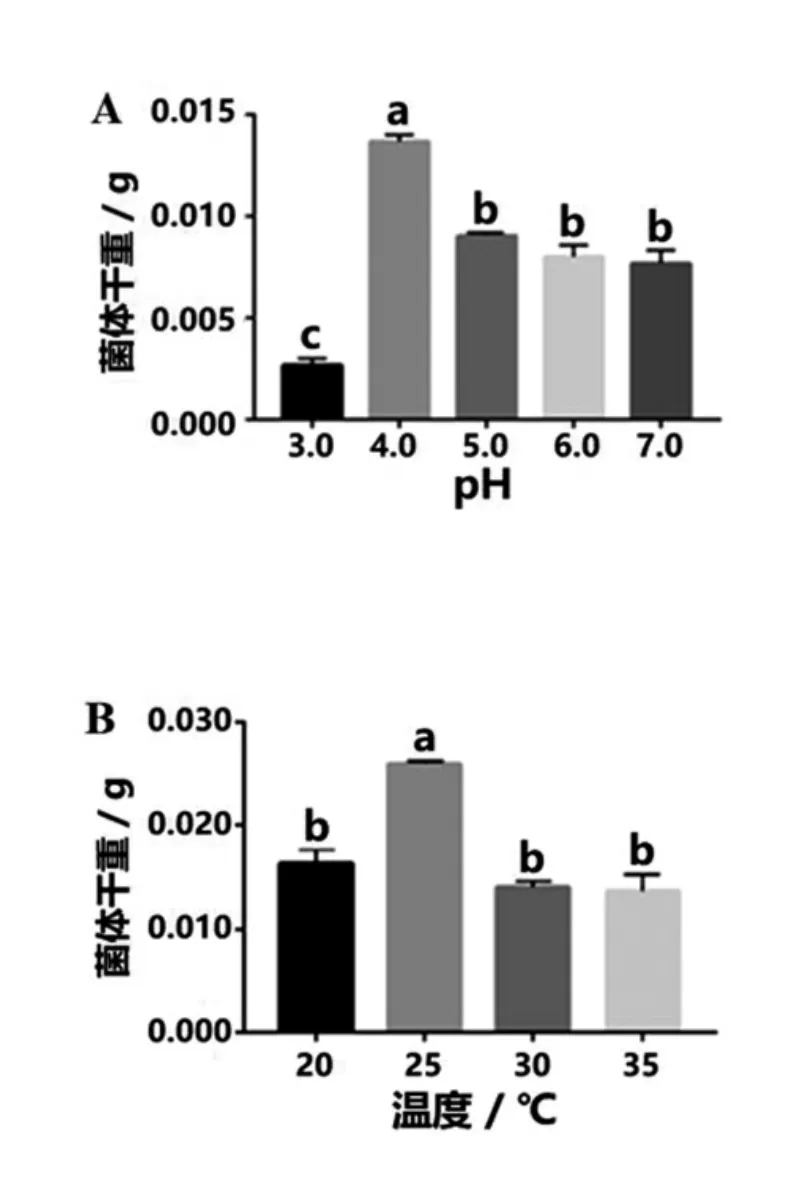
图7 不同培养条件下棘孢木霉Hfsu02培养48 h菌丝体干重
由图7-A结果可知,棘孢木霉Hfsu02在不同pH条件下生长状况不一样。五种pH下菌体干重的差异达显著水平(p<0.05),多重比较后可以得出,pH为4.0时棘孢木霉Hfsu02菌体干重显著性高于 pH为 3.0、5.0、6.0、7.0时的菌体干重,同时pH为3.0时棘孢木霉Hfsu02菌体干重显著性低于与其它pH培养下菌体干重,pH为5.0、6.0、7.0时菌体干重差异非显著性。综合考虑,基础培养基pH为4.0时菌体生长状况最好,为棘孢木霉的Hfsu02最适生长温度,但当pH小于4.0后对菌体生长有极强的负影响。
由图7-B结果可知,棘孢木霉在不同温度下生长速率不一。四种温度下菌体干重差异达显著水平(P<0.05),多重比较后可以得出,在基础培养基(pH=4.0)培养条件下,培养温度为25℃时棘孢木霉Hfsu02菌体干重显著性高于其他温度,而温度培养温度为20℃、30℃和 35℃时,棘孢木霉Hfsu02菌体干重的差异不显著,综合考虑,基础培养基(pH=4.0)培养条件下25℃时菌体生长状况最好,为棘孢木霉Hfsu02的最适生长温度。
使用基础培养基培养棘孢木霉Hfsu02,培养温度25℃,pH调整为4.0。摇瓶培养体积为30 mL条件下,接种棘孢木霉200 μL均匀孢子悬液(浓度为105/mL),培养后定时定量测得不同时期菌体干重,绘制生长曲线,如图8所示。
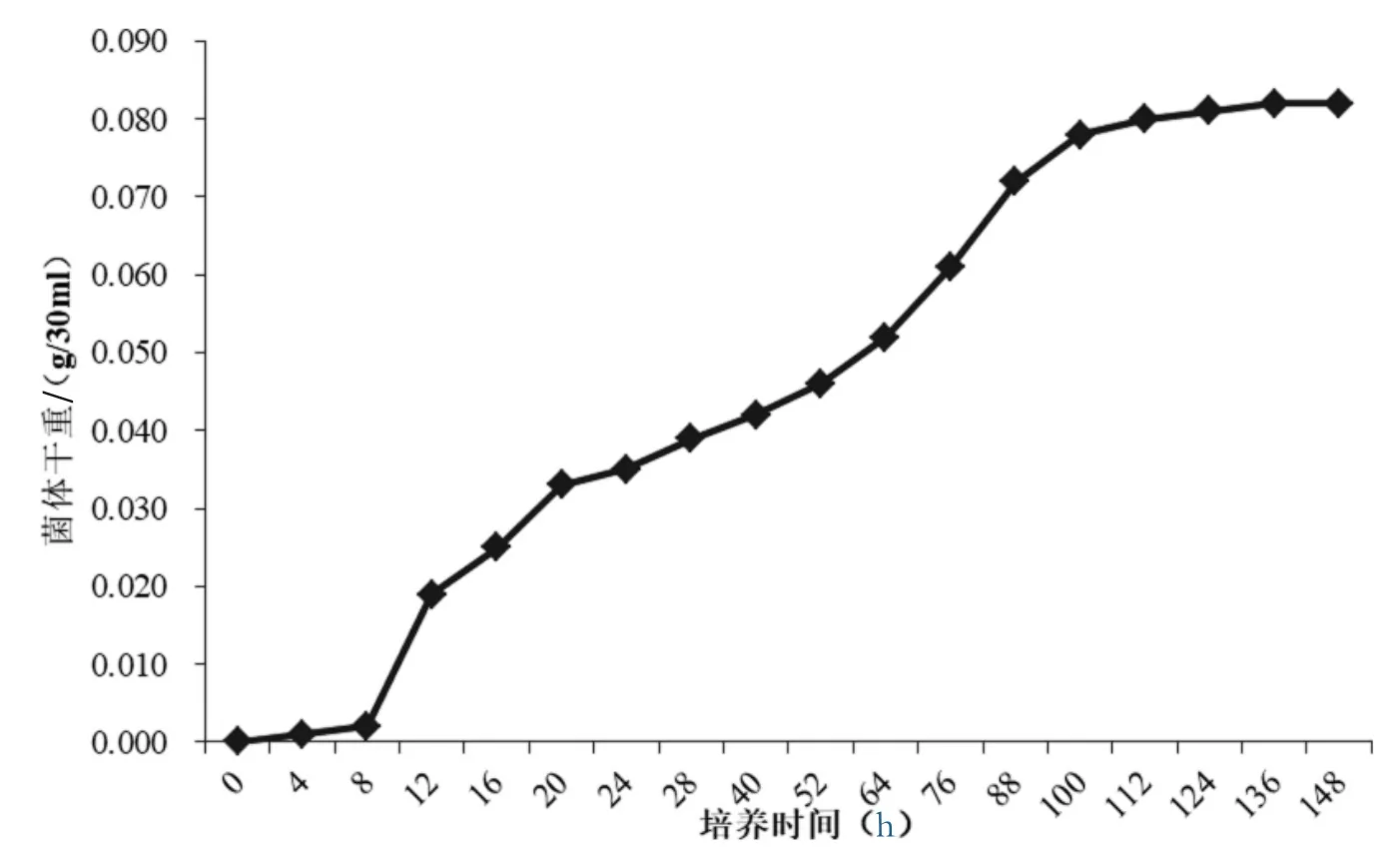
图8 棘孢木霉Hfsu02优化培养条件下的生长曲线
从图8可知棘孢木霉在0~8 h期间为延滞期,12~112 h为指数生长期,菌株生长速率较快,112 h之后菌株达到稳定生长期,生长速度缓慢,最高产量为2.76 g/L。
3 讨论
菌根真菌可以促进蓝莓对营养物质的吸收,并具有对有害微生物的拮抗能力。野生蓝莓基本上均侵染了菌根真菌[14],而在人工种植时,侵染率较低。本研究显示,宣城地区种植园中红壤和合肥地区种植园中改良水稻土栽培的蓝莓根系的侵染率相对较高,分别为43.33%和36.66%,而怀宁地区红黄壤中蓝莓根系侵染率较低为20.00%,菌根侵染率低于野生环境,这可能是人工种植蓝莓易出现各种疾病的原因之一。在选择蓝莓栽培土壤时,可以优先选择侵染率较高的土壤类型。目前在建设蓝莓种植园时,普遍使用硫磺等物质处理土壤,使土壤的理化性质适宜,但是缺少对土壤微生物群落结构维持和改造的考虑。因此,对改造后的土壤,可以考虑加入适当的促生微生物,改善土壤微生物结构,促进蓝莓的菌根侵染。
对安徽不同地区的蓝莓菌根形态观察表明,菌根主要表现为外生菌根,但怀宁地区和宣城地区的蓝莓根系中也有胞间贯穿菌丝和胞内菌丝团,侵染形式更加多样。合肥地区的蓝莓种植土壤中可考虑加入能形成胞内寄生的菌根真菌,提高侵染的多样性。本研究从安徽不同地区栽培的蓝莓根系中共分离出17株内生菌,共6种菌属。其中木霉属(Trichoderma)数量最多,为5株,为安徽蓝莓根系中内生的优势真菌。拮抗实验表明,大部分的木霉菌均可拮抗尖孢镰刀菌,是一类促进蓝莓抗病性的菌根真菌[21]。4株属于镰刀菌属(Fusarium),各地区蓝莓根系中均有发现,说明在安徽各地区,尖孢镰刀菌的侵染普遍存在,是威胁蓝莓健康生长的主要致病菌[22],对尖孢镰刀菌的进一步研究对蓝莓根腐病的防治提供理论依据。其余4株属于曲霉属(Aspergillus),2株属于青霉属(Penicillium),1 株属于枝孢属(Cladosporium),1株属于根霉属(Rhizopus)。青霉属的菌株一方面可以拮抗其它有害微生物,促进蓝莓生长,但在蓝莓果实贮藏、运输的过程中导致果实减产[23],枝孢属(Cladosporium)也是一种植物治病菌[24],可对蓝莓病原菌进行治理和防治。
安徽宣城地区的红壤,所筛菌株数目最多,种类也较丰富。这可能是因为红壤为酸性土壤,且微生物资源丰富,适宜蓝莓种植,对其土壤的人工改造不多,保留了较多的微生物类群。而合肥大圩地区的改良水稻土虽然经过硫磺等化学物质改造,但因为其富含腐殖质,导致侵染的菌根真菌的种类较多。怀宁地区蓝莓根系侵染率较低,且分离的菌根真菌种类较少,需要特别注意土壤微生物群落的改造。
蓝莓根腐病致病菌大多为尖孢镰刀菌,故寻找降低甚至杀死尖孢镰刀菌的生物防治方法方法成为当务之急。目前发现的拮抗尖孢镰刀菌的生防菌大多为木霉菌、丛枝根菌和芽孢杆菌,而本研究分离的棘孢木霉Hfsu02等多株木霉属菌根真菌可有效拮抗尖孢镰刀菌,说明木霉类群普遍在尖孢镰刀菌的生物防治上具有一定的效果,在蓝莓根腐病的生物防治方面,具有较好的应用潜力和应用价值。
棘孢木霉作为生防微生物,在农业生产中有重要作用。为提高棘孢木霉Hfsu02的生长速率,本研究探究了关于以下几个因素:碳源、氮源、温度及pH对其生长状况的影响。研究表明温度与pH对菌体生长状况的影响较大,其中最适于棘孢木霉Hfsu02的生长温度为25℃,最适的pH=4,此结果与李琳等[25]研究的棘孢木霉T31的最适温度30℃,最适的pH=6不相同,其对酸性条件的适应性和其长期生存在改造后的酸性土壤中(实测pH=3.2)有关。棘孢木霉Hfsu02的最适pH和蓝莓对土壤的酸碱性近似,有利于其与蓝莓根部的共生,相比其它棘孢木霉,更适用于防治蓝莓根腐病。本研究对棘孢木霉Hfsu02最适温度、最适pH的测定以及其在基础培养基中液体培养的生长曲线测定,为棘孢木霉Hfsu02的大规模培养和接种提供了理论依据,对扩大蓝莓产量和质量,预防蓝莓疾病具有重要的应用价值。

