神经母细胞瘤抑瘤蛋白1在肺动脉高压大鼠中的表达变化
孟刘坤,滕 晓,袁 雯,孟 健,李 君,刘晓艳
(1.中国医学科学院 北京协和医学院 国家心血管病中心阜外医院 心血管疾病国家重点实验室,北京 100037;2. 首都医科大学附属北京朝阳医院医学研究中心,北京 100020)
肺动脉高压(pulmonary arterial hypertension,PAH)是一种由异源性疾病以不同发病机制引起的,以肺小动脉进行性重构和肺血管阻力持续增加为特征的临床综合征[1],具有潜在致死性,是继冠脉综合征、高血压之后最常见的心血管病综合征。研究发现,肺动脉细胞组份重获增殖潜能导致的肺血管持续性重构是PAH的主要病理改变,表现为无肌层肺小动脉肌化,肌性肺动脉中膜肌层增厚,特征性的肺小动脉新生内膜和丛状病变的形成[2]。
先前的研究发现,神经母细胞瘤抑瘤蛋白1(neuroblastoma suppression of tumorigenicity 1,NBL1)在正常肺组织中表达水平最高,而其在肺组织发育及病理状态下的作用至今未知[3-5]。肿瘤方面的研究发现,NBL1对肿瘤细胞的增殖具有重要的调节作用[6-9],但NBL1对肺动脉细胞的影响至今未知。因此,我们推测NBL1或参与了PAH的肺血管重构。本实验拟研究野百合碱(monocrotaline,MCT)诱导的PAH大鼠肺组织和血浆中NBL1的水平及变化趋势,为探讨其在肺血管重构中的作用及作为PAH潜在的生物标志物奠定理论基础。
1 材料与方法
1.1 材料
1.1.1实验动物 SD大鼠40只,♂,体质量(200±10)g,购于北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2012-0001,均在中国医学科学院阜外医院实验动物中心饲养。
1.1.2试剂 MCT (Sigma公司);TRIzol (Invitrogen公司);AMV逆转录试剂盒、PCR引物(TaKaRa生物工程有限公司);抗NBL1抗体(Proteintech公司);抗p-Smad1/5/8抗体(Cell Signaling Technology公司);抗Smad1/5/8抗体(Santa Cruz公司);抗GAPDH抗体(Abmart公司);二辛可酸蛋白定量试剂盒(Abcam公司, ab102536);NBL1 ELISA检测试剂盒(R&D公司, DY955);Power SYBR green PCR mastermix (ABI公司);重组人BMP-2、重组人BMP-4(R&D公司)。
1.1.3仪器 Inspria ASVP小动物呼吸机(Harvard Apparatus公司);Powerlab 16/30生理记录仪(AD Instruments公司); 奥德赛红外成像系统(LI-COR Biosciences)。
1.2 动物实验
1.2.1MCT诱导的PAH动物模型的制备 大鼠随机分为对照组(Control组)、野百合碱3周组(MCT-3W)、野百合碱4周组(MCT-4W)、野百合碱5周组(MCT-5W),每组10只。分别腹腔注射无菌生理盐水或MCT 60 mg·kg-1。腹腔注射后,SD大鼠置于恒温室内饲养(21 ℃,相对湿度50%~70%),不限食水。本研究相关动物实验得到北京协和医学院阜外医院实验动物伦理委员会的批准(北京协和医学院阜外医院动物委员会,NO. 0000502)。
1.2.2肺血流动力学指标的测量 MCT组注射MCT后3~5周,以及Control组注射生理盐水后5周,行右心导管测量肺血流动力学指标[10-11]。将13 cm长、尖端弯曲的聚乙烯右心导管(外径0.9 mm,北京协和医学院基础所病理生理学实验室提供)用肝素生理盐水预充后,一端连于Powerlab 16/30,一端缓慢送入右侧颈外静脉、右心房、右心室和肺动脉主干,记录肺循环血流动力学指标(右心室收缩压、肺动脉收缩压、平均肺动脉压),右心导管的具体位置以上述部位的典型压力波形和波幅来确定。
1.2.3大鼠血浆NBL1浓度的测定 右心导管测压完成后,用采血针经下腔静脉采血2 mL, EDTA抗凝,4 ℃静置0.5 h后,3 000 r·min-1离心15 min;吸取上清,分装保存于-80 ℃冰箱备用。大鼠血浆NBL1浓度的测定分别使用双抗体夹心法ELISA试剂盒,检测范围分别为62.5~4 000 ng·L-1。具体操作按照试剂盒说明书进行。
1.2.4心肺组织取材及右室肥厚指数的计算 肺血流动力学测量后,以4 ℃ PBS经下腔静脉快速冲洗心肺组织,冲洗完毕后,迅速整体剪下心肺组织置于冰块上;剪下左肺上部,存放于冻存管后,迅速放于-80 ℃液氮中保存,以备后续qPCR和Western blot检测NBL1表达水平的变化;余肺置于10%中性福尔马林常温固定24 h,流水冲洗12 h,制成肺组织蜡块,用于免疫组织化学检测NBL1的肺组织定位。
取出心脏,生理盐水冲净,去除左右心房及相连大血管, 将右心室(right ventricular, RV)、左心室(left ventricular, LV)及室间隔(interventricular septum,IVS)剪下,滤纸吸干后称重。按如下公式计算右室肥厚指数(fulton index): Fulton index=RV/(LV+IVS)。
1.3 体外细胞功能学实验人肺动脉内皮细胞购于ScienCell公司,将液氮中冻存的肺动脉内皮细胞进行复苏及传代,置于37 ℃、5% CO2恒温细胞培养箱中,以完全内皮细胞培养液培养。将2~3代的肺动脉内皮细胞以2×105个细胞接种于25 cm2塑料细胞培养瓶,培养至融合率达到80%~90%后,进行后续的细胞功能学实验。分为4组:对照组、BMP-2/4(20 μg·L-1)刺激组、NBL1(100、2 000 μg·L-1)+BMP-2/4(20 μg·L-1)组。
1.4 实时荧光定量PCR检测TRIzol法提取肺组织总RNA,取纯化的RNA 1 μg逆转录为cDNA,利用qPCR方法检测NBL1 mRNA的表达变化[12]。各引物序列如下: NBL1正向引物5′-CCACAGGATGCCTGAAGATGAA-3′, 反向引物5′-AGGTTAGCCTGGGCAGGATTG-3′; GAPDH正向引物5′-GGCACAGTCAAGGCGAGAATG -3′, 反向引物5′-ATGGTGGTGAAGACGCCAGTA-3′。
1.5 Western blot实验提取制备肺组织或肺动脉内皮细胞总蛋白样品,二辛可酸法测定蛋白样品浓度后,各肺组织标本取50 μg蛋白,100 ℃加热5 min蛋白变性,然后4%~12%的Nu-PAGE预制胶上行电泳分离蛋白质; 经半干转的方式将蛋白转移至硝酸纤维素膜上,用5%的脱脂牛奶常温下封闭1 h,一抗 (抗NBL 1 ∶500,抗GAPDH 1 ∶5 000) 4 ℃摇床孵育过夜; 洗膜缓冲液漂洗后,加入IRDye 680二抗 (1 ∶1 000),室温下反应1 h后,TBST再次洗涤,使用奥德赛红外成像系统进行成像。
1.6 免疫组织化学染色取肺组织蜡块,切片(2~4 μm),贴片, 二甲苯透明及无水乙醇梯度脱水,PBS洗涤,5 min×3次,100 ℃沸水中高压修复抗原; 滴加Triton X-100(体积分数0.3%)破细胞膜,并孵育20 min; 山羊血清封闭非特异性位点20 min后,滴加抗NBL1一抗 (1 ∶400),4 ℃孵育过夜,37 ℃复温45 min, PBS洗涤,5 min×3次,滴加辣根过氧化物酶标记二抗 (1 ∶400),37 ℃孵育1 h; PBS洗涤,5 min×3次,DAB显色液显色5~10 min,显微镜下掌握好显色程度,流水冲洗10 min终止显色; 苏木精复染2 min;1%盐酸乙醇分化20 s;流水冲洗10 min;乙醇梯度脱水;二甲苯透明;封片,镜检拍片(显棕褐色者为阳性)。
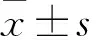
2 结果
2.1 实验动物总体存活情况与PAH模型程度的评估注射操作未引发相关死亡。Control组饲养过程中无死亡;MCT-3W组死亡1只,MCT-4W组死亡3只,MCT-5W组死亡4只,尸检发现胸腔积液,肝脏淤血硬化,死亡原因考虑为心力衰竭,剩余的实验动物全部存活至取材时间,右心导管测压过程无操作相关死亡,相应数据全部包括在最后的数据分析中。
腹腔注射MCT 3周~5周期间,MCT组的肺血流动力学指标(右室收缩压、肺动脉收缩压、平均肺动脉压)和右心室肥厚程度均较对照组大鼠明显升高,且这种升高表现为时间依赖的渐进性升高(Tab 1)。提示MCT在SD大鼠上成功诱导出典型的PAH疾病状态,能很好地模拟PAH的病理生理学状态。
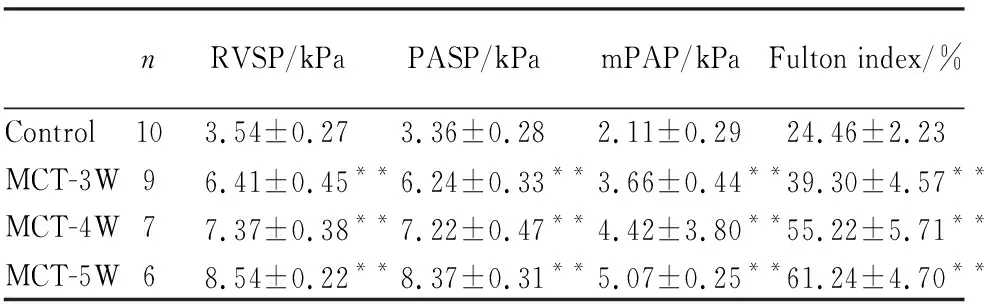
2.2 NBL1 mRNA在PAH大鼠肺组织中的表达变化如Fig 1所示,与对照组相比,MCT诱导的PAH大鼠肺组织NBL1 mRNA水平呈时间依赖性的降低,MCT注射后3周开始, SD大鼠肺组织NBL1 mRNA水平开始明显降低,3周、4周、5周时较对照组分别下降70%、81%和89%。
Tab 1 Hemodynamic indices and right ventricular hypertrophy index of rats
RVSP: right ventricular systolic pressure value; PASP: pulmonary artery systolic pressure value; mPAP: mean pulmonary artery pressure value; Fulton index: right ventricular hypertrophy index.**P<0.01vscontrol.
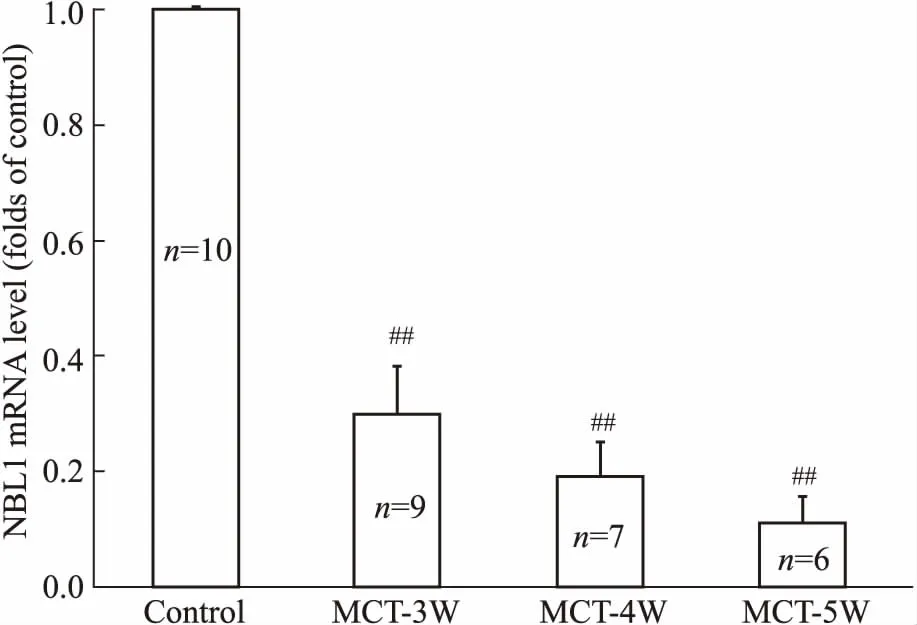
Fig 1 Changes of NBL1 mRNA levels in MCT induced PAH rat lungs
##P<0.01vscontrol group.
2.3 NBL1蛋白在PAH大鼠肺组织中的表达变化如Fig 2所示,与对照组相比,MCT诱导的PAH大鼠肺组织NBL1的蛋白水平呈时间依赖性的降低,MCT注射后3周开始, SD大鼠肺组织NBL1蛋白水平较对照组开始降低,5周时几乎检测不到。

Fig 2 Expression trend of protein level of NBL1 in rat lungs with MCT-induced PAH
##P<0.01vscontrol group
2.4 NBL1在MCT诱导的PAH肺组织中的变化趋势免疫组织化学染色显示(Fig 3),NBL1在正常肺组织肺小动脉管壁中强表达,但在MCT诱导的PAH大鼠肺组织中,中膜肥厚的肺小动脉管壁中仅检测到微弱的NBL1表达。
Fig 3 Localization of NBL1 protein in pulmonary arterioles (×1000)
A: Normal pulmonary artery in lungs from control group; B: Pulmonary artery with mild thickened media in lungs from MCT-5 weeks group; C: Pulmonary artery with severe thickened media in lungs from MCT-5 weeks group.
2.5 NBL1血浆浓度在PAH大鼠中的变化趋势Fig 4的ELISA结果显示,MCT诱导的PAH大鼠NBL1血浆浓度较对照组呈现出时间依赖性的明显降低。Fig 5的相关性分析显示,大鼠血浆NBL1浓度与右心导管测定的右心室收缩压(r=-0.762 2,P<0.01)、肺动脉收缩压(r=-0.767 1,P<0.01)、平均肺动脉压(r=-0.789 6,P<0.01)及右室肥厚指数(r=-0.812 9,P<0.01)均呈明显负相关。
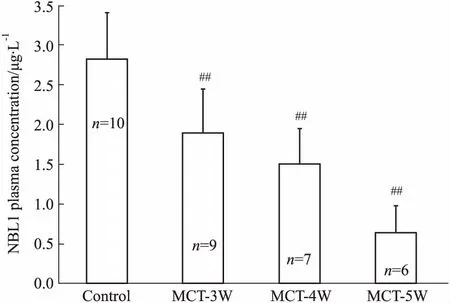
Fig 4 Change trend of plasma concentration of NBL1 in rats
##P<0.01vscontrol group
2.6 NBL1抑制BMP2/4诱导的肺动脉内皮细胞Smad 1/5/8信号通路的激活为了明确NBL1在PAH发生、发展中的作用机制,我们进行了细胞水平的研究。与预期一致,BMP2/4能诱导肺动脉内皮细胞Smad 1/5/8的磷酸化,提示肺动脉内皮细胞BMP信号通路的激活;而NBL1则浓度依赖性地抑制BMP2/4引起的肺动脉内皮细胞内Smad 1/5/8的磷酸化,提示NBL1能抑制BMP信号通路的激活。见Fig 6。

Fig 5 NBL1 plasma concentration presented a negative correlation with extent of PAH in rats with MCT-induced PAH
3 讨论
PAH是炎症、低氧、体-肺分流、基因突变等原因引起的,以肺血管严重重构导致肺血管阻力增高为特征的慢性致死性疾病[1]。研究已发现众多导致PAH的分子机制,信号通路靶向药物也已用于临床治疗,PAH患者的症状虽有改善,但患者的病死率并未明显改善[2],说明PAH研究领域中尚有未被阐明的发病机制。
NBL1是一种普遍存在于哺乳动物组织和体液中的分泌型蛋白质,起初在大鼠成纤维细胞转化模型中发现其具有抑制肿瘤作用[3]。后续研究发现,NBL1的表达水平在一些表型转换的细胞中明显下调,而NBL1的过表达则抑制静止细胞进入细胞周期的S期[4,9]。因此,NBL1或是细胞增殖的负调节因子,其下调或缺失或可导致细胞表型的转换。而肺动脉细胞组份表型的转换,即从静止的、非可迁移的分化表型转化为增殖、可迁移的合成或分泌表型,是PAH进展的主要特点[13]。因此,我们推测NBL1在PAH肺组织和血浆中的变化,可能参与了PAH的发生和发展。
目前,PAH研究中多采用MCT诱导的大鼠PAH模型,此模型制备简单,进展迅速,且个体间PAH程度较均一。另外,在此模型上,先前的研究发现了PAH的诸多发病机制,因此,MCT诱导的PAH大鼠模型是可靠的PAH动物模型[11, 14]。本研究发现,腹腔注射MCT 3周后,SD大鼠肺血流动力学指标(右室收缩压、肺动脉收缩压、平均肺动脉压)及右室肥厚指数均呈现时间依赖性的明显升高,证明MCT诱导的PAH模型制备成功。在此基础上,我们研究了NBL1水平在MCT诱导的PAH肺组织和血浆中的变化趋势及其临床意义。
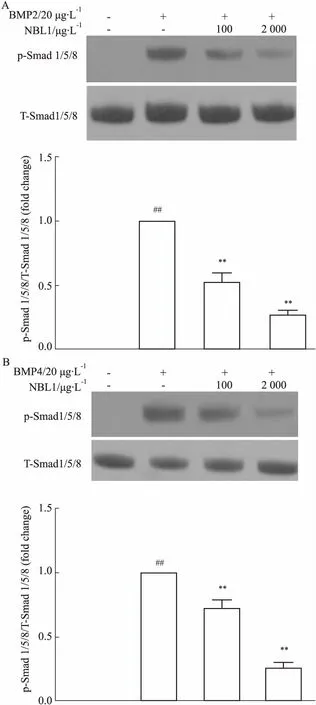
Fig 6 NBL1 inhibited activation of BMP signal of pulmonary artery endothelial cells induced by BMP2/4 n=3)
A: NBL1 dose-dependently inhibited BMP-2 induced Smad 1/5/8 phosphoralation; B: NBL1 dose-dependently inhibited BMP-4 induced Smad 1/5/8 phosphoralation.##P<0.01vscontrol group;**P<0.01vsBMP4 group.
先前的研究发现,除肝脏外,NBL1在多种组织器官中均有表达,当然表达的水平不尽相同,其中肺组织的表达最高[3-5],提示其在肺组织中存在特异性表达的可能,但NBL1在肺组织发育及病理状态下的作用至今没有研究。本研究发现,MCT诱导PAH大鼠肺组织NBL1的mRNA水平和蛋白水平呈现时间依赖性的逐步降低,且在正常肺组织中,NBL1在肺小动脉管壁中高表达,而在重构的肺小动脉中几乎检测不到NBL1的表达。BMP受体Ⅱ的致病性突变及BMP信号通路活性的下降,在PAH的进程中发挥重要作用[15-16]。我们的结果表明,在肺动脉内皮细胞中,NBL1可以拮抗BMP-2和BMP-4刺激Smad 1/5/8磷酸化的作用,提示NBL1可拮抗肺动脉内皮细胞中BMP信号通路的激活。本研究发现,MCT注射后,肺组织NBL1表达水平逐步降低,理论上讲,会减弱其对BMP信号通路的抑制作用,有拮抗炎症性PAH进展的潜在作用。目前,临床工作中常用心脏超声、右心导管及肺活检来评价PAH程度,近来生物标志物在PAH领域的研究结果令人鼓舞,有望在PAH的临床筛选、诊断、预后评估及随访等方面发挥重要作用[15]。因此,寻找PAH的生物标志物,协助准确界定PAH程度,可为PAH的临床干预提供可靠的理论依据。本研究的ELISA结果表明,MCT诱导的PAH大鼠模型中,NBL1的血浆浓度亦随MCT注射后时间的延长而逐渐降低,且与肺血流动力学指标和右室肥厚指数均呈明显负相关,提示NBL1血浆浓度可反映PAH严重程度,但PAH病人NBL1血浆浓度的变化尚无研究报道。因此,NBL1作为PAH临床生物标记物的可行性尚需进一步的临床验证。
总之,本实验证实在MCT诱导的PAH大鼠的肺组织及血浆中,NBL1的水平随着PAH的发生、发展而逐渐降低, 与PAH严重程度呈明显的相关性, 说明NBL1血浆水平或是PAH潜在的生物标志物。

