甜瓜粉霉病病原菌鉴定及三种药物对病原菌的体外抑制作用
范春霞,王军节,*,彭期定,王 鹏
(1.北方民族大学植物性农产品贮藏与加工重点实验室,宁夏银川 750021; 2.北方民族大学生物科学与工程学院,宁夏银川 750021)
玉金香甜瓜(CucumismeloL.cv.Yujinxiang)是我国西北地区主要栽培的经济作物,因其果实口感脆甜而深受广大消费者喜爱[1]。甜瓜果实采收期较为集中且正值夏季高温,并且贮运过程冷链缺乏或不完整,釆后流通各环节极易因遭受病菌侵染而腐烂变质,给当地农户和经销商带来巨大经济损失[2]。研究表明黑霉、青霉、白霉和粉霉是造成该果采后主要的真菌病害,且由粉霉造成的粉霉病最为严重[3]。因此,研究玉金香甜瓜粉霉病的控制措施十分必要。
病原鉴定是病害防治的前提与基础,形态学和分子生物学鉴定是目前病原真菌鉴定的主要手段。殷辉等[4]采用形态学特征及ITS序列特征分析,确定引起枣贮藏期粉霉病的致病菌为粉红单端孢。王勇等[5]对番茄粉霉病的致病菌进行了鉴定,确定为粉红单端孢。
化学杀菌剂如嘧菌酯虽能有效控制果蔬采后病害,但因存在药物残留、环境污染及病原物抗药性等问题而应用受限[4,6]。因此,开发绿色安全环保的措施已成为病害控制主要方向。植物精油和天然公认的安全药物成为研究热点,月桂酸是椰子、油棕等精油的主要成分之一,其对番茄叶霉病具有控制效果[7],富饶等[7]研究发现:月桂酸对番茄叶霉菌菌丝均具有抑制作用,浓度为1 mmol/L时抑菌效果最好;香芹酚为牛至、石香蕾、百里香等植物精油的主要成分之一,对桔子青霉[8]、面包酵母和黑曲霉[9]具有抑制效果,王新伟等[9]发现:香芹酚浓度为0.125 μL/mL时可抑制面包酵母的生长,浓度为0.0625 μL/mL时可抑制黑曲霉的生长;硅酸钾具有控制指状青霉、意大利青霉[10]和腐霉菌[11]等病原引起果实采后病害的潜力,Kaiser等[11]研究表明:硅酸钾的浓度为40 mL/L及更高时可达到抑制腐霉菌的效果。
然而,月桂酸、香芹酚和硅酸钾对甜瓜粉霉病菌控制效果研究和有关玉金香甜瓜果实粉霉病病原鉴定的研究鲜有报道。本研究首先对玉金香甜瓜果实粉霉病菌进行分离纯化,并通过孢子和群体形态观察以及分子生物学方法进行病原菌菌种鉴定。以化学杀菌剂嘧菌酯为阳性对照,通过月桂酸、香芹酚和硅酸钾三种药物对粉霉病病原菌进行体外抑菌试验,以期探明三种药物对甜瓜粉霉病菌抑菌效果。旨在为筛选控制甜瓜粉霉病的新型安全药物提供理论依据和技术支撑。
1 材料与方法
1.1 材料与仪器
自然发粉霉病的玉金香甜瓜果实 宁夏中卫市兴仁镇甜瓜种植农田;月桂酸(99.5%)、硅酸钾 上海麦克林生化科技有限公司;香芹酚(98.0%) 梯希爱(上海)化成工业发展有限公司。
HPS-250生化培养箱 哈尔滨东联电子技术开发有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-1FD超净工作台 苏净集团苏州安泰空气技术有限公司;B1-220A双筒生物显微镜、BA210-T生物显微镜 麦克奥迪实业集团有限公司;Multiskan Go全波长酶标仪 北京九宇金泰生物科技有限公司。
1.2 实验方法
1.2.1 病原菌的分离纯化 参照马文平等[12]方法略作修改。取有典型病害症状的甜瓜,无菌刀片切取病健交界处的组织(5 mm×5 mm),无菌超净工作台上依次在70%的酒精中浸洗3~5 s,0.1%的升汞中消毒30~45 s,然后用无菌水连续漂洗3次去除残余升汞,灭菌的吸水纸吸去多余的水分后放在事先备好的PDA平板上,于28 ℃恒温培养箱中培养3~4 d。用无菌水配制孢子悬浮液,稀释至每滴溶液中含有2~3个孢子。将配制的孢子悬浮液取10 μL于PDA培养基进行涂布,28 ℃条件培养2~3 d至单个菌落长出,再用打孔器取单个菌落于新的PDA培养基上培养,即可获得纯化的菌株(LC-1701)。随后将分离纯化的菌株在 PDA 培养基上培养7 d,加入含0.05% Tween-80 的无菌水10 mL,无菌纱布过滤,制成106个/mL孢子悬浮液,回接至健康的甜瓜果实,每个果实赤道部位用灭菌铁钉刺破果面,形成四个直径为5 mm、深为2 mm的接种点,接入10 μL配制好的孢子悬浮液,并用无菌水作对照。将对照与各处理均放入塑料框中,外套PE袋,室温(25±2) ℃培养,每个处理8~10个果实,观察其发病情况。
1.2.2 形态学观察和分子生物学鉴定
1.2.2.1 形态学鉴定 参考真菌鉴定手册等工具书[13-16],以PDA培养基为基础培养基,在28 ℃条件下恒温培养7 d连续观察菌落形态变化特征,记录菌落表面的形态结构以及培养过程中菌落大小、颜色变化。并观察有无分生孢子的产生以及分生孢子形态及产生方式、产孢梗的形态特征,对分离得到的菌株进行初步鉴定。
1.2.2.2 分子生物学鉴定 将纯化后的菌株于PDA培养基28 ℃条件下恒温培养7 d,加入10 mL无菌水在无菌环境下刮取菌丝,按照DNA提取试剂盒说明书步骤提取真菌基因组DNA,并对 rDNA-ITS 进行 PCR 扩增,扩增引物为通用引物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(3′-TCCTCCGCTTATTGATATGC-5′),引物均由上海美吉生物医药科技有限公司合成。20 μL反应体系:10×Ex Taq buffer 2.0 μL,5 U Ex Tap 0.2 μL,2.5 mmol/L dNTP Mix 1.6 μL,上下游引物各1.0 μL,模板DNA 0.5 μL,加ddH2O补至20 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,共25个循环;72 ℃充分延伸10 min。PCR产物经纯化后交由上海美吉生物医药科技有限公司测序。测序结果在NCBI数据库中通过BLAST程序与已知序列进行比对分析,应用ClustalX 2.1软件进行ITS序列对比,并利用MEGA 5.0软件以邻接法(NJ)构建基于rDNA-ITS序列的系统发育树,各分支置信度进行1000次重复分析。
1.2.3 药物处理对T.roseum菌丝生长的抑制作用 参照徐俊光[17]和李灿婴等[18]方法略作修改。以硅酸钾为例,其它两种药物及阳性对照嘧菌酯的方法相同。将浓度分别为 0.50、1.00、1.50和2.00 g/L的硅酸钾(香芹酚浓度分别为0.02、0.04、0.06和0.08 g/L;月桂酸浓度分别为0.04、0.08、0.12和0.16 g/L;嘧菌酯浓度分别为0.1、0.2、0.4、0.8 g/L)加入已灭菌并冷却至 60 ℃的PDA培养基中。再取直径为0.30 cm的菌饼,将菌饼放置于凝固后的培养基中央,于28 ℃避光条件培养。以不加任何药物的PDA培养基为空白对照,待空白对照菌落扩展至培养皿边缘时观察结果,采用十字交叉法测出菌落直径[6]。按公式(1)计算抑菌率。以抑制率转化为概率几率作为纵坐标(y),浓度转化为浓度对数为横坐标(x)做毒力回归方程,通过方程计算得到EC50,即抑制中浓度。
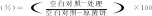
式(1)
1.2.4 药物处理对T.roseum孢子萌发的抑制作用 参照李大强[19]方法略作修改。以硅酸钾为例,其它两种药物及阳性对照的方法相同。硅酸钾(香芹酚、月桂酸)分别加入含4 mL PDB培养基的试管中,使其最终浓度分别为0.50、1.00、1.50和2.00 g/L(香芹酚最终浓度分别为0.02、0.04、0.06和0.08 g/L,月桂酸最终浓度分别为0.04、0.08、0.12和0.16 g/L;嘧菌酯浓度分别为0.1、0.2、0.4、0.8 g/L),再加入400 μL振荡均匀的浓度为 1×106个/mL 的孢子悬浮液,于28 ℃摇床培养(200 r/min)15 h后,统计孢子萌发数,方法参照李灿婴等[18]的方法。每处理各重复随机观察3个以上视野,每个视野数200个孢子,重复3 次。以不添加药物但加入400 μL孢子悬浮液的PDB培养基为空白对照组,根据公式(2)和(3)分别计算孢子萌发率及孢子萌发抑制率。以抑制率转化为概率几率作为纵坐标(y),浓度转化为浓度对数为横坐标(x)做毒力回归方程,通过方程计算得到EC50。

式(2)
孢子萌发抑制率(%)=1-孢子萌发数
式(3)
1.2.5 最小抑菌浓度(MIC)的测定 参照陶翠等[20]方法略作修改。采用试管倍比稀释法,以硅酸钾为例,另外两种药物方法相同。将2 mL 4.00 g/L的硅酸钾(香芹酚0.16 g/L、月桂酸0.32 g/L、嘧菌酯0.8 g/L)的药液置于1号试管中,再吸取2 mL最高浓度(4.00 g/L)药液于试管2号加2 mL稀释液,从2号试管吸取2 mL稀释液到试管3,以此类推,直到稀释到第10管,最后每根试管加入2 mL 105个/mL的孢子悬浮液,第11管为生长对照组(加菌不加药物),第12管为空白对照管(仅含培养基)。将各试管置于28 ℃(200 r/min)培养7 d,在不搅动的情况下肉眼判断,溶液清晰透明视为真菌完全不生长,取完全不生长管的最低药物浓度为MIC。
1.2.6 动态抑菌试验 参照熊骏等[21]方法并略作修改,取若干的干燥无菌试管于超净工作台中,加入经灭菌的察氏培养基5 mL,然后加入不同体积的母液药物配制成含硅酸钾(0.50、1.00、1.50和2.00 g/L);香芹酚(0.02、0.04、0.06和0.08 g/L);月桂酸(0.04、0.08、0.12和0.16 g/L);嘧菌酯浓度(0.1、0.2、0.4和0.8 g/L)的察氏培养基,再加入200 μL的浓度为106个/mL的孢子悬浮液,无菌橡胶塞好管口做好标记。以加入200 μL 106个/mL菌悬液的察氏培养基作为空白对照,在28 ℃恒温培养箱中振荡(200 r/min)培养,每隔1 d用分光光度计在λ=505 nm测定吸光值。重复实验测定3次,取平均值。以吸光值为纵坐标,培养时间为横坐标绘制动态抑菌曲线。
1.3 数据处理
实验数据利用SPSS 19.0软件统计分析,计算标准偏差或进行Duncan’s多重差异显著性分析,p<0.05时为差异显著。实验每组重复3次,数据采用M±SD表示。
2 结果与分析
2.1 病原菌的鉴定
2.1.1 病原菌的形态学特征及致病性 粉霉病是甜瓜采后常见的病害之一,自然发病症状如图1A所示,发病初期呈圆形或者椭圆形白色絮状霉点,后期形成厚重的粉色霉层。将分离纯化得到的病原菌在PDA 培养基培养,菌落初呈白色、粉状或絮状,后逐渐变成粉红色(图1B),背面呈米黄色(图1C)。分生孢子梗(图1D)无色、直立、不分枝,顶端稍膨大。分生孢子(图1E)顶生,倒洋梨形,1个隔膜、隔膜处稍缢缩,着生痕在分生孢子基端或其一侧。回接病原菌3 d后甜瓜果实表面出现明显症状(图1F),进一步分离纯化得到的病原与之前接种的病菌一致,符合科赫法则[12],证明该菌株(LC-1701)为致病菌。

图1 粉霉病发病症状及LC-1701形态Fig.1 Symptoms of pink rot and morphology of LC-1701
2.1.2 病原菌的分子生物学鉴定 将该病原菌的ITS区测序结果在NCBI网站进行比对,从Gen-Bank数据库中搜索相似度达90%以上的同源序列,通过MEGA 5.05软件构建系统发育树(图2)。结合形态学特征、致病性测定及分子鉴定,确定引起甜瓜粉霉病的病原为粉红单端孢(Trichotheciumroseum)。

图2 LC-1701系统发育树Fig.2 The phylogenetic tree of LC-1701
2.2 药物处理对T.roseum菌丝生长的抑制效果
三种药物对T.roseum菌落直径扩展的影响如表1所示。由表1可知三种药物处理对于病原菌T.roseum的菌落直径均有抑制作用,且随着浓度的增长,三种药物的抑制率也随之增长:硅酸钾KSI浓度为2.00 g/L时,抑制率为65.94%;香芹酚Xq浓度为0.08 g/L,抑制率为68.60%;月桂酸LA浓度为0.16 g/L,抑制率就达到80.41%。但是三种药物与阳性对照嘧菌酯相比,抑菌率均偏低,其中月桂酸的抑菌率最接近于嘧菌酯的抑菌率。三种药物的最大浓度抑制效果总体趋势为LA>Xq>KSI。

表1 不同药物浓度对T.roseum生长的影响Table 1 Effect of different chemical concentrations on the growth of T. roseum
三种药物浓度对数与病原真菌T.roseum的抑制率转化概率之间存在着一定的线性关系,线性方程如表2所示。从表2中可以看出决定系数R2均大于0.90,表明线性相关性良好。EC50数值的大小可以反映药剂对菌丝的毒性大小,数值越小表示毒性越强。三种药物中对于致病真菌菌丝的毒性均低于阳性对照嘧菌酯,其中香芹酚对致病真菌菌丝的毒性最接近阳性对照嘧菌酯,且三种药物对T.roseum毒性由强弱为Xq>LA>KSI。
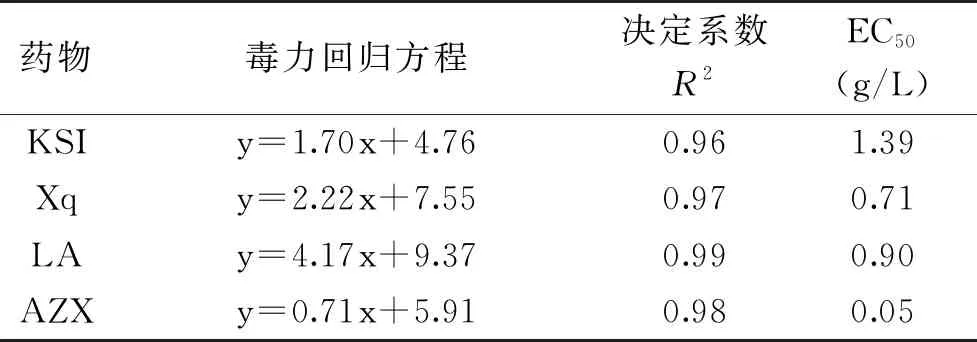
表2 不同药物对T.roseum菌丝生长的抑制作用Table 2 Inhibition of different chemicals on the hyphae growth of T. roseum
2.3 药物处理对T.roseum孢子萌发的抑制效果
三种药物对T.roseum孢子萌发的影响如表3所示。从表3可知,三种药物对T.roseum孢子萌发抑制率随着药物浓度的提高而增大。KSI浓度为2.00 g/L(Xq浓度为0.08 g/L,LA浓度为0.16 g/L)时,对孢子萌发抑制率分别为:61.24%(70.04%、77.53%),但是三种药物与阳性对照嘧菌酯相比,对T.roseum孢子萌发的抑菌率均偏低,其中月桂酸的抑菌率最接近于阳性对照嘧菌酯的抑菌率。三种药物的最大浓度抑制效果总体趋势为LA>Xq>KSI,该结果与三种药物对T.roseum菌丝生长的抑制效果结果一致。

表3 不同浓度药物对T.roseum孢子萌发的影响Table 3 Effects of different concentrations of chemical on the spore germination of T. roseum
三种药物浓度对数与病原真菌T.roseum的抑制率转化概率之间存在着一定的线性关系,线性方程如表4所示。毒力回归方程直线斜率可以反映病原菌对药剂的敏感性,斜率越大表明敏感性越强。由表4的数据可得T.roseum对于三种药物的敏感程度均强于阳性对照嘧菌酯,T.roseum对于三种药物的敏感程度由强至弱依次为Xq>KSI>LA。

表4 不同药物对T.roseum孢子萌发的抑制作用Table 4 Inhibition of different chemicals on the spore germination of T.roseum
2.4 最小抑菌浓度(MIC)
MIC表示最小抑菌药物浓度,数值越小,表明T.roseum对于该药物越敏感。由表5可得出,KSI、Xq和LA三种药物的MIC分别为1.50、0.08和0.12 g/L,说明T.roseum对Xq和AZX最敏感,LA次之,KSI最不敏感。
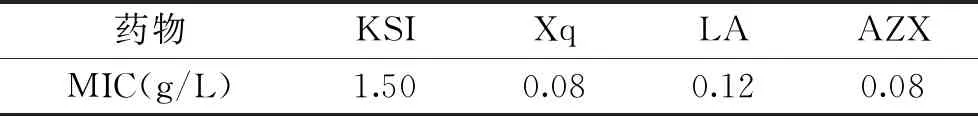
表5 不同药物的最小的抑菌浓度Table 5 Minimum inhibitory concentration of different chemicals
2.5 三种药物的动态抑制效果
由图3可知,三种药物在不同时间段与对照组吸光值相差较大。随着时间的增加,含药培养基与CK的OD505值均在增加,培养时间为1~2 d时,OD505值显著增加(p<0.05),2 d后OD505值均趋于稳态。培养时间为1 d时,各含药培养基与CK相比,OD505值没有显著差异。而从2 d开始,含药培养基与CK的吸光度值出现明显差异,CK的OD505值显著大于三种含药培养基的OD505值(p<0.05),说明培养2 d开始,三种药物均对病原菌T.roseum产生抑制作用。

图3 不同药物处理对T.roseum吸光度的影响Fig.3 Effect of different chemicals treatments on the absorbance of T. roseum注:同一时间标有不同字母表示有显著性差异(p<0.05)。
3 讨论与结论
采用形态学和分子生物学相结合的方法,确定了引起玉金香甜瓜粉霉病的病原菌为T.roseum。该结果与梨[22]、葡萄[23]、番茄[24-25]、菜豆[26]和辣椒[27]等果蔬发生粉霉病害的病原菌鉴定结果一致。形态学鉴定中该菌的形态特征与龙眼[28]和番茄[29]红粉病的病原菌的分生孢子形态特征基本一致。且发病症状与枣果实[4]和番茄果实[5]发病症状一致,均呈现前期为水浸状斑,初期呈圆形或椭圆形的白色絮状霉点;后期形成较厚的粉状霉层,严重时霉层密布整个果面,致使果实发硬、发苦。
硅酸钾、月桂酸和香芹酚三种药物对T.roseum的菌丝扩展和孢子萌发均有明显的抑制作用,且随着药物浓度的增加,抑菌效果增强。当硅酸钾在浓度为2.00 g/L对T.roseum的菌丝扩展和孢子萌发抑制率分别为65.94%和61.24%;月桂酸0.08 g/L对T.roseum的菌丝扩展和孢子萌发抑制率分别为68.60%和70.04%;0.16 g/L对T.roseum的菌丝扩展和孢子萌发抑制率分别为80.41%和77.53%。该结果与富饶等[6]和王新伟等[8]研究结果一致。王毅等[30]研究发现硅酸钠可通过直接抑菌和诱导果实抗性来抑制杏的粉霉病。牛黎莉等[31]发现硅酸钠之所以能够抑制T.roseum孢子萌发和菌落生长,其主要原因是硅酸根离子对其孢子结构的破坏。蒋增良等[32]研究结果表明:月桂酸的衍生物月桂酸单甘油酯的抑菌机理主要是通过影响细胞壁、细胞膜、代谢酶及蛋白质合成系统等细胞亚结构来实现。潘永梅[33]发现香芹酚能够抑制由炭疽病菌引起的批把果实腐栏的原因是间接提高果实抗氧化能力和抗病性以及直接抑菌作用三方面协调作用的结果。Ultee 等[34-35]研究结果表明,香芹酚可使微生物膜流动性增强,导致质子和钾离子渗漏,致使膜电位崩溃以及ATP 的合成受到抑制。由此可知,硅酸钾、月桂酸和香芹酚三种药物具有控制甜瓜果实粉霉病的潜力,但其对果实的体内作用效果以及抑菌机理均有待进一步研究。
综上可知,甜瓜粉霉病病原菌是T.roseum;硅酸钾、月桂酸和香芹酚三种药物对该菌均有体外抑制效果,且香芹酚抑菌效果最佳;三种药物均具有控制甜瓜粉霉病的潜力。

