PEG模拟干旱胁迫对水稻抗氧化酶基因表达的影响
连玲 许惠滨 何炜 朱永生 潘丽燕 魏毅东 郑燕梅 罗曦 谢华安 张建福



摘 要:【目的】干旱是影响水稻生产的重要环境因素之一,在干旱条件下水稻植株体内会发生一系列的抗逆反应,其中参与防御反应的关键酶基因表达会发生明显的变化。因此,本研究拟分析干旱胁迫处理后抗氧化酶类基因的表达变化,为进一步研究水稻抗旱机制提供理论参考。【方法】采用质量体积比为0(CK)、18%、20%、22%、24%、26% 的聚乙二醇(PEG6000)对三叶一心期的籼稻航2号植株进行干旱胁迫处理,筛选适合处理籼稻航2号的PEG6000质量体积比;进一步采用PEG6000对航2号植株进行干旱胁迫处理,分别于处理0、2、4、8、12、24、48、72 h取样;并用SYBR Green I荧光定量PCR(qRT-PCR)分析PEG6000处理不同时间段后植株中抗氧化酶类基因表达,包括过氧化氢酶(CATA、CATB、CATC)、过氧化物酶(POX5.1、POX1)、超氧化物歧化酶(plastidic Cu/Zn-SOD,cytosolic Cu/Zn-SOD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)基因的表达变化。【结果】根据表型观察和植株存活率,筛选出籼稻航2号对PEG6000的耐受临界质量体积比为22%;qRT-PCR结果表明PEG6000胁迫处理后9个基因的表达均出现上调,大部分基因表达都呈先上调后下调的趋势,且一般PEG处理4 h之后基因表达出现较明显上调,说明这些基因均不同程度地参与了PEG胁迫反应;其中,过氧化氢酶A基因(CATA)表达变化最显著,处理8 h表达量上调至处理0 h的28倍。【结论】PEG6000胁迫处理后主要的抗氧化酶类基因表达发生了明显的变化。
关键词:水稻;聚乙二醇(PEG6000);干旱胁迫;抗氧化酶基因;表达分析
中图分类号:S 511文献标识码:A文章编号:1008-0384(2019)03-255-09
Abstract: 【Objective】Expression of antioxidant enzyme genes of rice in response to drought-stress was studied. 【Method】 Simulated drought conditions using PEG6000 on Indica rice Hang 2 were used for the experimentation. The plants at 3-leaf stage were initially treated with 0% (CK),18%,20%,22%,24% or 26% PEG6000 to determine the appropriate concentration for the subsequent test. Under the selected PEG6000 treatment level,plant samples were collected at 0,2,4,8,12,24,48 and 72 h for analysis. The expressions of antioxidant enzyme genes (i.e.,CATA,CATB and CATC),peroxidase genes (i.e.,POX5.1 and POX1),superoxide dismutase genes (i.e.,plastidic Cu/Zn-SOD and cytosolic Cu/Zn-SOD),ascorbate peroxidase gene (i.e.,APX),and glutathione reductase gene (i.e.,GR) of the rice plants were determined by qRT-PCR. 【Result】Based on the phenotype and survival rate of the rice plants in the preliminary test,22% PEG6000 was chosen for the simulation experiment. The results of qRT-PCR showed that all 9 genes were upregulated initially under the treatment but downregulated afterward. Most of the genes significantly upregulated 4 h after treatment showing a response of the genes to the stress. In particular,CATA exhibited a most significant change at 8 h which was 28 times of that at 0 h. 【Conclusion】The expression of antioxidant enzyme genes significantly reacted to the PEG6000 treatment.
Key words:rice;PEG6000; drought stress; antioxidant enzymes genes; expression analysis
0 引言
【研究意義】水稻是我国第一大粮食作物,约占粮食总产量的40%,全国有60%以上的人口以大米为主食,水稻产量与国家粮食安全问题密切相关。水稻对水分要求高,干旱是水稻生产的主要限制因素,导致水稻生长发育受阻,造成严重减产[1]。因此,进行水稻抗旱分子机制及重要基因的表达调控等方面相关研究对提高水稻抗旱性具有重要意义。【前人研究进展】干旱胁迫会使植株出现叶片卷曲,气孔闭合,体内CO2含量降低,光合作用减弱等级联反应,引发植物体在渗透调节、酶保护体系、抗旱基因表达与遗传特性等方面产生一系列的生理生化变化,从而使植物体内平衡的自由基稳态遭到破坏[2]。植物细胞的第一层防线——质膜透性的破坏会使细胞膜上合成的过氧化产物(丙二醛,MDA)含量升高,同时植物体内容易产生大量的活性氧(ROS),包括超氧阴离子(O-2)、过氧化氢(H2O2)、单线态氧(1O2)和羟自由基(OH-)等[3]。过量的活性氧会造成生物膜的过氧化损伤,使得细胞器受损害,并造成DNA和蛋白质等的降解,最终导致膜整体结构瓦解和细胞死亡[4]。在干旱刺激下,植物首先会通过激活自身的酶系统进行协调运作以避免细胞内ROS的过分积累而伤害细胞膜。研究表明,植物体内的酶促系统对活性氧的清除起着举足轻重的作用,此酶促系统中包含的抗氧化酶包括过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxisome,POX)、超氧化物歧化酶(Superoxide dismutase,SOD)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、谷胱甘肽还原酶(Glutathione reductase,GR)等[5-7]。过氧化氢酶(CAT)是植物抗氧化防御系统的关键酶之一,其作用是把H2O2分解成水和氧气;在水稻中包含3种同工酶CATA、CATB、CATC,它们均参与H2O2的分解[8-10]。过氧化物酶(POX)也是维持植物细胞正常生理活动的保护酶,是一种含血红素的糖蛋白,催化H2O2和各种还原剂的氧化还原反应(H2O2+AH2→2 H2O+A)[11];水稻中已被鉴定的POX基因有22种[12]。超氧化物歧化酶(SOD)能清除植物体内多余的超氧阴离子(O-2),使O-2发生歧化反应生成H2O2和O2,H2O2可通过其他相关的抗氧化酶进行清除;根据其辅基部位所结合的金属离子的不同,植物中主要有3种超氧化物歧化酶(SOD),包括铜锌超氧化物歧化酶(Cu/Zn-SOD)、铁超氧化物歧化酶(Fe-SOD)、锰超氧化物歧化酶(Mn-SOD)[13];其中,水稻基因组中包含4个铜锌超氧化物歧化酶(Cu/Zn-SOD)基因[14]。抗坏血酸过氧化物酶(APX)是以抗坏血酸盐为电子供体,将H2O2还原为H2O和O2;在水稻中包含有8种APX同工酶基因[15]。谷胱甘肽还原酶(GR)是在NADPH的参与下将氧化型谷胱甘肽(GSSG)催化生成还原型谷胱甘肽GSH,后者再在清除过氧化物和过氧化氢中起作用[16];水稻中已被鉴定出来的谷胱甘肽还原酶(GR)有3种[17-18]。【本研究切入点】上述抗氧化酶在植物抗逆过程中起着重要作用,但相关基因的表达调控是复杂的,而且不同基因对逆境的响应程度也不尽相同,因此明确干旱胁迫下抗氧化酶基因的表达模式很有必要。【拟解决的关键问题】本研究采用PEG6000胁迫处理模拟干旱胁迫,首先筛选处理籼稻航2号的PEG6000临界浓度;并采用qRT-PCR详细分析PEG6000模拟干旱胁迫处理不同时间后相关抗氧化酶基因表达,获得相应的表达模式,为采用PEG6000模拟干旱胁迫研究水稻的抗旱分子机制提供理论参考。
1 材料与方法
1.1 试验材料
取当年收获的籼稻航2号种子,室内浸种、催芽,后移至Yoshida水稻营养液,在28℃培养箱(16 h光照/24 h)中培养至三叶一心期,用聚乙二醇(PEG6000)模拟干旱胁迫处理。
1.2 主要试验试剂
PEG6000购自Sigma公司;植物总RNA提取试剂Trizol购自全式金生物技术有限公司;cDNA链反转试剂盒(RevertAid TM First Strand cDNA Synthesis Kit)购自Fermentas公司;2×Power Pfu PCR MasterMix购自北京百泰克生物技术有限公司;荧光定量试剂Rox Reference DyeⅡ(50×)购自罗氏(Roche)公司。
1.3 试验方法
1.3.1 PEG6000处理植株
用Yoshida水稻营养液分别配制质量体积比为18%、20%、22%、24%、26%的PEG6000处理液,以Yoshida水稻营养液(即不含PEG6000)作为对照(CK),将三叶一心期的航2号植株于上述溶液中进行处理,每个处理3次重复,期间观察植株表型并拍照。处理7 d后将所有植株转移至营养液中恢复生长,8 d后统计植株存活率,筛选籼稻航2号的PEG6000处理临界值。之后用PEG6000对另一批三叶一心期的航2号植株进行处理,分别于处理0、2、4、8、12、24、48、72 h取整植株(包括根茎叶),将植株冲洗干净,并于-80℃保存,用于后续植株总RNA的提取。
1.3.2 水稻植株总RNA的提取和cDNA一链的合成
采用Trizol法提取水稻植株总RNA:样品于研钵中,用液氮研磨成粉末并迅速装入1.5 mL的EP管中,立即加入1 mL Trizol试剂,摇匀;于冰上静置10 min,加入200 μL氯仿,混匀;冰上静置10 min,12 000 r·min-1离心15 min;取上清,加入等量异丙醇,混匀;冰上静置10 min,12 000 r·min-1离心10 min;弃上清,用75%乙醇洗2次;晾干,并加入适量ddH2O溶解,进行琼脂糖凝胶电泳分析并测定OD值以检测所提RNA质量。
按照RevertAid TM First Strand cDNA Synthesis Kit的操作说明书,反转录合成cDNA一链,并稀释20倍,于-20℃保存,用于后续RT-PCR和荧光定量PCR(qRT-PCR)试验。
1.3.3 引物设计
从NCBI数据库中下载相关基因序列,GenBank编号具体如下:过氧化氢酶A基因(CATA),EF371902.2;过氧化氢酶B基因(CATB),DQ078758.1;过氧化氢酶C基因(CATC),DQ118681.1;过氧化物酶5基因(POX5.1),AF014469.1;过氧化物酶1基因(POX1),DQ855429.1;质体铜/锌超氧化物歧化酶基因(plastidic Cu/Zn-SOD),D85239.1;细胞质铜/锌超氧化物歧化酶基因(cytosolic Cu/Zn-SOD),L36320.1;抗坏血酸过氧化物酶基因(APX),D45423.1;谷胱甘肽还原酶基因(GR),GQ420382.1;内参基因,真核起始因子(eIf4a),AK073620;内参基因,肌动蛋白基因(Actin150),AK100267。采用primer5.0软件设计相关引物,详细信息如表1。1.3.4 RT-PCR
为了检验引物的扩增效果,以上述反转录的PEG6000处理0 h(即PEG处理前)的样品cDNA一链为模板,用相关基因引物进行RT-PCR扩增,反应体系:2×Power Pfu PCR MasterMix 5 μL,上下游引物F/R(10 μmol·L-1)各0.4 μL,cDNA 1 μL,ddH2O补足至10 μL。RT-PCR反应程序:94℃预变性5 min;94℃ 30 s,60℃ 30 s,72℃ 20 s,30个循环;72℃ 延伸7 min。反应完成后,取3 μL RT-PCR产物用1%琼脂糖凝胶电泳进行分析。
1.3.5 荧光定量PCR(qRT-PCR)
选择水稻肌动蛋白基因Actin150为内参基因,进行SYBR Green I荧光定量PCR,反应体系:Rox Reference DyeⅡ(50×) 10 μL,目的基因上游引物F/Actin 150 F (10 μmol·L-1) 0.6 μL,目的基因下游引物R/Actin 150 R (10 μmol·L-1) 0.6 μL,cDNA 2 μL,ddH2O补足至10 μL。每个反应设4次重复,采用ABI7500荧光定量PCR仪,反应程序:95℃ 10 min;95℃ 15 s,60℃ 60 s,40個循环;反应结束后进行熔解曲线分析,熔解曲线根据ABI7500仪器标准程序进行。导出相关数据,并采用Microsoft Excel 2016进行作图分析。
2 结果与分析
2.1 不同干旱胁迫程度对水稻生长的影响
不同质量体积比PEG6000营养液对水稻生长的影响见图1。处理0 h(即处理前),所有植株生长一致(图1-A)。处理3 h,与CK相比,含18%和20% PEG6000营养液中的大部分水稻植株叶片已蜷曲,20% PEG6000营养液中水稻叶片蜷曲更明显;22%、24%、26% PEG6000营养液中水稻植株叶片已全部蜷曲(图1-B)。处理24 h,CK植株保持正常生长,含18%和20% PEG6000营养液中的水稻植株叶片蜷曲但植株保持直立;而22%、24%、26% PEG6000营养液中水稻植株已开始出现萎蔫(图1-C)。处理48 h情况与24 h时类似,并且22%、24%、26% PEG6000营养液中水稻植株萎蔫明显(图1-D)。处理72 h,22%、24%、26% PEG6000营养液中水稻植株萎蔫更加明显(图1-E)。处理96 h,含PEG6000营养液中水稻植株变黄,且22%、24%、26% PEG6000营养液中水稻植株绝大部分已脱水枯萎(图1-F)。处理5、6、7 d情况类似,CK植株保持正常生长,含18%和20% PEG6000营养液中的水稻植株生长较CK植株缓慢,部分叶片变黄,其余叶片卷曲且保持绿色;22%、24%、26% PEG6000营养液中水稻植株绝大部分已明显脱水枯萎(图1-G)。处理7 d后将所有植株于营养液中恢复生长,恢复生长8 d,统计植株存活情况;与CK相比,18% PEG6000处理过的植株生长较缓慢且出现较多的枯叶,但所有的植株都存活,存活率100%;20% PEG6000处理的情况与前者类似,所有植株存活,存活率100%;22% PEG6000处理过的植株只有3株恢复生长,存活率为12%;24%和26% PEG6000处理过的植株没有恢复生长,存活率为0(图1-H、表2)。以上结果表明,22%的PEG6000是籼稻航2号对PEG6000耐受的临界值,小于22%植株基本存活,而大于22%植株全部脱水枯萎。因此,后续试验采用22% PEG6000对植株进行处理。2.2 22% PEG6000处理植株及cDNA的合成
将三叶一心期的水稻植株于含22% PEG6000的营养液中进行处理,分别在处理0、2、4、8、12、24、48、72 h取样。采用Trizol法提取样品总RNA。从图2可看出扩增条带清晰,28 S和18 S条带明显,说明所提取的RNA完整。分别取每个处理1 μg RNA样品进行反转录,并用内参引物Actin150F/R和eIf4aF/R进行RT-PCR。结果显示均可扩增出单一的亮条带,并且条带亮度一致(图3);说明cDNA质量较好且各样品浓度一致,可用于后续的试验。
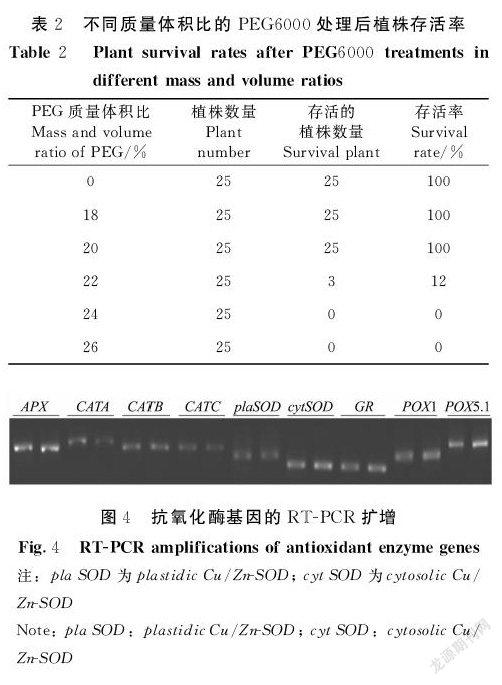
2.3 抗氧化酶基因的RT-PCR扩增
根据NCBI数据库中登录的过氧化氢酶(CATA、CATB、CATC),过氧化物酶(POX5.1、POX1),铜/锌超氧化物歧化酶(plastidic Cu/Zn-SOD、cytosolic Cu/Zn-SOD),抗坏血酸过氧化物酶(APX),谷胱甘肽还原酶(GR)基因序列设计引物,以PEG6000处理前的样品cDNA为模板进行RT-PCR。琼脂糖凝胶电泳图显示(图4),样品中均可扩增出以上基因的相关片段,且条带单一,说明所用引物扩增效果良好,并且由于基因表达量不同相应引物所扩增出的条带亮度不一样。
2.4 22% PEG6000处理水稻抗氧化酶基因表达变化
采用qRT-PCR分析22% PEG6000处理0、2、4、8、12、24、48、72 h后植株中过氧化氢酶、过氧化物酶、超氧化物歧化酶、抗坏血酸过氧化物酶、谷胱甘肽还原酶基因的表达变化。
2.4.1 过氧化氢酶基因的表达分析
结果显示,22% PEG6000处理后过氧化氢酶A基因(CATA)的表达量变化明显,处理2 h时稍微增加,处理4 h表达量是0 h的2倍;处理8h表达量达到最高,约为0 h的28倍,处理12 h表达量降低至0 h的11倍,而处理24 h后迅速降至处理前水平(图5-A)。过氧化氢酶B基因(CATB)的表达量在22% PEG6000处理2 h时稍微增加,处理4 h表达量迅速增加约为0 h的12倍,并继续增加,处理12 h达到最高,为0 h的17倍;处理24 h该基因的表达量下降至0 h的11倍,处理48 h表达量迅速下降至0 h的1.9倍,处理72 h表达量稍微提高至0 h的2.5倍(图5-B)。与前面两种过氧化氢酶基因不同,22% PEG6000处理后过氧化氢酶C基因(CATC)的表达量变化不明显,只稍微有所增加,处理72 h表达量达到最高也仅为0 h的1.8倍(图5-C)。
2.4.2 过氧化物酶基因的表达分析
22% PEG6000处理后过氧化物酶5基因(POX5.1)的表达量先下降,处理2 h表达量为0 h的一半,处理4 h该基因的表达量为0 h的67%左右;处理8 h和12 h表达量分别增加为0 h的2倍和5倍,处理24 h表达量最高为0 h的10.5倍,处理48 h表达量迅速降低至0 h的1.7倍,而处理72 h其表达量又提高为0 h的5倍(图5-D)。过氧化物酶1基因(POX1)的表达量呈先上升后下降的趋势,处理2 h表达量稍微增加,处理4 h达到最高为0 h的5倍,接着开始逐渐降低,处理8、12、24 h其表达量分别为0 h的4.3倍、3.3倍和2.4倍,而处理48h和72 h表达量均低于0 h(图5-E)。
2.4.3 铜/锌超氧化物歧化酶基因的表达分析
22% PEG6000处理后质体铜/锌超氧化物歧化酶基因(plastidic Cu/Zn-SOD)表达量稍有上调,但变化不明显,处理48 h表达量达到最高,仅为0 h的2倍(图5-F)。与前者相比,细胞质铜/锌超氧化物歧化酶基因(cytosolic Cu/Zn-SOD)表达变化较明显,处理2 h表达量稍微上调,处理4 h增加至0 h的3.7倍,后随处理时间的延长逐渐降低,处理72 h表达量为0 h的1.6倍(图5-G)。
2.4.4 抗坏血酸过氧化物酶基因的表达分析
22% PEG6000处理后抗坏血酸过氧化物酶基因(APX)的表达量增加,处理2 h其表达量约为0 h的2倍,处理4、8、12 h表达量维持在0 h的4.5倍左右,24 h表达量达到最高约为0 h的6.6倍,处理48 h下降至0 h的3倍,而处理72 h表达量又升高至处理24 h的水平,为0 h的6.3倍(图5-H)。
2.4.5 谷胱甘肽还原酶基因的表达分析
22% PEG6000处理后谷胱甘肽还原酶基因(GR)的表达量变化明显,处理2 h稍微上调,处理4 h表达量迅速增加至0 h的12倍,随后降低,处理8、12、24 h其表达量分别为0 h的9.3倍、8.8倍和5.7倍;处理48、72 h表达量降至0 h的2倍左右(图5 -I)。
3 讨论与结论
聚乙二醇(PEG)处理是研究作物抗旱性方法之一,也是较为常用的方法,此方法简单易行,条件容易控制,重复性好,试验周期短,适用于大批量材料的苗期抗旱性鉴定[19]。常用来模拟干旱胁迫处理的PEG质量体积比为20%,但不同水稻品种对PEG6000的耐受力不同。本研究用不同质量体积比的PEG6000处理籼稻航2号三叶一心期植株,根据恢复生长后植株存活情况发现籼稻航2号对PEG6000耐受的临界质量体积比为22%,这可为采用PEG处理研究籼稻品种的抗旱性提供参考。
在生理生化方面,有研究表明用15%PEG处理后辽星1号水稻植株中SOD同工酶和POD同工酶活性升高,并诱导出新的相应同工酶参与抗氧化过程;同时,随着PEG胁迫时间的增加CAT同工酶活性也增加[20]。另外,PEG胁迫处理0、2、4、6 d后水稻植株中SOD和POD的活性均随PEG胁迫时间的延长呈上升趋势,CAT活性则呈先上升后下降的趋势[21]。而有研究则表明随着20%PEG胁迫处理时间的增加水稻植株中SOD的活性呈现先迅速上升后急剧下降的趋势[22];张小娟等的研究也表明PEG胁迫处理后SOD的活性先上升后下降[23]。相应地,在基因表达方面,15%PEG胁迫处理后植株中Cu/Zn-SOD、APX1 和CAT1 基因在轉录水平有明显的上调[20]。而本研究的qRT-PCR分析表明,PEG处理后籼稻航2号植株中过氧化氢酶(CAT)、过氧化物酶(POX)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)基因的表达大部分都呈现先上升后下降的趋势,并且一般PEG处理4 h之后基因表达才出现较明显的上调,说明它们均不同程度地参与了PEG胁迫反应。另外,本研究还发现不同家族基因的表达受影响的程度不同,并且同一家族中不同基因的表达受影响的程度也不同;如PEG处理后过氧化氢酶基因家族中的过氧化氢酶A基因(CATA)表达变化显著,而过氧化氢酶C基因(CATC)变化并不明显;再如同一家族基因中的细胞质铜/锌超氧化物歧化酶基因(cytosolic Cu/Zn-SOD)的表达也出现了较明显的变化,但质体铜/锌超氧化物歧化酶基因(plastidic Cu/Zn-SOD)的表达变化不明显。较为特别的是,与其他基因不同,过氧化物酶5基因(POX5.1)的表达在PEG处理2 h和4 h时出现下调,PEG处理8 h才开始出现上调,即该基因的表达在PEG处理后出现先下调后上调而后又下调。这很可能是由于不同基因的表达受调控的机制不一样所导致的。
當水稻受干旱胁迫时,会出现一系列的自我防御机制,许多抗氧化酶包括过氧化氢酶(CAT)、过氧化物酶(POX)、超氧化物歧化酶(SOD)等将参与其中。本研究说明相关抗氧化酶类基因的表达均受PEG模拟干旱胁迫的诱导,并获得其表达模式,为水稻相关的抗旱分子机制研究奠定了一定的理论基础。
参考文献:
[1]匡勇,夏石头.干旱对水稻生长发育的影响及提高水稻抗旱性的途径[J].北京农业,2007(36):8-14.
KUANG Y,XIA S T. Effects of drought on growth and development and approachs to promoting droughtresistance of rice[J].Beijing Agriculture,2007(36): 8-14.(in Chinese)
[2]SALEHI S P,IZADPANAH M,FALAH H L,et al.Comparison of the effects of drought stress on pigments,peroxidase,osmotic adjustment and antioxidant enzymes in different accessions of anthemistinctoria and tripleurospermum servanes of natural resources gene bank of iran [J].En Journals,2015: 126-139.
[3]蒋明义,郭绍川.水分亏缺诱导的氧化胁迫和植物的抗氧化作用[J].植物生理学通讯,1996,32(2):144-150.
JIANG M Y,GUO S C. Oxidative stress and antioxidation induced by water deficiency in plants[J].Plant Physiology Communications,1996,32(2): 144-150.(in Chinese)
[4]BOWLER C,MONTAGU M V,INZE D. Superoxide dismutase and stress tolerance[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1992,43(1): 83-116.
[5]APEL K,HIRT H. Reactive oxygen species: metabolism,oxidative stress,and signal transduction [J]. Annual Review of Plant Biology,2004,55(1):373-399.
[6]NOCTOR G,FOYER C H. Ascorbate and glutathione: keeping active oxygen under control [J].Annual Review of Plant Physiology and Plant Molecular Biology,1998,49(1):249-279.
[7]AMUDHA J,BALASUBRAMANI G. Recent molecular advances to combat abiotic stresstolerance in crop plants[J]. Biotechnol Mol Biol Rev,2011(6):31-58.
[8]MORITA S,TASAKA M,FUJISAWA H,et al. A cDNA clone encoding a rice catalase isozyme[J]. Plant Physiol,1994,105 (3):1015-1016.
[9]HIGO K,HIGO H. Cloning and characterization of the rice CatA catalase gene,a homologue of the maize Cat3 gene[J]. Plant Molecular Biology,1996,30(3):505-521.
[10]AGRAWAL G K,RAKWAL R,JWA N S. Stress signaling molecules involved in defense and protein phosphatase 2A inhibitorsmodulate OsCATC expression in rice (Oryza sativa) seedlings [J].Journal of Plant Physiology,2001,158(10): 1349-1355.
[11]KIM S H,CHOI H S,CHO Y C,et al. Cold-Responsive Regulation of a Flower-Preferential Class III Peroxidase Gene,OsPOX1,in Rice (Oryzasativa L.)[J]. Journal of Plant Biology,2012,55(2):123-131.
[12]SASAKI K,IWAI T,HIRAGA S,et al. Ten rice peroxidases redundantly respond to multiple stresses including infection with rice blast fungus [J]. Plant & Cell Physiology,2004,45(10):1442-52.
[13]ALSCHER R G,ERTURK N,HEATH L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants[J]. Journal of Experimental Botany,2002,53(372):1331-1341.
[14]PRAKASH S R,SAMANT A,PRASHAR V,et al.Biochemical and functional characterization of OsCSD3,a novel CuZn superoxidedismutase from rice[J].Biochemical Journal,2018,475(19):3105-3121.
[15]TEIXEIRA F K,MENEZES-BENAVENTE L,GALVO V C,et al.Rice ascorbate peroxidase gene family encodes functionally diverse isoforms localized in different subcellular compartments[J].Planta,2006,224(2):300-314.
[16]NOCTOR G,FOYER C H. Ascorbate and glutathione: keepingactive oxygen under control [J]. Annual Review of Plant Physiology & Plant Molecular Biology,1998,49(1):249-279.
[17]BASHIR K,NAGASAKA S,ITAI R N,et al. Expression and enzyme activity of glutathione reductase is upregulated by Fe-deficiency in graminaceous plants[J]. Plant Molecular Biology,2007,65(3):277-284.
[18]ROUHIER N I,COUTURIER J,JACQUOT J P. Genome-wide analysis of plant glutaredoxin systems[J]. Journal of Experimental Botany,2006,57(8):1685-1696.
[19]楊春杰,张学昆,邹崇顺,等.PEG-6000模拟干旱胁迫对不同甘蓝型油菜品种萌发和幼苗生长的影响[J].中国油料作物学报,2007,29(4):425-430.
YANG C J,ZHANG X K,ZOU C S,et al. Effects of drought simulated by PEG-6000 on germination and seedling growth of rapeseed(Brassica napus L.)[J].Chinese Journal of Oil Crop Sciences,2007,29(4): 425-430.(in Chinese)
[20]李雪妹,刘畅,刘倩雯,等.PEG 预处理对水分胁迫下水稻叶片抗氧化酶同工酶及其表达的影响[J].作物杂志,2016(6):107-111.
LI X M,LIU C,LIU Q W,et al. The effect of PEG pretreatment on expression of antioxidant isozymes of rice leaves under water stress[J]. Crops,2016(6): 107-111.(in Chinese)
[21]陈美静,刘倚雯,张宝龙,等.不同预处理对P EG 胁迫下水稻幼苗抗氧化系统的影响[J],江苏农业科学,2015,43 (8):76 -78.
CHEN M J,LIU Y W,ZHANG B L,et al. The effect of different pretreatment on rice antioxidant system under PEG stress [J]. Jiangsu Agricultural Sciences,2015,43(8): 76-78.(in Chinese)
[22]戴高兴,彭克勤,萧浪涛,等.聚乙二醇模拟干旱对耐低钾水稻幼苗丙二醛、脯氨酸含量和超氧化物歧化酶活性的影响[J].中国水稻科学,2006,20(5):557-559.
DAI G X,PENG K Q,XIAO L T,et al. Effect of drought stress simulated by peg on m alonaldehyde,proline contents andsuperoxide dismutase activity in low potassium tolerant rice seedlings[J]. Chinese J Rice Sci,2006,20(5):557-559.(in Chinese)
[23]张小娟,宋涛,甄晓辉,等.模拟干旱胁迫对转C4双基因水稻幼苗光合功能及部分抗氧化酶活性的影响[J].江苏农业学报,2014,30(4):709-715.
ZHANG X J,SONG T,ZHEN X H,et al. Impact of simulated drought stress on photosynthesis and activities of someantioxidant enzymes of transgenic rice seedlings harboring maize PEPCand PPDK genes[J]. Jiangsu Journal of Agricultural Sciences,2014,30(40): 709-715.(in Chinese)
(责任编辑:张 梅)

