基于拉曼光谱和自荧光光谱的柑橘黄龙病快速检测方法
代芬 邱泽源 邱倩 刘楚健 黄国增 黄雅琳 邓小玲










摘 要:为了快速检测黄龙病这一柑橘毁灭性病害,分析了柑橘黄龙病样本和健康样本的自荧光和拉曼光谱差异,建立了基于自荧光光谱、拉曼光谱和混合光谱的PLS-DA模型,进行了模型的结果比较,最后绘制了三种模型的分类器特征曲线ROC,通过曲线下面积AUC参数进一步评价了模型的性能。试验结果表明,柑橘黄龙病叶片样本和健康叶片样本的自荧光光谱和拉曼光谱存在差异信息。在785nm波长激光诱导下,柑橘叶片样本都产生了比较强的自荧光。黄龙病叶片的自荧光相对于健康样本的自荧光在小于1203cm-1范围更弱,而在大于1206cm-1范围更强,其下降的斜率(绝对值)相对健康样本更小。在典型的黄龙病样本和健康样本的拉曼光谱数据中,均可发现具有以下拉曼峰且具有一致性:920cm-1,1160cm-1,1289cm-1,1331cm-1和1529cm-1。黄龙病样本和健康样本相比在1257cm-1、1396cm-1、1446cm-1、1601 cm-1和1622cm-1具有更大的拉曼峰值强度和光谱带宽,在1006cm-1、1160cm-1、1191cm-1和1529cm-1位置谱峰强度较弱,提示黄龙病样本的类胡萝卜素含量较低。基于自荧光光谱、拉曼光谱和混合光谱三种光谱的PLS-DA模型鉴别的准确率分别为86.08%、98.17%和94.75%。进一步计算三种模型的ROC曲线下面积AUC参数分别为0.9313、0.9991和0.9875,拉曼光谱模型的AUC值最大,也表明拉曼光谱模型的鉴别效果最优。拉曼光谱分析技术可以成为探索柑橘黄龙病快速诊断鉴别的新途径。
关键词:黄龙病检测;拉曼光谱;自荧光光谱;PLS-DA;柑橘;诊断
中图分类号:S-3 文献标志码:A 文章编号:201812-SA026
代 芬,邱泽源,邱 倩,刘楚健,黄国增,黄雅琳,邓小玲. 基于拉曼光谱和自荧光光谱的柑橘黄龙病快速检测方法[J].智慧农业,2019,1(3): 77-86.
Dai F, Qiu Z, Qiu Q, Liu C, Huang G, Huang Y, Deng X. Rapid detection of citrus Huanglongbing using Raman spectroscopy and Auto-fluorescence spectroscopy[J]. Smart Agriculture, 2019, 1(3): 77-86. (in Chinese with English abstract)
1 引言
柑桔黄龙病(Huanglongbing,HLB)是柑桔的毁灭性病害[1]。其发病症状主要表现为患病植株长势衰退,抽梢短而小,树叶出现斑驳性黄化和整体黄化枯萎,植株果实变小且果柄端橘红色,其余部分青色,俗称红鼻子果[2]。目前柑橘黄龙病诊断有田间诊断、嫁接诊断、电镜观察、血清学诊断、DNA(Deoxyribonucleic Acid)探针杂交以及聚合酶链式酶反应(Polymerase Chain Reaction,PCR)扩增等方法[2]。黄龙病检测目前存在的主要问题是症状非常复杂,肉眼鉴别易混淆[3];電镜检测病菌分布不均,易漏检[4];免疫学检测因克隆抗体专一性强,难以适应变异菌株,也易漏检[5]。目前最有效的PCR方法,耗时并且费用昂贵,难以普及应用。针对该病目前还没有发现抗病品种和特效药剂,柑橘感染黄龙病后,轻者严重影响产量和品质,重者则造成柑橘树枯死。目前病害主要靠检测发现和及时挖除病树来防止传播[6]。因此,探索一种适用于柑桔黄龙病早期快速检测的新方法显得尤为重要。
目前国内外针对黄龙病的快速检测已经取得了部分研究进展。Alireza等[7]利用视觉传感器对90个柑橘叶片样本进行分类,结果表明90个样本均能正确判别,且在591nm处的窄带偏振照明诊断准确性显著提高,达到无损诊断黄龙病的目的。此后,Alireza和Won[8]使用偏振光学成像追踪黄龙病阳性叶片上形成黄色岛状淀粉沉积状况,以平均灰度值指示淀粉积累的程度,结果表明该方法能成功检测叶片任何部位图像灰度值的增加。他们还采用由高灵敏度单色相机、窄带高功率LED和偏振滤光片构成的传感器,通过比较柑橘叶片的灰度值和标准偏差,区分黄龙病症状与缺锌的视觉类似症状,检测精度高达95.5%~98.5%[9]。Kumar等[10]通过高光谱成像软件(ENVI,ITT VIS)对光谱范围为400~1000nm的航空高光谱图像进行分析处理,将切片随机分成训练(70%)和验证(30%)数据集,光谱图表明冠层中心的黄龙病感染可以与健康对应物明显区分开来,总体准确度可达60%以上。Deng等[11]采用基于图像特征提取和两阶段反向传播神经网络(Back-Propagation neural network,BPNN)建模方法检测柑橘黄龙病,鉴别精度可达92%。Sindhuja等[12]利用波长范围为350~2500nm,并具有989个光谱特征的近红外光谱,基于分类类比软独立建模(Soft Independent Modeling of Classification Analogies, SIMCA)模型对黄龙病进行分类,准确率达约92%,漏检率小于3%。Li等[13]通过机载高光谱成像的扩展光谱角度映射检测柑橘黄龙病,检测精度达到86%。
拉曼光谱检测技术是一种无损光学技术,它易于操作,能探测组织中的分子和生物化学变化,而且能够在生物体内进行检测[14]。研究报道表明,因为叶片中淀粉降解通路上关键基因的转录下调,感染黄龙病的柑橘树(有症状和无症状)都在细胞器和细胞质中有淀粉颗粒非典型积累的现象:一些糖类如蔗糖、果糖、葡萄糖、麦芽糖分布和浓度不平衡,浓度转变,以及植物激素合成异常;而未感染黄龙病的没有出现这些异常[15]。前人采用的光学方法具有快速、无损等优点,但也存在不足,如近红外光谱存在检测限高、光谱谱峰归属不明确,检测精度有待进一步提高等问题。拉曼技术的优势有两点,一是灵敏度高,二是具有比较明确的指示性,拉曼峰可以明确指示化学键,从而能够对特异性物质起到指示作用[16]。
本文研究了利用自荧光光谱、拉曼光谱以及混合光谱快速检测黄龙病的方法,并比较三种光谱在柑橘黄龙病诊断上的准确性,以探索一种适用于柑桔黄龙病早期快速检测的新方法。
2 材料与方法
2.1 光谱采集设备
本研究采用微区激光拉曼光谱仪(Finder One,卓立汉光公司,北京)进行样本拉曼光谱采集,如图1所示。
采用785nm波长激光器(最大输出:100mw),拉曼光谱范围为180~5000cm-1,分辨率≤2cm-1,采用TE深制冷型背感光CCD(Charge-Coupled Device),有效像元为2000×256(像元尺寸15μm×15μm)。系统的控制由个人计算机执行,采用专用拉曼光谱数据成像分析软件FlexScan采集,显示和记录样本的实时拉曼光谱数据。
2.2 试验样本
试验样本为砂糖橘果树叶片,于2017年5月18日采集于广东省惠州市博罗县柑橘黄龙病防控示范基地。选取有明显症状(黄梢和叶片斑驳黄化)果树10棵和无症状果树10棵,在每棵树的底部位置摘取症状典型的老叶,共取得219片叶片样本。样本采集后用密封袋包装,24小时之内进行拉曼光谱采集,每片叶片在页面采集2个点(如图2所示),共得到438个光谱数据。最后所有样本送华南农业大学柑橘黄龙病实验室进行PCR扩增实验,确定110个患病叶片,109个健康叶片。
2.3 拉曼光谱数据采集
柑橘树叶样本采用华南农业大学电子工程學院购置的微区激光拉曼光谱仪器(如图3所示)采集光谱数据,将样本置于10倍放大镜观察,激光功率为43mW。每片叶片采集两个点,避开叶脉。采用累积扫描的方法,每个样本点曝光6次,每次5s,最终得到的拉曼光谱数据为6次扫描结果的叠加,并以*.txt格式文件保存为一个光谱数据。最终得到220个患病叶片的光谱数据和218个健康叶片的光谱数据。
2.4 基于PLS-DA的拉曼光谱和自荧光光谱的黄龙病诊断模型
本试验主要采用偏最小二乘判别分析(Partial Least Squares Discriminant Analysis,PLS-DA)来建立判别模型。PLS-DA是描述预测变量集合X上分类变量类别的二元变量集合Y的偏最小二乘回归。它是通常判别分析和对预测变量重要主成分的判别分析之间的折中。这种技术特别适合处理大量的预测因子。PLS回归的目标是在将一组响应变量Y与一组预测变量X相关联的情况下提供降维策略。光谱分析的流程如图3所示。
为了检测和分析谱峰,需要先对光谱数据进行插值计算。本研究将采集到的拉曼光谱数据使用三次样条插值(Cubic Spline Interpolation)方法进行插值处理,具体处理过程如下:
假定有n+1个数据节点 ,
计算步长 ,将数据节点和指定的首位端点条件带入矩阵方程,解矩阵方程,求得二次微分值mi,计算样条曲线的系数:
(1)
(2)
(3)
(4)
其中 ;ai、bi、ci和di是分别是三次样条插值中常数项、一次项、二次项和三次项的系数。最后在每个子区间 中创建方程:
(5)
插值预处理之后再对积分时间和激光强度进行归一化,提取指纹谱区,然后使用7次多项式对光谱曲线进行拟合并进行迭代减法,最终分离出自荧光光谱和拉曼光谱。
3 结果与讨论
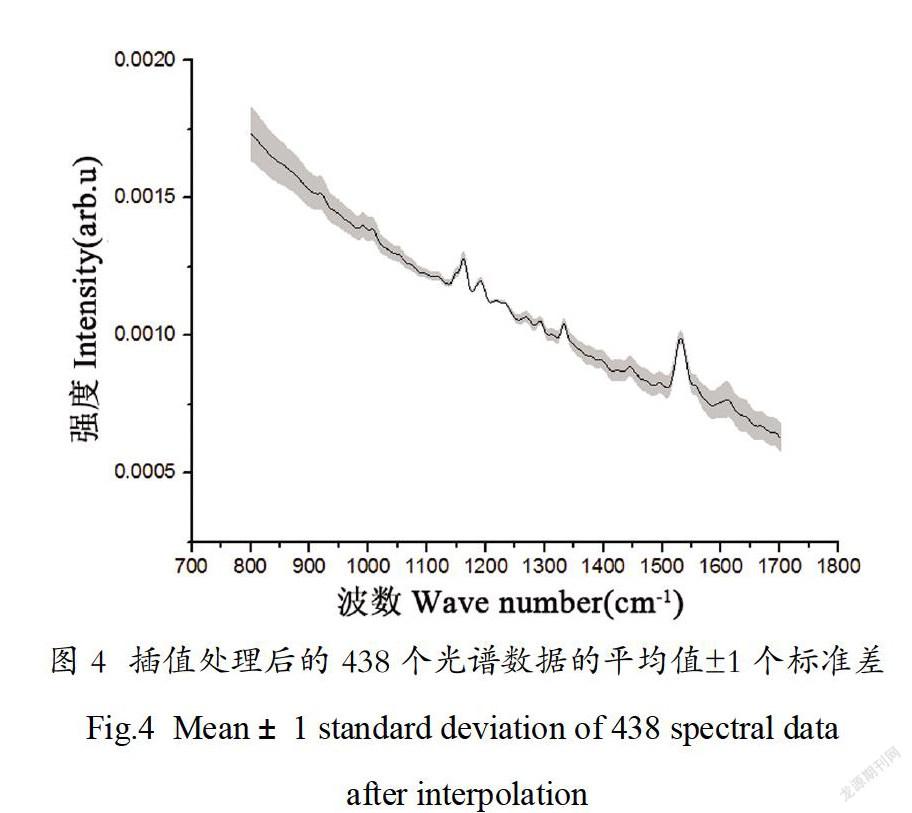
在采集到的219片叶片上,避开叶脉位置,每片采集两个点的光谱,一共得到438个光谱数据。插值处理后的全部样本(包括健康和患有黄龙病)的平均光谱如图4所示,图中实线表示平均值,灰色阴影代表平均值±1个标准差。从图4中可见,所有的柑橘叶片样本在785nm的激光诱导下都产生了较强的自荧光和拉曼峰,这为下一步的自荧光分析和拉曼光谱分析提供了数据基础。
3.1 自荧光光谱及建模分析
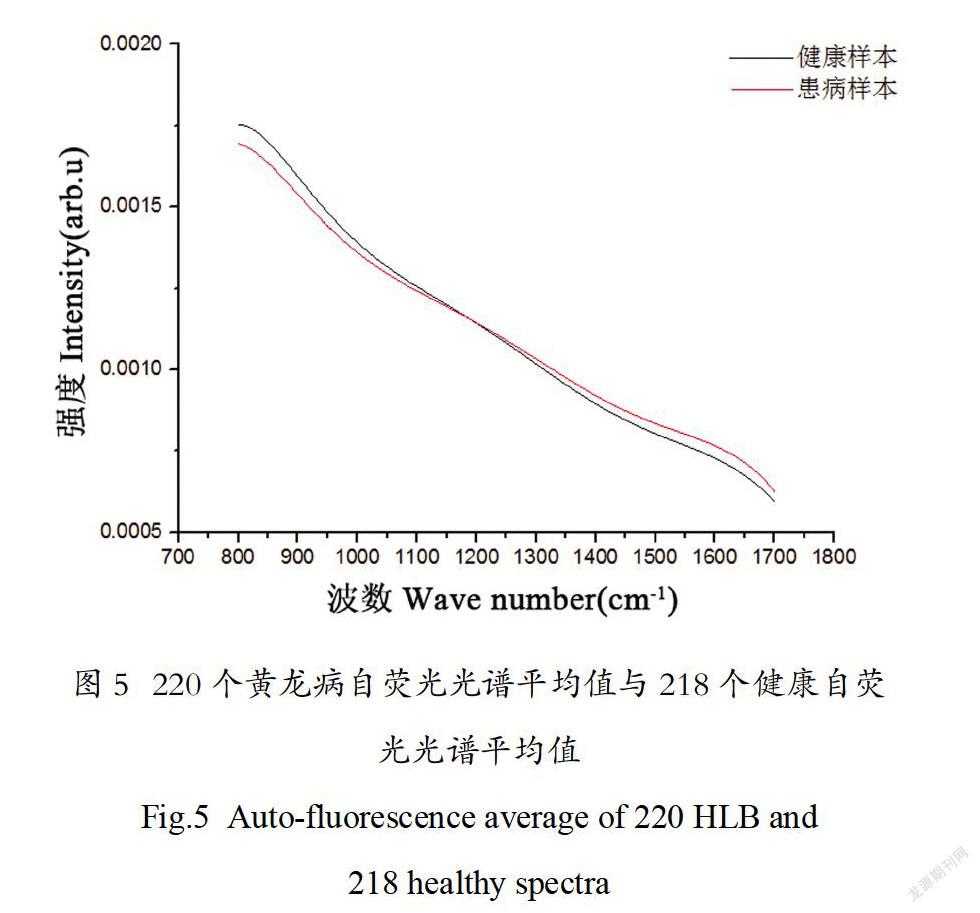
激光诱导荧光是介质受到激光激发后,先由基态跃迁到激发态,然后处于激发态的分子通过弛豫再下降到基态的过程中,以光量子的形式释放出它所吸收的能量。由于每种物质的能级结构不同,因此,其发射荧光的特性也不同,通过对荧光特性参量的测量,可以区分不同物质的种类。如图5所示,在785nm波长激光诱导下,柑橘叶片样本产生了比较强的荧光,即自荧光。患病叶片出现的黄化等症状导致其叶绿素含量较低,使得健康叶片的自荧光光谱在小于1203cm-1范围更强,在大于1206cm-1范围更弱,其下降的斜率(绝对值)更大,和患病叶片的自荧光光谱产生了差异。
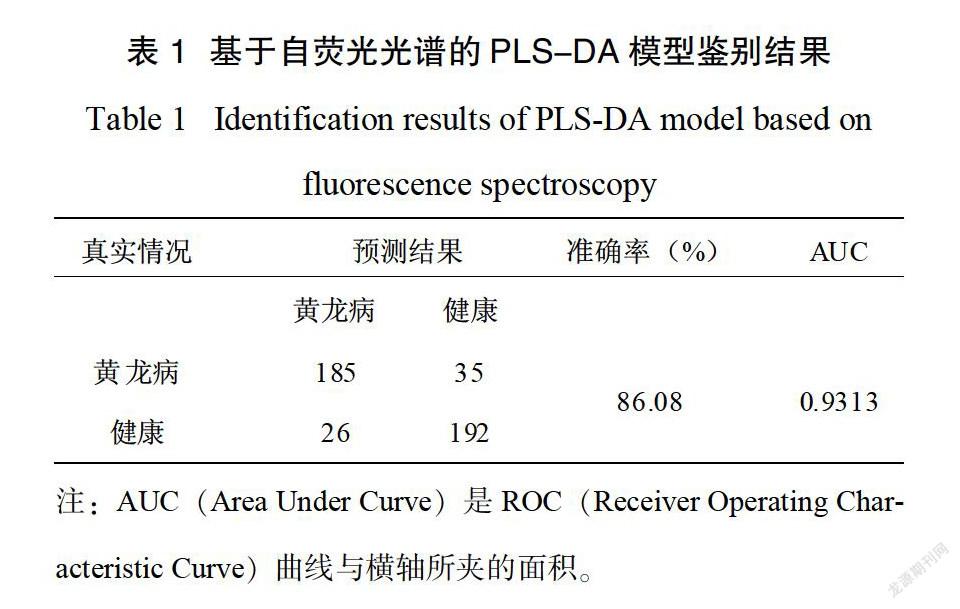
在分类问题中,PLS-DA采用了PCA的基本原理,通过使光谱变量x和分类矩阵y之间的协方差最大,得到潜变量(Latent Variable,LV),潜变量能更好解释光谱变量中与分类相关的信息,PLS-DA的优点是能够在自变量存在严重多重相关性的条件下进行回归建模,特别适合处理大量的预测因子。通过对荧光光谱进行PLS-DA分析,可以得到潜变量得分图(图6)。根据PLS-DA算法,潜变量的个数理论上与光谱变量数一样多,通常建模只选取信息含量较大的头几个潜变量参与建模。由图6可见三个潜变量(LV1,LV2,LV3)分别占自荧光光谱的方差信息为96.72%,1.39%,0.63%,总共对光谱信息的描述达到了98.74%。采用留一法内部交叉验证,对438个自荧光光谱建立PLS-DA分类模型,得到分类结果如表1所示。从表1中可见,220个黄龙病样本,通过分类模型分类结果是185个黄龙病,35个健康,真患病率是84%;218个健康样本,通过分类模型分类结果是26个黄龙病和192个健康,真健康率是88%。我们对模型的评价指标之一是准确率,其定义如下:
(6)
结果表明,基于荧光光谱的PLS-DA模型鉴别准确率为86.08%。
3.2 拉曼光谱及建模分析
拉曼光谱体现的是分子的振动或转动信息,拉曼谱图用散射光能量随拉曼位移的变化(即入射频率與散射频率之差)表示,通过峰的位置、强度、形状等信息,反映被测物质分子的官能团或化学键的特征振动频率,提供散射分子的结构信息。如图7所示,在典型的黄龙病样本和健康样本的拉曼光谱数据中,均可发现具有以下拉曼峰且具有一致性:920cm-1(C-C拉伸(脯氨酸环/葡萄糖/乳酸)),1160cm-1(C-C伸缩/C=C伸缩(蛋白质,也包括类胡萝卜素)),1289cm-1(CH2变形(脂质)),1331cm-1(多核苷酸链(DNA-嘌呤碱基)),1529cm-1(-C=C-(类胡萝卜素))[17]。
健康样本和黄龙病样本之间的拉曼谱图也显示出显著的差异,即拉曼峰值强度,拉曼峰值位置和光谱带宽,特别在920~1100cm-1,1150~1250cm-1,1400~1700cm-1这三个主要包含碳水化合物、氨基酸、蛋白质和脂质相关信息的波数范围内拉曼光谱变化尤为显著。黄龙病样本在1257cm-1,1396cm-1(CH振动),1446cm-1(CH2弯曲、拉伸(蛋白质和脂质)),1601~1622cm-1(C=C伸缩(酪氨酸和色氨酸))具有更大的拉曼峰值强度和光谱带宽,但是在1006cm-1(C-C拉伸),1160cm-1(C-C伸缩/C=C伸缩(蛋白质,也包括类胡萝卜素)),1191cm-1(类胡萝卜素),1529cm-1(-C=C-(类胡萝卜素))[14,17],相比健康样本,黄龙病样本的拉曼峰值较弱。有文献报导黄龙病影响植物激素的浓度和合成的变化,与碳水化合物代谢相关的基因的改变导致细胞中淀粉颗粒的积累,显症的叶片中类胡萝卜素的含量相对较低[18-20],而类胡萝卜素标准品的特征拉曼峰正是1006cm-1、1160cm-1、1191cm-1和1529cm-1,这与本研究光谱检测结果一致。这些试验结果表明,不同组织类型中独特生物分子相对于总拉曼活性成分的百分比显著增加和减少,这些差异的存在表明拉曼光谱检测技术在柑橘黄龙病快速判别中的具有潜力。通过对拉曼光谱进行PLS-DA建模分析,可以得到潜变量得分图(图8)。由图8可见前三个潜变量(LV1,LV2,LV3)分别占拉曼光谱的方差信息为46.63%,13.22%,5.38%,总共对光谱信息的描述达到了65.23%。采用留一法内部交叉验证,对438个拉曼光谱建立PLS-DA分类模型,结果如表2所示。从表2中可见,220个黄龙病样本,通过拉曼光谱分类模型分类结果是214个黄龙病,6个健康,模型的真患病率是97.27%;218个健康样本,通过拉曼光谱分类模型分类结果是2个黄龙病和216个健康,模型的真健康率是99.08%,模型总的准确率为98.17%。
3.3 拉曼和自荧光混合光谱及建模分析
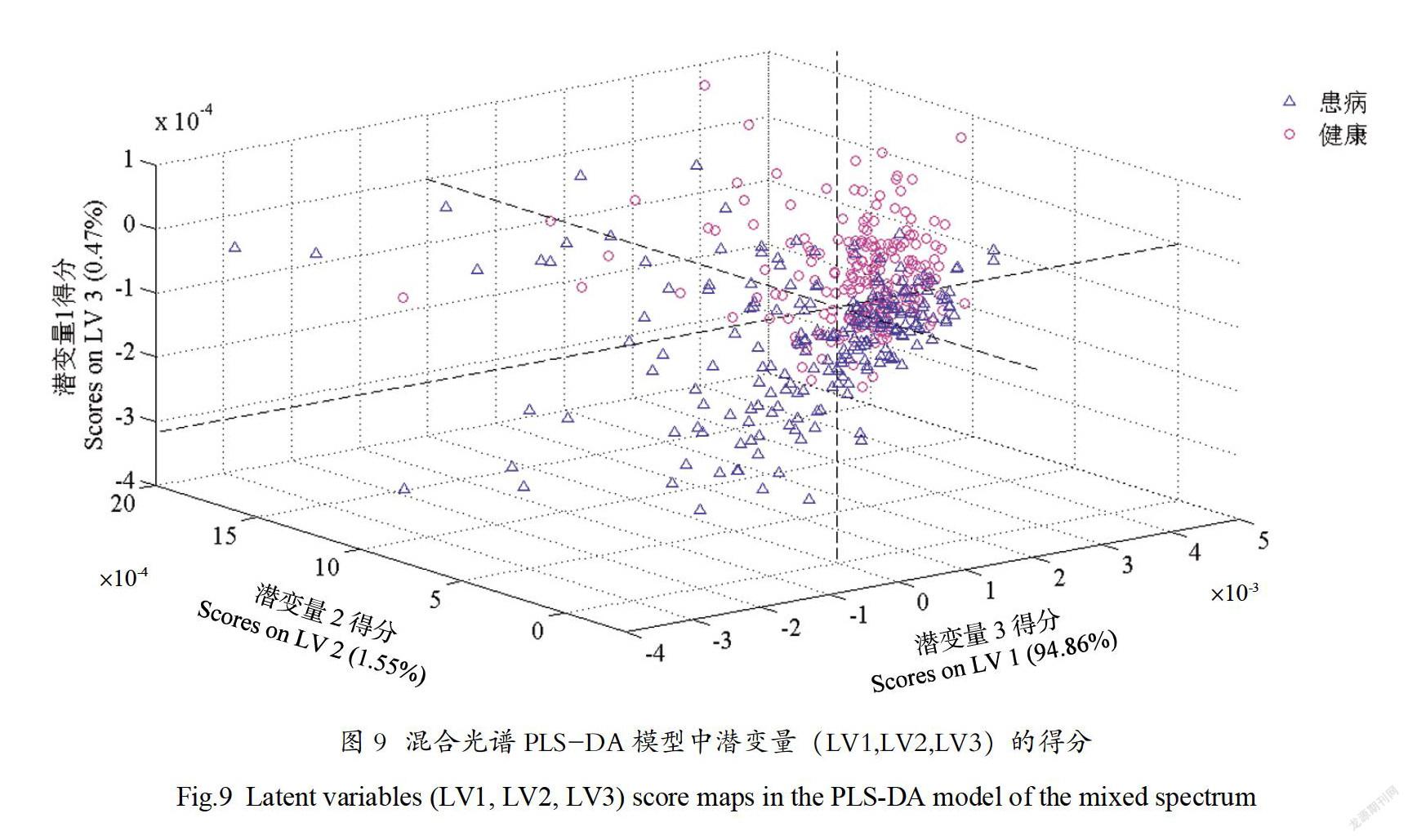
如前文所述,拉曼光谱和自荧光光谱中都包含有黄龙病和健康样本中的差异信息。本研究联合拉曼和自荧光构成的混合光谱进行建模分析。基于438个混合光谱进行PLS-DA分析,得到潜变量得分图(图9)。由图9可见这三个潜变量(LV1,LV2,LV3)分别占混合光谱的方差信息为94.86%,1.55%,0.47%,总共对光谱信息的描述达到了96.88%。采用留一法内部交叉验证,对438个混合光谱建立PLS-DA分类模型,结果如表3所示。从表3中可见,220个黄龙病样本,通过混合光谱分类模型分类结果是204个黄龙病,16个健康,模型的真患病率是92.73%;218个健康样本,通过拉曼光谱分类模型分类结果是9个黄龙病和209个健康,模型的真健康率是95.87%,模型总的准确率为94.75%。对比表1、表2和表3,基于拉曼光谱的模型鉴别的准确率最高(98.17%),基于混合模型鉴别的准确率次之(94.75%),基于自荧光光谱模型的鉴别准确率最低(86.08%)。究其原因,可能是因为拉曼光谱能探测组织中的分子和生物化学变化,灵敏度极高,但拉曼光谱的幅度相对于自荧光而言很小,与自荧光背景混合之后,拉曼光谱中的信息反而被大的荧光背景信息所覆盖,故而混合光谱的建模准确率低于拉曼光谱建模的准确率。
3.4 三种模型的ROC曲线分析
为了进一步评价三种模型的分类性能,采用分类器特性曲线(Receiver Operating Characteristic Curve ,ROC)以及曲线下的面积(Area under curve,AUC)进一步评价各个分类算法的鲁棒性。ROC曲线以真正率为纵坐标,假正率为横坐标绘制的曲线,如果二元分类器给出的是对正样本的一个分类概率,那么通过设定不同的阈值,可以得到不同的混淆矩阵,而每个混淆矩阵都对应于ROC曲线上的一个点,我们就可以得到一个经过(0,0),(1,1)的曲线,这就是该分类器的ROC曲线。ROC曲线越靠近左上角,试验的准确性就越高。最靠近左上角的ROC曲线的点是错误最少的最好阈值点,说明模型对测试集判断错误的总数最少。ROC曲线与X坐标轴所围成的面积为AUC,这个面积也可以作为分类器的性能评价指标。其AUC值越大,表征分类器的效果越好。对基于自荧光、拉曼及其混合的模型采用不同的分类阈值,画出其ROC曲线,如图10所示。对应于三种模型,ROC曲线的AUC分别为0.9313、0.9991和0.9875,这同样显示出使用拉曼光谱构建的模型具有更好的判别性能。
4 结论
本研究以微区激光拉曼光谱仪为实验仪器,以110片健康柑橘叶片和109片黄龙病的柑橘叶片为试验对象,每个样本采集两个点,共得到438个光谱数据。通过多项式拟合分离得到拉曼光谱和自荧光光谱,再结合PLS-DA分析方法和ROC曲线分析,研究了基于拉曼和自荧光信息的柑橘黄龙病的快速检测方法。试验结果表明,拉曼光谱以及自荧光光谱均可以反映出健康样本和黄龙病样本的差异。尤其是拉曼光谱,其谱峰位置都有比较明确的归属,健康样本与黄龙病样本的差异主要集中在与碳水化合物、氨基酸、蛋白质和脂质等物质相关的位置(920~1100cm-1,1150~1250cm-1和1400~1700cm-1)。
通過对自荧光光谱、拉曼光谱以及混合光谱进行建模分析,自荧光光谱模型的鉴别准确率为86.08%,拉曼光谱模型的鉴别准确率为98.17%,而结合拉曼光谱与自荧光光谱的混合光谱模型的鉴别准确率为94.75%,从单一阈值的判断准确率对比,拉曼光谱模型最优。进一步结合ROC曲线分析,拉曼光谱模型的ROC曲线下AUC最大,为0.9991,混合光谱的AUC次之为0.9875,荧光光谱模型的AUC最小为0.9313,这进一步表明在不同的阈值划分情况下,拉曼光谱模型的鉴别效果最优,表明基于分子水平的拉曼快速无损检测手段在柑橘黄龙病防治工程中具有巨大的潜力。
柑橘黄龙病是一种复杂的病症,本研究是以典型的黄龙病样本和健康样本进行对比,但对已经染病却未显症的病株能否检测,当染病病株的病菌分布不均匀,病株体内的淀粉颗粒非典型积累其浓度和分布都不均匀时,如何选取合适光谱采集位置都还需研究,进一步可以扩大样本范围,通过选取不同染病程度以及未染黄龙病却因缺素等原因有类似症状的病株为样本,通过多位置的光谱采集比较进行探索。
参考文献
[1] Reinking O A. Diseases of economic plants in South China[J]. Philippine Agricalture, 1919, (8): 109-135.
[2] 许美容, 陈燕玲, 邓晓玲, 等. 柑橘黄龙病症状与“Candidatus Liberibacter asiaticus”PCR检测结果的相关性分析[J]. 植物病理学报, 2016, 46(1): 367-373.
Xu M, Chen Y, Deng X, et al. Correlationships between symptoms of citrus huanglongbing and PCR detection of 'Candidatus Liberibacter asiaticus'[J]. Acta Phytopathologica Sinica, 2016, 46(1): 367-373.
[3] Raquel R, Jacqueline K B. Phytohormone changes and carbohydrate status in sweet orange fruit from Huanglongbing-infected trees[J]. Plant Growth Regul, 2011, (30): 312-321.
[4] Hajivand S, Thohirah L A, Kamaruzaman S, et al. Identification of physical and biochemical characteristic of mandarin (Citrus reticulata) fruit infected by Huanglongbing (HLB)[J]. Australian Journal of Crop Science, 2011, 5(2): 181-186.
[5] 袁亦文, 戈丽清, 王德善, 等. 柑橘黄龙病对柑橘产量和品质的影响[J]. 浙江农业科学, 2007, (1): 87-88.
Yuan Y, Ge Q, Wang D, et al. Citrus greening disease effects on yield and quality of citrus[J]. Journal of Zhejiang agricultural, 2007, (1): 87-88.
[6] Manjunath L, Keremanea, Chandrika R, Esteban R, et al. A rapid field detection system for citrus huanglongbing associated' Candidatus Liberibacter asiaticus' from the psyllid vector, Diaphorina citri Kuwayama and its implications in disease management[J]. Crop Protection, 2015, (68): 41-48.
[7] Alireza P, Won S L, Ed E, et al. An evaluation of a vision-based sensor performance in Huanglongbing disease identification[J]. Biosystems Engineering, 2015, (130): 13-22.
[8] Alireza P, Won S L. Identification of citrus Huanglongbing disease at the pre-Symptomatic stage using polarized imaging technique[J]. IFAC-Papers On Line, 2016, 49(16): 110-116.
[9] Alireza P, Won S L, Reza E, et al. An optimum method for real-time in-field detection of Huanglongbing disease using a vision sensor[J]. Computers and Electronics in Agriculture, 2015, (110): 221-232.
[10] Kumar A, Lee W S, Ehsani R, et al. Airborne hyperspectral imaging for citrus greening disease detection[C]. In the Proceedings of the 3rd Asian Conference on Precision Agriculture, 2009-10-14, Beijing, China.
[11] Deng X, Lan Y, Xing X et al. Detection of citrus Huanglongbing based on image feature extraction and two-stage BPNN modeling [J]. Int J Agric & Biol Eng, 2016, 9(6): 20-26.
[12] Sindhuja S, Ashish M, Joe M M, et al. Visible-near infrared spectroscopy for detection of Huanglongbing in citrus orchards[J]. Computers and Electronics in Agriculture, 2011, (77): 127-134.
[13] Li H, Lee W S, Wang K, et al. ‘Extended spectral angle mapping (ESAM)’ for citrus greening disease detection using airborne hyperspectral imaging[J]. Precision Agriculture, 2014, 2(15): 162-183.
[14] Moisés R, Vallejo P, Maria G, et al. Raman Spectroscopy an Option for the early Detection of Citrus Huanglongbing[J]. Applied Spectroscopy, 2016, 70(5): 829-839.
[15] Fan J, Chen C, Brlansky R H, et al. Changes in carbohydrate metabolism in citrus sinensis infected with candidatus liberibacter asiaticus[J]. Plant Pathol, 2010. 59(6): 1037-1043.
[16] 孫璐, 陈斌, 高瑞昌, 等. 拉曼光谱技术在食品分析中的应用[J]. 中国食品学报, 2012, 12(12): 113-118.
Sun L, Chen B, Gao R, et al. Review on Raman spectroscopy application in food analysis[J]. Journal of Chinese Institute of Food Science and Technology. 2012, 12(12): 113-118.
[17] 李晓丽, 许凯雯, 何勇. 基于拉曼光谱技术的茶树叶片中类胡萝卜素含量的无损快速检测. 光谱学与光谱分析, 2017, (37)11: 3465-3470.
Li X, Xu K, He Y. Determination of carotenoids contents in tea leaves based on Raman spectroscopy[J]. Spectroscopy and Spectral Analysis, 2017, (37)11: 3465-3470.
[18] Freitas D S, Carlos E F, Gil M C S S, et al. NMR-Based metabolomic analysis of Huanglongbing-Asymptomatic and symptomatic citrus trees[J]. Journal of agricultural and food chemistry, 2015, 63(34): 7582-7588.
[19] Schneider H. Anatomy of greening-disease sweet orange shoots[J]. Phytopathology, 1968, (58): 1155-1160.
[20] Liao H L, Burns J K. Gene Expression in Citrus sinensis fruit tissues harvested from Huanglongbing-infected trees: comparison with girdled fruit[J]. Exp. Bot, 2012, 63(8): 3307-3319.
Rapid detection of citrus Huanglongbing using Raman spectroscopy and Auto-fluorescence spectroscopy
Fen Dai1,2, Zeyuan Qiu1, Qian Qiu1, Chujian Liu1, Guozeng Huang1,
Yalin Huang1, Xiaoling Deng1,2*
(1. College of Electronic Engineering of South China Agricultural University, Guangzhou 510642, China;
2. Guangdong Engineering Research Center for Monitoring Agricultural Information, Guangzhou 510642, China)
Abstract: In order to detect citrus Huanglongbing (HLB, also named citrus greening) quickly, Auto-fluorescence and Raman spectra of HLB leaf samples and healthy ones were collected and analyzed. PLS-DA models based on Auto-fluorescence spectra, Raman spectra and mixed spectra were established and compared respectively. Finally, ROC curves of the three models were drawn, and the performance of the models were further evaluated by using the area under curve AUC parameters. The results demonstrated spectral differences between Huanglongbing samples and healthy ones could be seen. With 785 nm laser irradiation, citrus leaf samples produced strong Auto-fluorescence and Raman peaks. The Auto-fluorescence of HLB leaves was weaker than that of healthy samples in the range of 800-1203 cm-1, but stronger in the range of 1206-1800 cm-1, and the slope of decline (absolute value) was smaller than that of healthy samples. The similar shapes were found in the Raman spectra of typical HLB samples and healthy ones. But the HLB samples had larger Raman peak intensity and spectral bandwidth at 1257 cm-1, 1396 cm-1, 1446 cm-1, 1601 cm-1 and 1622 cm-1 than healthy ones. The Raman peak intensity of HLB samples was weaker than that of healthy samples at 1006 cm-1, 1160 cm-1, 1191 cm-1 and 1529 cm-1 positions, suggesting that the carotenoid content of HLB samples was lower than healthy ones. The Auto-fluorescence model, the Raman spectral model and the mixed spectral model could distinguish two kinds of samples with the accuracy of 86.08%, 98.17% and 94.75%, respectively. Furthermore, AUCs of Receiver Operating Characteristic Curve (ROC) were calculated. The AUCs for the Auto-fluorescence model, the Raman spectral model and the mixed spectral model were0.9313、0.9991 and 0.9875, respectively. Through further analysis of ROC curve, the identification effect of the Raman spectral model was optimal. Raman spectroscopy could be a new way to explore the rapid diagnosis of citrus HLB.
Key words: Huanglongbing detection; Raman spectra; Auto-fluorescence spectra; PLS-DA; citrus; diagnose

