他克莫司对阿霉素肾病大鼠肾组织氧化应激及klotho蛋白表达的影响
张静 王雁飞 刘丽秋 宋起


[摘要] 目的 觀察他克莫司对阿霉素肾病大鼠肾组织氧化应激及klotho蛋白表达的影响。方法 将雄性Wistar大鼠随机分为对照组(NC组)、阿霉素肾病模型组(ADR组)、奥美沙坦酯治疗组(OLM组)、他克莫司治疗组(FK506组),每组15只。其中ADR组、OLM组、FK506组均给予一次性尾静脉注射阿霉素5 mg/kg构建阿霉素肾病模型。造模成功后,OLM组、FK506组分别连续12周给予奥美沙坦酯10 mg/(kg·d)、他克莫司0.5 mg/(kg·d)灌胃,NC组及ADR组分别给予等量生理盐水灌胃。分别于实验第4、8、12周末检测各组大鼠24 h尿蛋白;每组分别于实验第4、8、12周末各处死5只大鼠,取肾组织,测定其超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量,苏木精-伊红染色观察其形态学变化,实时荧光定量PCR(q-PCR)检测klotho mRNA的表达,Wes-tern blot检测klotho蛋白的表达。结果 ADR组、OLM组及FK506组大鼠各时间点24 h尿蛋白含量均高于NC组,OLM组和FK506组较ADR组降低,FK506组较OLM组降低,差异均有显著性(F=126.969~781.905,P<0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中SOD活性均较NC组降低,OLM组和FK506组较ADR组升高,FK506组较OLM组升高,差异均有统计学意义(F=125.782~467.589,P<0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中MDA含量均较NC组升高,OLM组及FK506组较ADR组降低,FK506组较OLM组降低,差异均有统计学意义(F=52.782~162.589,P<0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中klotho的表达均较NC组降低,OLM组及FK506组较ADR组升高,FK506组较OLM组升高,差异具有统计学意义(F=116.671~609.513,P<0.05)。结论 阿霉素肾病大鼠肾脏组织klotho表达降低,他克莫司相对于奥美沙坦酯可以明显提高阿霉素肾病大鼠肾脏组织中klotho的表达,减少肾脏氧化应激损伤。
[关键词] 他罗利姆;肾病综合征;多柔比星;氧化性应激;klotho蛋白;大鼠
[中图分类号] R979.5;R692 [文献标志码] A [文章编号] 2096-5532(2019)04-0469-06
[ABSTRACT] Objective To investigate the effect of tacrolimus on oxidative stress and klotho protein expression in renal tissue in rats with adriamycin nephropathy. Methods A total of 60 male Wistar rats were randomly divided into normal control group (NC group), adriamycin nephropathy group (ADR group), olmesartan medoxomil treatment group (OLM group), and tacrolimus treatment group (FK506 group), with 15 rats in each group. The rats in the ADR group, the OLM group, and the FK506 group were given one-time injection of 5 mg/kg adriamycin via the caudal vein to establish a model of adriamycin nephropathy. After modeling, the rats in the OLM group and the FK506 group were given olmesartan medoxomil (10 mg·kg-1·d-1) and tacrolimus (0.5 mg/kg-1·d-1), respectively, by gavage for 12 consecutive weeks, and those in the NC group and the ADR group were given an equal volume of normal saline by gavage. 24 h urinary protein was measured at the end of weeks 4, 8, and 12. Five rats in each group were sacrificed at the end of weeks 4, 8, and 12, and renal tissue was collected to measure superoxide dismutase (SOD) activity and malondialdehyde (MDA) content; hematoxylin and eosin staining was used to observe morphological changes, and quantitative real-time PCR and Western blot were used to measure the mRNA and protein expression of klotho. Results At all time points, the ADR group, the OLM group, and the FK506 group had significantly higher 24 h urinary protein than the NC group; the OLM group and the FK506 group had significantly lower 24 h urinary protein than the ADR group; the FK506 group had significantly lower 24 h urinary protein than the OLM group (F=126.969-781.905,P<0.05). At all time points, the ADR group, the OLM group, and the FK506 group had significantly lo-wer SOD activity in renal tissue than the NC group; the OLM group and the FK506 group had significantly higher SOD activity than the ADR group; the FK506 group had significantly higher SOD activity than the OLM group (F=125.782-467.589,P<0.05). At all time points, the ADR group, the OLM group, and the FK506 group had significantly higher MDA content in renal tissue than the NC group; the OLM group and the FK506 group had significantly lower MDA content than the ADR group; the FK506 group had significantly lower MDA content than the OLM group (F=52.782-162.589,P<0.05). At all time points, the ADR group, the OLM group, and the FK506 group had significantly lower expression of klotho in renal tissue than the NC group; the OLM group and the FK506 group had significantly higher expression than the ADR group; the FK506 group had significantly higher expression than the OLM group (F=116.671-609.513,P<0.05). Conclusion There is a reduction in the expression of klotho in renal tissue in rats with adriamycin nephropathy. Compared with olmesartan medoxomil, tacrolimus can significantly increase the expression of klotho in renal tissue and reduce oxidative stress injury in the kidney in rats with adriamycin nephropathy.
[KEY WORDS] tacrolimus; nephrotic syndrome; doxorubicin; oxidative stress; klotho protein; rats
肾病综合征是一种发展缓慢、相对良性的疾病,但若未能及时有效诊治可导致病情进展甚至发展成为慢性肾衰竭。氧化应激是多种病理损伤的共同途径,贯穿于慢性肾脏病发生、发展的过程中。慢性肾脏病的发生、发展及恶化与体内氧化物质增多、抗氧化物质减少密切相关[1]。KURO-O等[2]研究显示,klotho主要在肾脏中高表达。MITANI等[3]采用原位杂交技术研究表明,Klotho mRNA主要在肾小管上皮细胞中表达,氧化应激和肾素-血管紧张素系统(RAS)的激活可以抑制其在肾脏中的表达。有研究结果表明,在肾小球肾炎模型小鼠体内过表达klotho蛋白,可使小鼠具有对抗氧化应激从而减少肾损伤的功能[4]。以上研究表明,klotho蛋白在体内能够抑制氧化应激,可以通过检测klotho蛋白在体内的表达水平估测小鼠肾脏的损伤情况。奥美沙坦酯为血管紧张素Ⅱ受体拮抗剂,临床上常用于降低血压和减少尿蛋白。有研究表明,奥美沙坦酯通过抑制血管紧张素Ⅱ引起的氧化应激起到保护肾脏的作用[5]。他克莫司为新型免疫抑制剂,属于钙调神经蛋白酶抑制剂,可对钙离子传导通路进行干扰,特异性提高细胞内钙离子浓度,减弱细胞去磷酸化功能,对白细胞介素分泌进行控制,发挥免疫抑制作用,近年来开始应用于肾病综合征的临床治疗,具有减少尿蛋白、延缓肾脏疾病进展的作用。本研究采用单次尾静脉注射阿霉素方法建立阿霉素肾病模型,给予奥美沙坦酯及他克莫司灌胃治療,探讨两种药物对模型大鼠肾脏氧化应激反应及klotho蛋白表达的影响,以期为他克莫司治疗肾病综合征提供新的理论支持。
1 材料与方法
1.1 实验材料
1.1.1 动物 清洁级雄性Wistar大鼠60只,体质量230~260 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006,饲养于青岛大学医学院动物房。
1.1.2 主要试剂 奥美沙坦酯(第一三共制药(上海)有限公司),盐酸阿霉素(MedChemExpress),他克莫司(Astellas Ireland Co.,Ltd),兔抗鼠anti-klotho多克隆抗体(英国Abcam),β-actin(北京博奥森),免疫组化试剂盒(北京中杉金桥),DAB显色试剂盒(福州迈新),苏木精-伊红染色试剂(北京索莱宝),Trizol试剂(美国Invitrogen),cDNA反转录试剂盒和RT-PCR试剂盒(北京Takara)。
1.2 实验方法
1.2.1 动物分组及处理 大鼠适应性喂养1周后,随机分为正常对照组(NC组)、阿霉素肾病模型组(ADR组)、奥美沙坦酯治疗组(OLM组)以及他克莫司治疗组(FK506组),每组15只。其中ADR组、OLM组和FK506组大鼠给予一次性尾静脉注射阿霉素5 mg/kg造模,NC组大鼠注射等量的生理盐水。7 d后留取大鼠24 h尿蛋白,与正常对照大鼠相比,尿蛋白升高有统计学意义视为造模成功[6]。造模后,OLM组连续12周给予奥美沙坦酯10 mg/(kg·d)灌胃[5],FK506组连续12周给予他克莫司0.5 mg/(kg·d)灌胃[7],NC组及ADR组给予等量生理盐水灌胃。
1.2.2 24 h尿蛋白检测 于实验第4、8、12周末从每组中随机各选5只大鼠放入清洁代谢笼中,收集24 h尿液,-80 ℃保存,用于检测24 h尿蛋白定量。实验重复3次,取均值。
1.2.3 标本采集 分别于实验第4、8、12周末每组取5只大鼠,处死,打开腹腔游离肾脏。迅速取出一侧肾脏放入40 g/L中性甲醛中固定,4 ℃保存,用于苏木精-伊红染色和免疫组织化学染色;将另一侧肾组织快速放入液氮中,-80 ℃保存,用于Wes-tern blot和实时荧光定量PCR(q-PCR)。
1.2.4 肾组织病理学观察 肾组织经包埋制成石蜡切片,切片脱蜡、复水后经苏木精染色10 min、伊红染色5 min,脱水、透明、封片,在显微镜下观察肾组织病理改变。
1.2.5 超氧化物歧化酶(SOD)和丙二醛(MDA)的测定 采用羟胺法检测大鼠肾组织中SOD活性,采用比色法检测大鼠肾组织中MDA含量。均严格按照试剂盒说明进行操作。实验重复3次,取均值。
1.2.6 Western blot检测klotho蛋白的表达 提取肾组织中总蛋白,加入RIPA裂解液匀浆后,用BCA法检测蛋白浓度,加入4×蛋白上样缓冲液,金属浴煮沸5 min,各组蛋白分别上样,用100 g/L SDS-PAGE分离后转移到PVDF膜上,以体积分数0.05的牛奶封闭1 h,加入一抗klotho(1∶1 000)和β-actin(1∶2 000),4 ℃孵育过夜,洗膜,加入二抗常温孵育,洗膜后显影,用Image J软件分析蛋白的相对表达量。实验重复3次,取均值。
1.2.7 q-PCR检测klotho mRNA的表达 按照Triol试剂说明书提取肾组织总RNA,逆转录合成cDNA,进行q-PCR。引物由睿博兴科生物技术有限公司合成,引物序列见表1。反应条件为:95 ℃、10 s,57 ℃、30 s,共40个循环。用2-△△Ct计算目的基因mRNA相对表达量。实验重复3次,取均值。
1.3 统计学分析
应用GraphPad Prism 5.0软件进行统计学分析,所得实验数据以±s表示,数据间比较采用析因设计的方差分析,相关性分析采用Spearson相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 造模后大鼠一般情况
大鼠尾静脉注射阿霉素1周后均出现不同程度的腹泻,食量下降,活动减少;2周后腹泻逐渐停止,饮食及活动逐渐恢复;第3周出现轻度水肿,以足部及睾丸最明显;第4周水肿最重。
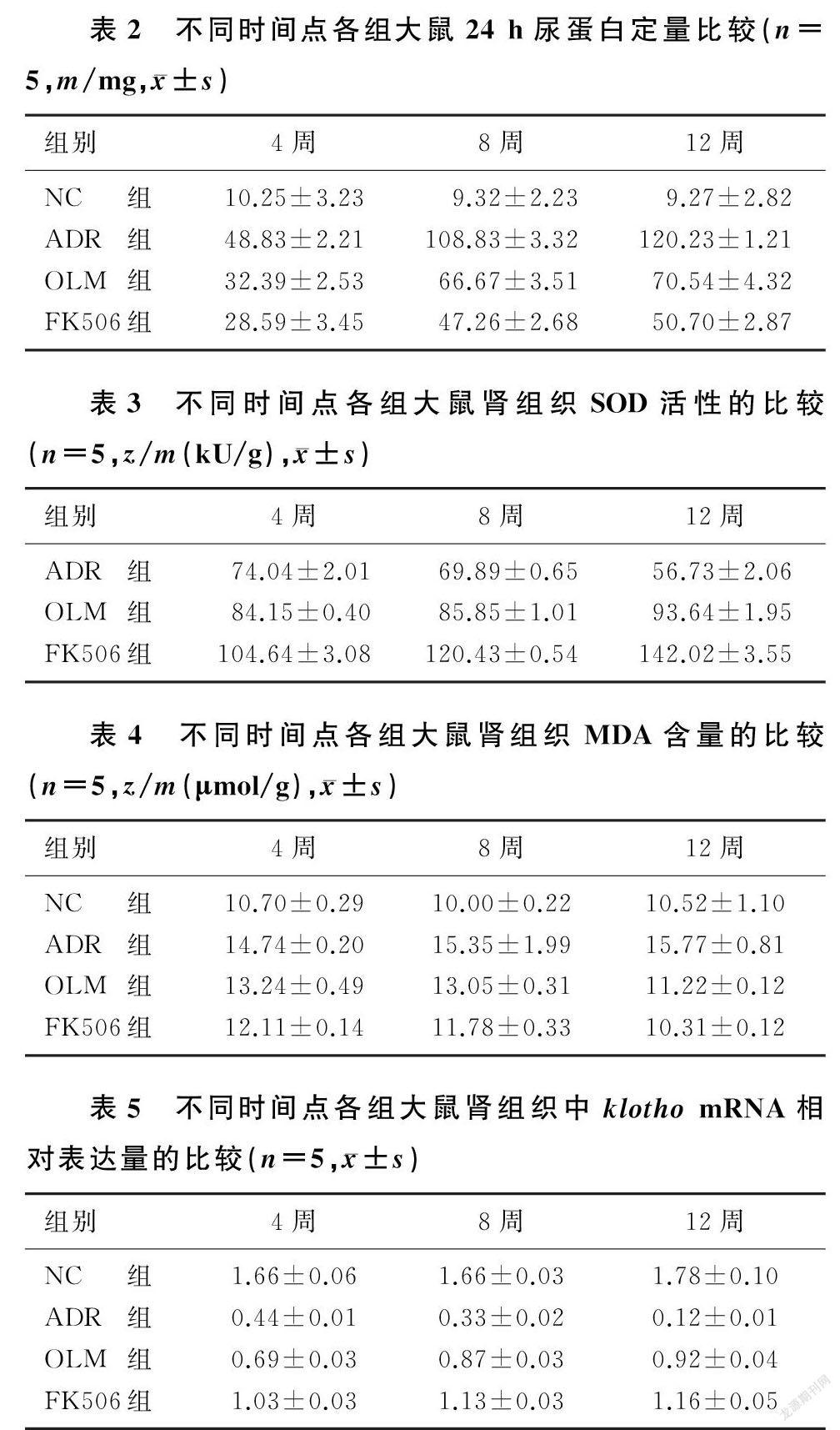
2.2 各组大鼠24 h尿蛋白定量比较
大鼠24 h尿蛋白定量检测组别与时间存在交互效应(F时间×组别=101.579,P<0.05)。ADR组、OLM组及FK506组大鼠各时间点24 h尿蛋白含量均高于NC组,OLM组和FK506组较ADR组降低,FK506组较OLM组降低,差异均有统计学意义(F=126.969~781.905,P<0.05);组内比较,随着时间的延长,ADR组24 h时尿蛋白含量进行性升高,OLM组和FK506组进行性降低,差异具有统计学意义(F=16.957~182.942,P<0.05)。见表2。
2.3 大鼠肾组织病理学观察
与NC组相比,ADR组实验第4周末可见肾小管上皮细胞轻度萎缩,上皮细胞内有颗粒和空泡变性,近端小管上皮细胞刷状缘脱落、管腔扩大并可见蛋白管型及少量炎细胞浸润;第8周末可见肾小管上皮细胞明显萎缩,空泡及颗粒变性更加明显,管内蛋白管型较前增多,间质血管肿胀更加明显,炎细胞数量增多;第12周末可见肾小管灶状萎缩,蛋白管型更多,肾间质小动脉管壁增厚、管腔狭窄,间质内炎细胞浸润更加明显,并有轻度纤维化。OLM组和FK506组大鼠肾脏的病理表现较ADR组呈时间依赖性的减轻,且FK506组病理改变较OLM组更加明显。
2.4 各组大鼠肾组织SOD活性和MDA含量比较
大鼠腎组织SOD活性检测组别与时间存在交互效应(F时间×组别= 201.531,P<0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中SOD活性均较NC组降低,OLM组和FK506组较ADR组升高,FK506组较OLM组升高,差异均有显著意义(F=125.782~467.589,P<0.05);组内比较,随着时间的延长,ADR组大鼠肾组织中SOD活性进行性降低,OLM组及FK506组进行性升高,差异具有显著性(F=6.871~57.072,P<0.05)。见表3。
大鼠肾组织MDA含量检测组别与时间存在交互效应(F时间×组别= 67.026,P<0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中MDA含量均较NC组升高,OLM组及FK506组较ADR组降低,FK506组较OLM组降低,差异具有统计学意义(F=52.782~162.589,P<0.05);组内比较,随着时间的延长,ADR组大鼠肾组织中MDA含量进行性升高,OLM组及FK506组进行性降低,差异具有显著性(F=6.871~57.072,P<0.05)。见表4。
2.5 各组大鼠肾组织中klotho mRNA表达的比较
大鼠肾组织中klotho mRNA表达检测组别与时间存在交互效应(F时间×组别=326.571,P<0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中klotho mRNA的表达均较NC组降低,OLM组及FK506组较ADR组升高,FK506组较OLM组升高,差异具有统计学意义(F=116.671~507.513,P<0.05);组内比较,随着时间的延长,ADR组大鼠肾组织中klotho mRNA的表达进行性降低,OLM组和FK506组的表达进行性升高,差异具有统计学意义(F=12.982~40.485,P<0.05)。见表5。
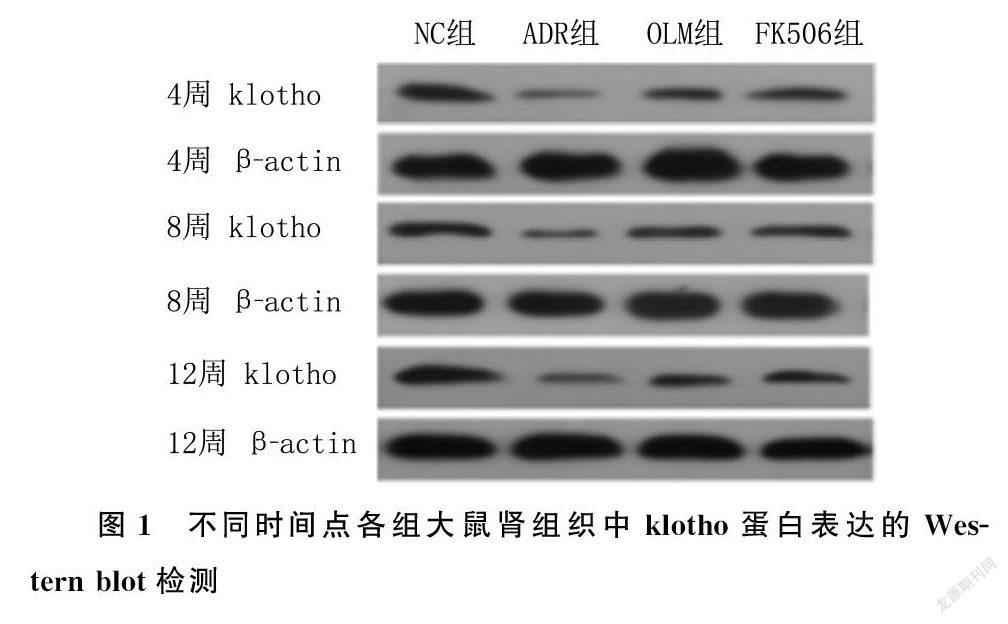
2.6 各组大鼠肾组织中klotho蛋白表达的比较
大鼠肾组织中klotho蛋白表达检测组别与时间存在交互效应(F时间×组别=223.581,P<0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中klotho蛋白的表达均较NC组降低,OLM组及FK506组较ADR组升高,FK506组较OLM组升高,差异具有统计学意义(F=126.969~609.513,P<0.05);组内比较,随着时间的延长,ADR组大鼠肾组织中klotho蛋白表达进行性降低,OLM组和FK506组进行性升高,差异具有统计学意义(F=10.985~38.405,P<0.05)。见图1。
2.7 klotho表达与氧化应激的关系
大鼠肾组织中klotho蛋白表达与MDA含量及24 h尿蛋白定量呈负相关(r=-0.896、-0.948,P<0.01),与SOD活性呈正相关(r=0.927,P<0.01)。见图2。
3 讨 论
阿霉素肾病模型是目前公认的肾病综合征动物模型。阿霉素对肾脏具有慢性毒性作用,它可以通过多种机制引起肾脏损伤,其中氧化应激是比较常见和重要的机制之一。有研究表明,活性氧(ROS)是引起足细胞损伤的重要因素[8]。另有研究表明,ROS可引起肾小管内皮细胞损伤,影响肾小管的重吸收作用,从而导致大量蛋白质随尿液排出体外,引起蛋白尿[9]。蛋白尿是诊断肾病综合征的标准之一,也是肾功能进展的独立危险因素。Klotho是一种与衰老相关的基因,其对机体的保护作用已经被广泛报道[10]。LIM等[11]研究表明,klotho通过抑制氧化应激、RAS激活和改善线粒体功能发挥肾脏保护作用。另有研究表明,klotho过表达转基因小鼠的锰超氧化物歧化酶(MnSOD)表达量升高[12-13],从而起到抑制氧化应激的作用。然而有研究表明,当机体出现氧化应激时,klotho基因在肾脏的转录及表达均减少[4]。ROS的产生是阿霉素肾病模型大鼠肾脏损伤的主要原因,因此,抑制氧化应激不仅可减轻其对肾脏的损伤还可提高klotho基因在肾小管上皮细胞的表达,从而起到保护肾脏的作用。
研究表明,肾脏RAS过度激活与许多肾脏疾病有关,RAS过度激活的主要效应包括氧化应激、NF-κB激活、纤维母细胞增殖及细胞外基质过度沉积等[14]。血管紧张素转化酶抑制剂(ACEI)类药物具有降血压、减少尿蛋白及保护肾脏的作用,其减少尿 蛋白的主要机制为阻断RAS,减少血管紧张素Ⅱ(AngⅡ)的产生。本研究以Wistar大鼠作为研究对象,采用一次性尾静脉注射阿霉素方法建立阿霉素肾病模型,模型大鼠分别给予奥美沙坦酯和他克莫司治疗12周,结果显示,奥美沙坦酯组和他克莫司组24h尿蛋白定量均较ADR组明显降低,证明奥美沙坦酯及他克莫司均具有减少尿蛋白的作用,这与既往的研究结论一致[15-16]。且他克莫司减少尿蛋白的疗效优于奥美沙坦酯。ACEI类药物可减少AngⅡ的产生,也具有抗氧化的作用。局部AngⅡ与血管紧张素Ⅱ1型受体(AngⅡ1)结合后可激活NADH/NADPH氧化酶,使O2-、H2O2等ROS类物质生成增多。AngⅡ还可作用于血管内皮细胞,刺激其产生ROS增加,从而使血浆氧化应激水平升高[17-18]。本研究结果显示,在分别给予奥美沙坦酯和他克莫司治疗4、8及12周后,奥美沙坦酯组及他克莫司组氧化应激反应均较模型组明显减弱,且他克莫司减弱氧化应激的作用较奥美沙坦酯更加明显,表明他克莫司能有效减轻氧化应激对肾脏的损害,其对肾脏的保护作用优于奥美沙坦酯。有动物实验结果表明,AngⅡ可下调klotho在肾脏中的表达[19]。糖尿病肾病大鼠给予缬沙坦治疗后,其肾脏组织中klotho蛋白表达水平升高而氧化应激反应降低[15]。另有研究表明,在慢性肾衰竭病人体内,klotho的表达量明显下降,RAS和氧化应激激活可抑制klotho在肾臟表达[20]。其机制可能是klotho通过抑制胰岛素样/胰岛素样生长因子-1介导的FoxO磷酸化而活化FoxO转录因子[21-22],去磷酸化的FoxO能够反过来上调抗氧化酶如过氧化氢酶-1和SOD的表达。本研究结果显示,在实验第4周末,ADR组大鼠肾组织中klotho的表达开始降低,第8、12周末降低更加明显;分别给予奥美沙坦酯和他克莫司灌胃治疗后,模型大鼠klotho的表达升高。实验第4、8、12周末,OLM组和FK506组大鼠肾组织中klotho的表达均较ADR组显著增加,且FK506组较OLM组增加更加明显。
综上所述,阿霉素肾病大鼠klotho表达下降与肾病综合征的发生、发展密切相关;在阿霉素肾病大鼠模型中,奥美沙坦酯和他克莫司均具有抑制氧化应激反应、提高肾组织中klotho表达进而达到保护肾脏的作用,但他克莫司保护肾脏的作用优于奥美沙坦酯。这两种药物的长期疗效、安全性及肾脏保护作用的具体分子机制目前尚不清楚,还需进一步研究。
[参考文献]
[1] YILMAZ M I, SIRIOPOL D, SAGLAM M, et al. Osteoprotegerin in chronic kidney disease:associations with vascular damage and cardiovascular events[J]. Calcified Tissue International, 2016,99(2):121-130.
[2] KURO-O M, MATSUMURA Y, AIZAWA H, et al. Mutation of the mouse klotho gene leads to a syndrome resembling ageing[J]. Nature, 1997,390(6655):45-51.
[3] MITANI H, ISHIZAKA N, AIZAWA T, et al. In vivo klotho gene transfer ameliorates angiotensin Ⅱ-induced renal damage[J]. Hypertension, 2002,39(4):838-843.
[4] 徐辰. KLOTHO基因介导钙磷代谢与慢性肾脏病关系的研究进展[J]. 国际泌尿系统杂志, 2012,32(5):692-695.
[5] 卢晓梅,马玲,于艳秋. 奥美沙坦酯对慢性心力衰竭小鼠肾脏氧化应激的作用[J]. 中华肾脏病杂志, 2011,27(3):190-193.
[6] 张勇,张蓓,宁华英,等. 单次尾静脉注射法阿霉素大鼠肾病模型的建立[J]. 中国实验动物学报, 2013,21(1):1-4,107.
[7] QI X M, WANG J, XU X X, et al. FK506 reduces albuminuria through improving podocyte nephrin and podocin expression in diabetic rats[J]. Inflammation Research, 2016,65(2):103-114.
[8] PAVENSTADT H, KRIZ W, KRETZLER M. Cell biology of the glomerular podocyte[J]. Physiological Reviews, 2003,83(1):253-307.
[9] VALKO M, RHODES C J, MONCOL J, et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-Biological Interactions,2006,160(1):1-40.
[10] XIAO Nengming, ZHANG Yanming, ZHENG Quan, et al. Klotho is a serum factor related to human aging[J]. Chinese Medical Journal, 2004,117(5):742-747.
[11] LIM S C, LIU J J, SUBRAMANIAM T, et al. Elevated circulating alpha-klotho by angiotensin Ⅱ receptor blocker losartan is associated with reduction of albuminuria in type 2 diabetic patients[J]. Journal of the Renin-Angiotensin-Aldosterone System, 2014,15(4):487-490.
[12] JIN J, JIN L, LIM S W, et al. Klotho deficiency aggravates tacrolimus-induced renal injury via the phosphatidylinositol 3-kinase-Akt-forkhead box protein O pathway[J]. American Journal of Nephrology, 2016,43(5):357-365.
[13] YAMAMOTO M, CLARK J D, PASTOR J V, et al. Regulation of oxidative stress by the anti-aging hormone Klotho[J]. Journal of Biological Chemistry, 2005,280(45):38029-38034.
[14] 贺明,陆利民,姚泰. 肾素-血管紧张素系统在调节肾脏活动和慢性肾功能不全中的作用[J]. 生理科学进展, 2004,35(2):188-192.
[15] 武晓碧,汪晓霞,张希尧,等. 缬沙坦对糖尿病大鼠klotho蛋白及氧化应激影响的研究[J]. 中国糖尿病杂志, 2017,25(8):733-736.
[16] SHEN Xiujin, JIANG Hong, YING Meike, et al. Calcineurin inhibitors cyclosporin A and tacrolimus protect against podocyte injury induced by puromycin aminonucleoside in rodent models[J]. Scientific Reports, 2016,6(6):32087-32116.
[17] HAUGEN E N, CROATT A J, NATH K A. Angiotensin Ⅱ induces renal oxidant stress in vivo and heme oxygenase-1 in vivo and in vitro[J]. Kidney International, 2000,58(1):144-152.
[18] 常洁,姜宗培,张海燕,等. NADPH氧化酶介导血管紧张素Ⅱ诱导的腹膜间皮细胞转分化及细胞外基质积聚[J]. 中华肾脏病杂志, 2007,23(5):328-333.
[19] YOON H E, GHEE J Y, PIAO S, et al. Angiotensin Ⅱ bloc-kade upregulates the expression of Klotho, the anti-ageing gene, in an experimental model of chronic cyclosporine nephropathy[J]. Nephrology Dialysis Transplantation, 2011,26(3):800-813.
[20] DEVARAJ S, SYED B, CHIEN A, et al. Validation of an immunoassay for soluble klotho protein decreased levels in diabetes and increased levels in chronic kidney disease[J]. American Journal of Clinical Pathology, 2012,137(3):479-485.
[21] SENGUPTA A, MOLKENTIN J D, PAIK J H, et al. FoxO transcription factors promote cardiomyocyte survival upon induction of oxidative stress[J]. The Journal of Biological Che-mistry, 2011,286(9):7468-7478.
[22] GREER E L, BRUNET A. FOXO transcription factors at the interface between longevity and tumor suppression[J]. Oncogene, 2005,24(50):7410-7425.
(本文編辑 马伟平)

