相关信号通路阻断对子宫内膜癌裸鼠移植瘤生长影响
朱博文 黄煜 郑晶 颜莉莉 林慧 张清宇



[摘要] 目的 探討阻断趋化因子通路CXCL12/CXCR4、CXCR7及细胞外调节蛋白激酶(ERK)信号通路,对人子宫内膜癌Ishikawa细胞裸鼠皮下移植瘤的抑制作用。方法 将子宫内膜癌Ishikawa细胞悬液与基质胶按1∶1混合,调整细胞密度为7.5×1010/L,取200 μL注射于裸鼠右侧背部肩胛皮下,制备子宫内膜癌动物模型,建模成功后随机分为AMD3100组、PD98059组、Anti-CXCR7组、AMD3100+Anti-CXCR7组和NaCl组(对照组),每组6只。各组裸鼠分别经腹腔给予相应药物,每3 d给药1次,共3周。观察荷瘤裸鼠的状态及移植瘤的生长情况,绘制肿瘤生长曲线,计算抑瘤率;应用RT-PCR方法检测各组瘤体组织中凋亡抑制基因Survivin mRNA的表达。结果 治疗周期结束后,AMD3100组、PD98059组、Anti-CXCR7组、AMD3100+Anti-CXCR7组肿瘤体积及质量均低于对照组,抑瘤率明显高于对照组,瘤体组织Survivin mRNA的表达低于对照组,差异有统计学意义(F=11.35~72.27,P<0.01);AMD3100组、PD98059组、Anti-CXCR7组、AMD3100+Anti-CXCR7组肿瘤体积、质量、抑瘤率及瘤体组织Survivin mRNA的表达比较差异均无显著性(P>0.05)。结论 阻断CXCL12的特异性受体CXCR4、CXCR7以及细胞内ERK信号通路,能够抑制子宫内膜癌Ishikawa细胞裸鼠移植瘤的生长,其机制可能与瘤体组织凋亡抑制基因Survivin的下调有关。
[关键词] 受体,CXCR4;趋化因子CXCL12;CXCR7;细胞外信号调节MAP激酶类;子宫内膜癌
[中图分类号] R737.33 [文献标志码] A [文章编号] 2096-5532(2019)04-0442-05
[ABSTRACT] Objective To investigate the inhibitory effects of blocking the chemokine pathways CXCL12/CXCR4 and CXCR7 and extracellular regulated protein kinase (ERK) signaling pathway on subcutaneous xenografts of human endometrial carcinoma Ishikawa cells in nude mice. Methods Endometrial carcinoma Ishikawa cell suspension was mixed with Matrigel at a ratio of 1∶1, and the cell density was adjusted to 7.5×1010/L; 200 μL of the mixture was subcutaneously injected into the right back scapula of nude mice to establish an animal model of endometrial carcinoma. After successful modeling, the animals were randomly divided into AMD3100 group, PD98059 group, anti-CXCR7 group, AMD3100+anti-CXCR7 group, and NaCl group (control group), with 6 animals in each group. Each group was administered intraperitoneally the corresponding drug, once every 3 d for 3 weeks. The status of tumor-bearing nude mice and the growth of transplanted tumor were observed. The tumor growth curve was plotted, and the tumor inhibition rate was calculated. The mRNA expression of apoptosis-inhibiting gene survivin in tumor tissues of each group was measured by RT-PCR. Results At the end of treatment cycle, the AMD3100 group, PD98059 group, anti-CXCR7 group, and AMD3100+anti-CXCR7 group had significantly lower tumor volume and weight, a significantly higher tumor inhibition rate, and significantly lower expression of Survivin mRNA in tumor tissues than the control group (F=11.35-72.27,P<0.01). There was no significant difference in tumor volume and weight, tumor inhibition rate, and Survivin mRNA expression in tumor tissues between the AMD3100 group, the PD98059 group, the anti-CXR7 group, and the AMD3100+anti-CXCR7 group (P>0.05). Conclusion Blocking CXCL12 specific receptors CXCR4 and CXCR7 and intracellular ERK signaling pathway can inhibit the growth of xenografts of endometrial carcinoma Ishikawa cells in nude mice, which may be related to the down-regulation of apoptosis-inhibiting gene Survivin in tumor tissues.
[KEY WORDS] receptors, CXCR4; chemokine CXCL12; CXCR7; extracellular signal-regulated MAP kinases; endometrial neoplasms
子宫内膜癌(EC)是女性生殖系统最常见的恶性肿瘤之一,在某些发达国家其发病呈年轻化的趋势[1-2]。在中国EC的发病率近年来也呈现出上升趋势[3]。由于其发病机制尚未明确,对于临床晚期病人特别是复发转移者,目前的治疗手段仍较为局限。近年来,EC发生中肿瘤细胞内信号通路的异常受到学者们广泛关注[4-6]。多数研究证实,趋化因子CXCL12及其受体CXCR4、CXCR7在多数肿瘤的发生发展中起重要作用,尤其是其在EC生物学行为中的作用及其机制成为目前研究的热点[7]。已有研究证实,特异性小分子抑制剂靶向干预肿瘤细胞内信号通路,能够抑制EC细胞的增殖[8-9]。体外研究显示,趋化因子通路CXCL12/CXCR4、CXCR7在EC细胞生物学行为中发挥正向调控的重要作用,且CXCL12/CXCR4生物轴通过激活ERK通路上调Survivin蛋白表达,从而引发Ishikawa细胞一系列增殖和侵袭效应,而应用小干扰RNA靶向沉默CXCR4、CXCR7的表达后,Ishikawa细胞的增殖及侵袭能力均降低,并且在细胞周期中出现S期阻滞[10-12]。体内实验将化学合成的CXCR4-siRNA和(或)CXCR7-siRNA局部注射于荷瘤裸鼠瘤体内,结果显示靶向沉默CXCR4及CXCR7的表达后,体内肿瘤细胞的增殖能力明显受限[13]。本研究拟建立EC裸鼠移植瘤动物模型,模拟肿瘤在体内生长的微环境,将CXCR4特异性拮抗剂AMD3100(商品名普乐沙福)、ERK信号通路阻断剂PD98059、CXCR7中和抗体Anti-CXCR7经腹腔注射于荷瘤裸鼠体内,观察移植瘤的生长情况并检测瘤体组织内凋亡抑制基因Survivin的表达,探讨AMD3100、PD98059、Anti-CXCR7对EC裸鼠皮下移植瘤生长的影响。现将结果报告如下。
1 材料和方法
1.1 细胞及实验动物来源
EC Ishikawa细胞由青岛大学附属医院中心实验室提供。SPF级雌性BALB/c裸鼠30只,4~5周龄,体质量14~18 g(购自北京维通利华实验动物技术有限公司),饲养于青岛大学医学部SPF级动物中心,适应1周后用于实验。
1.2 主要试剂
DMEM高糖培养基(Hyclone公司,美国),胎牛血清(PAN,德国),青链霉素混合液、2.5 g/L胰蛋白酶消化液(北京索莱宝,中国),Matrigel基质胶(B&D,美国);AMD3100、PD98059(MCE公司,美国),Anti-CXCR7(Abcam,英国),TRIzol(Invitrogen,美国),逆转录试剂盒、荧光定量PCR试剂盒(TaKaRa,日本)。Survivin和GAPDH PCR引物由上海生工生物工程有限公司合成。
1.3 实验方法
1.3.1 Ishikawa细胞培养 将Ishikawa细胞培养于含有体积分数0.10胎牛血清、10 g/L青链霉素混合液的DMEM完全培养基中,于恒温37 ℃、含体积分数0.05的CO2的培养箱中培养,待细胞铺满培养瓶底75%~85%时,使用2.5 g/L胰蛋白酶消化传代培养。
1.3.2 动物模型建立及分组 离心收集Ishikawa细胞后PBS重悬,将细胞悬液与Matrigel基质胶1∶1混匀调整细胞密度为7.5×1010/L。裸鼠置于超净工作台内,消毒皮肤后,将细胞悬液200 μL(约1.5×107个细胞)注射于裸鼠右侧背部肩胛皮下,于SPF环境中饲养。每天观察裸鼠状态、注射部位肿瘤大小及硬度。1周后,观察所有裸鼠右侧肩胛背部皮下移植瘤(直径>5 mm),将荷瘤裸鼠随机分为AMD3100组(6 mg/kg)、PD98059组(50 mg/kg)、Anti-CXCR7组(1 μL)、AMD3100+Anti-CXCR7组(6 mg/kg AMD3100+1 μL Anti-CXCR7)、对照组(生理盐水),每组6只。各组分别经腹腔注射相应药物,每3 d注射1次,共3周。
1.4 观察指标
1.4.1 裸鼠移植瘤生长情况 每次用药前分别用游标卡尺测量肿瘤的长径(a)、短径(b),根据公式(V=ab2/2)计算肿瘤体积,绘制肿瘤生长曲线。治疗结束后,脱颈处死所有裸鼠,于超净工作台内剥离瘤体,去除脂肪及血污后称质量,计算抑瘤率。抑瘤率(%)=(对照组瘤质量-治疗组瘤质量)/对照组瘤质量×100%。按照金氏公式计算q值以协助验证联合用药是否有叠加抑瘤效应,q<0.85表示联合用药有拮抗作用,q>1.15表示有协同作用,q值0.85~1.15表示有相加作用[14]。
1.4.2 实时荧光定量RT-PCR检测各实验组瘤体组织Survivin mRNA表达 用TRIzol试剂提取移植瘤组织中的总RNA,使用分光光度计(IMPLEN,德国)检测样本中RNA浓度及纯度。根据逆转录试剂盒说明合成cDNA,按荧光定量PCR说明书加入相应体积引物后,置于LightCycler PCR仪(Roche,瑞士)中进行Real Time PCR反应。应用LightCycler 96分析软件自动计算出目的基因Survivin及内参GAPDH的Ct值,以2-△△Ct计算目的基因的相对表达量[15]。Survivin及GAPDH的引物序列見表1。实验重复3次。
1.5 统计学处理
采用SPSS 19.0软件进行统计学分析,计量资料结果用±s表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组移植瘤的生长情况比较
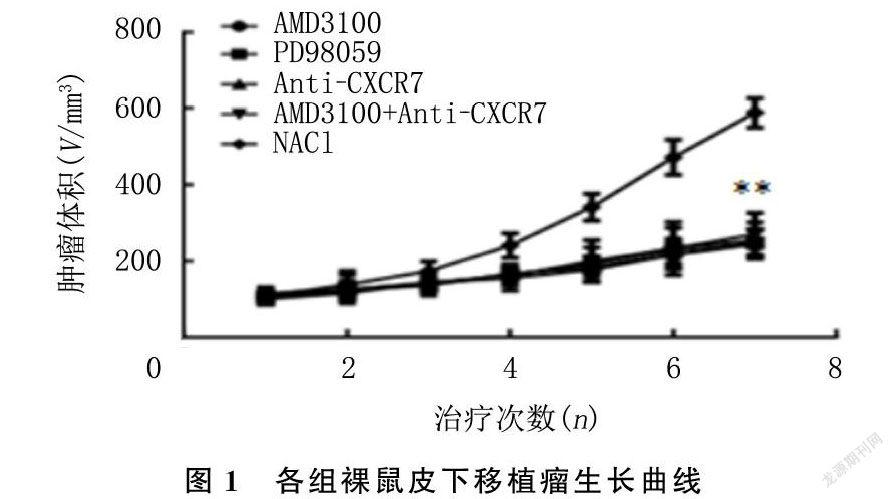
治疗期间,各组裸鼠生长良好,饮食、大小便、精神状态可,无皮肤溃烂及意外死亡。各组裸鼠治疗前体质量、肿瘤体积比较差异无显著统计学意义(P>0.05);治疗后AMD3100组、PD98059组、Anti-CXCR7组、AMD3100+Anti-CXCR7组的肿瘤体积与对照组相比均显著降低,差异有统计学意义(F=72.27,P<0.05);但AMD3100组、PD98059组、Anti-CXCR7组、AMD3100+Anti-CXCR7组肿瘤体积差异无显著性(P>0.05)。见表2、图1。
2.2 各组移植瘤质量比较
与对照组比较,AMD3100组、PD98059组、An-ti-CXCR7组、AMD3100+Anti-CXCR7组的肿瘤质量均明显减少,差异有统计学意义(F=11.35,P<0.01);4个组间肿瘤质量比较差异无统计学意义(P>0.05)。见表2。
2.3 各组抑瘤率比较
AMD3100组、PD98059组、Anti-CXCR7组、AMD3100+Anti-CXCR7组抑瘤率与对照组相比均明显升高,差异有显著性(F=22.94,P<0.01),但4组间的抑瘤率比较差异无统计学意义(P>0.05)。见表3。应用金氏公式计算得出q=0.60,提示联合用药有拮抗作用。2.4 各组移植瘤组织Survivin mRNA表达比较 本文AMD3100组、PD98059组、Anti-CXCR7组和AMD3100+Anti-CXCR7组移植瘤组织内的Survivin mRNA的相对表达量均较对照组明显下调,差异有统计学意义(F=17.16,P<0.01),4组间Survivin mRNA相对表达量比较差异无统计学意义(P>0.05)。见表3。
3 讨 论
EC好发于围绝经期和绝经后女性,严重影响女性身体健康及生活质量,早期EC经手术治疗有明显改善,但发生远处转移及复发病人即使采用联合放化疗和(或)激素治疗,也不能明显改善预后。近年来,随着对肿瘤分子机制和信号通路研究的深入,越来越多的学者开始关注小分子靶向药物在EC治疗中的应用,并取得了一定的效果。有研究发现,在EC中PI3K/AKT/mTOR通路的改变最为常见,该信号通路的激活与EC发展及不良预后有关,它似乎存在于所有实体瘤中[16]。临床上,对于复发、要求保留生育功能的EC病人,分子靶向药物治疗成为重要选择,这些药物包括酪氨酸激酶(TK)抑制剂[17]、哺乳动物雷帕霉素靶蛋白(mTOR)信号通路抑制剂[18]、磷脂酰肌醇-3-激酶(PI3K)抑制剂[19]、蛋白激酶B(Akt)抑制剂[20]、PI3K/mTOR双重抑制剂[21]、血管内皮生长因子(VEGF)抑制剂[22]、表皮生长因子受体(EGFR)抑制剂[23]、人类表皮生长因子受体(HER2/neu)抑制剂[24]。
CXCL12/CXCR4、CXCR7生物轴及ERK-1/2信号传导通路在EC的发生发展中起重要作用,应用相应的抑制剂靶向阻断该通路,能够抑制EC细胞的增殖,说明该通路的特异性阻断剂有望成为治疗EC的靶向药物。早在2006年,REDJA等[25]就报道应用CXCR4特异性阻断剂AMD3100抑制CXCL12/CXCR4信号传导,研究其对体内胶质瘤生长的抑制作用,并取得成功。而IERANO等[26]研究结果证实,CXCR4拮抗剂和CXCR7拮抗剂通过干扰CXCL12/CXCR4、CXCR7轴影响肾癌细胞mTOR信号通路的生物学效应而用于肾细胞癌的治疗;并且有研究证实,CXCR4和CXCR7可预测肾细胞癌的预后[27-28]。还有研究表明,肿瘤相关成纤维细胞通过分泌基质细胞衍生因子-1α(SDF-1α,又称趋化因子CXCL12)促进EC细胞的增殖、迁移和侵袭,而这一作用能够被CXCR4特异性拮抗剂AMD3100显著抑制[7]。CXCR7为CXCL12的另一种重要受体,与CXCR4相比,其与CXCL12亲和力更高。GU等[29]的研究显示,CXCR7 mRNA和蛋白在EC细胞系Ishikawa及原发性EC组织中均高表达,在体外实验中siCXCR7能够沉默EC细胞系及组织中CXCR7的表达,降低CXCR7导致的肿瘤细胞增殖的能力。郭瑞霞等[9]体内实验的结果也显示,ERK抑制剂PD98059通过阻断MAPK/ERK信号传导通路,增加EC细胞系Ishikawa和HEC-1A细胞裸鼠移植瘤组织中肿瘤细胞的凋亡,抑制肿瘤的生长。我们前期的研究结果也证实,ERK信号通路在EC细胞增殖和侵袭中起重要作用,通过CXCL12/CXCR4生物轴激活ERK信号通路上调Survivin蛋白和MMP-2蛋白表达可引发Ishikawa细胞的增殖和侵袭[10]。研究显示,Survivin蛋白在83%的EC中表达上调,下调Survivin蛋白表达能够增加Ishikawa细胞的凋亡[30];CXCL12/CXCR4、CXCR7轴在EC组织及细胞中高表达,采用siRNA靶向沉默CXCR4和(或)CXCR7基因表达后,能够抑制体内外EC细胞的增殖[10-13]。
然而,目前关于多种小分子靶向抑制剂用于体内EC的研究较少,并且抑制剂在体内发挥作用的机制尚未明确。本文研究通过建立裸鼠EC移植瘤模型,将CXCL12下游通路的4种分子靶向抑制剂AMD3100、PD98059、Anti-CXCR7以及AMD3100+Anti-CXCR7用于体内治疗。结果显示,与对照组比较,靶向抑制剂干预各组瘤体生长速度及体积均明显减小,瘤体组织Survivin mRNA的表达也明显下调,说明这些靶向抑制剂的抑瘤作用可能与凋亡抑制基因Survivin的下调有关。此外,本文结果还显示,AMD3100、Anti-CXCR7联合应用或者单用都能够抑制裸鼠皮下移植瘤的生长,下调瘤体组织Survivin的表達,但二者联合应用并不能产生协同抑瘤作用,这可能与存在不同信号通路的相互拮抗作用有关,与我们之前联合使用CXCR4-siRNA和(或)CXCR7-siRNA进行体内实验的结果相一致[13],说明趋化因子CXCL12与其受体CXCR4、CXCR7形成的信号通路可能相互影响。
综上所述,趋化因子生物轴CXCL12/CXCR4、CXCR7下游的靶向抑制剂AMD3100、PD98059和Anti-CXCR7均能抑制人EC Ishikawa细胞裸鼠皮下移植瘤的生长,且能下调瘤体组织凋亡抑制基因Survivin的表达。CXCR4、CXCR7趋化因子受体拮抗剂以及ERK通路抑制剂有望成为治疗EC的新型小分子靶向抑制剂,为临床治疗EC提供更多选择。现阶段,已经开发出拮抗CXCR4的小分子拮抗剂,其中一些正处于临床试验阶段。普乐沙福(AMD3100)目前已被批准应用于临床治疗非霍奇金淋巴瘤和多发性骨髓瘤[31],但其应用于EC的治疗还需要进一步的研究。本研究结果为CXCL12/CXCR4、CXCR7通路的靶向抑制剂用于治疗EC提供了实验支持。
[参考文献]
[1] SZWARC M M, KOMMAGANI R, PUTLURI V A, et al. Steroid receptor coactivator-2 controls the pentose phosphate pathway through RPIA in human endometrial cancer cells[J]. Scientific Reports, 2018,8(1):13134-13145.
[2] KIM T H, YOO J Y, KIM H I, et al. Mig-6 suppresses endometrial cancer associated with Pten deficiency and ERK activation[J]. Cancer Research, 2014,74(24):7371-7382.
[3] 陈万青,张思维,曾红梅,等. 中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014,23(1):1-10.
[4] 朱奕晓,王艳. Hedgehog信号通路与常见妇科恶性肿瘤的研 究进展[J]. 医学综述, 2017,23(12):2364-2369.
[5] 曹楚楚,黄炉仁,傅芬. PI3K/Akt/mTOR信号通路及其相关基因突变与子宫内膜癌靶向性药物治疗的研究进展[J]. 基础医学与临床, 2017,37(1):118-122.
[6] 车晓霞,姜洁. PI3K/Akt/mTOR信号通路靶向治疗在子宫内膜癌中的研究进展[J]. 现代妇产科进展, 2016,25(1):74-77.
[7] KRIKUN G. The CXL12/CXCR4/CXCR7 axis in female reproductive tract disease: review[J]. American Journal of Reproductive Immunology, 2018,80(5): e13028-e13035.
[8] TENG Fei, TIAN Wenyan, WANG Yingmei, et al. Cancer-associated fibroblasts promote the progression of endometrial cancer via the SDF-1/CXCR4 axis[J]. Journal of Hematology & Oncology, 2016,9(8):1-15.
[9] 郭瑞霞,王新燕,张瑞芳,等. 阻断丝裂原活化蛋白激酶信号通路对子宫内膜癌生长抑制作用的研究[J]. 现代妇产科进展, 2012,21(2):105-108.
[10] 马营营,黄煜,颜莉莉,等. ERK信号转导通路在CXCL12促进子宫内膜癌细胞增殖和侵袭中的作用[J]. 中国肿瘤生物治疗杂志, 2016,23(2):250-254.
[11] LONG Ping, SUN Fengyi, MA Yingying, et al. Inhibition of CXCR4 and CXCR7 for reduction of cell proliferation and invasion in human endometrial cancer[J]. Tumor Biology, 2016,37(6):7473-7480.
[12] LIU Pingping, LONG Ping, HUANG Yu, et al. CXCL12/CXCR4 axis induces proliferation and invasion in human endometrial cancer[J]. American Journal of Translational Research, 2016,8(4):1719-1729.
[13] HUANG Yu, YE Yuanying, LONG Ping, et al. Silencing of CXCR4 and CXCR7 expression by RNA interference suppresses human endometrial carcinoma growth in vivo[J]. American Journal of Translational Research, 2017,9(4):1896-1904.
[14] 金正鈞. 合并用药中的相加[J]. 中国药理学报, 1980,1(1):70-76.
[15] SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative C(T) method[J]. Nature Protocols, 2008,3(6):1101-1108.
[16] LIU Hua, ZHANG Liqin, ZHANG Xuyan, et al. PI3K/AKT/mTOR pathway promotes progestin resistance in endometrial cancer cells by inhibition of autophagy[J]. OncoTargets and Therapy, 2017,10(1):2865-2871.
[17] SUN Niankang, HUANG Shanglang, CHANG Tingchang, et al. Sorafenib induces endometrial carcinoma apoptosis by inhi-biting Elk-1-dependent Mcl-1 transcription and inducing Akt/GSK3 beta-dependent protein degradation[J]. Journal of Cellular Biochemistry, 2013,114(8):1819-1831.
[18] SLOMOVITZ B M, JIANG Y Y, YATES M S, et al. Phase Ⅱ study of everolimus and letrozole in patients with recurrent endometrial carcinoma[J]. Journal of Clinical Oncology, 2015,33(8):930-935.
[19] PACKER L M, GENG X Y, BONAZZI V F, et al. PI3K inhibitors synergize with FGFR inhibitors to enhance antitumor responses in FGFR2(mutant) endometrial cancers[J]. Molecular Cancer Therapeutics, 2017,16(4):637-648.
[20] HASEGAWA K, KAGABU M, MIZUNO M, et al. Phase Ⅱ basket trial of perifosine monotherapy for recurrent gynecolo-gic cancer with or without PIK3CA mutations[J]. Investigatio-nal New Drugs, 2017,35(6):800-812.
[21] DEL C J, BIRRER M, DAVIS C, et al. A randomized phase Ⅱ non-comparative study of PF-04691502 and gedatolisib (PF-05212384) in patients with recurrent endometrial cancer[J]. Gynecologic Oncology, 2016,142(1):62-69.
[22] AGHAJANIAN C, SILL M W, DARCY K M, et al. Phase Ⅱ trial of bevacizumab in recurrent or persistent endometrial cancer: a gynecologic oncology group study[J]. Journal of Cli-nical Oncology, 2011,29(16):2259-2265.
[23] YANG Yuan, ZHOU Jingyi, LI Xiaoping, et al. Gefitinib enhances sensitivity of endometrial cancer cells to progestin the-rapy via dual-specificity phosphatase 1[J]. Oncotarget, 2017,8(70):115360-115369.
[24] FADER A N, ROQUE D M, SIEGEL E, et al. Randomized phase Ⅱ trial of Carboplatin-Paclitaxel versus Carboplatin-Paclitaxel-Trastuzumab in uterine serous carcinomas that overexpress human epidermal growth factor receptor 2/neu[J]. Journal of Clinical Oncology, 2018,36(20):2044-2050.
[25] REDJAL N, CHAN J A, SEGAL R A, et al. CXCR4 inhibition synergizes with cytotoxic chemotherapy in gliomas[J]. Clinical Cancer Research, 2006,12(22):6765-6771.
[26] IERANO C, SANTAGATA S, NAPOLITANO M, et al. CXCR4 and CXCR7 transduce through mTOR in human renal cancer cells[J]. Cell Death & Disease, 2014,5(7): e1310-e1321.
[27] D’ALTERIO C, CONSALES C, POLIMENO M, et al. Concomitant CXCR4 and CXCR7 expression predicts poor prognosis in renal cancer[J]. Current Cancer Drug Targets, 2010,10(7):772-781.
[28] GOSSAGE L, EISEN T. Alterations in VHL as potential biomarkers in renal-cell carcinoma[J]. Nature Reviews Clinical Oncology, 2010,7(5):277-288.
[29] GU Hongqin, ZHANG Zhenbo, ZHANG Jiawen, et al. The role of the SDF-1/CXCR7 axis on the growth and invasion ability of endometrial cancer cells[J]. Archives of Gynecology and Obstetrics, 2017,295(4):987-995.
[30] KUMAR A, SIROHI V K, ANUM F, et al. Enhanced apoptosis, survivin down-regulation and assisted immunochemotherapy by curcumin loaded amphiphilic mixed micelles for subjugating endometrial cancer[J]. Nanomedicine: Nanotech-nology, Biology, and Medicine, 2017,13(6):1953-1963.
[31] YOGO T, TSUKADA N, NASHIMOTO J, et al. Efficacy of plerixafor in autologous peripheral blood stem cell collection[J]. Rinsho Ketsueki, 2019,60(3):165-170.
(本文編辑 黄建乡)

