落葵种子蛋白提取工艺优化及其抑菌和抗氧化特性分析
张清 桂萌 高亮 周康 李军


摘要:【目的】優化落葵(Basella alba L.)种子蛋白提取工艺,并分析其抑菌和抗氧化特性,为开发利用落葵种子蛋白提供参考依据。【方法】采用盐析法提取落葵种子蛋白,以大肠杆菌为指示菌,通过比较不同浸泡缓冲液、浸泡时间、料液比和硫酸铵饱和度提取蛋白的抑菌效果,选出影响较大的因素进行正交试验从而确定最佳提取方案;通过牛津杯抑菌试验评价落葵种子蛋白对33株菌的抑菌效果,同时对其还原力及清除DPPH自由基能力进行测定。【结果】3个因素对落葵种子蛋白提取效果的影响排序为料液比>硫酸铵饱和度>浸泡时间;其最佳提取工艺为:浸泡时间14 h、料液比1∶8、硫酸铵饱和度95%,在此条件下提取物的蛋白含量可达33.00 mg/mL,大肠杆菌抑菌圈直径为19.68 mm。落葵种子蛋白抑菌范围较广,对红酵母、枯草芽孢杆菌、金黄色葡萄球菌、单增李斯特菌、藤黄球菌、副溶血性弧菌、假单胞菌、气单胞菌、大肠杆菌等33株菌均具有良好的抑菌效果。落葵种子蛋白还原力测定的半最大效应浓度(EC50)为4.867 mg/mL,对DPPH自由基清除率的半抑制浓度(IC50)为27.817 mg/mL。【结论】落葵种子蛋白具有良好的抑菌效果和抗氧化特性,有作为天然抑菌剂和抗氧化剂的潜在价值。
关键词: 落葵种子蛋白;单因素;正交试验;提取工艺;抑菌;抗氧化
中图分类号: S649 文献标志码: A 文章编号:2095-1191(2019)04-0816-09
Abstract:【Objective】The extraction technology of Basella alba L. seed protein was optimized, its bacteriostasis and antioxidant properties were analyzed. It provided theoretical basis for the development and utilization of B. alba seeds.【Method】Salting-out method was used to extract protein of B. alba seeds. Escherichia coli was used as indicator bacteria. The antimicrobial effect of protein extracted by different soaking buffers, soaking times, material-liquid ratios and ammonium sulfate saturation was compared, and the influencing factors were selected for orthogonal test to determine the best extraction scheme. Antimicrobial effect of B. alba seed protein against thirty-three strains of bacteria were tested in Oxford cup. The reducing power and DPPH free radicals scavenging ability were also studied. 【Result】Three prominent influen-cing factors were selected and their effects on B. alba seed protein extraction were: material-liquid ratio>saturation of ammonium sulfate>soaking time. The optimum extraction conditions were as follows: soaking time 14 h, ratio of material to liquid 1∶8 and saturation of ammonium sulfate 95%. Under such condition, the extracted protein content was 33.00 mg/mL and the diameter of the inhibition zone for E. coli was 19.68 mm.The inhibition zone of B. alba seed protein was large, it had fine inhibition effects against 33 strains of bacteria such as Rhodothece glutinis, Bacillus subtilis, Staphylococcus aureus, Listeria monocytogenes, Micrococcus luteus, Vibrio parahemolyticus, Pseudomonas aeruginosa, Aeromonas and E. coli. Half-maximal effect concentration(EC50) of B. alba seed protein reducing ability was 4.867 mg/mL, and its half-inhibitory concentration(IC50) against DPPH radical scavenging rate was 27.817 mg/mL. 【Conclusion】B. alba seed protein has fine antibacterial effect and antioxidant property, and has potential value as a natural antimicrobial and antioxidant.
Key words: seed protein of Basella alba L.; single factor; orthogonal test; extraction technique; bacteriostatic; antioxidation
0 引言
【研究意义】落葵(Basella alba L.)为落葵科落葵属多年生蔓生肉质藤本植物(赵金莉等,2011),其味道清香爽口,作为新型绿色健康蔬菜越来越受到人們喜爱。落葵营养丰富,叶和茎均可食用,每1 kg可食部分含有蛋白质17 g、脂肪2 g和碳水化合物31 g,同时含有丰富的钙、磷、铁等元素(卢毓星等,2005)。落葵全株可入药,民间常用其治病或作食疗,能清热滑肠、凉血、解毒,主治大便秘结、小便短涩、痢疾便血等症(彭会军,2008)。落葵种子富含蛋白,李艳梅等(2011)采用碱溶酸沉法提取分离落葵种子蛋白,在优化条件下得到蛋白质提取率为82.15%。虽然落葵种子蛋白含量丰富,但未得到充分利用,为研究其潜在价值,本研究采用正交优化法最大限度地提取落葵种子活性蛋白。植物源防腐剂是从植物的根、茎、叶和果实等提炼出的蛋白类、肽类、多糖类、黄酮类、多酚类、萜类、精油及植物自身成分的酶解产物等,具有一定的营养保健价值,即发挥抑菌、抗菌和食品保鲜作用的同时,还具有抗氧化、降血脂、降血压、预防肿瘤等疾病的保健功能(张媛媛等,2014)。落葵本身具有药食同源性,具有研发成为天然抑菌剂和天然抗氧化剂的潜力,因此研究落葵种子蛋白的特性具有重要意义。【前人研究进展】关于植物蛋白特性的研究,主要包括抑菌和抗氧化两方面。食品腐败不仅降低食品的营养价值,还增加食源性疾病风险(张新武等,2014),目前食品防腐剂种类繁多,化学防腐剂是使用最广泛的一种,但由于其对人体有一定的毒害作用,所以人们开始寻求天然食品防腐剂(肖素荣和李京东,2007;赵国萍等,2017)。王佐等(2002)分离纯化得到色谱纯的抗3型科萨奇病毒的苦瓜蛋白,通过体外抗病毒试验表明一定范围内的苦瓜蛋白对3型科萨奇病毒感染的HepG2细胞有明显保护作用;李军等(2018b)从萝卜籽中分离得到一种抑菌蛋白,研究发现该蛋白对9株鲟鱼腐败菌均具有很好的抑制作用。目前工业上使用的抗氧化剂大多是合成型,虽然抗氧化效果好,但其安全性一直受到质疑;天然抗氧化剂是从天然食品中提取的具有抗氧化活性的物质,具有安全性高、抗氧化能力强、无副作用等特点(章林等,2012),如莲子蛋白对羟基自由基具有较好的清除作用(张羽,2008)。关于落葵的研究目前主要集中在对落葵色素和多糖的研究,张美荣等(2010)对落葵果实中的色素提取工艺进行优化并研究其稳定性;林爱琴(2010)研究表明落葵多糖具有清除自由基的作用;邹群等(2011)研究发现落葵多糖有抑制肿瘤生长和免疫调节功效;李小莉等(2012)研究表明落葵多糖对荷瘤小鼠的肿瘤生长表现出显著的抑制作用;Reshmi和Suganya(2012)采用琼脂扩散法将落葵果实甲醇提取物对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、乳酸杆菌等多种微生物的抑菌范围进行测定,结果表明,落葵果实提取物具有良好的抑菌性能。【本研究切入点】目前对落葵种子蛋白的功能特性研究较少,针对落葵种子蛋白抑菌和抗氧化特性的研究也鲜见报道。【拟解决的关键问题】通过硫酸铵沉淀、单因素试验和正交试验优化提取落葵种子蛋白的工艺条件,并对其抑菌特性、DPPH自由基清除能力和还原力进行研究,为开发利用落葵种子蛋白提供参考依据。
1 材料与方法
1. 1 试验材料
落葵种子购自北京市丰台区新发地种子市场。红酵母(Rhodothece glutinis)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aur-eus)、乳酸菌(Lactobacillus)、藤黄菌(Micrococcus luteus)、单增李斯特菌(Listeria monocytogenes)、副溶血性弧菌(Vibrio parahemolyticus)和河水细菌由四川农业大学食品学院提供,假单胞菌(Pseudomonas aeruginosa)、腐败希瓦氏菌(Shewanella putrefaciens)、气单胞菌(Aeromonas)、大肠杆菌(Escheri-chia coli)和不动杆菌(Acinetobacter sp.)为北京市水产科学研究所保藏并提供。平板计数琼脂(PCA)培养基和3%氯化钠胰蛋白胨大豆琼脂购自青岛海博生物技术有限公司;硫酸铵、六氰合铁酸钾、三氯乙酸、三氯化铁、氯化钠和琼脂粉均为分析纯,购自国药集团化学试剂有限公司;Bradford蛋白质定量试剂盒购自天根生化科技(北京)有限公司;2,6-二叔丁基-4-甲基苯酚(BHT)和乙二胺四乙酸(EDTA)购自索莱宝生物科技有限公司;DPPH自由基购自美国Sigma公司。
主要仪器设备:冷冻离心机(美国Sigma公司);全波长酶标仪(美国伯腾仪器有限公司);4 ℃冰箱(青岛海尔股份有限公司);洁净工作台(北京东联哈尔仪器制造有限公司);生化培养箱、恒温水浴锅(上海一恒科学仪器有限公司);全温振荡器(苏州培英实验设备有限公司);微波炉(广东美的厨房电器制造有限公司)。
1. 2 落葵种子蛋白提取物制备
采用硫酸铵沉淀法。将落葵种子磨成粉后(现磨现用,无需过筛,尽可能磨成细粉,便于落葵种子蛋白析出)与15 g/L EDTA缓冲液以1∶5(m/v)比例浸泡12 h,8层纱布过滤后取滤液于4 ℃下12000 r/min离心5 min,收集上清液,边搅拌边添加硫酸铵,使饱和度达80%,沉淀3 h后于4 ℃下12000 r/min离心20 min,收集沉淀,用去离子水复溶(每10 g落葵种子干粉蛋白提取物添加10 mL去离子水),4 ℃、12000 r/min离心20 min后收集上清液,0.22 μm水相滤膜过滤后4 ℃保存备用(李军等,2018a)。
1. 3 落葵种子蛋白提取物含量测定
根据Bradford蛋白定量测定原理(Compton and Jones,1985)进行。制备蛋白定量标准曲线,按照表1添加試剂于10 mL EP管中并混匀;摇匀后用96孔板分别在595 nm处测吸光值,记录数据,以蛋白质量浓度为横坐标、吸光值为纵坐标绘制标准曲线。取100 μL待测样品加入3 mL Bradford蛋白定量测定试剂混匀后在595 nm处测吸光值,通过蛋白定量标准曲线可得知待测样品的蛋白含量。
1. 4 落葵种子蛋白抑菌试验
真菌选取红酵母;致病菌选取单增李斯特菌、藤黄球菌、金色葡萄球菌和副溶血性弧菌;腐败菌选取大肠杆菌、假单胞菌、气单胞菌、腐败希瓦氏菌、枯草芽孢杆菌,以及从腐败鱼中筛选出的14株腐败菌菌株和从河水中筛出的9种细菌,共33株菌进行抑菌研究。除副溶血性弧菌外的其他菌株用PCA培养基活化后,用无菌生理盐水稀释至106 CFU/mL,取1 mL菌悬液置于10 mL PCA固体培养基中混匀凝固;副溶血性弧菌用10 mL 3%氯化钠胰蛋白胨水稀释至106 CFU/mL,取1 mL置于10 mL 3%氯化钠胰蛋白胨琼脂固体培养基中混匀凝固,凝固的平板用牛津杯(外径8 mm、内径6 mm、高10 mm)进行抑菌试验,每个牛津杯中加入200 μL落葵种子蛋白提取物(用无菌超纯水将1.3测得的落葵种子蛋白提取物浓度稀释至30.00 mg/mL),37 ℃培养18~24 h后观察抑菌圈直径,每组3个平行。
1. 5 落葵种子蛋白提取工艺优化
1. 5. 1 单因素试验
1. 5. 1. 1 浸泡缓冲液选择 选择4种缓冲液[硼酸钠缓冲液(0.05 mol/L,pH 8.2)、磷酸缓冲液(0.1 mol/L KCl,2 mmol/L EDTA,pH 7.5)、Tris-HCl缓冲液(0.05 mol/L,pH 8.0)和EDTA缓冲液(15 g/L,pH 8.0)]对落葵种子蛋白进行浸提,比较提取效果。以大肠杆菌(浓度106 CFU/mL)为指示菌株,取1 mL菌悬液置于无菌培养皿中,加入10 mL适温PCA固体培养基混匀静置,待其凝固后放入牛津杯,再取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,通过观察抑菌圈选择适宜的缓冲液,每组试验3个平行。
1. 5. 1. 2 浸泡时间选择 用最佳浸泡缓冲液分别浸泡落葵种子粉末4、8、12、16、20和24 h,按照1.2操作得到蛋白提取物后,以大肠杆菌(106 CFU/mL)为指示菌株,取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,观察抑菌圈。每组试验3个平行。
1. 5. 1. 3 料液比选择 将落葵种子粉末与缓冲液以1∶3、1∶5、1∶7、1∶9、1∶11和1∶12(w/v)的比例浸泡合适时间,按照1.2操作得到蛋白提取物后,以大肠杆菌(106 CFU/mL)为指示菌株,取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,观察抑菌圈。每组试验3个平行。
1. 5. 1. 4 硫酸铵饱和度选择 称取80 g落葵种子粉末,加入560 mL EDTA缓冲液浸泡12 h后纱布过滤,4 ℃下12000 r/min离心5 min,取上清液分为8份,每份30 mL,分别添加硫酸铵4.92、6.78、8.73、10.83、13.08、15.48、18.09和20.91 g(对应饱和度分别为30%、40%、50%、60%、70%、80%、90%和100%)沉淀落葵种子蛋白。后续步骤按照1.2操作,并将不同硫酸铵饱和度沉淀的落葵蛋白提取物以大肠杆菌(106 CFU/mL)为指示菌株测抑菌效果。每组试验3个平行。
1. 5. 2 正交优化试验 以对大肠杆菌的抑菌圈为筛选指标,根据单因素试验结果选取浸泡时间、料液比和硫酸铵饱和度进行正交试验,因素及水平设计见表2。
1. 6 落葵种子蛋白提取物还原力测定
取1 mL不同质量浓度样液,与1 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和1 mL 1.0%六氰合铁酸钾溶液混合,在50 ℃下水浴20 min后快速冷却,然后在反应混合物中加入1 mL 10%三氯乙酸,放置10 min,待反应充分后6000 r/min离心10 min,取上清1 mL,加入1 mL蒸馏水和0.2 mL 0.1%三氯化铁溶液,充分混匀,室温静置10 min后在700 nm处测吸光值(吸光值的增加代表反应混合物还原力增强,样品的抗氧化活性增加),以维生素C为阳性对照。得吸光值在一定质量浓度范围内的线性回归方程,通过回归方程计算半最大效应浓度EC50(吸光值为0.5时对应的样液质量浓度)。EC50越小,表明其还原力越强,抗氧化活性越强(孟德敬等,2007;王雅,2012;Zhang et al.,2017)。
1. 7 落葵种子蛋白提取物对DPPH自由基清除能力测定
1. 7. 1 标准曲线制作 准确称取DPPH自由基1 mg,用乙醇定容至10 mL,配制成质量浓度为0.1 mg/mL的标准溶液(现用现配)。分别吸取0、0.1、0.2、0.4、0.6、0.8和1.0 mL标准溶液,用乙醇定容至5 mL,最终质量浓度分别为0、2、4、8、12、16和20 μg/mL。测定上述标准溶液在517 nm波长处的吸光值,以不同质量浓度DPPH自由基为横坐标、吸光值为纵坐标,制作标准曲线。
1. 7. 2 样品测定 0.25 mL不同质量浓度落葵蛋白提取物与0.25 mL 0.1 mmol/L DPPH(溶解于95%乙醇中)混合后振荡,室温下避光反应30 min。若有沉淀,6400 g离心3 min,取200 μL上清液加到96孔板中,517 nm测定吸光值。对照组用0.25 mL蒸馏水替代样品,BHT(200 μg/mL)作阳性对照(Enujiugha et al.,2012)。按照下式计算落葵种子蛋白提取物对DPPH自由基的清除率(曹辉等,2009):
DPPH自由基清除率(%)=[1-(Ai-Aj)/A0]×100
式中,Ai为加入蛋白样品与DPPH反应后517 nm处吸光值,Aj为加入蛋白样品与无水乙醇混合后517 nm處吸光值,A0为不加蛋白样品时测得DPPH 517 nm的吸光值。
半抑制浓度(IC50)为DPPH自由基清除率等于50%时添加落葵种子提取物的质量浓度。
1. 8 统计分析
所有试验均重复3次。采用SPSS 17.0的One-way ANOVA进行方差分析,Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2. 1 落葵种子蛋白提取物的蛋白含量测定结果
落葵种子蛋白提取物溶液中蛋白质量浓度的标准曲线为y=0.3135x+0.3482(R2=0.9913)。经测定,落葵种子硫酸铵沉淀蛋白提取物溶液中蛋白质量浓度为32.30 mg/mL。
2. 2 落葵种子蛋白提取优化结果
2. 2. 1 单因素试验结果
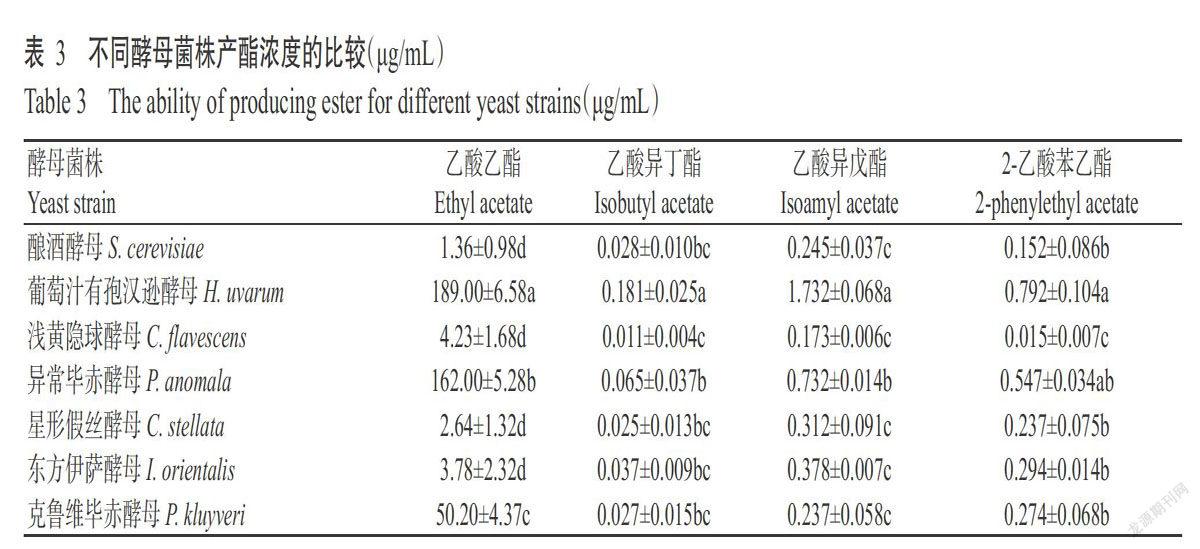
2. 2. 1. 1 浸泡缓冲液优化 由图1可知,采用硼酸钠缓冲液、磷酸缓冲液、Tris-HCl缓冲液和EDTA缓冲液提取的落葵种子蛋白含量分别为36.20、36.58、34.30和36.17 mg/mL,其中Tris-HCl缓冲液浸提的蛋白含量显著低于其他3种缓冲液浸提的蛋白含量(P<0.05,下同),其他三者间差异不显著(P>0.05,下同)。将4种不同处理后的落葵种子蛋白(统一稀释到30.00 mg/mL)对大肠杆菌进行抑菌试验,结果显示,只有EDTA缓冲液浸提的落葵种子蛋白具有抑菌效果,对大肠DH5α的抑菌圈直径为17.02 mm。原因可能是硼酸钠缓冲液、磷酸缓冲液和Tris-HCl缓冲液对落葵蛋白中的有效抑菌活性蛋白结构造成破坏或使蛋白发生降解(古卓良等,2003)。与其他3种缓冲液相比,EDTA缓冲液较温和,能保留有效抑菌蛋白,其浸提出的蛋白具有最佳的抑菌效果,故选择EDTA作为浸提缓冲液进行后续试验。
2. 2. 1. 2 浸泡时间优化 由图2可看出,在浸泡时间4~8 h范围内,落葵种子蛋白对指示菌株大肠杆菌的抑菌圈直径差异不显著,浸泡12 h的抑菌圈直径显著增大(17.53 mm),抑菌效果最佳;然而随着浸泡时间的继续延长,抑菌效果显著下降。可能是由于缓冲液中可溶性杂质多,导致有效蛋白沉降。因此,选择10、12和14 h 3个水平进行正交优化试验。
2. 2. 1. 3 料液比优化 从图3可看出,在料液比1∶3~1∶7范围内,抑菌圈直径显著增大,在1∶7~1∶12范围内抑菌圈直径均在17.00 mm左右,4个水平间差异不显著。适当减小料液比,有利于有效抑菌蛋白质的充分溶出,而使提取率提高(周丽卿,2012);但料液比过小,蛋白质分子与水分子间的相互作用增强,使得蛋白质分子易发生作用而沉淀。从经济效益角度考虑,选择料液比1∶7进行蛋白提取,得到的蛋白对大肠杆菌抑菌圈直径为17.86 mm,抑菌效果较好。因此,选择1∶6、1∶7和1∶8 3个水平进行正交优化试验。
2. 2. 1. 4 硫酸铵饱和度优化 由图4可知,硫酸铵饱和度在30%~40%范围内时抑菌圈从无到有,饱和度在50%~70%时抑菌圈直径显著增大,在70%~80%时抑菌圈直径缓慢增大;当硫酸铵饱和度为90%时,抑菌蛋白对大肠杆菌的抑菌圈直径达18.51 mm,显著大于其他饱和度的抑菌圈直径。表明抑菌蛋白在90%硫酸铵饱和度时沉淀最多,且相对100%硫酸铵沉淀更节约成本,故选取90%饱和度硫酸铵作为蛋白沉淀条件,选择85%、90%和95% 3个水平进行正交试验。
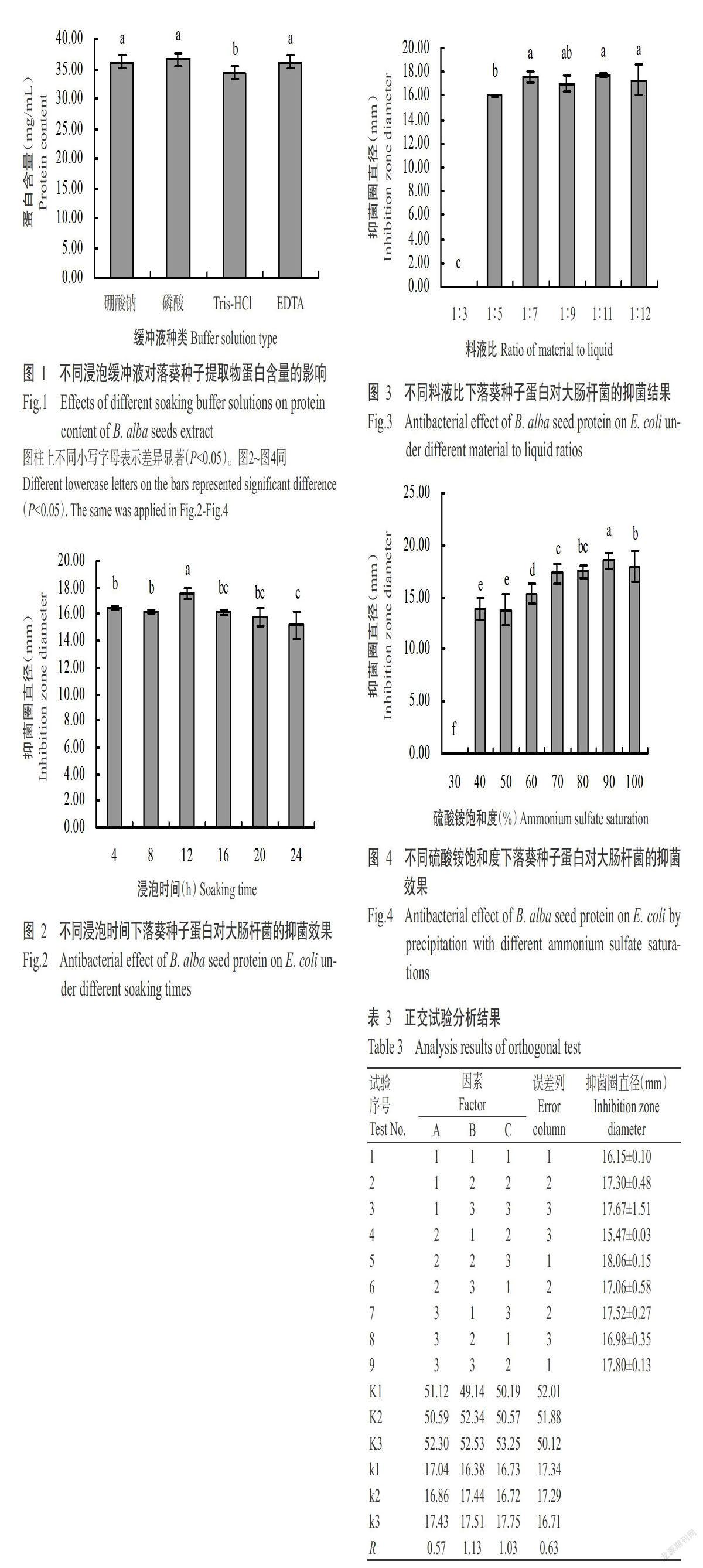
2. 2. 2 正交试验结果 由单因素试验结果可知,落葵种子蛋白对大肠杆菌的抑菌效果受浸泡时间、料液比和硫酸铵饱和度影响明显,故选择这3个因素采用正交试验3因素3水平表优化落葵种子蛋白的提取工艺。由表3可知,在浸泡时间(因素A)中K3>K1>K2,料液比(因素B)中K3>K2>K1,硫酸铵饱和度(因素C)中K3>K2>K1,得出最优组合为A3B3C3(以大肠DH5α为指示菌株,抑菌圈直径大为选取条件),即浸泡时间为14 h、料液比为1∶8、硫酸铵饱和度为95%;由表3中R可知影响落葵种子蛋白提取因素的主次排序为料液比>硫酸铵饱和度>浸泡时间。以最优方案进行提取,重复试验3次,得到的蛋白含量为33.00 mg/mL,对大肠杆菌的抑菌圈直径为19.68 mm。正交试验结果大于其他水平值,说明正交试验优化提取落葵种子蛋白工艺可行。
2. 3 落葵种子蛋白抑菌结果
由表4可知,通过EDTA缓冲液浸提,95%饱和硫酸铵沉淀的落葵种子蛋白提取物(30.00 mg/mL)对真菌具有抑菌作用,以红酵母为代表,其抑菌圈直径为24.59 mm;对致病菌金黄色葡萄球菌、单增李斯特菌、藤黄球菌和副溶血性弧菌均有抑菌作用,其抑菌圈直径分别为19.60、26.27、25.98和15.24 mm;对腐败菌也有抑菌作用,如腐败希瓦氏菌和假单胞菌,其抑菌直径分别为28.01和30.32 mm。表4中菌株除常见的食源性致病菌和肉类腐败菌外,还有来自河水中的9株细菌,这些细菌随水附着在鱼体表面,当鱼类失去生命时,具有潜在致腐的可能,因此控制这些细菌能降低潜在致腐风险。落葵种子蛋白对Bacillus velezensis具有最大抑菌圈直径(39.77 mm),对气单胞属中的Aeromonas allosaccharophila strain S5-33菌株具有最小抑菌圈直径(14.06 mm),对大肠杆菌DH5α抑菌直径为17.00 mm。落葵种子蛋白对这些腐败致病菌均具有良好的抑菌效果。
2. 4 落葵种子蛋白提取物还原力测定结果
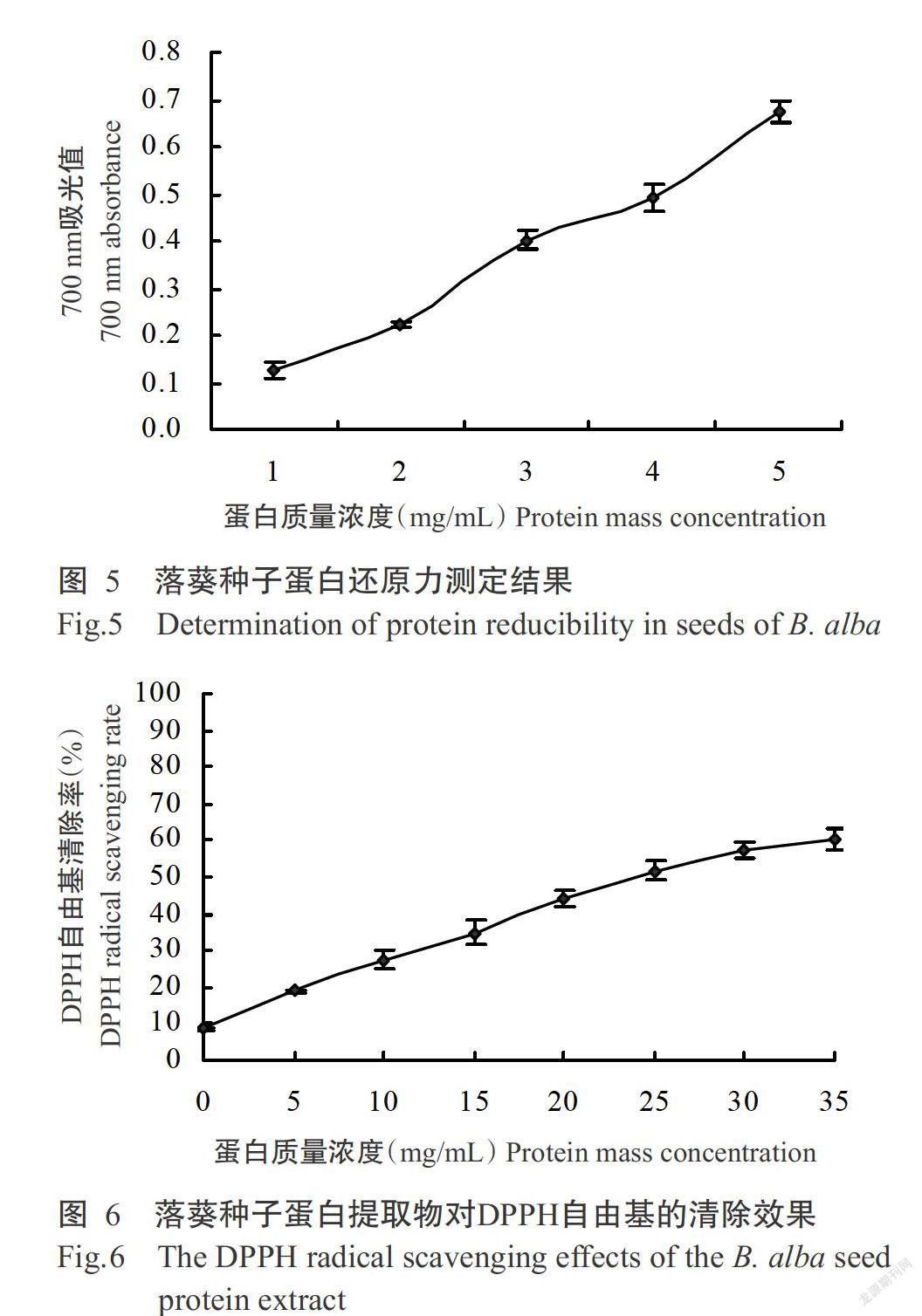
落葵种子蛋白提取物还原性测定如图5所示,吸光值随蛋白质量浓度的增加而增加,根据吸光值与蛋白质量浓度的关系得出线性回归方程y=0.1324x-0.1444,R2=0.9918。当吸光值为0.5时对应的蛋白质量浓度为4.867 mg/mL,即为EC50。
2. 5 落葵种子蛋白提取物对DPPH自由基清除能力测定结果
以不同质量浓度DPPH自由基为横坐标、517 nm处吸光值为纵坐标,制得标准曲线为y=0.0076x+0.0408,R2=0.9994。
加样质量浓度与DPPH自由基清除率关系方程为y=1.6317x+8.4665,R2=0.9854,如图6所示。根据方程推算出当DPPH自由基残留率为50%时,IC50为27.817 mg/mL。落葵种子蛋白提取物对DPPH自由基的清除能力随着蛋白质量浓度(一定范围内)的增加而增强。
3 讨论
本研究采用硫酸铵沉淀盐析法对落葵种子蛋白进行提取,该方法是从粗制剂中浓缩和纯化蛋白的经典方法,能更好地保留蛋白活性。在提取过程中,蛋白大部分通过硫酸铵沉淀,用去离子水溶解沉淀后再次离心,此时糖类、脂类等杂质基本在沉淀中,而蛋白基本溶解出来。能否最大限度地提取落葵种子中的活性蛋白,单因素优化条件十分关键,不同的浸泡缓冲液对蛋白析出率和蛋白活性影响不同(Li et al.,2016)。本研究比较磷酸缓冲液、EDTA缓冲液、硼酸钠缓冲液和Tris-HCl缓冲液对落葵种子蛋白浸提的效果,结果显示,除Tris-HCl缓冲液浸提出的落葵种子蛋白含量稍低外,其他3种缓冲液浸提蛋白析出含量差异不显著;将4种缓冲液浸提的落葵种子蛋白提取物用无菌超纯水稀释至30.00 mg/mL进行大肠杆菌抑菌试验,结果显示只有EDTA缓冲液浸提的蛋白具有抑菌活性,说明不同的浸泡缓冲液对蛋白活性影响明显。
落葵种子中蛋白质含量丰富,本研究利用Bradford蛋白定量测定法测得落葵种子蛋白提取物的蛋白含量为32.30 mg/mL。李艳梅等(2011)采用碱溶酸沉法提取分离落葵种子蛋白,其提取率达82.15%,但并未对提取的粗蛋白进行深入研究。本研究对落葵种子蛋白提取物的特性进行分析,在硫酸铵饱和度80%~100%沉淀出的落葵种子蛋白提取物抑菌效果较好;此外,本研究还发现落葵种子蛋白提取物在pH 8.0左右抑菌特性消失,可能是蛋白等电点导致蛋白质变性或聚沉,温度高于80 ℃時抑菌活性显著下降,进一步说明起抑菌作用的是蛋白类而非糖类等其他物质。Reshmi和Suganya(2012)发现落葵果实甲醇提取物抑菌效果好,本研究也发现落葵种子蛋白提取物具有抑菌作用。落葵种子蛋白提取物对试验中的33株菌的抑菌圈直径为14.06~39.77 mm,抑菌效果优于苦瓜蛋白对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌和酵母的抑菌效果(抑菌圈直径分别为15.0、14.5、13.5和1.02 mm)(于群和朱新产,2012);优于苦荞蛋白对大肠杆菌和金黄色葡萄球菌的抑菌效果(抑菌圈直径分别为12.8和13.2 mm)(陈英娇,2015);也优于紫菜蛋白对金黄色葡萄球菌的抑菌效果(抑菌圈直径为18.70 mm)(宋惠平等,2015)。综上所述,落葵种子蛋白对真菌、致病菌和腐败菌均具有良好的抑制作用,作为食品防腐抑菌剂具有广阔的发展前景。
落葵种子还原力的测定中,随着有效活性蛋白质量浓度的增加,还原力不断增强,在吸光值0.5时其EC50为4.867 mg/mL,说明落葵种子蛋白有很强的抗氧化能力。彭会军(2008)测得落葵多糖对超氧自由基和羟基自由基的最大清除率分别为54.32%和52.94%,研究发现落葵中提取的活性物质可能为糖蛋白或蛋白多糖。这与本研究得出落葵种子蛋白提取物具有抗氧化作用的结论相符。落葵种子蛋白提取物还原能力测定的EC50为4.867 mg/mL,优于青刺果果实的还原力(EC50为24.7 mg/mL)(张瑞琳等,2017);同时落葵种子蛋白提取物对DPPH自由基清除能力的IC50为27.817 mg/mL,优于葡萄籽原花青素清除DPPH自由基能力,其清除DPPH自由基(2.5×10-2 mg/mL)的IC50为118 g/kg(李春阳等,2006)。本研究对落葵种子中粗蛋白进行了初步分析,但落葵种子蛋白粗提物中活性成分可能是一种或几种蛋白的混合物或多肽,后续试验将对蛋白提取物进行纯化和质谱鉴定。此外,关于落葵种子蛋白是否具有抗肿瘤、降血糖、降胆固醇等功效,其理化性质及在食品保鲜上的应用等均有待后续研究。
4 结论
落葵种子蛋白在EDTA缓冲液中可浸提出有效抑菌蛋白,最佳提取工艺为浸泡时间14 h、料液比1∶8、硫酸铵饱和度95%;落葵种子蛋白对1株真菌、4株致病菌和28株腐败菌均有较好的抑菌效果,对DPPH自由基清除效果良好,且抗氧化活性强。落葵种子蛋白具有开发为天然防腐抑菌剂和抗氧化剂的潜在价值。
参考文献:
曹辉,马海乐,曲文娟,贾俊强,潘忠礼,丁青芝,骆琳,王振斌,何荣海. 2009. 大米蛋白的木瓜酶酶解及其水解物的抗氧化活性[J]. 中国粮油学报,24(7):10-13. [Cao H,Ma H L,Qu W J,Jia J Q,Pan Z L,Ding Q Z,Luo L,Wang Z B,He R H. 2009. Enzymatic hydrolysis of rice protein with papain and antioxidation activity of hydrolysate[J]. Journal of the Chinese Cereals and Oils Association,24(7):10-13.]
陈英娇. 2015. 苦荞蛋白酶解物的制备及抗菌活性的研究[D]. 上海:上海师范大学. [Chen Y J. 2015. Enzymatic pre-paration and research on the antibacterial activity of tartary buckwheat protein hydrolysates[D]. Shanghai:Shanghai Normal University.]
古卓良,周国华,张晓丹,罗国安,章晓. 2003. 缓冲液种类对毛细管区带电泳分离蛋白质的影响[J]. 解放军药学学报,19(6):404-407. [Gu Z L,Zhou G H,Zhang X D,Luo G A,Zhang X. 2003. Effects of buffer types on the protein separation by capillary zone electrophoresis[J]. Pharmaceutical Journal of Chinese People’s Liberation Army,19(6):404-407.]
李春阳,许时婴,王璋. 2006. DPPH法测定葡萄籽原花青素清除自由基的能力[J]. 食品与生物技术学报,25(2):102-106. [Li C Y,Xu S Y,Wang Z. 2006. Measuring the antiradical efficiency of proanthocyanidin from grape seed by the DPPH· assay[J]. Journal of Food Science and Biotechnology,25(2):102-106.]
李军,李平兰,高亮,王顺,桂萌. 2018a. 萝卜籽蛋白提取物对托盘包装鲟鱼片冷藏品质的影响[J]. 食品科学,39(9):224-231. [Li J,Li P L,Gao L,Wang S,Gui M. 2018a. Effect of radish seed protein extract on quality of tray-packaged sturgeon fillets stored at 4 ℃[J]. Food Science,39(9):224-231.]
李军,李平兰,王顺,高亮,桂萌. 2018b. 萝卜籽蛋白提取物对鲟鱼腐败菌抑制作用及其理化性质的研究[J]. 食品科学,39(13):41-46. [Li J,Li P L,Wang S,Gao L,Gui M. 2018b. Inhibition of sturgeon spoilage bacteria by protein extract from radish seed and its physicochemical characteristics[J]. Food Science,39(13):41-46.]
李小莉,鄒群,张迎庆,孙寅钧. 2012. 落葵多糖抗肿瘤及对红细胞免疫功能的影响[J]. 时珍国医国药,23(1):46-48. [Li X L,Zou Q,Zhang Y Q,Sun Y J. 2012. The effects of Basella rubra polysaccharide on anti-tumor and erythrocyte immune function[J]. Lishizhen Medicine and Materia Medica Researd,23(1):46-48.]
李艳梅,赵福顺,钟智敏,刘敏. 2011. 落葵种子蛋白质提取工艺的研究[J]. 食品工业,(7):28-30. [Li Y M,Zhao F S,Zhong Z M,Liu M. 2011. Study on the extraction of protein of Basella rubra Linn. seed[J]. The Food Industry,(7):28-30.]
林爱琴. 2010. 落葵多糖的提取及抗氧化活性的研究[J]. 应用化工,39(7):990-992. [Lin A Q. 2010. Study on extraction and antioxidant effects of polysaccharide of Basella[J]. Applied Chemical Industry,39(7):990-992.]
卢毓星,岳森,卢隆杰. 2005. 营养保健型蔬菜——落葵[J]. 蔬菜,9(2):30-31. [Lu Y X,Yue S,Lu L J. 2005. Nutritional health-type vegetables—Basella alba[J]. Vegetables,9(2):30-31.]
孟德敬,龙杰,陆健,孙军勇,樊伟,董建军. 2007. 麦芽中SOD活性与麦汁还原力的关系以及糖化温度对它们的影响[J]. 食品与发酵工业,33(11):13-17. [Meng D J,Long J,Lu J,Sun J Y,Fan W,Dong J J. 2007. Relationship between superoxide dismutase activity in malts and redu-cing power of wort,and effects of mashing temperature on them[J]. Food and Fermentation Industries,33(11):13-17.]
彭会军. 2008. 落葵多糖的提取分离与药理学研究[D]. 武汉:华中农业大学. [Peng H J. 2008. Extraction and isolation of polysaccharide from the Basella rubral L. and study on its pharmacological activity[D]. Wuhan:Huazhong Agricultural University.]
宋惠平,于佳,李钐,魏玉西,王文秀,许丽娜,韩丹. 2015. 条斑紫菜蛋白酶解多肽的抑菌活性[J]. 渔业科学进展,36(2):140-145. [Song H P,Yu J,Li S,Wei Y X,Wang W X,Xu L N,Han D. 2015. The antibacterial activity of peptides from Porphyra yezoensis[J]. Progress in Fishery Sciences,36(2):140-145.]
王雅. 2012. 沙枣果实可食部分活性物质提取及抗氧化、抗肿瘤作用研究[D]. 杨凌:西北农林科技大学. [Wang Y. 2012. Extraction of active components from fruits of Elaeagnus angustifolia L. fruits and their anti-oxidation and anti-tumor effects[D]. Yangling:Northwest Agriculture & Forestry University.]
王佐,李双杰,杨永宗. 2002. 苦瓜蛋白的分离纯化及其体外抗CoxB3型病毒作用的研究[J]. 南华大学学报(医学版),30(1):1-3. [Wang Z,Li S J,Yang Y Z. 2002. Purification of MCP and measurement of it’s anti-virus effect to CoxB3 in vitro[J]. Journal of Hengyang Medical College(Medical Edition),30(1):1-3.]
肖素荣,李京东. 2007. 天然食品防腐剂及其发展前景[J]. 中国食物与营养,(6):30-33. [Xiao S R,Li J D. 2007. Preservative of natural food and its development prospect[J]. Food and Nutrition in China,(6):30-33.]
于群,朱新產. 2012. 苦瓜种子蛋白的双水相提取及抑菌性研究[J]. 江西农业学报,24(1):88-90. [Yu Q,Zhu X C. 2012. Extraction of seed protein from Momordica charantia by aqueous two-phase system and its antibacterial effect[J]. Acta Agriculturae Jiangxi,24(1):88-90.]
章林,黄明,周光宏. 2012. 天然抗氧化剂在肉制品中的应用研究进展[J]. 食品科学,33(7):299-303. [Zhang L,Huang M,Zhou G H. 2012. Research progress in applications of natural antioxidants in meat products[J]. Food Science,33(7):299-303.]
张美荣,张慧,朱宏达,王冉冉,魏艳. 2010. 落葵色素的提取、分离、分析及稳定性研究[J]. 中国食品添加剂,(1):104-111. [Zhang M R,Zhang H,Zhu H D,Wang R R,Wei Y. 2010. The study of Basella rubra red’s extraction,separation,analysis and stability[J]. China Food Additives,(1):104-111.]
张瑞琳,吴文惠,张静怡,欧爱宇,郭锐华,包斌. 2017. 还原性青刺果果实蛋白生物化学特性的研究[J]. 天然产物研究与开发,29(9):1595-1601. [Zhang R L,Wu W H,Zhang J Y,Ou A Y,Guo R H,Bao B. 2017. Biochemical characteristics of reductive prinsepiautilis fruit protein[J]. Natural Product Research and Development,29(9):1595-1601.]
张新武,杜小波,徐素玲,黄继红. 2014. 食品中微生物危害的分析和控制[J]. 食品安全质量检测学报,5(10):3295-3299. [Zhang X W,Du X B,Xu S L,Huang J H. 2014. Analysis and control of microbiological hazards in food[J]. Journal of Food Safety & Quality,5(10):3295-3299.]
张羽. 2008. 莲子中蛋白质的分离及其食品功能特性研究[D]. 南京:南京师范大学. [Zhang Y. 2008. Study on se-paration of protein from lotus seed and its food functional characteristics[D]. Nanjing:Nanjing Normal University.]
张媛媛,李艳丽,李书国. 2014. 植物源食品防腐剂抑菌机理和效果及在食品保鲜中的应用[J]. 粮油食品科技,22(4):48-53. [Zhang Y Y,Li Y L,Li S G. 2014. Antibacterial mechanism and effects of botanical food preservatives and their application in food fresh-keeping[J]. Science and Technology of Cereals,Oils and Foods,22(4):48-53.]
赵国萍,李迎秋,冯林慧,宁厚齐. 2017. 天然防腐剂的应用研究进展[J]. 中国调味品,42(8):155-159. [Zhao G P,Li Y Q,Feng L H,Ning H Q. 2017. Research progress on application of natural preservatives[J]. China Condiment,42(8):155-159.]
赵金莉,张亚如,宋娟. 2011. 短序落葵薯多糖含量测定及体外抗氧化活性研究[J]. 江西农业学报,23(10):65-67. [Zhao J L,Zhang Y R,Song J. 2011. Study on content determination and antioxidant activity in vitro of polysaccharide produced by Anredera scandens[J]. Acta Agriculturae Jiangxi,23(10):65-67.]
周丽卿. 2012. 鹰嘴豆多肽的制备及其改性研究[D]. 杨凌:西北农林科技大学. [Zhou L Q. 2012. Study on the pre-paration and modification of chickpea peptide[D]. Yang-ling:Northwest Agriculture & Forestry University.]
邹群,肖松,彭会军,糜志远,李小莉. 2011. 落葵多糖的免疫调节和肿瘤抑制作用[J]. 食品与药品,13(3):165-167. [Zou Q,Xiao S,Peng H J,Mi Z Y,Li X L. 2011. Immunoloregulation and anti-tumor effect of polysaccharides from Basella rubra L.[J]. Food and Drug,13(3):165-167.]
Compton S J,Jones C G. 1985. Mechanism of dye response and interference in the Bradford protein assay[J]. Analy-tical Biochemistry,151(2):369-374.
Enujiugha V N,Talabi J Y,Malomo S A,Olagunju A I. 2012. DPPH Radical scavenging capacity of phenolic extracts from African yam bean(Sphenostylis stenocarpa)[J]. Food & Nutrition Sciences,3(1):7-13.
Li Q,Sui B,Yao J M. 2016. Analysis of activity and stability of cellulase based on different buffer systems[J]. Textile Dyeing & Finishing Journal,38(2):5-8.
Reshmi K,Suganya D P. 2012. Antimicrobial activity of Basella alba fruit[J]. International Journal of Pharmaceutical Sciences and Research,3(12):4757-4761.
Zhang R L,Wu W H,Zhang J Y,Ou A Y,Guo R H,Bao W. 2017. Biochemical characteristics of reductive Prinsepiautilis fruit protein[J]. Natural Product Research and Development,(9):1595-1601.
(責任编辑 罗 丽)
0 引言
【研究意义】落葵(Basella alba L.)为落葵科落葵属多年生蔓生肉质藤本植物(赵金莉等,2011),其味道清香爽口,作为新型绿色健康蔬菜越来越受到人们喜爱。落葵营养丰富,叶和茎均可食用,每1 kg可食部分含有蛋白质17 g、脂肪2 g和碳水化合物31 g,同时含有丰富的钙、磷、铁等元素(卢毓星等,2005)。落葵全株可入药,民间常用其治病或作食疗,能清热滑肠、凉血、解毒,主治大便秘结、小便短涩、痢疾便血等症(彭会军,2008)。落葵种子富含蛋白,李艳梅等(2011)采用碱溶酸沉法提取分离落葵种子蛋白,在优化条件下得到蛋白质提取率为82.15%。虽然落葵种子蛋白含量丰富,但未得到充分利用,为研究其潜在价值,本研究采用正交优化法最大限度地提取落葵种子活性蛋白。植物源防腐剂是从植物的根、茎、叶和果实等提炼出的蛋白类、肽类、多糖类、黄酮类、多酚类、萜类、精油及植物自身成分的酶解产物等,具有一定的营养保健价值,即发挥抑菌、抗菌和食品保鲜作用的同时,还具有抗氧化、降血脂、降血压、预防肿瘤等疾病的保健功能(张媛媛等,2014)。落葵本身具有药食同源性,具有研发成为天然抑菌剂和天然抗氧化剂的潜力,因此研究落葵种子蛋白的特性具有重要意义。【前人研究进展】关于植物蛋白特性的研究,主要包括抑菌和抗氧化两方面。食品腐败不仅降低食品的营养价值,还增加食源性疾病风险(张新武等,2014),目前食品防腐剂种类繁多,化学防腐剂是使用最广泛的一种,但由于其对人体有一定的毒害作用,所以人们开始寻求天然食品防腐剂(肖素荣和李京东,2007;赵国萍等,2017)。王佐等(2002)分离纯化得到色谱纯的抗3型科萨奇病毒的苦瓜蛋白,通过体外抗病毒试验表明一定范围内的苦瓜蛋白对3型科萨奇病毒感染的HepG2细胞有明显保护作用;李军等(2018b)从萝卜籽中分离得到一种抑菌蛋白,研究发现该蛋白对9株鲟鱼腐败菌均具有很好的抑制作用。目前工业上使用的抗氧化剂大多是合成型,虽然抗氧化效果好,但其安全性一直受到质疑;天然抗氧化剂是从天然食品中提取的具有抗氧化活性的物质,具有安全性高、抗氧化能力强、无副作用等特点(章林等,2012),如莲子蛋白对羟基自由基具有较好的清除作用(张羽,2008)。关于落葵的研究目前主要集中在对落葵色素和多糖的研究,张美荣等(2010)对落葵果实中的色素提取工艺进行优化并研究其稳定性;林爱琴(2010)研究表明落葵多糖具有清除自由基的作用;邹群等(2011)研究发现落葵多糖有抑制肿瘤生长和免疫调节功效;李小莉等(2012)研究表明落葵多糖对荷瘤小鼠的肿瘤生长表现出显著的抑制作用;Reshmi和Suganya(2012)采用琼脂扩散法将落葵果实甲醇提取物对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、乳酸杆菌等多种微生物的抑菌范围进行测定,结果表明,落葵果实提取物具有良好的抑菌性能。【本研究切入点】目前对落葵种子蛋白的功能特性研究较少,针对落葵种子蛋白抑菌和抗氧化特性的研究也鲜见报道。【拟解决的关键问题】通过硫酸铵沉淀、单因素试验和正交试验优化提取落葵种子蛋白的工艺条件,并对其抑菌特性、DPPH自由基清除能力和还原力进行研究,为开发利用落葵种子蛋白提供参考依据。
1 材料与方法
1. 1 试验材料
落葵种子购自北京市丰台区新发地种子市场。红酵母(Rhodothece glutinis)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aur-eus)、乳酸菌(Lactobacillus)、藤黄菌(Micrococcus luteus)、单增李斯特菌(Listeria monocytogenes)、副溶血性弧菌(Vibrio parahemolyticus)和河水细菌由四川农业大学食品学院提供,假单胞菌(Pseudomonas aeruginosa)、腐败希瓦氏菌(Shewanella putrefaciens)、气单胞菌(Aeromonas)、大肠杆菌(Escheri-chia coli)和不动杆菌(Acinetobacter sp.)为北京市水产科学研究所保藏并提供。平板计数琼脂(PCA)培养基和3%氯化钠胰蛋白胨大豆琼脂购自青岛海博生物技术有限公司;硫酸铵、六氰合铁酸钾、三氯乙酸、三氯化铁、氯化钠和琼脂粉均为分析纯,购自国药集团化学试剂有限公司;Bradford蛋白质定量试剂盒购自天根生化科技(北京)有限公司;2,6-二叔丁基-4-甲基苯酚(BHT)和乙二胺四乙酸(EDTA)购自索莱宝生物科技有限公司;DPPH自由基购自美国Sigma公司。
主要仪器设备:冷冻离心机(美国Sigma公司);全波长酶标仪(美国伯腾仪器有限公司);4 ℃冰箱(青岛海尔股份有限公司);洁净工作台(北京东联哈尔仪器制造有限公司);生化培养箱、恒温水浴锅(上海一恒科学仪器有限公司);全温振荡器(苏州培英实验设备有限公司);微波炉(广东美的厨房电器制造有限公司)。
1. 2 落葵种子蛋白提取物制备
采用硫酸铵沉淀法。将落葵种子磨成粉后(现磨现用,无需过筛,尽可能磨成细粉,便于落葵种子蛋白析出)与15 g/L EDTA缓冲液以1∶5(m/v)比例浸泡12 h,8层纱布过滤后取滤液于4 ℃下12000 r/min离心5 min,收集上清液,边搅拌边添加硫酸铵,使饱和度达80%,沉淀3 h后于4 ℃下12000 r/min离心20 min,收集沉淀,用去离子水复溶(每10 g落葵种子干粉蛋白提取物添加10 mL去离子水),4 ℃、12000 r/min离心20 min后收集上清液,0.22 μm水相滤膜过滤后4 ℃保存备用(李军等,2018a)。
1. 3 落葵种子蛋白提取物含量测定
根据Bradford蛋白定量测定原理(Compton and Jones,1985)进行。制备蛋白定量标准曲线,按照表1添加试剂于10 mL EP管中并混匀;摇匀后用96孔板分别在595 nm处测吸光值,记录数据,以蛋白质量浓度为横坐标、吸光值为纵坐标绘制标准曲线。取100 μL待测样品加入3 mL Bradford蛋白定量测定试剂混匀后在595 nm处测吸光值,通过蛋白定量标准曲线可得知待测样品的蛋白含量。
1. 4 落葵种子蛋白抑菌试验
真菌选取红酵母;致病菌选取单增李斯特菌、藤黄球菌、金色葡萄球菌和副溶血性弧菌;腐败菌选取大肠杆菌、假单胞菌、气单胞菌、腐败希瓦氏菌、枯草芽孢杆菌,以及从腐败鱼中筛选出的14株腐败菌菌株和从河水中筛出的9种细菌,共33株菌进行抑菌研究。除副溶血性弧菌外的其他菌株用PCA培养基活化后,用无菌生理盐水稀释至106 CFU/mL,取1 mL菌悬液置于10 mL PCA固体培养基中混匀凝固;副溶血性弧菌用10 mL 3%氯化钠胰蛋白胨水稀释至106 CFU/mL,取1 mL置于10 mL 3%氯化钠胰蛋白胨琼脂固體培养基中混匀凝固,凝固的平板用牛津杯(外径8 mm、内径6 mm、高10 mm)进行抑菌试验,每个牛津杯中加入200 μL落葵种子蛋白提取物(用无菌超纯水将1.3测得的落葵种子蛋白提取物浓度稀释至30.00 mg/mL),37 ℃培养18~24 h后观察抑菌圈直径,每组3个平行。
1. 5 落葵种子蛋白提取工艺优化
1. 5. 1 单因素试验
1. 5. 1. 1 浸泡缓冲液选择 选择4种缓冲液[硼酸钠缓冲液(0.05 mol/L,pH 8.2)、磷酸缓冲液(0.1 mol/L KCl,2 mmol/L EDTA,pH 7.5)、Tris-HCl缓冲液(0.05 mol/L,pH 8.0)和EDTA缓冲液(15 g/L,pH 8.0)]对落葵种子蛋白进行浸提,比较提取效果。以大肠杆菌(浓度106 CFU/mL)为指示菌株,取1 mL菌悬液置于无菌培养皿中,加入10 mL适温PCA固体培养基混匀静置,待其凝固后放入牛津杯,再取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,通过观察抑菌圈选择适宜的缓冲液,每组试验3个平行。
1. 5. 1. 2 浸泡时间选择 用最佳浸泡缓冲液分别浸泡落葵种子粉末4、8、12、16、20和24 h,按照1.2操作得到蛋白提取物后,以大肠杆菌(106 CFU/mL)为指示菌株,取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,观察抑菌圈。每组试验3个平行。
1. 5. 1. 3 料液比选择 将落葵种子粉末与缓冲液以1∶3、1∶5、1∶7、1∶9、1∶11和1∶12(w/v)的比例浸泡合适时间,按照1.2操作得到蛋白提取物后,以大肠杆菌(106 CFU/mL)为指示菌株,取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,观察抑菌圈。每组试验3个平行。
1. 5. 1. 4 硫酸铵饱和度选择 称取80 g落葵种子粉末,加入560 mL EDTA缓冲液浸泡12 h后纱布过滤,4 ℃下12000 r/min离心5 min,取上清液分为8份,每份30 mL,分别添加硫酸铵4.92、6.78、8.73、10.83、13.08、15.48、18.09和20.91 g(对应饱和度分别为30%、40%、50%、60%、70%、80%、90%和100%)沉淀落葵种子蛋白。后续步骤按照1.2操作,并将不同硫酸铵饱和度沉淀的落葵蛋白提取物以大肠杆菌(106 CFU/mL)为指示菌株测抑菌效果。每组试验3个平行。
1. 5. 2 正交优化试验 以对大肠杆菌的抑菌圈为筛选指标,根据单因素试验结果选取浸泡时间、料液比和硫酸铵饱和度进行正交试验,因素及水平设计见表2。
1. 6 落葵种子蛋白提取物还原力测定
取1 mL不同质量浓度样液,与1 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和1 mL 1.0%六氰合铁酸钾溶液混合,在50 ℃下水浴20 min后快速冷却,然后在反应混合物中加入1 mL 10%三氯乙酸,放置10 min,待反应充分后6000 r/min离心10 min,取上清1 mL,加入1 mL蒸馏水和0.2 mL 0.1%三氯化铁溶液,充分混匀,室温静置10 min后在700 nm处测吸光值(吸光值的增加代表反应混合物还原力增强,样品的抗氧化活性增加),以维生素C为阳性对照。得吸光值在一定质量浓度范围内的线性回归方程,通过回归方程计算半最大效应浓度EC50(吸光值为0.5时对应的样液质量浓度)。EC50越小,表明其还原力越强,抗氧化活性越强(孟德敬等,2007;王雅,2012;Zhang et al.,2017)。
1. 7 落葵种子蛋白提取物对DPPH自由基清除能力测定
1. 7. 1 标准曲线制作 准确称取DPPH自由基1 mg,用乙醇定容至10 mL,配制成质量浓度为0.1 mg/mL的标准溶液(现用现配)。分别吸取0、0.1、0.2、0.4、0.6、0.8和1.0 mL标准溶液,用乙醇定容至5 mL,最终质量浓度分别为0、2、4、8、12、16和20 μg/mL。测定上述标准溶液在517 nm波长处的吸光值,以不同质量浓度DPPH自由基为横坐标、吸光值为纵坐标,制作标准曲线。
1. 7. 2 样品测定 0.25 mL不同质量浓度落葵蛋白提取物与0.25 mL 0.1 mmol/L DPPH(溶解于95%乙醇中)混合后振荡,室温下避光反应30 min。若有沉淀,6400 g离心3 min,取200 μL上清液加到96孔板中,517 nm测定吸光值。对照组用0.25 mL蒸馏水替代样品,BHT(200 μg/mL)作阳性对照(Enujiugha et al.,2012)。按照下式计算落葵种子蛋白提取物对DPPH自由基的清除率(曹辉等,2009):
DPPH自由基清除率(%)=[1-(Ai-Aj)/A0]×100
式中,Ai为加入蛋白样品与DPPH反应后517 nm处吸光值,Aj为加入蛋白样品与无水乙醇混合后517 nm处吸光值,A0为不加蛋白样品时测得DPPH 517 nm的吸光值。
半抑制浓度(IC50)为DPPH自由基清除率等于50%时添加落葵种子提取物的质量浓度。
1. 8 统计分析
所有试验均重复3次。采用SPSS 17.0的One-way ANOVA进行方差分析,Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2. 1 落葵种子蛋白提取物的蛋白含量测定结果
落葵种子蛋白提取物溶液中蛋白质量浓度的标准曲线为y=0.3135x+0.3482(R2=0.9913)。经测定,落葵种子硫酸铵沉淀蛋白提取物溶液中蛋白质量浓度为32.30 mg/mL。
2. 2 落葵种子蛋白提取优化结果
2. 2. 1 单因素试验结果
2. 2. 1. 1 浸泡缓冲液优化 由图1可知,采用硼酸钠缓冲液、磷酸缓冲液、Tris-HCl缓冲液和EDTA緩冲液提取的落葵种子蛋白含量分别为36.20、36.58、34.30和36.17 mg/mL,其中Tris-HCl缓冲液浸提的蛋白含量显著低于其他3种缓冲液浸提的蛋白含量(P<0.05,下同),其他三者间差异不显著(P>0.05,下同)。将4种不同处理后的落葵种子蛋白(统一稀释到30.00 mg/mL)对大肠杆菌进行抑菌试验,结果显示,只有EDTA缓冲液浸提的落葵种子蛋白具有抑菌效果,对大肠DH5α的抑菌圈直径为17.02 mm。原因可能是硼酸钠缓冲液、磷酸缓冲液和Tris-HCl缓冲液对落葵蛋白中的有效抑菌活性蛋白结构造成破坏或使蛋白发生降解(古卓良等,2003)。与其他3种缓冲液相比,EDTA缓冲液较温和,能保留有效抑菌蛋白,其浸提出的蛋白具有最佳的抑菌效果,故选择EDTA作为浸提缓冲液进行后续试验。
2. 2. 1. 2 浸泡时间优化 由图2可看出,在浸泡时间4~8 h范围内,落葵种子蛋白对指示菌株大肠杆菌的抑菌圈直径差异不显著,浸泡12 h的抑菌圈直径显著增大(17.53 mm),抑菌效果最佳;然而随着浸泡时间的继续延长,抑菌效果显著下降。可能是由于缓冲液中可溶性杂质多,导致有效蛋白沉降。因此,选择10、12和14 h 3个水平进行正交优化试验。
2. 2. 1. 3 料液比优化 从图3可看出,在料液比1∶3~1∶7范围内,抑菌圈直径显著增大,在1∶7~1∶12范围内抑菌圈直径均在17.00 mm左右,4个水平间差异不显著。适当减小料液比,有利于有效抑菌蛋白质的充分溶出,而使提取率提高(周丽卿,2012);但料液比过小,蛋白质分子与水分子间的相互作用增强,使得蛋白质分子易发生作用而沉淀。从经济效益角度考虑,选择料液比1∶7进行蛋白提取,得到的蛋白对大肠杆菌抑菌圈直径为17.86 mm,抑菌效果较好。因此,选择1∶6、1∶7和1∶8 3个水平进行正交优化试验。
2. 2. 1. 4 硫酸铵饱和度优化 由图4可知,硫酸铵饱和度在30%~40%范围内时抑菌圈从无到有,饱和度在50%~70%时抑菌圈直径显著增大,在70%~80%时抑菌圈直径缓慢增大;当硫酸铵饱和度为90%时,抑菌蛋白对大肠杆菌的抑菌圈直径达18.51 mm,显著大于其他饱和度的抑菌圈直径。表明抑菌蛋白在90%硫酸铵饱和度时沉淀最多,且相对100%硫酸铵沉淀更节约成本,故选取90%饱和度硫酸铵作为蛋白沉淀条件,选择85%、90%和95% 3个水平进行正交试验。
2. 2. 2 正交试验结果 由单因素试验结果可知,落葵种子蛋白对大肠杆菌的抑菌效果受浸泡时间、料液比和硫酸铵饱和度影响明显,故选择这3个因素采用正交试验3因素3水平表优化落葵种子蛋白的提取工艺。由表3可知,在浸泡时间(因素A)中K3>K1>K2,料液比(因素B)中K3>K2>K1,硫酸铵饱和度(因素C)中K3>K2>K1,得出最优组合为A3B3C3(以大肠DH5α为指示菌株,抑菌圈直径大为选取条件),即浸泡时间为14 h、料液比为1∶8、硫酸铵饱和度为95%;由表3中R可知影響落葵种子蛋白提取因素的主次排序为料液比>硫酸铵饱和度>浸泡时间。以最优方案进行提取,重复试验3次,得到的蛋白含量为33.00 mg/mL,对大肠杆菌的抑菌圈直径为19.68 mm。正交试验结果大于其他水平值,说明正交试验优化提取落葵种子蛋白工艺可行。
2. 3 落葵种子蛋白抑菌结果
由表4可知,通过EDTA缓冲液浸提,95%饱和硫酸铵沉淀的落葵种子蛋白提取物(30.00 mg/mL)对真菌具有抑菌作用,以红酵母为代表,其抑菌圈直径为24.59 mm;对致病菌金黄色葡萄球菌、单增李斯特菌、藤黄球菌和副溶血性弧菌均有抑菌作用,其抑菌圈直径分别为19.60、26.27、25.98和15.24 mm;对腐败菌也有抑菌作用,如腐败希瓦氏菌和假单胞菌,其抑菌直径分别为28.01和30.32 mm。表4中菌株除常见的食源性致病菌和肉类腐败菌外,还有来自河水中的9株细菌,这些细菌随水附着在鱼体表面,当鱼类失去生命时,具有潜在致腐的可能,因此控制这些细菌能降低潜在致腐风险。落葵种子蛋白对Bacillus velezensis具有最大抑菌圈直径(39.77 mm),对气单胞属中的Aeromonas allosaccharophila strain S5-33菌株具有最小抑菌圈直径(14.06 mm),对大肠杆菌DH5α抑菌直径为17.00 mm。落葵种子蛋白对这些腐败致病菌均具有良好的抑菌效果。
2. 4 落葵种子蛋白提取物还原力测定结果
落葵种子蛋白提取物还原性测定如图5所示,吸光值随蛋白质量浓度的增加而增加,根据吸光值与蛋白质量浓度的关系得出线性回归方程y=0.1324x-0.1444,R2=0.9918。当吸光值为0.5时对应的蛋白质量浓度为4.867 mg/mL,即为EC50。
2. 5 落葵种子蛋白提取物对DPPH自由基清除能力测定结果
以不同质量浓度DPPH自由基为横坐标、517 nm处吸光值为纵坐标,制得标准曲线为y=0.0076x+0.0408,R2=0.9994。
加样质量浓度与DPPH自由基清除率关系方程为y=1.6317x+8.4665,R2=0.9854,如图6所示。根据方程推算出当DPPH自由基残留率为50%时,IC50为27.817 mg/mL。落葵种子蛋白提取物对DPPH自由基的清除能力随着蛋白质量浓度(一定范围内)的增加而增强。
3 讨论
本研究采用硫酸铵沉淀盐析法对落葵种子蛋白进行提取,该方法是从粗制剂中浓缩和纯化蛋白的经典方法,能更好地保留蛋白活性。在提取过程中,蛋白大部分通过硫酸铵沉淀,用去离子水溶解沉淀后再次离心,此时糖类、脂类等杂质基本在沉淀中,而蛋白基本溶解出来。能否最大限度地提取落葵种子中的活性蛋白,单因素优化条件十分关键,不同的浸泡缓冲液对蛋白析出率和蛋白活性影响不同(Li et al.,2016)。本研究比较磷酸缓冲液、EDTA缓冲液、硼酸钠缓冲液和Tris-HCl缓冲液对落葵种子蛋白浸提的效果,结果显示,除Tris-HCl缓冲液浸提出的落葵种子蛋白含量稍低外,其他3种缓冲液浸提蛋白析出含量差异不显著;将4种缓冲液浸提的落葵种子蛋白提取物用无菌超纯水稀释至30.00 mg/mL进行大肠杆菌抑菌试验,结果显示只有EDTA缓冲液浸提的蛋白具有抑菌活性,说明不同的浸泡缓冲液对蛋白活性影响明显。
落葵种子中蛋白质含量丰富,本研究利用Bradford蛋白定量测定法测得落葵种子蛋白提取物的蛋白含量为32.30 mg/mL。李艳梅等(2011)采用碱溶酸沉法提取分离落葵种子蛋白,其提取率达82.15%,但并未对提取的粗蛋白进行深入研究。本研究对落葵种子蛋白提取物的特性进行分析,在硫酸铵饱和度80%~100%沉淀出的落葵种子蛋白提取物抑菌效果较好;此外,本研究还发现落葵种子蛋白提取物在pH 8.0左右抑菌特性消失,可能是蛋白等电点导致蛋白质变性或聚沉,温度高于80 ℃时抑菌活性显著下降,进一步说明起抑菌作用的是蛋白类而非糖类等其他物质。Reshmi和Suganya(2012)发现落葵果实甲醇提取物抑菌效果好,本研究也发现落葵种子蛋白提取物具有抑菌作用。落葵种子蛋白提取物对试验中的33株菌的抑菌圈直径为14.06~39.77 mm,抑菌效果优于苦瓜蛋白对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌和酵母的抑菌效果(抑菌圈直径分别为15.0、14.5、13.5和1.02 mm)(于群和朱新产,2012);优于苦荞蛋白对大肠杆菌和金黄色葡萄球菌的抑菌效果(抑菌圈直径分别为12.8和13.2 mm)(陈英娇,2015);也优于紫菜蛋白对金黄色葡萄球菌的抑菌效果(抑菌圈直径为18.70 mm)(宋惠平等,2015)。综上所述,落葵种子蛋白对真菌、致病菌和腐败菌均具有良好的抑制作用,作为食品防腐抑菌剂具有广阔的发展前景。
落葵种子还原力的测定中,随着有效活性蛋白质量浓度的增加,还原力不断增强,在吸光值0.5时其EC50为4.867 mg/mL,说明落葵种子蛋白有很强的抗氧化能力。彭会军(2008)测得落葵多糖对超氧自由基和羟基自由基的最大清除率分别为54.32%和52.94%,研究发现落葵中提取的活性物质可能为糖蛋白或蛋白多糖。这与本研究得出落葵种子蛋白提取物具有抗氧化作用的结论相符。落葵种子蛋白提取物还原能力测定的EC50为4.867 mg/mL,优于青刺果果实的还原力(EC50为24.7 mg/mL)(张瑞琳等,2017);同时落葵种子蛋白提取物对DPPH自由基清除能力的IC50为27.817 mg/mL,优于葡萄籽原花青素清除DPPH自由基能力,其清除DPPH自由基(2.5×10-2 mg/mL)的IC50为118 g/kg(李春阳等,2006)。本研究对落葵种子中粗蛋白进行了初步分析,但落葵种子蛋白粗提物中活性成分可能是一种或几种蛋白的混合物或多肽,后续试验将对蛋白提取物进行纯化和质谱鉴定。此外,关于落葵种子蛋白是否具有抗肿瘤、降血糖、降胆固醇等功效,其理化性质及在食品保鲜上的应用等均有待后续研究。
4 结论
落葵种子蛋白在EDTA缓冲液中可浸提出有效抑菌蛋白,最佳提取工艺为浸泡时间14 h、料液比1∶8、硫酸铵饱和度95%;落葵种子蛋白对1株真菌、4株致病菌和28株腐败菌均有较好的抑菌效果,对DPPH自由基清除效果良好,且抗氧化活性强。落葵种子蛋白具有开发为天然防腐抑菌剂和抗氧化剂的潜在价值。
参考文献:
曹辉,马海乐,曲文娟,贾俊强,潘忠礼,丁青芝,骆琳,王振斌,何荣海. 2009. 大米蛋白的木瓜酶酶解及其水解物的抗氧化活性[J]. 中国粮油学报,24(7):10-13. [Cao H,Ma H L,Qu W J,Jia J Q,Pan Z L,Ding Q Z,Luo L,Wang Z B,He R H. 2009. Enzymatic hydrolysis of rice protein with papain and antioxidation activity of hydrolysate[J]. Journal of the Chinese Cereals and Oils Association,24(7):10-13.]
陈英娇. 2015. 苦荞蛋白酶解物的制备及抗菌活性的研究[D]. 上海:上海师范大学. [Chen Y J. 2015. Enzymatic pre-paration and research on the antibacterial activity of tartary buckwheat protein hydrolysates[D]. Shanghai:Shanghai Normal University.]
古卓良,周国华,张晓丹,罗国安,章晓. 2003. 缓冲液种类对毛细管区带电泳分离蛋白质的影响[J]. 解放军药学学报,19(6):404-407. [Gu Z L,Zhou G H,Zhang X D,Luo G A,Zhang X. 2003. Effects of buffer types on the protein separation by capillary zone electrophoresis[J]. Pharmaceutical Journal of Chinese People’s Liberation Army,19(6):404-407.]
李春阳,许时婴,王璋. 2006. DPPH法测定葡萄籽原花青素清除自由基的能力[J]. 食品与生物技术学报,25(2):102-106. [Li C Y,Xu S Y,Wang Z. 2006. Measuring the antiradical efficiency of proanthocyanidin from grape seed by the DPPH· assay[J]. Journal of Food Science and Biotechnology,25(2):102-106.]
李军,李平兰,高亮,王顺,桂萌. 2018a. 萝卜籽蛋白提取物对托盘包装鲟鱼片冷藏品质的影响[J]. 食品科学,39(9):224-231. [Li J,Li P L,Gao L,Wang S,Gui M. 2018a. Effect of radish seed protein extract on quality of tray-packaged sturgeon fillets stored at 4 ℃[J]. Food Science,39(9):224-231.]
李军,李平兰,王顺,高亮,桂萌. 2018b. 萝卜籽蛋白提取物对鲟鱼腐败菌抑制作用及其理化性质的研究[J]. 食品科学,39(13):41-46. [Li J,Li P L,Wang S,Gao L,Gui M. 2018b. Inhibition of sturgeon spoilage bacteria by protein extract from radish seed and its physicochemical characteristics[J]. Food Science,39(13):41-46.]
李小莉,邹群,张迎庆,孙寅钧. 2012. 落葵多糖抗肿瘤及对红细胞免疫功能的影响[J]. 时珍国医国药,23(1):46-48. [Li X L,Zou Q,Zhang Y Q,Sun Y J. 2012. The effects of Basella rubra polysaccharide on anti-tumor and erythrocyte immune function[J]. Lishizhen Medicine and Materia Medica Researd,23(1):46-48.]
李艳梅,赵福顺,钟智敏,刘敏. 2011. 落葵种子蛋白质提取工艺的研究[J]. 食品工业,(7):28-30. [Li Y M,Zhao F S,Zhong Z M,Liu M. 2011. Study on the extraction of protein of Basella rubra Linn. seed[J]. The Food Industry,(7):28-30.]
林爱琴. 2010. 落葵多糖的提取及抗氧化活性的研究[J]. 应用化工,39(7):990-992. [Lin A Q. 2010. Study on extraction and antioxidant effects of polysaccharide of Basella[J]. Applied Chemical Industry,39(7):990-992.]
盧毓星,岳森,卢隆杰. 2005. 营养保健型蔬菜——落葵[J]. 蔬菜,9(2):30-31. [Lu Y X,Yue S,Lu L J. 2005. Nutritional health-type vegetables—Basella alba[J]. Vegetables,9(2):30-31.]
孟德敬,龙杰,陆健,孙军勇,樊伟,董建军. 2007. 麦芽中SOD活性与麦汁还原力的关系以及糖化温度对它们的影响[J]. 食品与发酵工业,33(11):13-17. [Meng D J,Long J,Lu J,Sun J Y,Fan W,Dong J J. 2007. Relationship between superoxide dismutase activity in malts and redu-cing power of wort,and effects of mashing temperature on them[J]. Food and Fermentation Industries,33(11):13-17.]
彭会军. 2008. 落葵多糖的提取分离与药理学研究[D]. 武汉:华中农业大学. [Peng H J. 2008. Extraction and isolation of polysaccharide from the Basella rubral L. and study on its pharmacological activity[D]. Wuhan:Huazhong Agricultural University.]
宋惠平,于佳,李钐,魏玉西,王文秀,许丽娜,韩丹. 2015. 条斑紫菜蛋白酶解多肽的抑菌活性[J]. 渔业科学进展,36(2):140-145. [Song H P,Yu J,Li S,Wei Y X,Wang W X,Xu L N,Han D. 2015. The antibacterial activity of peptides from Porphyra yezoensis[J]. Progress in Fishery Sciences,36(2):140-145.]
王雅. 2012. 沙棗果实可食部分活性物质提取及抗氧化、抗肿瘤作用研究[D]. 杨凌:西北农林科技大学. [Wang Y. 2012. Extraction of active components from fruits of Elaeagnus angustifolia L. fruits and their anti-oxidation and anti-tumor effects[D]. Yangling:Northwest Agriculture & Forestry University.]
王佐,李双杰,杨永宗. 2002. 苦瓜蛋白的分离纯化及其体外抗CoxB3型病毒作用的研究[J]. 南华大学学报(医学版),30(1):1-3. [Wang Z,Li S J,Yang Y Z. 2002. Purification of MCP and measurement of it’s anti-virus effect to CoxB3 in vitro[J]. Journal of Hengyang Medical College(Medical Edition),30(1):1-3.]
肖素荣,李京东. 2007. 天然食品防腐剂及其发展前景[J]. 中国食物与营养,(6):30-33. [Xiao S R,Li J D. 2007. Preservative of natural food and its development prospect[J]. Food and Nutrition in China,(6):30-33.]
于群,朱新产. 2012. 苦瓜种子蛋白的双水相提取及抑菌性研究[J]. 江西农业学报,24(1):88-90. [Yu Q,Zhu X C. 2012. Extraction of seed protein from Momordica charantia by aqueous two-phase system and its antibacterial effect[J]. Acta Agriculturae Jiangxi,24(1):88-90.]
章林,黄明,周光宏. 2012. 天然抗氧化剂在肉制品中的应用研究进展[J]. 食品科学,33(7):299-303. [Zhang L,Huang M,Zhou G H. 2012. Research progress in applications of natural antioxidants in meat products[J]. Food Science,33(7):299-303.]
张美荣,张慧,朱宏达,王冉冉,魏艳. 2010. 落葵色素的提取、分离、分析及稳定性研究[J]. 中国食品添加剂,(1):104-111. [Zhang M R,Zhang H,Zhu H D,Wang R R,Wei Y. 2010. The study of Basella rubra red’s extraction,separation,analysis and stability[J]. China Food Additives,(1):104-111.]
张瑞琳,吴文惠,张静怡,欧爱宇,郭锐华,包斌. 2017. 还原性青刺果果实蛋白生物化学特性的研究[J]. 天然产物研究与开发,29(9):1595-1601. [Zhang R L,Wu W H,Zhang J Y,Ou A Y,Guo R H,Bao B. 2017. Biochemical characteristics of reductive prinsepiautilis fruit protein[J]. Natural Product Research and Development,29(9):1595-1601.]
张新武,杜小波,徐素玲,黄继红. 2014. 食品中微生物危害的分析和控制[J]. 食品安全质量检测学报,5(10):3295-3299. [Zhang X W,Du X B,Xu S L,Huang J H. 2014. Analysis and control of microbiological hazards in food[J]. Journal of Food Safety & Quality,5(10):3295-3299.]
张羽. 2008. 莲子中蛋白质的分离及其食品功能特性研究[D]. 南京:南京师范大学. [Zhang Y. 2008. Study on se-paration of protein from lotus seed and its food functional characteristics[D]. Nanjing:Nanjing Normal University.]
张媛媛,李艳丽,李书国. 2014. 植物源食品防腐剂抑菌机理和效果及在食品保鲜中的应用[J]. 粮油食品科技,22(4):48-53. [Zhang Y Y,Li Y L,Li S G. 2014. Antibacterial mechanism and effects of botanical food preservatives and their application in food fresh-keeping[J]. Science and Technology of Cereals,Oils and Foods,22(4):48-53.]
趙国萍,李迎秋,冯林慧,宁厚齐. 2017. 天然防腐剂的应用研究进展[J]. 中国调味品,42(8):155-159. [Zhao G P,Li Y Q,Feng L H,Ning H Q. 2017. Research progress on application of natural preservatives[J]. China Condiment,42(8):155-159.]
赵金莉,张亚如,宋娟. 2011. 短序落葵薯多糖含量测定及体外抗氧化活性研究[J]. 江西农业学报,23(10):65-67. [Zhao J L,Zhang Y R,Song J. 2011. Study on content determination and antioxidant activity in vitro of polysaccharide produced by Anredera scandens[J]. Acta Agriculturae Jiangxi,23(10):65-67.]
周丽卿. 2012. 鹰嘴豆多肽的制备及其改性研究[D]. 杨凌:西北农林科技大学. [Zhou L Q. 2012. Study on the pre-paration and modification of chickpea peptide[D]. Yang-ling:Northwest Agriculture & Forestry University.]
邹群,肖松,彭会军,糜志远,李小莉. 2011. 落葵多糖的免疫调节和肿瘤抑制作用[J]. 食品与药品,13(3):165-167. [Zou Q,Xiao S,Peng H J,Mi Z Y,Li X L. 2011. Immunoloregulation and anti-tumor effect of polysaccharides from Basella rubra L.[J]. Food and Drug,13(3):165-167.]
Compton S J,Jones C G. 1985. Mechanism of dye response and interference in the Bradford protein assay[J]. Analy-tical Biochemistry,151(2):369-374.
Enujiugha V N,Talabi J Y,Malomo S A,Olagunju A I. 2012. DPPH Radical scavenging capacity of phenolic extracts from African yam bean(Sphenostylis stenocarpa)[J]. Food & Nutrition Sciences,3(1):7-13.
Li Q,Sui B,Yao J M. 2016. Analysis of activity and stability of cellulase based on different buffer systems[J]. Textile Dyeing & Finishing Journal,38(2):5-8.
Reshmi K,Suganya D P. 2012. Antimicrobial activity of Basella alba fruit[J]. International Journal of Pharmaceutical Sciences and Research,3(12):4757-4761.
Zhang R L,Wu W H,Zhang J Y,Ou A Y,Guo R H,Bao W. 2017. Biochemical characteristics of reductive Prinsepiautilis fruit protein[J]. Natural Product Research and Development,(9):1595-1601.
(责任编辑 罗 丽)0 引言
【研究意义】落葵(Basella alba L.)为落葵科落葵属多年生蔓生肉质藤本植物(赵金莉等,2011),其味道清香爽口,作为新型绿色健康蔬菜越来越受到人们喜爱。落葵营养丰富,叶和茎均可食用,每1 kg可食部分含有蛋白质17 g、脂肪2 g和碳水化合物31 g,同时含有丰富的钙、磷、铁等元素(卢毓星等,2005)。落葵全株可入药,民间常用其治病或作食疗,能清热滑肠、凉血、解毒,主治大便秘结、小便短涩、痢疾便血等症(彭会军,2008)。落葵种子富含蛋白,李艳梅等(2011)采用碱溶酸沉法提取分离落葵种子蛋白,在优化条件下得到蛋白质提取率为82.15%。虽然落葵种子蛋白含量丰富,但未得到充分利用,为研究其潜在价值,本研究采用正交优化法最大限度地提取落葵种子活性蛋白。植物源防腐剂是从植物的根、茎、叶和果实等提炼出的蛋白类、肽类、多糖类、黄酮类、多酚类、萜类、精油及植物自身成分的酶解产物等,具有一定的营养保健价值,即发挥抑菌、抗菌和食品保鲜作用的同时,还具有抗氧化、降血脂、降血压、预防肿瘤等疾病的保健功能(张媛媛等,2014)。落葵本身具有药食同源性,具有研发成为天然抑菌剂和天然抗氧化剂的潜力,因此研究落葵种子蛋白的特性具有重要意义。【前人研究进展】关于植物蛋白特性的研究,主要包括抑菌和抗氧化两方面。食品腐败不仅降低食品的营养价值,还增加食源性疾病风险(张新武等,2014),目前食品防腐剂种类繁多,化学防腐剂是使用最广泛的一种,但由于其对人体有一定的毒害作用,所以人们开始寻求天然食品防腐剂(肖素荣和李京东,2007;赵国萍等,2017)。王佐等(2002)分离纯化得到色谱纯的抗3型科萨奇病毒的苦瓜蛋白,通过体外抗病毒试验表明一定范围内的苦瓜蛋白对3型科萨奇病毒感染的HepG2细胞有明显保护作用;李军等(2018b)从萝卜籽中分离得到一种抑菌蛋白,研究发现该蛋白对9株鲟鱼腐败菌均具有很好的抑制作用。目前工业上使用的抗氧化剂大多是合成型,虽然抗氧化效果好,但其安全性一直受到质疑;天然抗氧化剂是从天然食品中提取的具有抗氧化活性的物质,具有安全性高、抗氧化能力强、无副作用等特点(章林等,2012),如莲子蛋白对羟基自由基具有较好的清除作用(张羽,2008)。关于落葵的研究目前主要集中在对落葵色素和多糖的研究,张美荣等(2010)对落葵果实中的色素提取工艺进行优化并研究其稳定性;林爱琴(2010)研究表明落葵多糖具有清除自由基的作用;邹群等(2011)研究发现落葵多糖有抑制肿瘤生长和免疫调节功效;李小莉等(2012)研究表明落葵多糖对荷瘤小鼠的肿瘤生长表现出显著的抑制作用;Reshmi和Suganya(2012)采用琼脂扩散法将落葵果实甲醇提取物对枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、乳酸杆菌等多种微生物的抑菌范围进行测定,结果表明,落葵果实提取物具有良好的抑菌性能。【本研究切入点】目前对落葵种子蛋白的功能特性研究较少,针对落葵种子蛋白抑菌和抗氧化特性的研究也鲜见报道。【拟解决的关键问题】通过硫酸铵沉淀、单因素试验和正交试验优化提取落葵种子蛋白的工艺条件,并对其抑菌特性、DPPH自由基清除能力和还原力进行研究,为开发利用落葵种子蛋白提供参考依据。
1 材料与方法
1. 1 试验材料
落葵种子购自北京市丰台区新发地种子市场。红酵母(Rhodothece glutinis)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aur-eus)、乳酸菌(Lactobacillus)、藤黄菌(Micrococcus luteus)、单增李斯特菌(Listeria monocytogenes)、副溶血性弧菌(Vibrio parahemolyticus)和河水细菌由四川农业大学食品学院提供,假单胞菌(Pseudomonas aeruginosa)、腐败希瓦氏菌(Shewanella putrefaciens)、气单胞菌(Aeromonas)、大腸杆菌(Escheri-chia coli)和不动杆菌(Acinetobacter sp.)为北京市水产科学研究所保藏并提供。平板计数琼脂(PCA)培养基和3%氯化钠胰蛋白胨大豆琼脂购自青岛海博生物技术有限公司;硫酸铵、六氰合铁酸钾、三氯乙酸、三氯化铁、氯化钠和琼脂粉均为分析纯,购自国药集团化学试剂有限公司;Bradford蛋白质定量试剂盒购自天根生化科技(北京)有限公司;2,6-二叔丁基-4-甲基苯酚(BHT)和乙二胺四乙酸(EDTA)购自索莱宝生物科技有限公司;DPPH自由基购自美国Sigma公司。
主要仪器设备:冷冻离心机(美国Sigma公司);全波长酶标仪(美国伯腾仪器有限公司);4 ℃冰箱(青岛海尔股份有限公司);洁净工作台(北京东联哈尔仪器制造有限公司);生化培养箱、恒温水浴锅(上海一恒科学仪器有限公司);全温振荡器(苏州培英实验设备有限公司);微波炉(广东美的厨房电器制造有限公司)。
1. 2 落葵种子蛋白提取物制备
采用硫酸铵沉淀法。将落葵种子磨成粉后(现磨现用,无需过筛,尽可能磨成细粉,便于落葵种子蛋白析出)与15 g/L EDTA缓冲液以1∶5(m/v)比例浸泡12 h,8层纱布过滤后取滤液于4 ℃下12000 r/min离心5 min,收集上清液,边搅拌边添加硫酸铵,使饱和度达80%,沉淀3 h后于4 ℃下12000 r/min离心20 min,收集沉淀,用去离子水复溶(每10 g落葵种子干粉蛋白提取物添加10 mL去离子水),4 ℃、12000 r/min离心20 min后收集上清液,0.22 μm水相滤膜过滤后4 ℃保存备用(李军等,2018a)。
1. 3 落葵种子蛋白提取物含量测定
根据Bradford蛋白定量测定原理(Compton and Jones,1985)进行。制备蛋白定量标准曲线,按照表1添加试剂于10 mL EP管中并混匀;摇匀后用96孔板分别在595 nm处测吸光值,记录数据,以蛋白质量浓度为横坐标、吸光值为纵坐标绘制标准曲线。取100 μL待测样品加入3 mL Bradford蛋白定量测定试剂混匀后在595 nm处测吸光值,通过蛋白定量标准曲线可得知待测样品的蛋白含量。
1. 4 落葵种子蛋白抑菌试验
真菌选取红酵母;致病菌选取单增李斯特菌、藤黄球菌、金色葡萄球菌和副溶血性弧菌;腐败菌选取大肠杆菌、假单胞菌、气单胞菌、腐败希瓦氏菌、枯草芽孢杆菌,以及从腐败鱼中筛选出的14株腐败菌菌株和从河水中筛出的9种细菌,共33株菌进行抑菌研究。除副溶血性弧菌外的其他菌株用PCA培养基活化后,用无菌生理盐水稀释至106 CFU/mL,取1 mL菌悬液置于10 mL PCA固体培养基中混匀凝固;副溶血性弧菌用10 mL 3%氯化钠胰蛋白胨水稀释至106 CFU/mL,取1 mL置于10 mL 3%氯化钠胰蛋白胨琼脂固体培养基中混匀凝固,凝固的平板用牛津杯(外径8 mm、内径6 mm、高10 mm)进行抑菌试验,每个牛津杯中加入200 μL落葵种子蛋白提取物(用无菌超纯水将1.3测得的落葵种子蛋白提取物浓度稀释至30.00 mg/mL),37 ℃培养18~24 h后观察抑菌圈直径,每组3个平行。
1. 5 落葵种子蛋白提取工艺优化
1. 5. 1 单因素试验
1. 5. 1. 1 浸泡缓冲液选择 选择4种缓冲液[硼酸钠缓冲液(0.05 mol/L,pH 8.2)、磷酸缓冲液(0.1 mol/L KCl,2 mmol/L EDTA,pH 7.5)、Tris-HCl缓冲液(0.05 mol/L,pH 8.0)和EDTA缓冲液(15 g/L,pH 8.0)]对落葵种子蛋白进行浸提,比较提取效果。以大肠杆菌(浓度106 CFU/mL)为指示菌株,取1 mL菌悬液置于无菌培养皿中,加入10 mL适温PCA固体培养基混匀静置,待其凝固后放入牛津杯,再取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,通过观察抑菌圈选择适宜的缓冲液,每组试验3个平行。
1. 5. 1. 2 浸泡时间选择 用最佳浸泡缓冲液分别浸泡落葵种子粉末4、8、12、16、20和24 h,按照1.2操作得到蛋白提取物后,以大肠杆菌(106 CFU/mL)为指示菌株,取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,观察抑菌圈。每组试验3个平行。
1. 5. 1. 3 料液比选择 将落葵种子粉末与缓冲液以1∶3、1∶5、1∶7、1∶9、1∶11和1∶12(w/v)的比例浸泡合适时间,按照1.2操作得到蛋白提取物后,以大肠杆菌(106 CFU/mL)为指示菌株,取200 μL落葵种子蛋白提取物加入牛津杯中,37 ℃培养18~24 h,观察抑菌圈。每组试验3个平行。
1. 5. 1. 4 硫酸铵饱和度选择 称取80 g落葵种子粉末,加入560 mL EDTA缓冲液浸泡12 h后纱布过滤,4 ℃下12000 r/min离心5 min,取上清液分为8份,每份30 mL,分别添加硫酸铵4.92、6.78、8.73、10.83、13.08、15.48、18.09和20.91 g(对应饱和度分别为30%、40%、50%、60%、70%、80%、90%和100%)沉淀落葵种子蛋白。后续步骤按照1.2操作,并将不同硫酸铵饱和度沉淀的落葵蛋白提取物以大肠杆菌(106 CFU/mL)为指示菌株测抑菌效果。每组试验3个平行。
1. 5. 2 正交优化试验 以对大肠杆菌的抑菌圈为筛选指标,根据单因素试验结果选取浸泡时间、料液比和硫酸铵饱和度进行正交试验,因素及水平设计见表2。
1. 6 落葵种子蛋白提取物还原力测定
取1 mL不同质量浓度样液,与1 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和1 mL 1.0%六氰合铁酸钾溶液混合,在50 ℃下水浴20 min后快速冷却,然后在反应混合物中加入1 mL 10%三氯乙酸,放置10 min,待反应充分后6000 r/min离心10 min,取上清1 mL,加入1 mL蒸馏水和0.2 mL 0.1%三氯化铁溶液,充分混匀,室温静置10 min后在700 nm处测吸光值(吸光值的增加代表反应混合物还原力增强,样品的抗氧化活性增加),以维生素C为阳性对照。得吸光值在一定质量浓度范围内的线性回归方程,通过回归方程计算半最大效应浓度EC50(吸光值为0.5时对应的样液质量浓度)。EC50越小,表明其还原力越强,抗氧化活性越强(孟德敬等,2007;王雅,2012;Zhang et al.,2017)。
1. 7 落葵种子蛋白提取物对DPPH自由基清除能力测定
1. 7. 1 标准曲线制作 准确称取DPPH自由基1 mg,用乙醇定容至10 mL,配制成质量浓度为0.1 mg/mL的标准溶液(现用现配)。分别吸取0、0.1、0.2、0.4、0.6、0.8和1.0 mL标准溶液,用乙醇定容至5 mL,最终质量浓度分别为0、2、4、8、12、16和20 μg/mL。测定上述标准溶液在517 nm波长处的吸光值,以不同质量浓度DPPH自由基为横坐标、吸光值为纵坐标,制作标准曲线。
1. 7. 2 样品测定 0.25 mL不同质量浓度落葵蛋白提取物与0.25 mL 0.1 mmol/L DPPH(溶解于95%乙醇中)混合后振荡,室温下避光反应30 min。若有沉淀,6400 g离心3 min,取200 μL上清液加到96孔板中,517 nm测定吸光值。对照组用0.25 mL蒸馏水替代样品,BHT(200 μg/mL)作阳性对照(Enujiugha et al.,2012)。按照下式计算落葵种子蛋白提取物对DPPH自由基的清除率(曹辉等,2009):
DPPH自由基清除率(%)=[1-(Ai-Aj)/A0]×100
式中,Ai为加入蛋白样品与DPPH反应后517 nm处吸光值,Aj为加入蛋白样品与无水乙醇混合后517 nm处吸光值,A0为不加蛋白样品时测得DPPH 517 nm的吸光值。
半抑制浓度(IC50)为DPPH自由基清除率等于50%时添加落葵种子提取物的质量浓度。
1. 8 统计分析
所有试验均重复3次。采用SPSS 17.0的One-way ANOVA进行方差分析,Duncan’s新復极差法进行差异显著性分析。
2 结果与分析
2. 1 落葵种子蛋白提取物的蛋白含量测定结果
落葵种子蛋白提取物溶液中蛋白质量浓度的标准曲线为y=0.3135x+0.3482(R2=0.9913)。经测定,落葵种子硫酸铵沉淀蛋白提取物溶液中蛋白质量浓度为32.30 mg/mL。
2. 2 落葵种子蛋白提取优化结果
2. 2. 1 单因素试验结果
2. 2. 1. 1 浸泡缓冲液优化 由图1可知,采用硼酸钠缓冲液、磷酸缓冲液、Tris-HCl缓冲液和EDTA缓冲液提取的落葵种子蛋白含量分别为36.20、36.58、34.30和36.17 mg/mL,其中Tris-HCl缓冲液浸提的蛋白含量显著低于其他3种缓冲液浸提的蛋白含量(P<0.05,下同),其他三者间差异不显著(P>0.05,下同)。将4种不同处理后的落葵种子蛋白(统一稀释到30.00 mg/mL)对大肠杆菌进行抑菌试验,结果显示,只有EDTA缓冲液浸提的落葵种子蛋白具有抑菌效果,对大肠DH5α的抑菌圈直径为17.02 mm。原因可能是硼酸钠缓冲液、磷酸缓冲液和Tris-HCl缓冲液对落葵蛋白中的有效抑菌活性蛋白结构造成破坏或使蛋白发生降解(古卓良等,2003)。与其他3种缓冲液相比,EDTA缓冲液较温和,能保留有效抑菌蛋白,其浸提出的蛋白具有最佳的抑菌效果,故选择EDTA作为浸提缓冲液进行后续试验。
2. 2. 1. 2 浸泡时间优化 由图2可看出,在浸泡时间4~8 h范围内,落葵种子蛋白对指示菌株大肠杆菌的抑菌圈直径差异不显著,浸泡12 h的抑菌圈直径显著增大(17.53 mm),抑菌效果最佳;然而随着浸泡时间的继续延长,抑菌效果显著下降。可能是由于缓冲液中可溶性杂质多,导致有效蛋白沉降。因此,选择10、12和14 h 3个水平进行正交优化试验。
2. 2. 1. 3 料液比优化 从图3可看出,在料液比1∶3~1∶7范围内,抑菌圈直径显著增大,在1∶7~1∶12范围内抑菌圈直径均在17.00 mm左右,4个水平间差异不显著。适当减小料液比,有利于有效抑菌蛋白质的充分溶出,而使提取率提高(周丽卿,2012);但料液比过小,蛋白质分子与水分子间的相互作用增强,使得蛋白质分子易发生作用而沉淀。从经济效益角度考虑,选择料液比1∶7进行蛋白提取,得到的蛋白对大肠杆菌抑菌圈直径为17.86 mm,抑菌效果较好。因此,选择1∶6、1∶7和1∶8 3个水平进行正交优化试验。
2. 2. 1. 4 硫酸铵饱和度优化 由图4可知,硫酸铵饱和度在30%~40%范围内时抑菌圈从无到有,饱和度在50%~70%时抑菌圈直径显著增大,在70%~80%时抑菌圈直径缓慢增大;当硫酸铵饱和度为90%时,抑菌蛋白对大肠杆菌的抑菌圈直径达18.51 mm,显著大于其他饱和度的抑菌圈直径。表明抑菌蛋白在90%硫酸铵饱和度时沉淀最多,且相对100%硫酸铵沉淀更节约成本,故选取90%饱和度硫酸铵作为蛋白沉淀条件,选择85%、90%和95% 3个水平进行正交试验。
2. 2. 2 正交试验结果 由单因素试验结果可知,落葵种子蛋白对大肠杆菌的抑菌效果受浸泡时间、料液比和硫酸铵饱和度影响明显,故选择这3个因素采用正交试验3因素3水平表优化落葵种子蛋白的提取工艺。由表3可知,在浸泡时间(因素A)中K3>K1>K2,料液比(因素B)中K3>K2>K1,硫酸铵饱和度(因素C)中K3>K2>K1,得出最优组合为A3B3C3(以大肠DH5α为指示菌株,抑菌圈直径大为选取条件),即浸泡时间为14 h、料液比为1∶8、硫酸铵饱和度为95%;由表3中R可知影响落葵种子蛋白提取因素的主次排序为料液比>硫酸铵饱和度>浸泡时间。以最优方案进行提取,重复试验3次,得到的蛋白含量为33.00 mg/mL,对大肠杆菌的抑菌圈直径为19.68 mm。正交试验结果大于其他水平值,说明正交试验优化提取落葵种子蛋白工艺可行。
2. 3 落葵种子蛋白抑菌结果
由表4可知,通过EDTA缓冲液浸提,95%饱和硫酸铵沉淀的落葵种子蛋白提取物(30.00 mg/mL)对真菌具有抑菌作用,以红酵母为代表,其抑菌圈直径为24.59 mm;对致病菌金黄色葡萄球菌、单增李斯特菌、藤黄球菌和副溶血性弧菌均有抑菌作用,其抑菌圈直径分别为19.60、26.27、25.98和15.24 mm;对腐败菌也有抑菌作用,如腐败希瓦氏菌和假单胞菌,其抑菌直径分别为28.01和30.32 mm。表4中菌株除常见的食源性致病菌和肉类腐败菌外,还有来自河水中的9株细菌,这些细菌随水附着在鱼体表面,当鱼类失去生命时,具有潜在致腐的可能,因此控制这些细菌能降低潜在致腐风险。落葵种子蛋白对Bacillus velezensis具有最大抑菌圈直径(39.77 mm),对气单胞属中的Aeromonas allosaccharophila strain S5-33菌株具有最小抑菌圈直径(14.06 mm),对大肠杆菌DH5α抑菌直径为17.00 mm。落葵种子蛋白对这些腐败致病菌均具有良好的抑菌效果。
2. 4 落葵种子蛋白提取物还原力测定结果
落葵种子蛋白提取物还原性测定如图5所示,吸光值随蛋白质量浓度的增加而增加,根据吸光值与蛋白质量浓度的关系得出线性回归方程y=0.1324x-0.1444,R2=0.9918。当吸光值为0.5时对应的蛋白质量浓度为4.867 mg/mL,即为EC50。
2. 5 落葵种子蛋白提取物对DPPH自由基清除能力测定结果
以不同质量浓度DPPH自由基为横坐标、517 nm处吸光值为纵坐标,制得标准曲线为y=0.0076x+0.0408,R2=0.9994。
加样质量浓度与DPPH自由基清除率关系方程为y=1.6317x+8.4665,R2=0.9854,如图6所示。根据方程推算出当DPPH自由基残留率为50%时,IC50为27.817 mg/mL。落葵种子蛋白提取物对DPPH自由基的清除能力随着蛋白质量浓度(一定范围内)的增加而增强。
3 讨论
本研究采用硫酸铵沉淀盐析法对落葵种子蛋白进行提取,该方法是从粗制剂中浓缩和纯化蛋白的經典方法,能更好地保留蛋白活性。在提取过程中,蛋白大部分通过硫酸铵沉淀,用去离子水溶解沉淀后再次离心,此时糖类、脂类等杂质基本在沉淀中,而蛋白基本溶解出来。能否最大限度地提取落葵种子中的活性蛋白,单因素优化条件十分关键,不同的浸泡缓冲液对蛋白析出率和蛋白活性影响不同(Li et al.,2016)。本研究比较磷酸缓冲液、EDTA缓冲液、硼酸钠缓冲液和Tris-HCl缓冲液对落葵种子蛋白浸提的效果,结果显示,除Tris-HCl缓冲液浸提出的落葵种子蛋白含量稍低外,其他3种缓冲液浸提蛋白析出含量差异不显著;将4种缓冲液浸提的落葵种子蛋白提取物用无菌超纯水稀释至30.00 mg/mL进行大肠杆菌抑菌试验,结果显示只有EDTA缓冲液浸提的蛋白具有抑菌活性,说明不同的浸泡缓冲液对蛋白活性影响明显。
落葵种子中蛋白质含量丰富,本研究利用Bradford蛋白定量测定法测得落葵种子蛋白提取物的蛋白含量为32.30 mg/mL。李艳梅等(2011)采用碱溶酸沉法提取分离落葵种子蛋白,其提取率达82.15%,但并未对提取的粗蛋白进行深入研究。本研究对落葵种子蛋白提取物的特性进行分析,在硫酸铵饱和度80%~100%沉淀出的落葵种子蛋白提取物抑菌效果较好;此外,本研究还发现落葵种子蛋白提取物在pH 8.0左右抑菌特性消失,可能是蛋白等电点导致蛋白质变性或聚沉,温度高于80 ℃时抑菌活性显著下降,进一步说明起抑菌作用的是蛋白类而非糖类等其他物质。Reshmi和Suganya(2012)发现落葵果实甲醇提取物抑菌效果好,本研究也发现落葵种子蛋白提取物具有抑菌作用。落葵种子蛋白提取物对试验中的33株菌的抑菌圈直径为14.06~39.77 mm,抑菌效果优于苦瓜蛋白对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌和酵母的抑菌效果(抑菌圈直径分别为15.0、14.5、13.5和1.02 mm)(于群和朱新产,2012);优于苦荞蛋白对大肠杆菌和金黄色葡萄球菌的抑菌效果(抑菌圈直径分别为12.8和13.2 mm)(陈英娇,2015);也优于紫菜蛋白对金黄色葡萄球菌的抑菌效果(抑菌圈直径为18.70 mm)(宋惠平等,2015)。综上所述,落葵种子蛋白对真菌、致病菌和腐败菌均具有良好的抑制作用,作为食品防腐抑菌剂具有广阔的发展前景。
落葵种子还原力的测定中,随着有效活性蛋白质量浓度的增加,还原力不断增强,在吸光值0.5时其EC50为4.867 mg/mL,说明落葵种子蛋白有很强的抗氧化能力。彭会军(2008)测得落葵多糖对超氧自由基和羟基自由基的最大清除率分别为54.32%和52.94%,研究发现落葵中提取的活性物质可能为糖蛋白或蛋白多糖。这与本研究得出落葵种子蛋白提取物具有抗氧化作用的结论相符。落葵种子蛋白提取物还原能力测定的EC50为4.867 mg/mL,优于青刺果果实的还原力(EC50为24.7 mg/mL)(张瑞琳等,2017);同时落葵种子蛋白提取物对DPPH自由基清除能力的IC50为27.817 mg/mL,优于葡萄籽原花青素清除DPPH自由基能力,其清除DPPH自由基(2.5×10-2 mg/mL)的IC50为118 g/kg(李春阳等,2006)。本研究对落葵种子中粗蛋白进行了初步分析,但落葵种子蛋白粗提物中活性成分可能是一种或几种蛋白的混合物或多肽,后续试验将对蛋白提取物进行纯化和质谱鉴定。此外,关于落葵种子蛋白是否具有抗肿瘤、降血糖、降胆固醇等功效,其理化性质及在食品保鲜上的应用等均有待后续研究。
4 结论
落葵种子蛋白在EDTA缓冲液中可浸提出有效抑菌蛋白,最佳提取工艺为浸泡时间14 h、料液比1∶8、硫酸铵饱和度95%;落葵种子蛋白对1株真菌、4株致病菌和28株腐败菌均有较好的抑菌效果,对DPPH自由基清除效果良好,且抗氧化活性强。落葵种子蛋白具有开发为天然防腐抑菌剂和抗氧化剂的潜在价值。
参考文献:
曹辉,马海乐,曲文娟,贾俊强,潘忠礼,丁青芝,骆琳,王振斌,何荣海. 2009. 大米蛋白的木瓜酶酶解及其水解物的抗氧化活性[J]. 中国粮油学报,24(7):10-13. [Cao H,Ma H L,Qu W J,Jia J Q,Pan Z L,Ding Q Z,Luo L,Wang Z B,He R H. 2009. Enzymatic hydrolysis of rice protein with papain and antioxidation activity of hydrolysate[J]. Journal of the Chinese Cereals and Oils Association,24(7):10-13.]
陈英娇. 2015. 苦荞蛋白酶解物的制备及抗菌活性的研究[D]. 上海:上海师范大学. [Chen Y J. 2015. Enzymatic pre-paration and research on the antibacterial activity of tartary buckwheat protein hydrolysates[D]. Shanghai:Shanghai Normal University.]
古卓良,周国华,张晓丹,罗国安,章晓. 2003. 缓冲液种类对毛细管区带电泳分离蛋白质的影响[J]. 解放军药学学报,19(6):404-407. [Gu Z L,Zhou G H,Zhang X D,Luo G A,Zhang X. 2003. Effects of buffer types on the protein separation by capillary zone electrophoresis[J]. Pharmaceutical Journal of Chinese People’s Liberation Army,19(6):404-407.]
李春阳,许时婴,王璋. 2006. DPPH法测定葡萄籽原花青素清除自由基的能力[J]. 食品与生物技术学报,25(2):102-106. [Li C Y,Xu S Y,Wang Z. 2006. Measuring the antiradical efficiency of proanthocyanidin from grape seed by the DPPH· assay[J]. Journal of Food Science and Biotechnology,25(2):102-106.]
李军,李平兰,高亮,王顺,桂萌. 2018a. 萝卜籽蛋白提取物对托盘包装鲟鱼片冷藏品质的影响[J]. 食品科学,39(9):224-231. [Li J,Li P L,Gao L,Wang S,Gui M. 2018a. Effect of radish seed protein extract on quality of tray-packaged sturgeon fillets stored at 4 ℃[J]. Food Science,39(9):224-231.]
李军,李平兰,王顺,高亮,桂萌. 2018b. 萝卜籽蛋白提取物对鲟鱼腐败菌抑制作用及其理化性质的研究[J]. 食品科学,39(13):41-46. [Li J,Li P L,Wang S,Gao L,Gui M. 2018b. Inhibition of sturgeon spoilage bacteria by protein extract from radish seed and its physicochemical characteristics[J]. Food Science,39(13):41-46.]
李小莉,邹群,张迎庆,孙寅钧. 2012. 落葵多糖抗肿瘤及对红细胞免疫功能的影响[J]. 时珍国医国药,23(1):46-48. [Li X L,Zou Q,Zhang Y Q,Sun Y J. 2012. The effects of Basella rubra polysaccharide on anti-tumor and erythrocyte immune function[J]. Lishizhen Medicine and Materia Medica Researd,23(1):46-48.]
李艳梅,赵福顺,钟智敏,刘敏. 2011. 落葵种子蛋白质提取工艺的研究[J]. 食品工业,(7):28-30. [Li Y M,Zhao F S,Zhong Z M,Liu M. 2011. Study on the extraction of protein of Basella rubra Linn. seed[J]. The Food Industry,(7):28-30.]
林愛琴. 2010. 落葵多糖的提取及抗氧化活性的研究[J]. 应用化工,39(7):990-992. [Lin A Q. 2010. Study on extraction and antioxidant effects of polysaccharide of Basella[J]. Applied Chemical Industry,39(7):990-992.]
卢毓星,岳森,卢隆杰. 2005. 营养保健型蔬菜——落葵[J]. 蔬菜,9(2):30-31. [Lu Y X,Yue S,Lu L J. 2005. Nutritional health-type vegetables—Basella alba[J]. Vegetables,9(2):30-31.]
孟德敬,龙杰,陆健,孙军勇,樊伟,董建军. 2007. 麦芽中SOD活性与麦汁还原力的关系以及糖化温度对它们的影响[J]. 食品与发酵工业,33(11):13-17. [Meng D J,Long J,Lu J,Sun J Y,Fan W,Dong J J. 2007. Relationship between superoxide dismutase activity in malts and redu-cing power of wort,and effects of mashing temperature on them[J]. Food and Fermentation Industries,33(11):13-17.]
彭会军. 2008. 落葵多糖的提取分离与药理学研究[D]. 武汉:华中农业大学. [Peng H J. 2008. Extraction and isolation of polysaccharide from the Basella rubral L. and study on its pharmacological activity[D]. Wuhan:Huazhong Agricultural University.]
宋惠平,于佳,李钐,魏玉西,王文秀,许丽娜,韩丹. 2015. 条斑紫菜蛋白酶解多肽的抑菌活性[J]. 渔业科学进展,36(2):140-145. [Song H P,Yu J,Li S,Wei Y X,Wang W X,Xu L N,Han D. 2015. The antibacterial activity of peptides from Porphyra yezoensis[J]. Progress in Fishery Sciences,36(2):140-145.]
王雅. 2012. 沙枣果实可食部分活性物质提取及抗氧化、抗肿瘤作用研究[D]. 杨凌:西北农林科技大学. [Wang Y. 2012. Extraction of active components from fruits of Elaeagnus angustifolia L. fruits and their anti-oxidation and anti-tumor effects[D]. Yangling:Northwest Agriculture & Forestry University.]
王佐,李双杰,杨永宗. 2002. 苦瓜蛋白的分离纯化及其体外抗CoxB3型病毒作用的研究[J]. 南华大学学报(医学版),30(1):1-3. [Wang Z,Li S J,Yang Y Z. 2002. Purification of MCP and measurement of it’s anti-virus effect to CoxB3 in vitro[J]. Journal of Hengyang Medical College(Medical Edition),30(1):1-3.]
肖素荣,李京东. 2007. 天然食品防腐剂及其发展前景[J]. 中国食物与营养,(6):30-33. [Xiao S R,Li J D. 2007. Preservative of natural food and its development prospect[J]. Food and Nutrition in China,(6):30-33.]
于群,朱新产. 2012. 苦瓜种子蛋白的双水相提取及抑菌性研究[J]. 江西农业学报,24(1):88-90. [Yu Q,Zhu X C. 2012. Extraction of seed protein from Momordica charantia by aqueous two-phase system and its antibacterial effect[J]. Acta Agriculturae Jiangxi,24(1):88-90.]
章林,黄明,周光宏. 2012. 天然抗氧化剂在肉制品中的应用研究进展[J]. 食品科学,33(7):299-303. [Zhang L,Huang M,Zhou G H. 2012. Research progress in applications of natural antioxidants in meat products[J]. Food Science,33(7):299-303.]
张美荣,张慧,朱宏达,王冉冉,魏艳. 2010. 落葵色素的提取、分离、分析及稳定性研究[J]. 中国食品添加剂,(1):104-111. [Zhang M R,Zhang H,Zhu H D,Wang R R,Wei Y. 2010. The study of Basella rubra red’s extraction,separation,analysis and stability[J]. China Food Additives,(1):104-111.]
张瑞琳,吴文惠,张静怡,欧爱宇,郭锐华,包斌. 2017. 还原性青刺果果实蛋白生物化学特性的研究[J]. 天然产物研究与开发,29(9):1595-1601. [Zhang R L,Wu W H,Zhang J Y,Ou A Y,Guo R H,Bao B. 2017. Biochemical characteristics of reductive prinsepiautilis fruit protein[J]. Natural Product Research and Development,29(9):1595-1601.]
張新武,杜小波,徐素玲,黄继红. 2014. 食品中微生物危害的分析和控制[J]. 食品安全质量检测学报,5(10):3295-3299. [Zhang X W,Du X B,Xu S L,Huang J H. 2014. Analysis and control of microbiological hazards in food[J]. Journal of Food Safety & Quality,5(10):3295-3299.]
张羽. 2008. 莲子中蛋白质的分离及其食品功能特性研究[D]. 南京:南京师范大学. [Zhang Y. 2008. Study on se-paration of protein from lotus seed and its food functional characteristics[D]. Nanjing:Nanjing Normal University.]
张媛媛,李艳丽,李书国. 2014. 植物源食品防腐剂抑菌机理和效果及在食品保鲜中的应用[J]. 粮油食品科技,22(4):48-53. [Zhang Y Y,Li Y L,Li S G. 2014. Antibacterial mechanism and effects of botanical food preservatives and their application in food fresh-keeping[J]. Science and Technology of Cereals,Oils and Foods,22(4):48-53.]
赵国萍,李迎秋,冯林慧,宁厚齐. 2017. 天然防腐剂的应用研究进展[J]. 中国调味品,42(8):155-159. [Zhao G P,Li Y Q,Feng L H,Ning H Q. 2017. Research progress on application of natural preservatives[J]. China Condiment,42(8):155-159.]
赵金莉,张亚如,宋娟. 2011. 短序落葵薯多糖含量测定及体外抗氧化活性研究[J]. 江西农业学报,23(10):65-67. [Zhao J L,Zhang Y R,Song J. 2011. Study on content determination and antioxidant activity in vitro of polysaccharide produced by Anredera scandens[J]. Acta Agriculturae Jiangxi,23(10):65-67.]
周丽卿. 2012. 鹰嘴豆多肽的制备及其改性研究[D]. 杨凌:西北农林科技大学. [Zhou L Q. 2012. Study on the pre-paration and modification of chickpea peptide[D]. Yang-ling:Northwest Agriculture & Forestry University.]
邹群,肖松,彭会军,糜志远,李小莉. 2011. 落葵多糖的免疫调节和肿瘤抑制作用[J]. 食品与药品,13(3):165-167. [Zou Q,Xiao S,Peng H J,Mi Z Y,Li X L. 2011. Immunoloregulation and anti-tumor effect of polysaccharides from Basella rubra L.[J]. Food and Drug,13(3):165-167.]
Compton S J,Jones C G. 1985. Mechanism of dye response and interference in the Bradford protein assay[J]. Analy-tical Biochemistry,151(2):369-374.
Enujiugha V N,Talabi J Y,Malomo S A,Olagunju A I. 2012. DPPH Radical scavenging capacity of phenolic extracts from African yam bean(Sphenostylis stenocarpa)[J]. Food & Nutrition Sciences,3(1):7-13.
Li Q,Sui B,Yao J M. 2016. Analysis of activity and stability of cellulase based on different buffer systems[J]. Textile Dyeing & Finishing Journal,38(2):5-8.
Reshmi K,Suganya D P. 2012. Antimicrobial activity of Basella alba fruit[J]. International Journal of Pharmaceutical Sciences and Research,3(12):4757-4761.
Zhang R L,Wu W H,Zhang J Y,Ou A Y,Guo R H,Bao W. 2017. Biochemical characteristics of reductive Prinsepiautilis fruit protein[J]. Natural Product Research and Development,(9):1595-1601.
(責任编辑 罗 丽)

