西藏虎头兰高效植株再生体系的研究
袁芳 宋凯杰 蔡熙彤 杨泽东 王兵 兰小中



摘 要:为建立西藏虎头兰(Cymbidium tracyanum)的高效快速繁殖体系,该研究以野生西藏虎头兰种子为外植体,通过分析不同基本培養基和植物激素配比对原球茎诱导、增殖和分化的影响,以及光照时间和培养温度对试管苗生长的影响,筛选出适宜西藏虎头兰植株高效再生的条件。结果表明:适宜西藏虎头兰生长的基本培养基为1/2 MS;种子萌发和原球茎诱导的最适培养基为1/2 MS+1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA,培养50d后,有95.00%的种子发育成原球茎;原球茎增殖的最适培养基为1/2 MS+2.0 mg·L-1 NAA,培养30d,增殖倍数为4.25;原球茎的最适分化培养基为1/2 MS+2.0 mg·L-1 NAA+60 g·L-1土豆泥+0.5 g·L-1活性炭,培养10d,不定芽发生率为98.33%,培养40d,幼苗生根率为94.67%;试管苗在温度20 ℃、光照时间12 h·d-1、光照强度2 000 lx的条件下培养,苗长势好,叶片生理性焦尖发生率仅为3.33%;以腐殖土作为栽培基质,试管苗的移栽成活率为97.78%。该研究结果为保护西藏虎头兰野生资源和工厂化育苗提供了科学依据和技术支持。
关键词:西藏虎头兰, 种子, 原球茎, 组织培养, 植株再生
中图分类号:Q943.1, Q813.1
文献标识码:A
文章编号:1000-3142(2019)04-0482-08
Abstract:In order to establish a highly efficient plant regeneration system, Cymbidium tracyanum was selected as explant to screen out the conditions to regenerate with highly efficiency, by evaluating the effects of basic medium and hormone combination on the plant regeneration of C. tracyanum, and the effects of illumination time and culture temperature on the growth of plantlets were also studied. The results were as follows:The optimum basic medium for C. tracyanum growth was 1/2 MS. The optimal medium for protocorm induction was 1/2 MS+1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA, 95.00% of the seedsdeveloped into the protocorms after cultured for 50d. The optimal medium for protocorm proliferation was 1/2 MS+2.0 mg·L-1 NAA, the maximum proliferation multiple of protocorm reached 4.25 after cultured for 30d. The optimal medium for protocormdifferentiation was 1/2 MS+2.0 mg·L-1 NAA+60 g·L-1 mashed potato+0.5 g·L-1acticarbon, the induction rate of indefinite bud was 98.33% after cultured for 10d, the rooting rate was 94.67% after cultured for 40d. In the process of plantlets subculture, temperature of 20 ℃ , illumination time of 12 h·d-1 and illumination intensity of 2 000 lx were suited for the growth of plantlets, the physiological scorch rate of leaf tip was 3.33%. Using humus as cultivation substrate, the transplanting survival rate of plantlets was 97.78%. This study provides an effective way for keeping good varieties of features and rapid propagation of C. tracyanum, at the same time, helps to solve some theoretical problems in factory production of C. tracyanum.
Key words:Cymbidium tracyanum, seed, protocorm, tissue culture, plant regeneration
西藏虎头兰(Cymbidium tracyanum)是兰科兰属附生型多年生草本植物,在中国主要分布于贵州西南部、云南西南部至东南部和西藏东南部(中国植物志编委会,1999)。西藏虎头兰的叶长碧绿,花姿粗旷,豪放壮丽,花香清淑,又名沉香虎头兰,适宜做盆栽或切花,具有很高的观赏价值和经济价值(李慧敏,2014;李枝林等,2005;王莲辉等,2009;蓝玉甜等,2010;陈和明等,2015)。野生西藏虎头兰的种子在自然条件下极难萌发,主要靠分株繁殖,资源再生缓慢,受到濒危野生动植物国际贸易公约(CITES)的保护,被《中国物种红色名录》(植物部分)和《国家重点保护野生植物名录》(第二批讨论稿)列为Ⅰ级保护植物(中国科学院植物研究所,2013;刘思思等,2015;王喜龙,2018)。
国内外以西藏虎头兰为研究材料的报道甚少,现有的研究主要集中在对环境胁迫的响应机制(匡美龄和张石宝,2015;Li & Zhang,2016;Li et al., 2018)和組织培养研究(李枝林等,2005;王莲辉等,2009;蓝玉甜等,2010;陈和明等,2015)方面。虽然国内学者以西藏虎头兰的种子为外植体开展了一些组培快繁研究,但仍然存在原球茎诱导和增殖分化率不高、幼苗弱、组培周期不稳定等现象。因此,本研究利用种子诱导产生原球茎,通过对原球茎增殖以及再生条件的研究,旨在建立西藏虎头兰高效快速繁殖体系,为保护其野生资源及种苗生产奠定基础。
1 材料与方法
1.1 材料
材料为野生西藏虎头兰未开裂的成熟蒴果(图1:A,B),采自西藏自治区林芝市墨脱县。
1.2 方法
1.2.1 种子消毒与接种 用洗洁精清洗蒴果表面,用解剖刀轻轻刮去表面脏物,自来水冲洗1 h。在超净工作台上将蒴果用75%乙醇消毒5 min,无菌水冲洗3次,再放入0.1%的HgCl2溶液中消毒15 min,无菌水冲洗3次,并用无菌水浸泡蒴果30 min;消毒过程中不断轻轻摇动烧杯以便消毒剂和蒴果充分接触。将消毒完毕的蒴果置于无菌滤纸上吸干表面的水分,用解剖刀将蒴果纵向劈开,使种子可以倒出,用镊子夹住蒴果,将种子轻轻抖落在原球茎诱导培养基上。
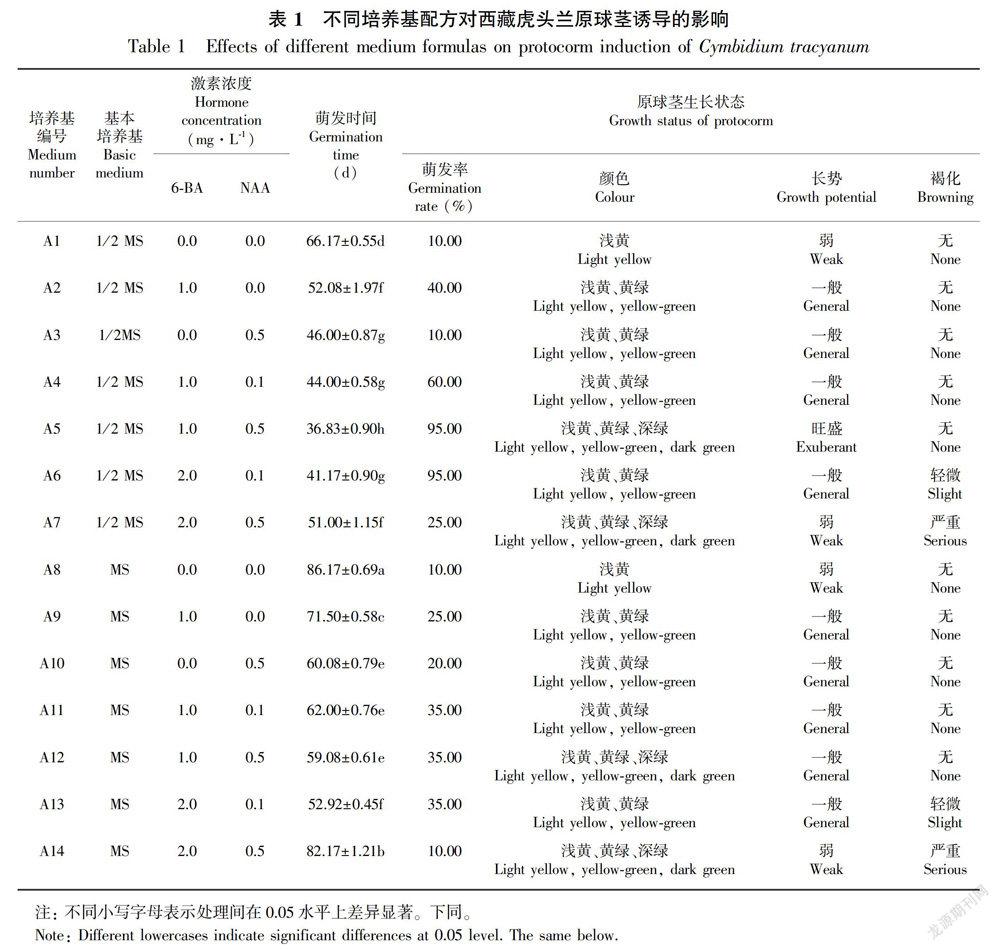
1.2.2 原球茎的诱导 分别以1/2 MS和MS为基本培养基,添加不同配比的6-BA和NAA,配制成14种不同的原球茎诱导培养基(表1)。每种培养基接种6瓶种子,每两周向组培瓶中注入相同配方的液体培养基3 mL,用以保持瓶内的水分和养分。观察和记录种子萌发、原球茎诱导和生长情况,筛选出最适合的基本培养基和原球茎诱导培养基。
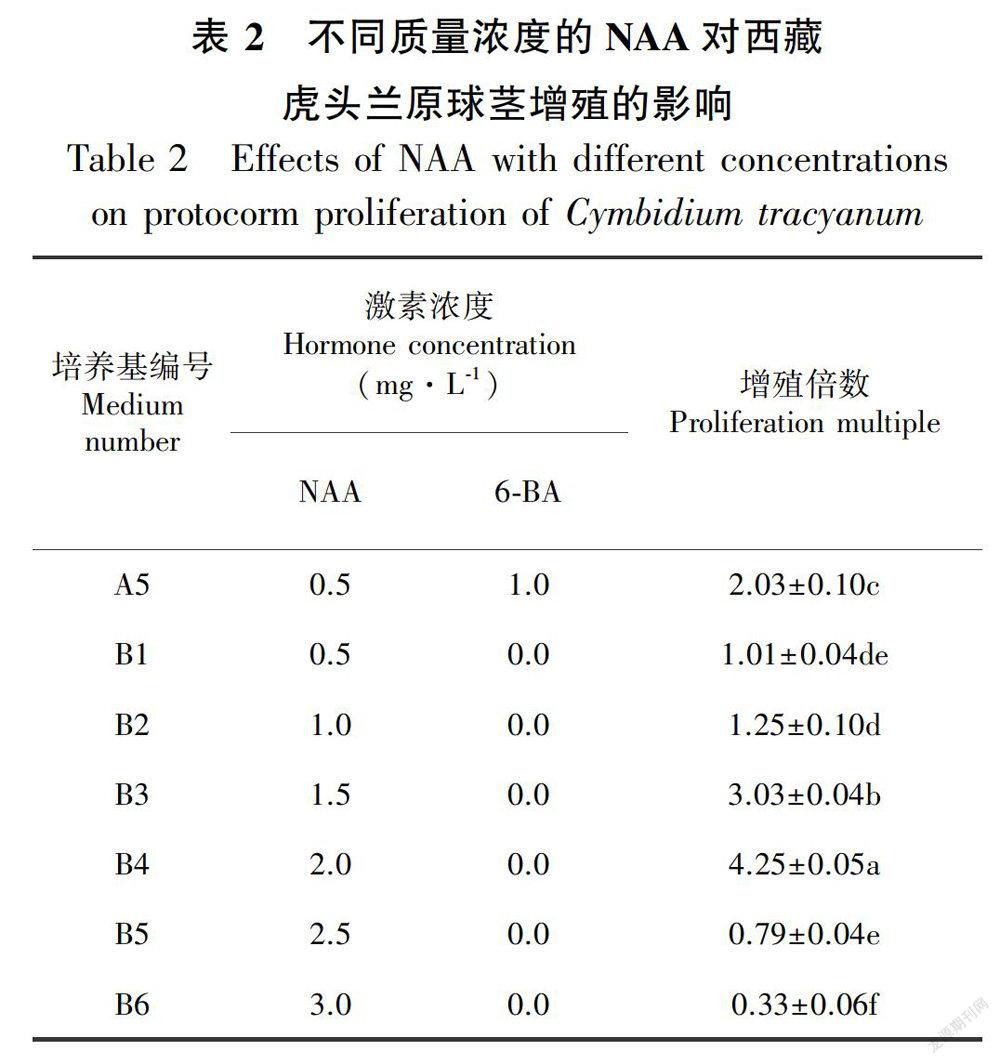
1.2.3 原球茎的增殖培养 在1.2.2筛选出的最适基本培养基的基础上,以1/2 MS为基本培养基,添加不同质量浓度的NAA配制成原球茎增殖培养基,并以最佳原球茎诱导培养基为对照(表2)。选取生长良好的原球茎,接种于试验培养基中,每个处理接种6瓶,每瓶接种50个原球茎。30d后观察和记录原球茎的增殖效果,统计原球茎增殖倍数。原球茎增殖倍数(倍)=(增殖后原球茎数-接种原球茎数)/接种原球茎数(邱玥等,2010;姚绍嫦等,2012)。
1.2.4 原球茎的分化培养 在最佳原球茎增殖培养基中单独或一起添加60 g·L-1土豆泥和0.5 g·L-1活性炭,配制成不同的原球茎分化培养基,并以最佳原球茎增殖培养基为对照(表3)。以原球茎增殖培养基中培养30d后、生长良好的原球茎为材料,接种于试验培养基中,每个处理接种6瓶,每瓶接种50个原球茎。分化培养第10天统计原球茎不定芽发生率,第40天统计生根率,并观察记录幼苗的生长状态。
不定芽发生率=产生不定芽原球茎数(芽高≥0.5 cm)/接种原球茎数×100%;
生根率=生根幼苗数(苗高、根长≥2 cm)/接种原球茎数×100%。
以上培养基均添加6.5 g·L-1琼脂、25 g·L-1蔗糖,pH 5.8。培养条件:温度(25 ± 2)℃、光照时间16 h·d-1、光照强度2 000 lx。
1.2.5 试管苗生长发育环境因子的筛选 选取长势较好、苗高1 cm左右、无生理性焦尖的带根试管苗,接种在最佳原球茎分化培养基中,置于温度(25 ± 2)℃,光照强度2 000 lx,光照时间分别为8、12、16和20 h·d-1的条件下,培养30d后观察和记录试管苗的生长情况(表4)。在最适光照时间筛选的基础上,将试管苗分别置于温度为15、20、25和30 ℃的条件下,培养30d后观察和记录试管苗的生长情况(表5)。每个光照时间和温度处理接种试管苗20株(1瓶,每瓶含50 mL培养基),重复3次。
生理性焦尖率=生理性焦尖苗数/接种苗数×100%。
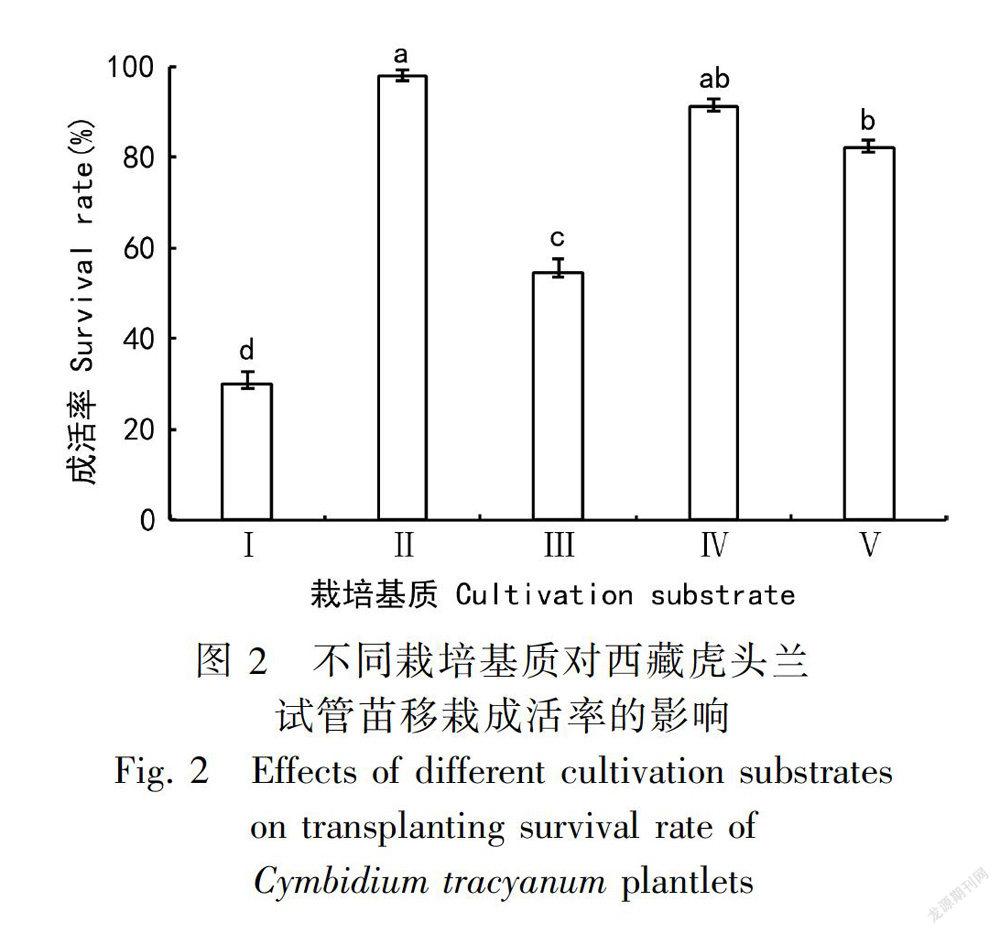
1.2.6 炼苗移栽 选取根系发达、苗高约为10 cm的壮苗,开盖并置于自然光下炼苗3d,之后取出幼苗,小心洗净残余培养基后进行移栽。栽培基质共设置5个处理,分别为(Ⅰ)农田土、(Ⅱ)腐殖土、(Ⅲ)农田土∶腐殖土=1∶1(混合土)、(Ⅳ)腐殖土∶蛭石∶珍珠岩=8∶1∶1和(Ⅴ)混合土∶蛭石∶珍珠岩=8∶1∶1。移栽前将不同栽培基质浇透水,移栽后再一次浇透水,每个处理30株苗,重复3次。在温室中保温保湿 [温度为(20 ± 2)℃,湿度为70%~80%]培养20d后,观察移栽苗的生长情况及移栽成活率(图2)。移栽成活率=萎蔫死亡苗数/总苗数×100%。
1.2.7 统计分析 所得的数据采用 Excel 和SPSS 19.0 软件进行处理分析。
2 结果与分析
2.1 种子诱导产生原球茎
在以1/2 MS和MS为基本培养基、添加不同配比的6-BA和NAA所配制成的14种不同的原球茎诱导培养基中(表1),不同配方对西藏虎头兰种子原球茎的诱导效果明显不同。以1/2 MS为基本培养基中的原球茎诱导和生长速度较快,其中又以A5培养基的诱导效果最佳,种子经过(36.83±0.90)d培养,大部分种子开始膨大,呈浅黄色,继续培养14d左右,有95.00%的种子发育成原球茎,原球茎呈黄绿色或深绿色,颗粒状膨大,生长快(图1:C)。以MS为基本培养基,种子萌发较慢,原球茎诱导率较低。6-BA和NAA对西藏虎头兰种子萌发和原球茎诱导均有一定的效果。0.5 mg·L-1 NAA可以促进种子萌发,缩短萌发时间。1.0 mg·L-1 6-BA促进原球茎的形成和生长,但是当6-BA的质量浓度达到2.0 mg·L-1时,则会抑制原球茎的生长,使大部分原球茎褐化死亡。将1.0 mg·L-1 6-BA和0.5 mg·L-1 NAA配合使用,可显著缩短种子萌发时间和提高原球茎的诱导率,且原球茎长势旺盛。不添加6-BA和NAA的1/2 MS和MS培养基,种子萌发时间分别为(66.17±0.55)d和(86.17±0.69)d,继续培养3~4个月后,原球茎变为黄绿色或深绿色,诱导率仅为10.00%,生长缓慢。因此,诱导西藏虎头兰种子萌发并形成原球茎的适合培养基应为A5(1/2 MS+6-BA 1.0 mg·L-1+NAA 0.5 mg·L-1)。
2.2 原球茎的增殖培养
将A5培养基中生长良好的绿色原球茎,接种到以1/2 MS为基本培养基、添加不同质量浓度NAA的原球茎增殖培养基中,并以最佳原球茎诱导培养基A5为对照(表2)。观测发现,当NAA的质量浓度在0.5~2.0 mg·L-1时,随着NAA质量浓度的提高,原球茎增殖的越多,长势越好。当NAA
为2.0 mg·L-1时,原球茎的增殖倍数最高,达到(4.25±0.05)倍,原球茎呈黄绿色或深绿色,大部分呈球形和圆锥形,少部分呈梭形,圆锥形的原球茎为一端有突起,梭形的原球茎为两端有突起,大多数的原球茎多个聚生在一起,呈桑椹状(图1:D)。当NAA的质量浓度大于2.0 mg·L-1时,对原球茎的增殖有抑制作用。原球茎在作为对照的A5培养基上的增殖倍数为(2.03±0.10)倍,原球茎形成的突起较少。因此,西藏虎头兰最佳的原球茎增殖培养基应为B4(1/2 MS+NAA 2.0 mg·L-1)。
2.3 原球茎的分化培养
原球茎增殖培养30d后,选取有突起的黄绿色和深绿色原球茎,接种到添加了土豆泥和活性碳的原球茎最适增殖培养基1/2 MS+NAA 2.0 mg·L-1上进行分化培养 (表3)。接种时, 对聚生在一起的原球茎只记录个数,不进行切割。培养结果发现,添加60.0 g·L-1土豆泥,可显著提高原球茎不定芽的诱导率和生根率,且幼苗长势旺盛;同时添加0.5 g·L-1的活性炭,即可显著降低幼苗基部的褐化程度, 又在不定芽诱导和根系生長方面
有明显促进作用。原球茎在C2培养基中培养10d左右,就能分化出芽和根,长势整齐,不定芽发生率达到(98.33±1.37)%,同时又有新的原球茎产生,均呈深绿色,原球茎紧密的聚生在一起,有白色绒毛状假根产生(图1:E);培养至40d,幼苗的生根率达到(94.67±2.21)%,根系发达,大部分苗高超过2 cm(图1:F)。因此,西藏虎头兰原球茎适合的分化培养基为C2(1/2 MS+NAA 2.0 mg·L-1+土豆泥60 g·L-1+活性碳0.5 g·L-1)。
2.4 不同光照时间和温度对试管苗生长的影响
原球茎分化成苗后,在继代培养过程中西藏虎头兰出现叶片生理性焦尖。将长势良好的幼苗接种在原球茎分化培养基1/2 MS+NAA 2.0 mg·L-1+土豆泥60 g·L-1+活性碳0.5 g·L-1上,置于不同光照时间和培养温度下培养(表4,表5)。结果发现,不同光照时间对西藏虎头兰幼苗长势和生理性焦尖发生率有显著影响。光照时间越长,幼苗焦尖越严重,光照时间短,幼苗生长缓慢、细弱。当光照时间为12 h·d-1时,虽然焦尖率为(28.33±2.36)%,但是幼苗粗壮,生长速度快。因此,12 h·d-1为西藏虎头兰试管苗培养的最佳光照时间。当光照时间固定为12 h·d-1,设定不同的培养温度对西藏虎头兰分化苗进行培养(表5),结果发现,不同的培养温度对幼苗长势和生理性焦尖发生率有显著影响。培养温度为15 ℃时,幼苗没有出现焦尖,但是长势弱;为20 ℃时,幼苗长势非常旺盛,只有极少数的叶片出现焦尖(图1:G);25~30 ℃时,随着温度的逐渐升高,幼苗焦尖越严重。因此,20 ℃为西藏虎头兰试管苗培养的最佳温度。
综上分析,西藏虎头兰试管苗继代分化培养过程中,最适光照时间为12 h·d-1,最适培养温度为20 ℃。
2.5 试管苗的移栽
当西藏虎头兰带根试管苗的株高约10 cm时(图1:H),可进行炼苗移栽。观测发现,不同栽培基质对西藏虎头兰幼苗的移栽成活率有一定影响(图2);含有腐殖土的栽培基质比农田土更有利于西藏虎头兰幼苗的生长;以腐殖土作为栽培基质的移栽成活率最高,达到(97.78±1.57)%,且植株健壮,长势良好(图1:I)。因此,西藏虎头兰试管生根苗的最佳移栽基质为腐殖土(Ⅱ)。
3 讨论与结论
西藏虎头兰是一种具有很高观赏价值和经济价值的兰科兰属植物。目前,关于西藏虎头兰组织培养的研究较少。李枝林等(2005)在1/2 MS培养基中添加6-BA和NAA促进西藏虎头兰种子萌发,KT和NAA诱导形成原球茎,再利用6-BA和NAA促进原球茎分化。王莲辉等(2009)认为西藏虎头兰种子在1/2 MS+100 mL·L-1土豆和MS+100 mL·L-1土豆的培养基上,种子萌发率均达到90%以上,且MS基本培养基比1/2 MS基本培养基更有利于种子萌发及原球茎的增殖分化;6-BA和NAA可促进原球茎增殖分化,但是随着6-BA浓度的增加,植株有弱化的趋势;无根苗在1/2 MS+0.2 mg·L-1 IBA培养基上的生根率在95%以上。蓝玉甜等(2010)将西藏虎头兰种子接种在1.0 g·L-1 花宝1号+1.0 g·L-1 花宝2号+1.0 mg·L-1 6-BA+10%香蕉汁+2%苹果汁+20 g·L-1 蔗糖+6.0 g·L-1 琼脂+1.0 g·L-1 活性炭的培养基上,种子萌发率为90%~98%;原球茎分化最佳培养基为MS+1.0 mg·L-1 NAA+5%香蕉汁+2%苹果汁,芽分化率为89%;1/2 MS+1.0 mg·L-1 NAA+5%香蕉汁适合壮苗生根。陈和明等(2015)发现,MS基本培养基中添加0.5 mg·L-1 NAA、100 g·L-1土豆和1.0 g·L-1活性炭适宜西藏虎头兰种子萌发和小苗增殖,添加1.0 mg·L-1 NAA、100 g·L-1香蕉和1.0 g·L-1活性炭适宜小苗壮苗生根。上述这些研究以西藏虎头兰种子为外植体,诱导种子萌发和原球茎的增殖分化,所提供的数据和结果不尽相同,未能对西藏虎头兰组培快繁过程提供比较系统、详细及完整的技术资料。
本研究从种子萌发、原球茎的诱导、增殖分化、试管苗生长发育环境因子的筛选及移栽等方面对西藏虎头兰进行了较为系统和全面的组培快繁研究,建立了西藏虎头兰高效植株再生体系。本研究结果表明,1/2 MS基本培养基较MS基本培养基更适合西藏虎头兰种子原球茎的诱导、增殖及分化。添加1.0 mg·L-1 6-BA+0.5 mg·L-1 NAA,比不添加任何激素配比或单独使用6-BA或NAA的原球茎诱导效果好,种子萌发所需时间较短,原球茎诱导及生长情况好。原球茎在1/2 MS+2.0 mg·L-1 NAA的培养基上培养30d就可实现4.25倍的增殖,再添加60 g·L-1土豆泥+0.5 g·L-1活性炭可以有效促进增殖后的原球茎分化出不定芽和根。从种子萌发产生原球茎到获得苗高约2 cm的带根试管苗只需4~5个月,原球茎诱导率和分化率均在95%以上;试管苗在温度20 ℃、光照时间12 h·d-1、光照强度2 000 lx的条件下继代培养约2个月,苗高在10 cm左右,植株粗壮,长势旺盛。本研究与前人的研究结果(李枝林等,2005;王莲辉等,2009;蓝玉甜等,2010;陈和明等,2015)相比较,简化了西藏虎头兰组培快繁过程中的培养基配方和程序,获得了较高的原球茎诱导率和分化率,缩短了组培周期,节约了组培成本。
在西藏虎头兰试管苗继代培养过程中遇到生理性焦尖现象,有时整瓶试管苗有一半以上的叶片呈黑色焦尖,严重影响了植株的正常生长和观赏价值。湿度太低/高、光照太强和高温等因素会引起叶片生理性焦尖(王志红,2003;吴亚光,2003)。组织培养室空间和组培瓶内环境相对密闭,通常使用的温度(25 ± 2)℃、光照时间16 h·d-1、光照强度2 000 lx的培养条件不适合西藏虎头兰试管苗的继代培养。兰属植物大多数种类生长在适度荫蔽的环境中,但附生型的西藏虎头兰能在短时间阳光直射的环境下良好生长(匡美龄和张石宝,2015)。因此,本研究对适合试管苗继代生长的光照时间和培养温度进行了筛选,在光照时间12 h·d-1、温度20 ℃的条件下,只有极少数的叶片出现焦尖,焦尖发生率为3.33%。
本研究建立的西藏虎头兰植株高效再生体系,为西藏虎头兰的繁殖培育工作奠定了良好基础,在野生资源保护与合理开发利用方面具有一定的参考价值。
参考文献:
China Flora Editorial Board, 1999. China of Flora [M]. Beijing:Science Press,18:201. [中国植物志编委会, 1999. 中国植物志 [M]. 北京:科学出版社,18:201.]
CHEN HM, L FB, LI Z, et al., 2015 . The tissue culture and rapid propagation of Cymbidium tracyanum L. Castler. [D]// Chinese Society for Horticultural Science. Advances in Ornamental Horticulture of China. Beijing:China Forestry Publishing House:253-255. [陈和明, 吕复兵, 李佐, 等, 2015. 西藏虎头兰组培快繁技术研究 [D]// 中国园艺学会.中国观赏园艺研究进展. 北京:中国林业出版社:253-255.]
Institute of Botany, the Chinese Academy of Sciences, 2013. List of rare and endangered plants in China [DB/OL]. http://rep.iplant.cn/protlist. [中国科学院植物研究所, 2013. 中国珍稀濒危植物名录 [DB/OL]. http://rep.iplant.cn/protlist.]
KUANG ML, ZHANG BS, 2015. Physiological response to high light in Cymbidium tracyanum and C. sinense [J]. Plantdivers Resour, 37(1):55-62. [匡美龄, 张石宝, 2015. 西藏虎头兰和墨兰对强光的生理响应 [J]. 植物分类与资源学报, 37(1):55-62.]
LAN YT, WU TG, LIU SY, et al., 2010. Study on tissue culture of wild Cymbidium tracyanum L. Castler [J]. J Fujian For Sci Technol, 37(1):77-79. [藍玉甜, 吴天贵, 刘世勇, 等, 2010. 野生西藏虎头兰组培技术研究 [J]. 福建林业科技, 37(1):77-79.]
LI HM, 2014. Advances in studies of tissue culture and rapid multiplication of Orchids [J]. Agric Res Appl, (1):53-56. [李慧敏, 2014. 兰花组培快繁研究进展 [J]. 农业研究与应用, (1):53-56.]
LI ZL, YU CX, WANG YY, et al., 2005. Research on aseptic budding and fast propagation of the Cymbidium tracyanum seed [J]. Chin Agric Bull, 21(8):269-270, 281. [李枝林, 余朝秀, 王玉英, 等, 2005. 野生沉香虎头兰种子无菌萌发及快速繁殖技术研究 [J]. 中国农学通报, 21(8):269-270, 281.]
LIU SS, CHEN J, GUO SX, 2015. Review on germination of Orchid seeds [J]. Seed, 34(6):43-49. [刘思思, 陈娟, 郭顺星, 2015. 兰科植物种子萌发的研究进展 [J]. 种子, 34(6):43-49.]
LI JW, ZHANG SB, 2016.differences in the responses of pho-tosystems I and II in Cymbidium sinense and C. tracyanum to long-term chilling stress [J]. Front Plant Sci,doi:10.3389/fpls.2015.01097.
LI JW, CHEN XD, HU XY, et al., 2018. Comparative physiological and proteomic analyses revealdifferent adaptive strategies by Cymbidium sinense and C. tracyanum todrought [J]. Planta, 247(1):69-97.
QIU Y, GONG N, ZHANG KY, 2010. Seed germination and the protocorm multiplication of Anoectochilus roxburghii [J]. Guihaia, 30(4):555-559. [邱玥, 龚宁, 张奎一, 2010. 金线兰种子萌发及其原球茎的增殖培养 [J]. 广西植物, 30(4):555-559.]
WANG LH, JIANG YL, YU JY, et al., 2009. Tissue culture and rapid propagation of Cymbidium tracyanum L. Castler. [J]. Plant Physiol Comm, 45(1):51-52. [王莲辉, 姜运力, 余金勇, 等, 2009. 西藏虎头兰的组织培养与快速繁殖 [J]. 植物生理学通讯, 45(1):51-52.]
WANG XL, 2018. Evaluation of endangered grade of wild Orchidaceae in Tibet [J]. Tibet Sci Technol, (1):65-67. [王喜龙, 2018. 西藏野生兰科植物濒危等级评价 [J]. 西藏科技, (1):65-67.]
WANG ZH, 2003.diagnosis and treatment of physiological scorch of leaf tip of orchid [J]. Flower Plant Penjing, (6):32. [王志紅, 2003. 兰叶生理性焦尖的诊治 [J]. 花木盆景, (6):32.]
WU YG, 2003.diagnosis and treatment of bacterial scorch of leaf tip of orchid [J]. Flower Plant Penjing, (6):32. [吴亚光, 2003. 兰叶细菌性焦尖的诊治 [J]. 花木盆景, (6):32.]
YAO SC, LING ZZ, LAN ZZ, et al., 2012. Study on seed germination and the protocorm multiplication of Phaius tankervillese [J]. Acta Bot Boreal-Occident Sin, 32(7):1474-1479. [姚绍嫦, 凌征柱, 蓝祖栽, 等, 2012. 鹤顶兰种子萌发及原球茎增殖培养研究 [J]. 西北植物学报, 32(7):1474-1479.]

