不同冻存条件对甘蔗原生质体活力和再生能力的影响
李素丽 宋亚妮 李志刚 刘芳君




摘 要:为了获得活力高和再生能力强的甘蔗原生质体,该文对甘蔗原生质体的冻存液浓度、冻存温度和冻存部位进行了研究。结果表明:(1)不同的冻存液、不同的冻存温度和不同的取材部位原生质体冻存后复苏对甘蔗原生质体的活力影响有显著差异性,三个冻存液组合比较,在组合2(70%培养基+20%血清+10%dMSO),冻存30d后复苏活力最强,高达72%;冻存90d内复苏,-196 ℃液氮和-80 ℃冰箱冻存,甘蔗原生质体的活力差异不显著,活力均在75%以上,但90d冻存后复苏,-196 ℃液氮冻存后复苏比-80 ℃冰箱冻存冻存后复苏原生质活力强;不同取材部位比较,幼叶冻存30d后复苏所得原生质体活力较高(达79.2%),茎尖冻存30d后复苏所得原生质体活力仅为42.7%。(2)不同的冻存液和不同的冻存温度,细胞第一次启动分裂和形成细胞团的时间差异不显著,一般培养5~6d,细胞壁基本形成完整,培养6d后,细胞启动分裂,培养15d后形成细胞团。不同的材料部位相比较,茎尖酶解所得原生质体再生能力最强,较幼叶酶解原生质体,形成细胞壁的时间早3d,第一次分裂时间早2d。
关键词:甘蔗, 原生质体,冻存, 活力, 再生
中图分类号:Q945
文献标识码:A
文章编号:1000-3142(2019)04-0427-10
Abstract:In order to obtain high vitality and regeneration ability of sugarcane protoplast, this experiment wasdone to study the protoplast of frozen storage liquid combination, frozen storage temperature, frozen storage time and recovery temperature. The results were as follows:(1)different cryopreservations,different cryopreservation temperatures anddifferent protoplast sources ofdifferent materials had significantdifferences on the vitality of the protoplast of sugarcane. Compared with the combination of three frozen liquiddeposits, in Combination 2 (70% medium +20% serum +10%dMSO), the recovery activity was the strongest after 30d, as high as 72%. Cryopreserved recovery within 90d, liquid nitrogen -80 ℃ and -196 ℃ freezer, sugarcane protoplast energydifference was not significant, and the vigor was above 75%. But after 90d of frozen-storage, the protoplastdynamic at -196 ℃ was stronger than -80 ℃ after recovery. Fordifferent materials, the protoplastdynamic of the young leaves frozen stored for 30d was up to 79.2%, and the protoplastdynamic of stem tip frozen for 30d was only 42.7%. (2) There was no significantdifference in the time between the first initiation ofdivision and the formation of cell mass in the treatments withdifferent cryopreservation liquids anddifferent cryopreservation temperatures. After the protoplasts were cultured for about 5-6d, the cell wall was basically complete, and the cells began todivide after 6d, and the cell masses formed after 15d of culture. Fordifferent materials, the strongest regeneration ability was found in the protoplasts from stem tip by enzymatic hydrolysis, which cell wall formation showed 3d earlier, and 2d earlier in the first celldivision than those from the juvenile leaves.
Key words:sugarcane, protoplast, frozen storage, vatality, regeneration
植物体细胞融合育种,是根据细胞的全能性和细胞膜的流动性原理,用酶解法去除细胞壁,先将植物不同种、属,甚至科间的原生质体通过人工方法誘导融合,然后进行离体培养,使其再生杂合体植株的技术。其打破了有性杂交不亲和性的界限,广泛地组合各种基因型,从而形成有性杂交方法所无法获得的新型杂合体植株,而且细胞融合技术避免了分离、提纯、剪切、拼接等基因操作,转移的基因基本不存在基因安全性问题,因为被转移的基因本身存在于甘蔗中,在技术和仪器设备上的要求不像基因工程那样复杂,投资少,有利于广泛开展研究和推广(李志勇,2003),加之体细胞杂交来自双亲的遗传物质并非简单的堆积,而是发生了复杂的遗传重组,这正是改良作物所期望的。植物体细胞融合育种是改造细胞遗传物质的有力手段,有着重大的实践意义。
原生质体是体细胞融合的必需材料,同时还可以用于突变体筛选和遗传转化等研究,是科学研究的理想材料。由于植物材料的获得受季节和植物生长发育阶段的影响,导致原生质体融合育种等实验也会受到以上因素的限制,实验不能随时随地进行。当前国内对原生质体的获得,大多数是及时采样并且及时酶解。这样做的缺点是:酶解耗时长;未用完的原生质体只能培养或者丢弃,效率低;材料的季节性导致有些季节实验因没有材料而搁置(庄春慧,2015)。原生质体冻存技术可以很好地解决这些问题。超低温条件能够较好保存种质资源。随着原生质体再生植株种类的不断增多,玉米、水稻、小麦等禾谷类的主要农作物的原生质体也成为种质保存的重要材料(Takeuchi et al., 1982)。冻存过程对原生质体的主要伤害是冰晶刺破的伤害,二甲基亚砜(DMSO)是一种高效的渗透性保护剂,可迅速渗透细胞,降低细胞内细胞液冰点是低温保护剂,它易于透入细胞内部,使之不至于在细胞冻融时因强烈脱水而损伤(黄玲,2011)。目前,许多实验室广泛采用dMSO作冻存保护剂,除了价格低廉、保护效果良好外,DMSO 另一特点是很容易洗脱干净(吕维敏等,2014)。但不同浓度DMSO会触发冻存细胞复苏后大量细胞凋亡,对细胞有一定的毒害作用(李中文等,2016)。如何优化植物原生质体冻存条件,降低冻存试剂的毒性作用,改善冻存效果,最大程度保留原生质体的生物学特性是体细胞融合育种顺利进行的重要环节之一。
甘蔗是我国食糖工业的重要支柱,也是能源、纤维、糖基化工和饲料的原料,作为再生能源作物,甘蔗有很大的潜力。然而蔗糖生产中存在着糖料蔗品种单一,选育的新品种不能满足甘蔗生产需求等问题,严重影响了蔗糖业健康稳定发展和竞争能力的进一步提高。因此,增强甘蔗育种的创新力度,提供更多优良的甘蔗品种已成为糖业发展,乃至经济发展急需解决的问题。由于甘蔗的生长受季节和地域性的限制,如果缺乏合适的甘蔗原生质体冻存方法,会导致甘蔗原生质体融合育种研究不在甘蔗生长季节和亚热带地区时,找不到研究材料,而在生长季节时大量的实验材料因无法得到及时利用和长期保存而被浪费,极大地限制了甘蔗体融合育种研究顺利进行。本研究针对以上问题,研究了不同的冻存液、不同的冻存温度和不同的取材部位甘蔗原生质体冻存后复苏对活力和再生能力的影响,为后期甘蔗原生质体的融合育种以及以甘蔗原生质体为受体进行遗传转化等研究提供储备材料。旨在为甘蔗原生质体的超低温保存提供科学依据,为体细胞融合育种、遗传学和转基因提供材料和技术支撑。
1 材料与方法
1.1 材料
采取黄玲(2011)所用幼叶分离原生质体的方法获得新台糖22号甘蔗原生质体。甘蔗材料来自广西大学农学院甘蔗实验基地。所用酶液组合为2%纤维素酶+0.5%果膠酶+0.1%离析酶+0.3%半纤维素酶。所用洗液为CPW(含9%甘露醇)。酶液和洗液的pH均为5.8。
1.2 方法
1.2.1 不同甘蔗材料部位及其酶解方法 选取甘蔗ROC22号伸长初期的茎尖和幼叶作为研究材料。
1.2.1.1 甘蔗幼叶的酶解方法 参考黄玲(2011)所用幼叶分离原生质体的方法,稍有改动。以健壮甘蔗尾鞘作为幼叶酶解材料,先剥去外面2~3层叶鞘,然后用75%酒精灭菌30 s,无菌水清洗3次后,再切除外层和两端叶鞘,漏出淡黄色心叶,并留下生长点以上1~5 cm嫩叶,切成厚度为1 mm左右的薄片,收集幼叶0.5 g,加入5 mL CPW(含13%甘露醇)溶液,使材料质壁分离0.5~1 h后,除去CPW(含13%甘露醇)溶液,加入5 mL组合酶液常温酶解4 h,然后分别过100目、200目细胞筛,收集原生质体悬浮液,梯度离心纯化原生质体,所得原生质体为幼叶原生质体。
1.2.1.2 甘蔗茎尖的酶解方法 参考洪翠(2000)所用甘蔗茎尖分离原生质体的方法,稍有改动。取伸长初期的甘蔗茎尖,剥去幼叶,然后用75%酒精灭菌30 s,无菌水清洗3次后,再切除外层和两端叶鞘,将包裹生长锥的几片大的幼叶剥去,仅保留生长锥附近的第3天至第6片幼叶或叶原基。将甘蔗茎尖修成1 cm×1 cm×2 cm的组织块,其中包括幼叶原基、生长锥、伸长区的初生增粗分生组织和部分成熟区,将茎尖切成1 mm左右的薄片,加入5 mL CPW(含13%甘露醇)溶液,使材料质壁分离0.5~1 h后,除去CPW(含13%甘露醇)溶液,加入5 mL组合酶液常温酶解4 h,分别过100目、200目细胞筛,收集原生质体悬浮液,梯度离心纯化原生质体,所得原生质体为茎尖原生质体。
1.2.2 不同冻存液组合设计和冻存方法 用KM8P培养基、BSA(小牛血清蛋白)以及不同浓度的DMSO(二甲基亚砜)组合成不同的冻存液,所做设计为组合1(75%培养基+20%BSA+5%DMSO)、组合2(70%培养基+20%BSA+10%DMSO)、组合3(65%培养基+20%BSA+15%DMSO)。
将酶解的原生质体用细胞计数板调密度至每mL为1×106个,设3个处理温度(4 ℃,-80 ℃,-196 ℃),每个处理3个重复。每只冻存管内放细胞悬液200 μL,分别冻存7、30、60、90d后复苏,观察原生质体的活力和培养观察再生能力。
采用缓慢冻存的方法,将装有细胞悬液的冻存管首先放入4 ℃,约40 min;之后置于-20 ℃, 30~60 min;再置于-80 ℃放置过夜;最后置于液氮罐 -196 ℃中长期保存。
1.2.3 甘蔗原生质体的复苏方法 采用快速化冻的方法,从液氮罐或-80 ℃冰箱中取出冻存管快速放入37 ℃的恒温水浴锅中不断摇晃,使其快速解冻,然后离心弃掉冻存液,CPW(含9%甘露醇)清洗三遍,加KM8P培养基培养。
1.2.4 甘蔗原生质体的活力测定 参考李玉珠(2012)的方法制备4%台盼蓝母液:称取4 g台盼蓝,加少量蒸馏水研磨,加双蒸水至100 mL,用滤纸过滤,4 ℃保存。使用时,用PBS稀释至0.4%(Widholm, 1972)。测定时,被染蓝色即为死细胞。
原生质体活力=(有活力的原生质体/数原生质体总数)×100%。
1.2.5 甘蔗原生质体细胞壁的观察 参考柳琳等(2014)的方法,将荧光增白剂VBL溶于用无离子水配制的pH5.8的9%CPW中,使成0.1%浓度,待完全溶解后,于85×g离心10 min,去沉淀杂质,用上清液(黄祥辉和颜季琼,1980)。
向原生质体悬浮液中加入等体积的 VBL染色液,温下静置染色5 min,9% CPW溶液清洗3~4次,浮于9% CPW溶液中。吸取适量染色后的悬浮液滴于载玻片上,于波长345 nm、倍数100倍的荧光显微镜下观察细胞壁的生长情况。
2 结果与分析
2.1 不同处理对原生质体活力的影响
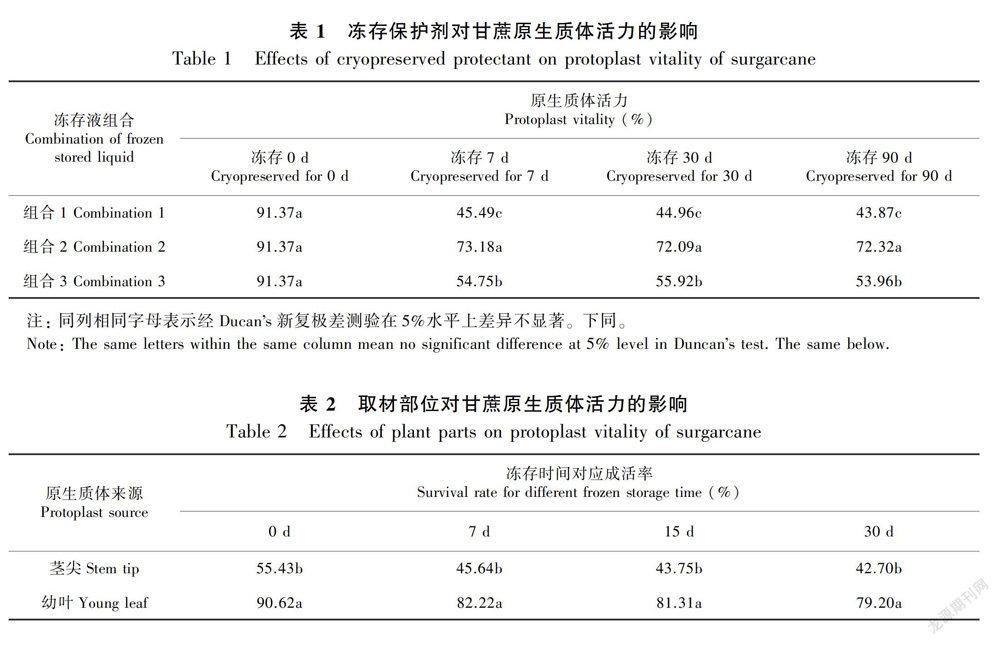
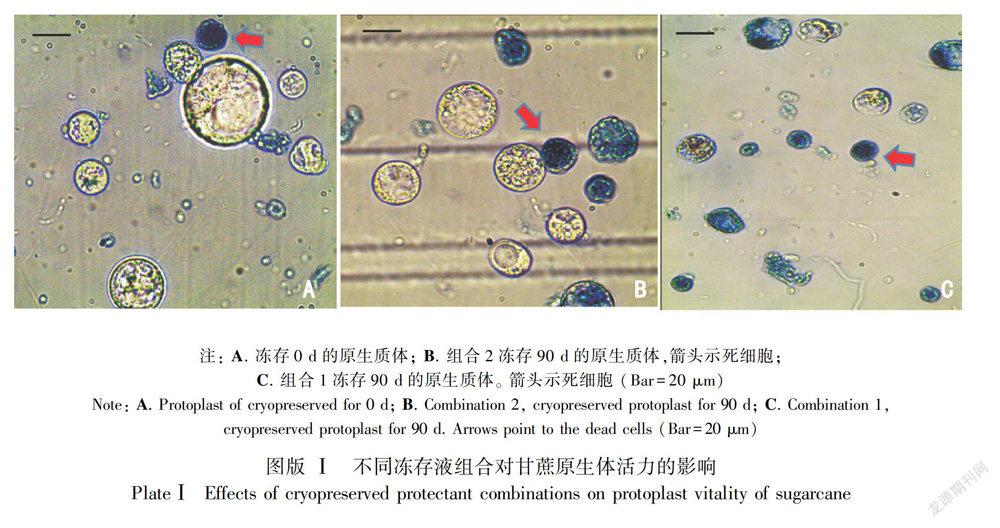
2.1.1 不同的冻存液组合对甘蔗原生体活力的影响 从表1和图版I可以看出,在用缓慢冻存的方式冻存不同时间段后,在三种冻存液组合中冻存的甘蔗原生质体和冻存前比活力都会有所降低,降低幅度总体表现为组合1 (75%培养基+20%小牛血清蛋白+5%dMSO)>组合3(65%培养基+20%小牛血清蛋白+15%dMSO)>组合2 (70%培养基+20%小牛血清蛋白+10%dMSO),不同组合之间原生质体活力差异显著。最佳的冻存液为组合2(70%培养基+20%小牛血清蛋白+10%dMSO),冻存后7d复苏,组合2原生质体活力比组合1高27.69%,比组合3高18.43%;冻存后30d复苏,组合2原生质体活力比组合1高27.13%,比组合3高16.17%;冻存后90d复苏,组合2原生质体活力比组合1高28.45%,比组合3高18.36%。
2.1.2 不同的取材部位对甘蔗原生质体活力的影响 由表2和图版Ⅱ可知,在对幼叶和茎尖酶解后,分别冻存7、15、30d后复苏,幼叶的活力均显著高于茎尖,分别比茎尖高35.91%、37.56%和36.5%。冻存7d后复苏,幼叶和茎尖活力降低10%左右,差异显著。分别冻存7、15、30d后复苏,幼叶和茎尖活力降低差异不显著。
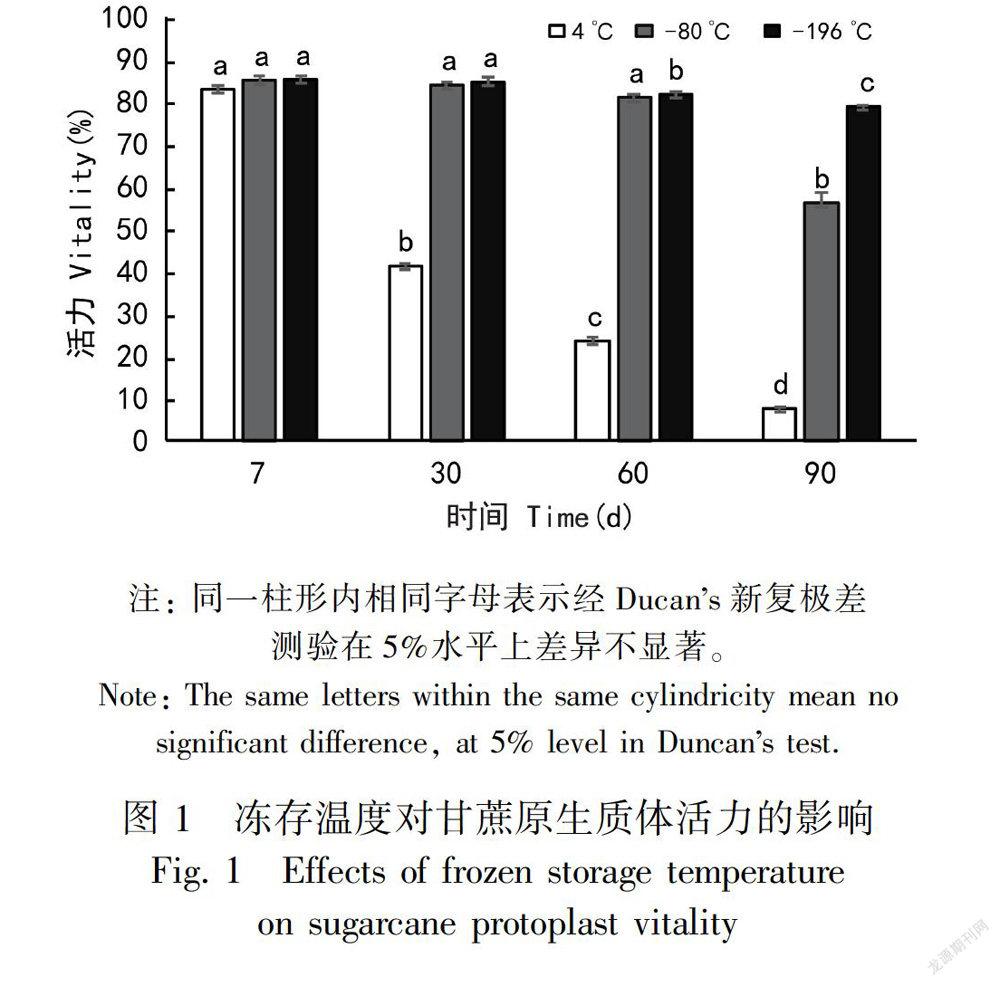
2.1.3 不同的冻存温度对甘蔗原生质体活力的影响 由图1可知,冻存7d后复苏,不同冻存温度(4、-80、-196 ℃)之间,原生质体活力差异不显著;冻存30d和60d后复苏,-80 ℃和-196 ℃中复苏的原生质体活力差异不显著,但显著高于4 ℃处理,分别高40%和60%,达到显著性差异;冻存90d后复苏, -196 ℃原生质体活力最高, 4 ℃处理最低,-196 ℃中复苏的原生质体活力较-80 ℃处理高22.81%,较4 ℃处理高71.37%,差异显著。处理时间对在液氮-196 ℃中冻存的原生质体活力影响不显著。
2.2 不同处理对甘蔗原生质体细胞壁再生的影响
2.2.1 不同冻存液组合对甘蔗原生体细胞壁形成的影响 细胞壁的形成是一个逐渐形成的过程,整个再生过程中,随着培养时间的增加,荧光强度由弱变强。冻存30d后复苏培养,不同冻存液组合对细胞壁形成的影响差异不显著,原生质体培养1d于荧光显微镜下观察,细胞周围均无蓝色荧光,说明培养1d没有形成细胞壁(图版Ⅲ:A);培养2~3d之后,在荧光显微镜下可看到由于VBL和细胞壁的纤维素结合而在细胞周围开始发出淡蓝色的荧光 (图版Ⅲ:B); 培养5~6d, 在荧光显微镜下观察到整个细胞边缘蓝色荧光均匀、强烈且明显(图版Ⅲ:C),表明细胞壁在逐渐形成,5d左右基本形成完整。
2.2.2 不同取材部位对甘蔗细胞壁再生的影响 冻存30d后复苏培养,在第3天至第4天的时候,茎尖细胞壁形成完整,而幼叶在第5天至第6天的时候才观察到细胞壁形成,茎尖细胞壁早形成幼叶。但是形成细胞壁的过程并无差异(图版IV)。
2.2.3 不同冻存温度对甘蔗原生体细胞壁形成的影响 在后期的细胞壁形成过程中,冻存于4、-80、-196 ℃的原生质体形成细胞壁的时间上无显著差异,培养1d没有形成细胞壁(图版Ⅴ:A),培养2~3d之后,在荧光显微镜下可看到细胞周围开始发出淡蓝色的荧光(图版Ⅴ:B),培养5~6d左右可以在荧光显微镜下观察整个细胞边缘蓝色荧光均匀、强烈且明显(图版Ⅴ:C)。
2.3 不同处理对甘蔗原生质体细胞分裂的影响
2.3.1 不同冻存液组合对甘蔗细胞分裂的影响 冻存90d后,复苏观察。结果表明不同的冻存液组合冻存90d后,原生质体复苏启动分裂的时间并无差别,培养0d三个组合的原生质体都未观察到细胞分裂相,原生质体呈圆球形,细胞膜边缘清晰(图版Ⅵ:A)。培养6d后,细胞分裂相增多,出现较多的第一次细胞分裂(图版Ⅵ:B)培养第15天左右,视野中出现少量细胞团,细胞排列紧密(图版Ⅵ:C)。
2.3.2不同取材部位对甘蔗原生体细胞分裂的影响 由表3和图版Ⅶ可知,茎尖比幼叶更早启动分裂,且差异显著。第一次分裂,茎尖比幼叶早2d,第二次分裂,茎尖比幼叶早3d,形成小细胞团所需时间比幼叶早5d,形成小愈伤所需时间比幼叶早10d,但分裂过程并无差异。
2.3.3 不同冻存温度对甘蔗原生质体细胞分裂的影响 不同冻存温度对第一次分裂启动时间都是7d左右,差異不显著,培养一周后可观察到原生质体第一次分裂(图版Ⅷ:A,B,C)。
3 讨论
DMSO(二甲基亚砜)是超低温保存中常用的一种高效的渗透性低温保护剂,在常温下dMSO 对细胞有轻度药害,但随着温度的降低, 药害作用也随之减小(吕维敏等,2014)。
在冻存时不同植物最适合DMSO浓度的不同,林小园(2014)发现DMSO浓度为15%时,小球藻活力最高。薛建平(2004)在地黄试管块根诱导及茎尖玻瑞化法超低温保存的研究表明DMSO浓度为5%,复苏后活力最高,达65%。本研究发现不同的冻存液组合对甘蔗原生质体活力影响差异显著,最适合甘蔗原生质体的冻存液组合是组合2(70%培养基+20% BSA+10%dMSO),在此冻存液中原生质体的活力最高。组合2优于组合1和组合3,可能原因是5%dMSO浓度过低,起不到充分保护的作用,造成细胞细胞被冰晶刺破,而15%dMSO浓度又过高,可能对细胞产生了毒害作用,造成细胞的活力下降。程斐(2009)对二桥槐的冻存液研究结果为10%dMSO+0.5 mo1·L-1蔗糖+10%(w/v)聚乙二醇,与本研究结果相近。
不同取材部位冻存后复苏细胞活性、细胞分裂和再生能力也不一样。近年来植物冻存技术的研究主要集中在茎尖(李享等,2018)、组织(洪森荣等,2018)等。陈勇(2000)对铁皮石斛原生质的冻存研究过程中,对铁皮石斛的叶、茎、愈伤组织的研究结果表明,取材以刚展开的幼嫩叶片,愈伤组织较理想。简令成等(1987)对甘蔗的愈伤组织冻存后复苏,研究表明愈伤组织恢复再生能力,长出新植株。本研究结果发现幼叶原生质体冻存后复苏较茎尖原生质体冻存后复苏获得更高活力的原生质体,但是茎尖酶解所得原生质体冻存后复苏更早进行分裂。植物茎尖细胞具有持续、周期性分裂的能力,茎尖原生质体冻存后复苏更早分裂的原因可能是茎尖细胞小,细胞壁薄,细胞核大,细胞质浓,具有很强且持续的分裂能力,导致其更早进行分裂。
不同的冻存温度复苏后对原生质体活力有一定的差异性。刘红泉(2004)在条斑紫菜的转基因研究中发现,紫菜原生质体冻存于-196 ℃液氮中活力最高,可达66.5%,且能再生成叶状体。董晋江和夏镇澳(1996)对谷子胚性细胞系的超低温冰冻保存研究发现,谷子胚性细胞冻存在-40 ℃的不如在-196 ℃的,可能的原因是-40 ℃时细胞内仍然能形成冰晶从而影响细胞的恢复生长率,而在-196 ℃下不能形成冰晶所以影响较小。本研究结果表明,如果是短时间(90d内)冻存,-80 ℃冰箱和-196 ℃液氮冻存后复苏原生质体的活力差异不显著。如果长期保存, -80 ℃冰箱冻存后复苏,原生质体活力有下降趋势。4 ℃保存30d后原生质体活力显著下降,不能用来长期存放细胞,结果与前人研究结果一致。本研究还发现冻存温度对细胞的再生能力无明显影响,原生质体可以在第5天左右形成完整的细胞壁,第7天左右可进行第一次分裂。马锋旺和李嘉瑞(1998)对杏原生质体的冻存研究中发现,冻存于-196 ℃的杏原生质体复苏后5~6d开始第一次分裂,植板率2.2%,冻存不影响其再生能力,本研究与此研究结果基本一致。
本研究成功地优化了甘蔗原生质体的冻存条件,并得出以下结论:幼叶原生质体冻存后复苏活力显著高与茎尖原生质体;冻存剂DMSO组合为(70%培养基+20%血清+10%dMSO)保护原生质体冻存90d后复苏活力高达72.3%;冻存幼叶原生质体3个月内复苏,-80 ℃和液氮-196 ℃冻存效果差异不显著,超过3个月后, -196 ℃冻存温度显著高于-80 ℃,甘蔗原生质体经超低温保存后,其再生能力并无太大变化。以上研究结果为甘蔗原生质体的超低温保存提供科学依据,为体细胞融合育种、遗传学和转基因研究提供了材料和技术支撑。
参考文献:
CHEN Y, 2000. Protoplasm of Dendrobium candidum cryopreserved by vitrification [J]. J Wenzhou Teach Coll (Nat Sci Ed), (3):40-41. [陈勇,2000. 铁皮石斛原生质体的玻璃化法超低温保存 [J]. 温州师范学院学报(自然科学版), (3):40-41.]
CHENG F, 2009. Cryopreservation of callus of Robinia idaho and in vitro plant regeneration [D]. Zhengzhou:Henan Agriculture University. [程斐, 2009. 二乔刺槐愈伤组织超低温保存及植株再生 [D]. 郑州:河南农业大学.]
DONG JJ, XIA ZA,1996. Ultra low temperature cryopreservation of embryogenie cell lines of foxtail millet(Setaria italica L.Beauv) [J]. Chin J Biotechnol, 12(4):400-403. [董晋江,夏镇澳,1996. 谷子胚性細胞系的超低温冰冻保存 [J]. 生物工程学报, 12(4):400-403.]
HONG C,2000. The study on primary factors influencing the protoplast culture and isolation in sugareane [D]. Fuzhou:Fujian Agriculture and Forestry University. [洪翠,2000. 影响甘蔗原生质体分离、培养因素的研究 [D]. 福州:福建农林大学.]
HONG SR, NING BS, YE SY, et al., 2018. Thedark culture and semi-thin section of the regenerated plants were observed after the callus [J]. J Zhejiang Agric Sci, 30(1):65-70. [洪森荣, 宁本松, 叶思雨, 等, 2018. 黄独胚性愈伤组织冻后黑暗培养及其再生植株半薄切片观察 [J]. 浙江农业学报, 30(1):65-70.]
HUANG L, 2011. The protoplast culrure and plant regeneration of head cabbage [D]. Jinhua:Zhejiang Normal University. [黄玲, 2011. 结球甘蓝原生质体培养及植株再生 [D]. 金华:浙江师范大学.]
HUANG XH, YAN JQ,1980. The application of calcofluor whiteVBL studying the regeneration of cell wall protoplast [J]. Acta Phytophysiol Sci, 6(2):207-211. [黄祥辉, 颜季琼, 1980. 应用荧光增白剂VBL研究原生质体细胞壁的再生 [J]. 植物生理学报, 6(2):207-211.]
JIAN LC, 1988. Low temperature biology and long-term preservation of plant germplasm [J]. Chin Bull Bot, (2):65-68. [簡令成, 1988. 低温生物学与植物种质的长期保存 [J]. 植物学通报, (2):65-68.]
JIAN LC, SUNdL, SUN HL, 1987. Some factors in the sugarcane callus tissue cryopreservation [J]. J Integr Plant Biol , (2):123-131. [简令成, 孙德兰, 孙龙华, 1987. 甘蔗愈伤组织超低温保存中一些因素的研究 [J]. 植物学报, (2):123-131.]
LI X, SU Q, SONG H, 2018. Preservation and regeneration of stem tip of peach leaf [J]. Jiangsu Agric Sci, 46(5):140-143. [李享, 苏晴, 宋红, 2018. 桃叶卫矛茎尖超低温保存及再生 [J]. 江苏农业科学,46(5):140-143.]
LI YZ, 2012. The study of protoplast culture and somatic cell hybridization between alfalfa and baimai [D]. Lanzhou:Gansu Agriculture University. [李玉珠, 2012. 苜蓿与百脉根原生质体培养及体细胞杂交的研究 [D]. 兰州:甘肃农业大学.]
LI ZW, WU T, FU YX, et al., 2016. Low concentration ofdMSO protects SSMC7721 cell viability after cryopreservation [J]. Chin J Histochem Cytochem, (1):70-74. [李中文, 吴涛, 付应霄, 等, 2016. 低浓度二甲基亚砜保护SSMC7721细胞冻存后活力 [J]. 中国组织化学与细胞化学杂志, 25(1):70-74.]
LI ZY, 2003. Cell engineering [M]. Beijing:Science Press:3-21. [李志勇, 2003. 细胞工程 [M]. 北京:科学出版社:3-21.]
LIN XY, 2014. Cryopreservation and mutagenesis breeding of high yield EPA marine microalgae [D]. Nanning:Guangxi University for Nationalities. [林小园, 2014. 海洋微藻的玻璃化冻存及高产EPA藻株的选育 [D]. 南宁:广西民族大学.]
LIU HQ, 2004.The transgenic study of porphyry seaweed [D]. Qingdao:Ocean University of China. [刘红全, 2004. 条斑紫菜的转基因研究 [D]. 青岛:中国海洋大学.]
LIU HQ, YU S, LIN XY, et al., 2017. Study on the vitrification of two green algae [J]. Jiangsu Agric Sci, 45(21):183-186. [刘红全, 袁莎, 林小园, 等, 2017. 2种绿藻的玻璃化冻存研究 [J]. 江苏农业科学, 45(21):183-186.]
LIU L, CHEN Y, CHEN L, et al., 2014.detection of rice protoplast cell wall stained with fluorescent whitening agent VBL [J]. Guizhou Agric Sci, 42(11):70-72. [柳琳, 陈越, 陈玲, 等, 2014. VBL增白剂细胞染色的水稻原生质体细胞壁变化检测 [J]. 贵州农业科学, 42(11):70-72.]
L WM, HUANG GM, ZENG Y,et al., 2014. The operation mechanism of cryoprotective-agent and experimental study on cryopreservation of biological material [J]. Cryo Sup,42(5):12-16. [吕维敏, 黄钢妹, 曾叶, 等, 2014. 生物材料冻存中低温保护剂的作用机理及实验研究 [J]. 低温与超导, 42(5):12-16.]
MA FW, LI JR, 1998. Cryopreservation of apricot protoplast [J]. J Hortic, (4):18-21. [马锋旺, 李嘉瑞, 1998. 杏原生质体的超低温保存 [J]. 园艺学报, (4):18-21.]
TAKEUCHI M, MATSUSHIMA H, AND SUGAWARAY, 1982. Totipotency and viability of protoplasts after long-term freeze preservation [M]. “Plant Tissue Culture”:797-798. Published by The Japanese Association For Plant Tissue Culture, Japan.
WIDHOLM JM, 1972. The use of fluoresceindiacetate and phenosafranine fordetermining viability of cultured plant cells [J]. Stain Technol, 47(4):189–194.
XUE JP, 2004. Induction of tuberous roots and eyropresevration of shoot-tips by vitriifcation in Rehmannia glutionsa in vitor [D]. Wuhan:Huazhong Agriculture University. [薛建平, 2004. 地黄试管块根诱导及茎尖玻璃化法超低温保存 [D]. 武汉:华中农业大学.]
ZHUANG CH, 2015. The preservation of germplasm resources and the establishment of seed embryo regeneration system [D]. Harbin:Northeast Forestry University. [庄春慧, 2015. 玉蝉花种质资源超低温保存和种子胚再生体系的建立 [D]. 哈尔滨:东北林业大学.]

