幽门螺杆菌感染患者的膳食营养状况分析
孙重秀 高桃 贾梦茹 刘成霞 林松 马爱国


摘 要:目的:探讨Hp感染患者的膳食营养状况及膳食模式特点,为合理膳食预防和控制幽门螺杆菌(Hp)感染提供参考。方法:采用病例对照研究,于2017年10月—2018年9月在山东某医院选取1 140名(≥18岁)完成 13 C-尿素呼气试验( 13 C-UBT)的检查者,根据 13 C-尿素呼气试验结果(DOB)和标准,将研究对象分为感染组(DOB≥4)596名和非感染组(DOB<4)544名。收集研究对象的基本信息、相关临床检查指标;采用3d连续24h膳食回顾法收集研究对象近期膳食情况,分析两组人群营养素摄入水平及供能来源。根据食物频率表收集研究对象过去约6个月内的食物种类及平均每天的食物消费水平,并累计每位研究对象1周内消费的食物种类来计算膳食多样化评分(DDS),每消费1类食物计1分,两类食物计2分,最高为9分。结果:营养状况分析显示,感染组患者营养不良率达7.9%,显著高于非感染组的2.0%(P<0.05)。膳食营养素摄入情况显示,感染组人群能量摄入水平为1 980kcal/d,显著高于非感染组的1 823kcal/d,碳水化合物摄入(287.51g/d)显著高于非感染组(253.81g/d)(P均<0.05)。膳食种类分析,感染者DDS评分为6.65分,显著低于非感染组的7.58分(P<0.05)。感染组蔬菜和水果的平均摄入量(291.39 g/d和92.46 g/d)显著低于非感染组(330.09 g/d和119.10 g/d)(P<0.05)。经偏相关分析,校正经济水平、文化水平、饮酒史3项混杂因素,Hp感染与营养状况和膳食多样化均呈负相关。结论:Hp感染患者营养不良率较高,膳食结构不合理,每周食用的食物种类较少,碳水化合物摄入量较高,而蔬菜和水果攝入量明显不足;应加强Hp感染人群的营养不良风险监测,及时有效地改善其营养状况。
关键词:幽门螺杆菌;营养状况;膳食结构
幽门螺杆菌(Hp)是由Marshall和Warren首次鉴定并命名的一种革兰氏阴性菌[1],于1994年被WHO确认为I类致癌物[2],该菌不仅与胃部疾病密切相关[3],也与身体的营养状态密切相关[4-8],由于铁是Hp的必需生长因子,Hp感染后便会和宿主形成竞争关系,影响宿主铁吸收过程[9]。另外,Hp还可通过胃酸影响维生素B12 和β-胡萝卜素的吸收和利用[10-11]。但既往的研究主要集中在某单一食物或其成分与Hp感染风险的关系,高盐、肉类、井水[12-15]等可增加Hp感染的风险,有研究认为,益生菌、乳制品、大蒜、西兰花(含花椰菜)等食物具有抗Hp感染的作用[16]。但是日常饮食是一个较为复杂的过程,是多种食物混合食用的过程,所以在该过程中,营养素可能独立作用,也可能是多种营养素之间的相互作用。故与单一食物或成分的研究相比,研究Hp感染患者的日常膳食营养状况及膳食模式与Hp感染之间的关系更有实际指导意义。该研究采用病例对照研究,分析比较Hp感染人群与非感染人群的营养状况及膳食营养素摄入水平,并通过分析两组人群的产能营养素供能情况、每周摄入的食物种类及各种食物的消费水平,了解Hp感染患者的膳食模式,为改善Hp感染者的营养状况提供科学参考,并为Hp感染患者的膳食指导提供理论基础。
1 对象与方法
1.1 研究对象
该研究为病例对照研究。2017年10月—2018年9月,在山东某医院收集 13 C-尿素呼气试验( 13 C-UBT)检查者,按照纳入和排除标准筛选研究对象:纳入标准:(1)年龄≥18岁,性别不限;(2)无消化系统器质性病变。排除标准:(1)年龄低于18岁;(2)近6个月服用抗生素;(3)存在较严重的反酸、呕吐等胃肠道症状;(4)肝脏病变、肾脏病变等器质性病变;(5)有严重的身心疾病,或正处于疾病治疗期;(6)有肠易激综合征等。签订知情同意后,共纳入研究对象1 140名,其中男性565名、女性575名。收集所有研究对象的个人基本信息、相关临床检查信息,采用3d连续24h膳食回顾法和食物频率法收集研究对象近期和过去约6个月内的食物摄入情况。根据 13 C-UBT结果(DOB)和标准,将研究对象分为感染组(DOB≥4)和非感染组(DOB<4),比较感染组与非感染组人群食物摄入种类及数量。采用方差分析、独立样本Mann-Whitney U检验、χ 2检验或者Fishers精确概率法分析研究对象营养状况及生活习惯、营养素摄入水平、膳食种类。
1.2 研究方法
1.2.113 C-尿素呼气试验( 13 C-UBT) 受试者空腹或禁食8h以上方可进行 13 C-UBT检测,操作者在2个袋子的“基本信息”处填好受试者的基本信息,取下呼气袋上端的小塞,打开吹气管并将其与袋口相接,让受试者保持正常呼吸,将气体徐徐吹入气袋内,使气袋充满;保持呼气的状态,用手握住软管或密封袋口,取下吹气管,立即将小塞塞紧气囊以防止气体泄漏,该气体为服药前的基础气体。然后,让受试者用20mL左右的温开水,口服1粒 13 C尿素片并静坐约20~25min,并按照上述气体收集的方法继续收集服药后的气体。将收集的2袋呼气样品在HG-IRIC 13 C-红外光谱仪上进行 13 CO2检测。仪器检测服药丸前后气体中 13 C原子标记的二氧化碳的丰度,计算出(服药后-服药前)丰度的差值,即超基准值(DOB,δ‰),DOB值≥4为Hp阳性,提示存在幽门螺杆菌感染;DOB值<4时,为Hp阴性。
1.2.2 问卷调查 问卷调查已取得了医院相关工作人员的配合,所有调查人员均参与培训并考核合格。调查时采用面对面交流的方式,告知患者关于本次调查的目的及意义,签署“知情同意”或加盖手印。问卷内容包括基本信息(性别、年龄、身高、体重、经济水平等)、食物摄入频率和3d连续24h膳食回顾。以家庭为单位对油脂类的摄入量进行了定量调查,其他食物均以个人为单位调查摄入频率和摄入量,设置4个频率单位(次/天、次/周、次/月、次/年)。
1.2.3 能量及供能物质的摄入水平 采用3d连续24h膳食回顾调查获得研究对象的过去3d内摄入的所有食物的种类和数量(含加餐),根据家用量具、食物模型以及食物图谱等估计食物摄入量,并在调查中尽量避免节假日等特殊时间,以减少偏倚。将调查的膳食资料输入“家庭营养师——营养学专家系统veil.1(测试版)”的“营养计算器”,计算其24h内的平均能量及各类营养素摄入水平。
1.2.4 膳食多样化评分(DDS)计算 根据“中国居民平衡膳食宝塔”将日常食物分为9大类:谷薯类、蔬菜类、蛋类、鱼虾类、畜肉类、奶类及其制品、豆类及其制品、水果类、油脂类。根据食物频率表(FFQ),累计研究对象1周内消费的食物种类计算DDS,消费1类食物计1分,两类食物计2分,最高为9分,食物消费频率及数量、饮料以及糖果等均不参与计分。
1.2.5 体质指数(BMI) 根据测量的身高和体重计算BMI值,计算公式为:BMI=体重(kg)÷身高(m) 2;采用适用于中国人群的分类标准,将BMI<18.5kg/m 2、18.5~23.9kg/m 2、24.0~27.9kg/m 2和≥28.0kg/m 2分别定义为消瘦、正常、超重和肥胖。
1.3 质量控制
所有调查人员在开始调查以前均需要参加统一的培训,并在培训结束后通过考核者方可参加调查。在培训中,根据统一标准对食物重量进行精确的量化,数据录入后按5%比例分别对调查结果和数据录入结果进行抽样复核,保证数据的准确性。调查员应根据被调查者的文化水平及时调整询问方式,提高研究对象理解配合水平。
1.4 统计分析
采用SPSS 24.0处理数据;能量、营养素及食物摄入量的集中趋势与离散趋势的统计描述采用均数±标准差(±s),对符合正态或近似正态的计量资料采用方差分析,对方差不齐的计量资料采用独立样本Mann-Whitney U检验;对各组营养状况和生活习惯等定性资料的集中趋势与离散趋势均采用n(%)形式进行统计描述,组间率的比较采用χ 2检验或者Fishers精确概率法;营养状况及膳食多样化水平与Hp感染的相关性采用偏相关分析,显著性检验水平α=0.05。
2 结果与分析
2.1 基本特征
共1 140名研究对象参与该研究,年龄在18~69岁内,平均年龄为47.01岁,其中女性575人(50.4%)、男性565人(49.6%);Hp感染组与非感染组在年龄、性别构成无统计学差异。非感染组高中及以上学历达77.8%、感染组高中及以上学历占72.4%(P< 0.05);非感染组家庭月均收入超过4 000元者占73.5%,明显低于非感染组的60.3%(P<0.05)(表1)。
2.2 营养状况及生活习惯
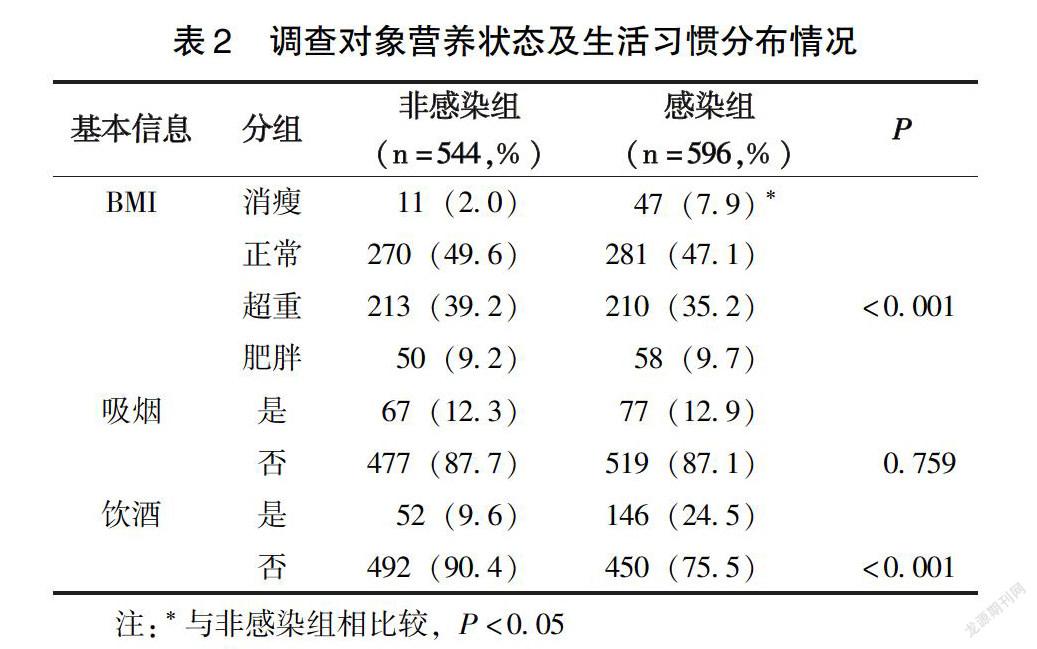
根据BMI水平判断研究对象的营养状况,结果显示,感染组BMI正常者占感染组的47.1%,明显低于非感染组的49.6%,而感染组消瘦、超重、肥胖的人群分别占7.9%、35.2%、9.7%;非感染组分别为2.0%、39.2%、9.2%;经两两比较分析,感染组的消瘦率水平高于非感染组(P<0.05),而两组间的超重率、肥胖率均无明显统计学差异。从生活习惯分析,非感染组吸烟率为12.3%,感染组为12.9%,两组间吸烟率无显著的统计学差异;感染组人群饮酒率为24.5%,明显高于非感染组的9.6%(P<0.05)(表2)。
2.3 能量及供能物质分析
由图1可见,非感染组和感染组的能量平均摄入水平为1 823、1 980kcal/d,感染组能量摄入水平显著高于非感染组(P<0.05);从三大产能营养素摄入水平看,非感染组碳水化合物摄入明显低于感染组(253.81g/d vs 287.51g/d)(P<0.05)、蛋白质摄入量稍高于感染组的摄入水平(67.53g/d vs 66.89g/d)(P>0.05)、非感染组脂肪摄入量(59.69g/d)低于感染组(62.50g/d)(P<0.05)。
2.4 膳食多样化(DDS)及食物消费水平分析
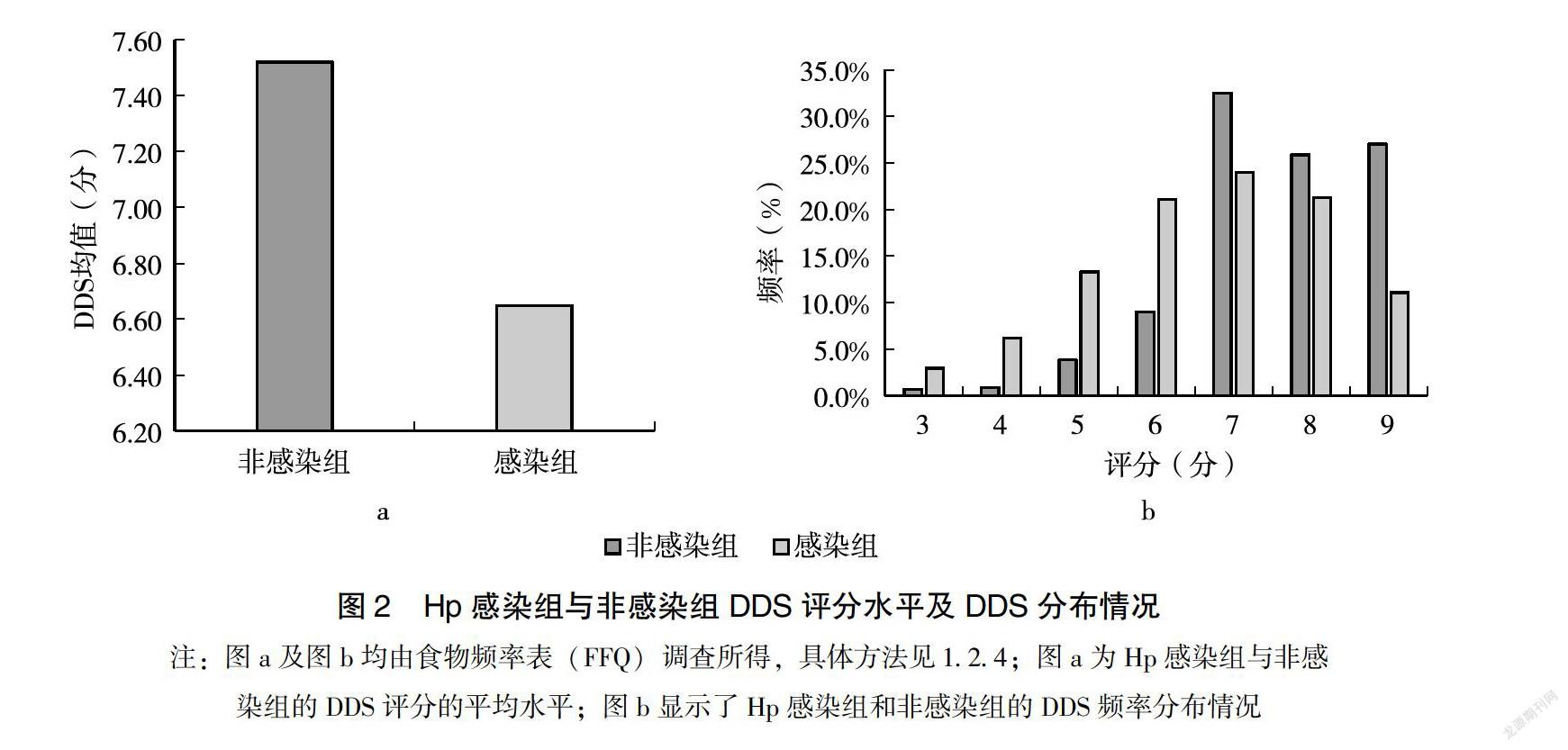
膳食多样化是指在1周以内摄入的食物种类,每摄入1类为1分,最高为9分。研究对象1周内摄入的食物种类为3~9类,Hp感染组DDS为6.65分,明显低于非感染组的7.58分(图2)。Hp感染组DDS主要集中于6~ 8分,占66.4%,其中,24.0%的人群每周摄入食物种类达7类,每周摄入8类、6类分居二、三位,分别为21.3%(127人)、21.1%(126人),感染组每周摄入食物种类达9类的仅11.1%;非感染组DDS主要集中于7~9分,32.5%的人群能每周摄入7类食物,8类的有141人(25.9%)、9类的人群为147人(27.0%),在DDS不同分值中,DDS评分为8分时,感染组与非感染组所占的比重无显著的统计学差异(P>0.05),其他各分值中两组人群所占的比重均存在显著的统计学差异(P<0.05)。
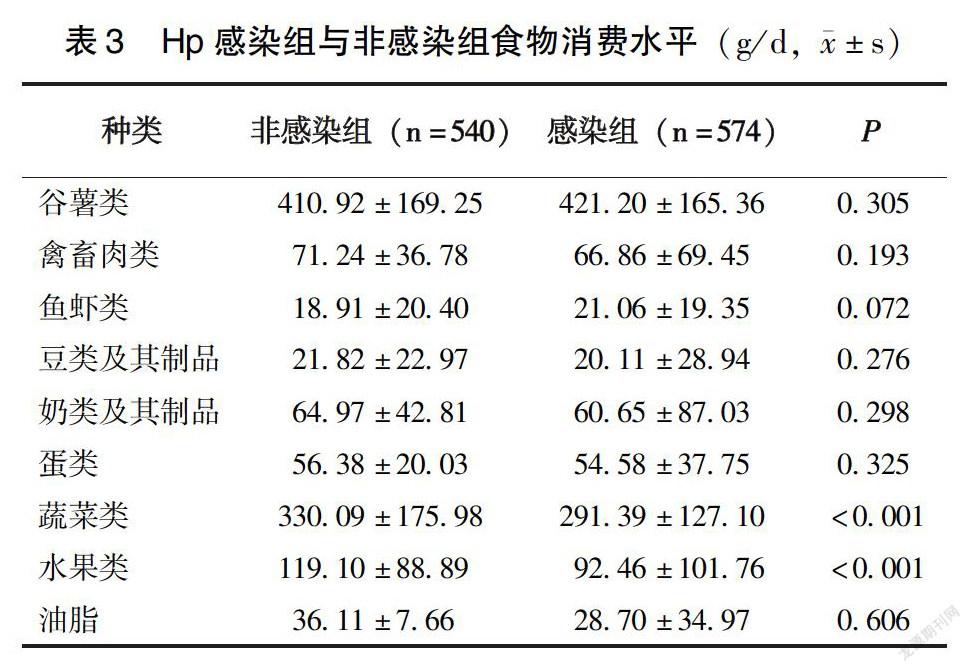
由表3可见,感染组谷薯类、蔬菜、水果的平均摄入量分别达421.20、291.39、92.46g/d,非感染组谷薯类的平均摄入量为410.92g/d(P>0.05),非感染组蔬菜平均摄入量为330.09g/d,显著高于感染组(P<0.05),水果平均摄入量为119.10g/d,显著高于感染組(P<0.05);此外,还可发现该地鱼虾类、豆类及其制品、奶类及其制品均远未达到膳食推荐量。
2.5 相关分析
经偏相关分析发现,调整经济水平、文化水平、饮酒史等3个混杂因素后,Hp感染与营养状况呈负相关(r=- 0.068,P=0.022);与膳食多样化呈负相关(r=-0.310,P=0.000)。
3 討论
该研究发现,Hp感染与非感染人群的营养状况存在差异,Hp感染人群低体重营养不良率明显高于非感染人群。从膳食营养素摄入水平看,Hp感染组的能量、碳水化合物、脂肪的摄入量均高于非感染组;从膳食种类消费情况分析,较非感染组相比,Hp感染组膳食种类单调,谷薯类摄入量均达到膳食宝塔推荐水平,且感染组摄入水平高于非感染组,同时还发现,感染组蔬菜水果摄入量明显低于非感染组;另外,两组研究对象的奶类及其制品、豆类及其制品和鱼虾类的摄入量均远远低于膳食宝塔推荐摄入量。此研究首次揭示了国内Hp感染成年患者的膳食营养状况及膳食特点。
Bertuccio[17]等研究发现,富含淀粉的饮食模式中,最高四分位数与最低四分位数的摄入量相比,Hp感染风险增加(OR=1.67;95%CI∶1.01~2.77)。Xia[3]等认为,碳水化合物与Hp感染呈正相关,与最低四分位数相比,最高四分位数Hp感染患病风险增加65%,该研究与以往研究结果一致,感染组碳水化合物和脂肪的平均摄入量均显著高于非感染组。膳食多样化指1周内摄入的食物种类,能有效地反映个体的膳食营养质量,该研究中43.6%的感染组人群每周摄入的食物种类不足7类,非感染组仅有14.5%不足7类食物,表明感染组人群膳食比较单调,种类偏少,这可能与两组人群不同的营养与健康意识造成的。研究显示,学历越低和经济水平越差的人群,知识储存及获取途径越少,对营养与健康的关注越小[18],与该研究一致。感染组人群家庭月均收入低于4 000 元的明显高于非感染组,且感染组人群中初中及以下学历的人群明显多于非感染组。
该研究显示,感染组低体重营养不良率明显高于非感染者,但Hp感染组人群的能量摄入量明显高于非感染组,碳水化合物、脂肪等的摄入水平也明显高于非感染组,这可能是两组研究对象消化吸收能力不同造成的。Hp在胃内定植会导致胃环境的变化,影响营养物质的消化与吸收,导致Hp营养物质的消化吸收能力较非感染组低,可能的途径包括:(1)Hp的代谢产物中和胃酸,胃内pH值上升,胃内酸环境受损。Hp的正常生存环境为pH 4.0~8.0内,而其在胃内低pH值的环境中能存活的主要因素就是脲酶。Hp的尿素酶将尿素水解,形成二氧化碳和氨气[19],而氨气能提高pH值,中和胃酸,从而降低食物的消化能力。(2)胃酸分泌减少。胃酸主要由壁细胞产生,Hp感染可致壁细胞减少[20],进而胃酸分泌减少。研究发现,Hp可通过ERK1/2介导的NF-кBp50亚基同源二聚体与HKα启动子结合,使得H-K-ATP酶α-亚基基因表达受到抑制[21],从而抑制胃酸分泌,导致胃部消化吸收水平降低。(3)促 炎因子。Hp感染不仅会直接损伤胃粘膜,还可引发促炎因子的分泌,如白细胞介素-8、IL-1β和肿瘤坏死因子α(TNF-α)等物质均为强抑酸剂,能引起上皮细胞损伤,进而影响胃酸分泌[22]。除此以外,感染者的饮酒率高于非感染者,而酒精能直接破坏粘膜组织的防御屏障,破坏胃粘膜的完整性,导致其更易受胃酸、消化酶、胆汁等物质的侵袭,引起粘膜组织水肿、糜烂等组织改变,酒精可以通过削弱胃粘膜保护作用,使细胞内钙超载等机制造成粘膜损伤,不仅为Hp定植创造了条件,还使胃酸分泌受到抑制,削弱胃酸对Hp的杀灭作用,形成Hp易感环境,增加Hp定植密度[23],进而加重胃粘膜损伤,形成恶性循环,导致胃粘膜功能减退。总而言之,尽管Hp感染者膳食摄入水平较高,但是由于Hp感染导致胃环境改变,胃内pH值上升,胃酸水平降低,从而导致食物在胃内的消化吸收水平降低,低体重营养不良率增加。
综上所述,Hp感染可能增加低体重营养不良发生,感染者每周摄入的食物种类较少,以多谷薯类、少蔬菜水果等饮食结构为主,整体的膳食结构不合理;应加强Hp感染患者的饮食指导,增加食物摄入种类。在后续研究中,应注重对膳食模式、营养状况及单一食物之间的综合性研究,将理论研究转化为实际应用,为Hp感染患者的膳食指导提供科学依据,在不久的未来可以做到根据Hp感染患者的营养状况,综合考虑单一食物对Hp的作用,并调整适当的膳食结构,保证膳食种类多种多样,既做到降低Hp感染风险,也保证Hp感染者的合理营养,提高Hp感染者的营养质量和生活质量。◇
参考文献
[1]Warren J R,Marshall B,Warreb J R,et al. Unidentified curved bacilli on gastric epithelium in active chronic gastritis[J].Lancet,1983,321(8336):1273-1275.
[2]Xie C,Lu N H.Clinical management of helicobacter pylori infection in China[J].Helicobacter,2015,20(1):1-10.
[3]Xia Y,Meng G,Zhang Q,et al.Dietary patterns are associated with Helicobacter pylori infection in Chinese adults:a cross-sectional study[J].Scientific Reports,2016(6):32334.
[4]Lahner E,Persechino S,Annibale B. Micronutrients(Other than iron)and Helicobacter pylori infection:a systematic review[J].Helicobacter,2012,17(1):1-15.
[5]Gravina A,Federico A,Ruocco E,et al. Helicobacter pylori infection but not small intestinal bacterial overgrowth may play a pathogenic role in rosacea[J].United European Gastroenterol J,2015,3(1):17-24.
[6]Karbasiafshar R,Khedmat H,Izadi M. Helicobacter pylori infection and atherosclerosis:a systematic review[J].Acta Medica Iranica,2015,53(2):78-88.
[7]Lin S Y,Lin C L,Liu J H,et al.Association between Helicobacter pylori infection and the subsequent risk of end-stage renal disease:a nationwide population-based cohort study[J].International Journal of Clinical Practice,2015,69(5):604-610.
[8]Nisha K J,Nandakumar K,Shenoy K T,et al. Periodontal disease and Helicobacter pylori infection:a community-based study using serology and rapid urease test[J].Journal of Investigative &; Clinical Dentistry,2016,7(1):37-45.
[9]P rezp rez G I,israel D A.Role of iron in Helicobacter pylori:its influence in outer membrane protein expression and in pathogenicity[J].European Journal of Gastroenterology & Hepatology,2000,12(12):1263-1265.
[10]Zhang Z W,Patchett S E,Perrett D,et al. Gastric alpha-tocopherol and beta-carotene concentrations in association with Helicobacter pylori infection[J].European Journal of Gastroenterology & Hepatology,2000,12(5):497-503.
[11]Annibale B,Capurso G,Delle F G.Consequences of Helicobacter pylori infection on the absorption of micronutrients[J].Digestive & Liver Disease,2002,34(9):S72-S77.
[12]Gaddy J A,Radin J N,Loh J T,et al.High dietary salt intake exacerbates Helicobacter pylori-induced gastric carcinogenesis[J].Infection and Immunity,2013,81(6):2258-2267.
[13]Mard S A,Haghighian H K,Sebghatulahi V,et al.Dietary factors in relation to Helicobacter pylori infection[J].Gastroenterology Research and Practice,2014(2014):826910.25574164.
[14]Mhaskar R S,Ricardo I,Azliyati A,et al. Assessment of risk factors of Helicobacter pylori infection and peptic ulcer disease[J].Journal of Global Infectious Diseases,2013,5(2):60-67.
[15]Amaral O,Fernandes I,Veiga N,et al.Living Co-nditions and Helicobacter pylori in Adults[J].BioMed Research International,2017,2017(5-6):9082716.
[16]Fahey J W,Stephenson K K,Wallace A J.Dietary amelioration of Helicobacter infection[J].Infection and Immunity,2015,35(6):461-473.
[17]Bertuccio P,Edefonti V,Bravi F,et al.Nutrient dietary patterns and gastric cancer risk in Italy[J].Cancer epidemiology,biomarkers & prevention :a publication of the American Association for Cancer Research,cosponsored by the American Society of Preventive Oncology,2009,18(11):2882-2886.
[18]王曄琳,甘薇,苏琴,等.结肠癌患者营养知识知晓状况及营养干预效果研究[J].护理实践与研究,2017,14(16):1-3.
[19]Ciara,Dunne,Brendan,et al.Factors that mediate colonization of the human stomach by Helicobacter pylori[J].World Journal of Gastroenterology,2014,20(19):5610-5624.
[20]Beckett A C,Piazuelo M B,Noto J M,et al. Dietary composition influences incidence of helicobacter pylori-induced iron deficiency anemia and gastric ulceration[J].Infection and Immunity,2016,84(12):3338-3349.
[21]Hammond C E,Beeson C,Suarez G,et al. Helicobacter pylori virulence factors affecting gastric proton pump expression and acid secretion[J].American Journal of Physiology Gastrointestinal & Liver Physiology,2015,309(3):G193-G201.
[22]Elomar E M.Mechanisms of increased acid secretion after eradication of Helicobacter pylori infection[J].Gut,2006,55(2):144-146.
[23]李书群,李晓勤,李巍.酒精依赖住院患者幽门螺杆菌感染的多因素研究[J].国际检验医学杂志,2016,37(10):1310-1312.
Nutritional Status and Nutrient Intake in Patients with Helicobacter pylori Infection
SUN Chong-xiu 1,GAO Tao 2,JIA Meng-ru 1,LIU Cheng-xia 2,LIN Song 1,MA Ai-guo 1
( 1 Public Health College of Qingdao University,Qingdao 266021,China; 2 Binzhou Medical University Hospital,Binzhou 256600,China)
Abstract:ObjectivePrevious studies indicated that dietary nutrition was associated with Helicobacter pylori(Hp) infection.The aim of this study was to evaluate the dietary nutritional status and dietary patterns of patients with Helicobacter pylori infection,and to provide reference for prevention and control of Hp infection via rational dietary.MethodThe case-control study was designed.Totally 1 140 subjects(≥18 years),completed the13 C-urea breath test( 13 C-UBT)from October 2017 to September 2018 in a hospital in Shandong province,were recruited.According to delta-over-baseline(DOB),a results of13 C-UBT,596 subjects were diagnosed as infected patients(DOB≥4)as infected group,and 544 subjects were not infected as non-infected group(DOB<4).The information of physical examination and related indicators of all subjects were collected,such as height,weight,smoking,drinking,and education and so on.Dietary consumption of subjects was collected via 3d 24 hours dietary recall in recent ,and nutrient intake level and energy source of the two groups were compared.Analysis dietary types weekly and food consumption levels of the two groups via the food frequency questionnaire(FFQ)over the past(about 6 months),and the dietary diversity score(DDS)of each subjects was calculated by accumulating the type of food consumed within 7 days.,consumed one type as one point,two types as two points,up to 9 points.ResultNutritional status analysis showed that low body weight malnutrition was significantly higher in infected group(7.9%)than that in non-infected group(2.0%)(P<0.05).The amount of average energy intake in Hp-infected population(1 980kcal/d)was significantly higher than that in the non-infected group(1 823kcal/d)(P<0.05),while the level of carbohydrate in the infected group(287.51 g/d)was significantly higher than that in the non-infected group(253.81g/d)(Pall<0.05).Based on nine types of food classification,dietary diversity showed that dietary diversity score(DDS)in the infected group(6.65)was significantly lower than that in the non-infected group(7.58)(P<0.05).The average intake of vegetables and fruits were 291.39 g/d and 92.46 g/d in the infected group respectively,which were significantly lower than 330.09 g/d and 119.10 g/d in the non-infected group(P<0.05).After adjusting for economic level,education and drinking three confounding factors,Hp infection was negatively correlated with nutritional status and dietary diversity.ConclusionPatients with Hp infection suffered from a high rate of low body weight malnutrition,and having unreasonable dietary structure,less food species per week,higher carbohydrate intake and lower vegetables and fruits intake.Therefore,it is necessary to strengthen the nutritional monitoringof patients with Hp infection and improve their nutritional status.
Keywords:Hp;nutritional status;dietary pattern
(責任编辑 李婷婷)

