SATB1在食管鳞状细胞癌组织中的表达及意义
李立明 张秋莹 栗四方 花光斌 李向楠


[摘要]目的 探讨AT富集序列特异性结合蛋白1(SATB1)在食管鱗状细胞癌(简称鳞癌)组织中的表达及意义。方法 选取食管鳞癌病人103例,采用免疫组化法检测鳞癌及癌旁组织中SATB1蛋白表达。培养人食管鳞癌Eca109细胞,将其随机分为siRNA-SATB1组、siRNA-对照组和空白对照组,采用实时荧光定量PCR技术检测细胞中SATB1基因表达,MTT法检测细胞增殖能力,Transwell法检测细胞迁移和侵袭能力。结果 食管鳞癌组织SATB1蛋白阳性表达率高于癌旁组织,差异有统计学意义(χ2=33.669,P<0.05);与高分化、TNM分期Ⅰ~Ⅱ期和未发生淋巴结转移组织比较,中低分化、TNM分期Ⅲ~Ⅳ期和发生淋巴结转移食管鳞癌组织SATB1蛋白阳性表达率显著升高(χ2=14.766~27.333,P<0.05)。siRNA-SATB1组细胞中SATB1 mRNA相对表达量显著低于siRNA-对照组和空白对照组(F=172.993,P<0.05);siRNA-SATB1组细胞培养24、48、72和96 h时的吸光度值均显著低于siRNA-对照组和空白对照组(F=10.286~29.154,P<0.05);siRNA-SATB1组24和48 h时划痕愈合率、侵袭细胞数均显著低于siRNA-对照组和空白对照组(F=62.696~136.852,P<0.05)。结论 食管鳞癌组织中SATB1蛋白呈高表达,且参与肿瘤恶性进展,沉默SATB1基因可减少食管鳞癌细胞增殖,抑制鳞癌细胞迁移和侵袭。
[关键词]食管肿瘤;癌,鳞状细胞;核基质相关蛋白质类;细胞增殖;肿瘤侵袭;肿瘤转移
[中图分类号]R735.1
[文献标志码]A
[文章编号] 2096-5532(2019)05-0572-05
doi:10.11712/jms201905017
[开放科学(资源服务)标识码(OSID)]
食管癌作为我国高发的恶性肿瘤,具有发病率高、转移率高、生存率低、预后差等特点,是严重威胁我国人群健康的重要肿瘤类型[1-2]。鳞状细胞癌(简称鳞癌)是我国食管癌的主要病理学类型,占食管癌的90%以上[3]。目前,食管鳞癌的具体发病机制尚没有完全的清楚。AT富集序列特异性结合蛋白1(SATB1)作为新近发现的一种基因调节因子,是在细胞或组织中特异性表达的核基质结合域DNA结合蛋白,与细胞增殖、分化、凋亡关系密切[4]。近年来研究发现,SATB1参与了多种恶性肿瘤的侵袭、转移过程[5-7]。本研究通过检测SATB1蛋白在食管鳞癌及癌旁组织中的表达情况,探讨其表达与食管鳞癌病人临床病理特征之间的关系,并利用小分子干扰RNA(siRNA)技术沉默SATB1基因,观察SATB1基因沉默后食管鳞癌Eca109细胞增殖和运动能力的变化情况。
1 资料与方法
1.1 一般资料
2015年3月—2017年4月,选择在我院择期行手术治疗的食管鳞癌病人103例作为研究对象,所有研究对象术前均未进行放化疗,术后经病理学检查明确诊断为食管鳞癌。其中,男性62例,女性41例;年龄43~74岁,平均(59.2±12.6)岁;肿瘤部位:食管上段26例,中段52例,下段25例;分化程度:中低分化77例,高分化26例;TNM分期:Ⅰ~Ⅱ期47例,Ⅲ~Ⅳ期56例;发生淋巴结转移63例。手术过程中取肿瘤组织及距离肿瘤>5 cm的癌旁组织,用甲醛固定后石蜡包埋保存。
本研究获我院伦理委员会批准,病人或近亲属对研究方案知情并签署知情同意书。
1.2 主要试剂和设备
兔抗人SATB1多克隆抗体购自美国Abcam公司,免疫组化试剂盒购自上海拜力生物科技公司,人食管鳞癌Eca109细胞系购自中国科学院上海细胞生物学研究所,RPMI-1640培养液、脂质体2000转染试剂盒、胎牛血清和总RNA提取试剂购自美国Invitrogen公司,逆转录试剂及PCR试剂购自大连宝生物公司,SATB1及内参引物由上海生工生物公司设计合成,SATB1干扰序列、对照序列均由上海吉玛制药有限公司设计合成,MTT试剂盒购自美国Sigma公司,Transwell小室购自北京乐博生物科技公司,实时荧光定量PCR仪购自美国ABI公司。
1.3 研究方法
1.3.1 鳞癌及癌旁组织中SATB1蛋白表达的检测
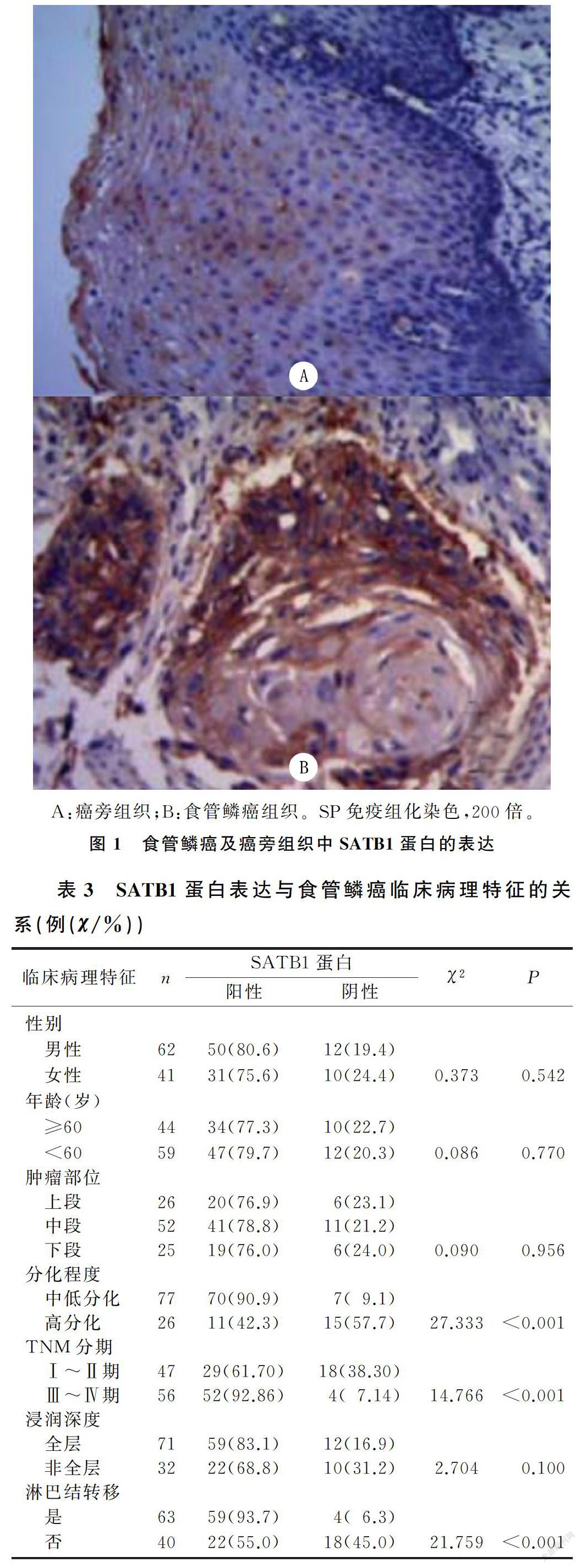
按照SP免疫组化试剂盒说明进行操作。将石蜡标本切片(约厚4 μm)脱蜡、梯度乙醇水化,加入体积分数为0.03的过氧化氢溶液,灭活内源性过氧化物酶,以微波加热进行抗原修复,使用山羊血清封闭15 min,加入兔抗人SATB1多克隆抗体(1∶800稀释),在4 ℃条件下过夜孵育,以PBS冲洗3次,加入二抗,37 ℃孵育60 min,PBS冲洗3次,DAB显色,苏木精复染,透明后封片,显微镜下观察。随机取5个高倍视野,按半定量法判定结果。按染色强度评分:0分,无着色;1分,染成淡黄色;2分,染成黄色;3分,染成棕褐色。按阳性细胞比例评分:0分,阳性细胞≤5%;1分,阳性细胞6%~25%;2分,阳性细胞26%~50%;3分,阳性细胞>50%。根据染色强度得分和阳性细胞比例得分乘积判定结果:0~1分为阴性,2~9分为阳性[8]。每张切片均由两位病理科医师采用盲法独立完成判定。
1.3.2 细胞培养及处理 Eca109细胞置于含体积分数0.10胎牛血清的RPMI-1640培养液中,在含体积分数0.05 CO2的37 ℃恒温培养箱中培养,当细胞融合度>80%时进行消化、传代。取对数生长期细胞进行分组并转染:空白对照组(A组)细胞只加入培养液;siRNA-对照组(B组)细胞转染siRNA对照序列;siRNA-SATB1组(C组)细胞利用脂质体2000转染试剂盒转染SATB1基因的干扰序列。SATB1基因的干扰序列和对照序列见表1。细胞转染后继续培养48 h。
1.3.3 实时荧光定量PCR检测细胞中SATB1基因表达 取3组转染后48 h细胞,裂解,提取总RNA,并检测总RNA纯度。按逆转录试剂盒说明书将RNA逆转录为cDNA,按PCR试剂盒说明书以cDNA为模板对引物进行扩增。引物序列见表2。PCR反应条件:95 ℃、30 s,95 ℃、30 s,53 ℃、30 s,60 ℃、30 s,连续进行40个循环。用2-△△Ct法计算细胞中SATB1基因表达量[9-10]。
1.3.4 MTT法检测细胞增殖能力 取3组细胞,消化,按每孔5×103个接种于96孔板中,继续培养。分别于培养12、24、48、72和96 h时,将MTT液20 μL加入各孔,孵育4 h,弃去上清,将二甲基亚砜150 μL加入各孔,振荡反应15 min,于酶标仪上检测490 nm波长处各孔吸光度(A)值[11-12]。
1.3.5 划痕实验检测细胞迁移能力 取各组细胞,消化,离心,用无血清培养液重悬细胞,按每孔105个接种于6孔板中,待细胞贴壁融合度达90%以上时,用200 μL的移液器枪头划痕,以PBS冲洗3次,去除漂浮的细胞,加入无血清培养液继续培养,分别于培养0、24和48 h时,用显微镜观察并测量划痕宽度,计算划痕愈合率。劃痕愈合率(%)=(0 h划痕宽度-24或48 h划痕宽度)/0 h划痕宽度×100%。
1.3.6 Transwell法检测细胞侵袭能力 用无血清培养液按1∶10稀释Matrigel胶,平铺于上室,风干备用。取各组转染后培养48 h细胞,用无血清培养液培养12 h,消化,用无血清培养液按109/L重悬细胞。取细胞悬液200 μL加入上室,下室则加入含体积分数0.10胎牛血清的培养液500 μL,恒温培养12 h,乙醇固定10 min,结晶紫染色,将小室内散落的细胞用棉签拭去,镜下随机取10个视野观察穿膜细胞数[13-14]。
1.4 统计学分析
使用SPSS 21.0软件进行统计学分析。计量资料以[AKx-D]±s表示,多组间比较采用单因素方差分析和LSD-t检验;计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 食管鳞癌及癌旁组织中SATB1蛋白表达
SATB1蛋白主要表达于食管鳞癌细胞核和细胞质中,以细胞质中为主,见图1。SATB1蛋白在食管鳞癌组织中的阳性表达率为78.6%,显著高于癌旁组织的38.8%(χ2=33.669,P<0.05)。
2.2 SATB1蛋白表达与食管鳞癌临床病理特征的关系
不同性别、年龄、部位和浸润深度的食管鳞癌组织SATB1蛋白表达差异无显著性(P>0.05);与高分化、TNM分期Ⅰ~Ⅱ期和未发生淋巴结转移组织比较,中低分化、TNM分期Ⅲ~Ⅳ期和发生淋巴结转移的食管鳞癌组织SATB1蛋白阳性表达率显著升高(χ2=14.766~27.333,P<0.05)。见表3。
2.3 各组细胞SATB1基因表达比较
SATB1 mRNA在siRNA-SATB1组、siRNA-对照组和空白对照组细胞中的相对表达量分别为1.15±0.16、9.25±1.01和9.66±1.17(n=6),差异有统计学意义(F=172.993,P<0.01)。两两比较,siRNA-SATB1组细胞SATB1 mRNA相对表达量低于siRNA-对照组和空白对照组,差异有统计学意义(t=10.915、11.117,P<0.05)。
2.4 各组细胞增殖能力比较
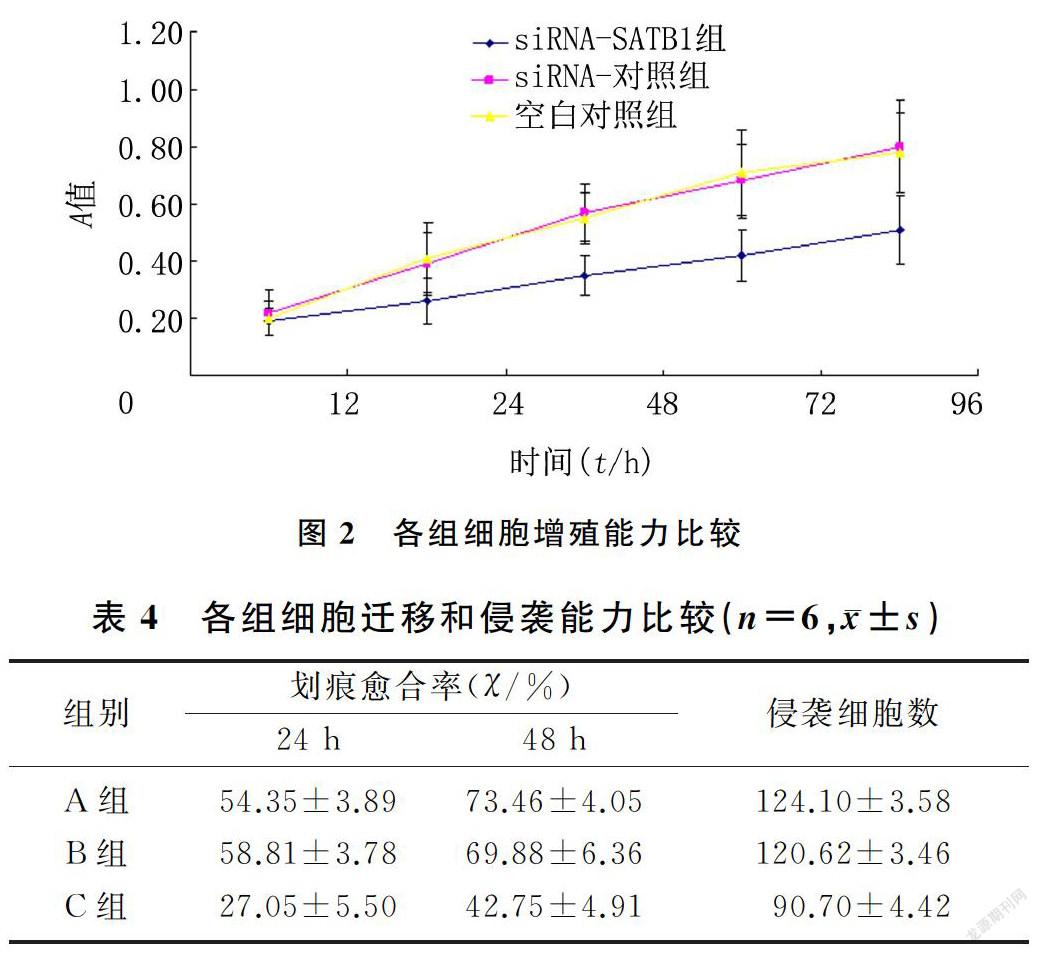
与siRNA-对照组和空白对照组比较,siRNA-SATB1组细胞培养24、48、72和96 h时的A值均有显著降低(F=10.286~29.154,P<0.05),提示siRNA-SATB1组细胞增殖能力被抑制。见图2。
2.5 各组细胞迁移和侵袭能力比较
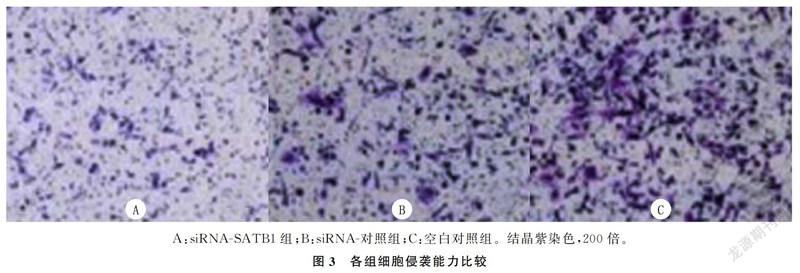
siRNA-SATB1组24和48 h时划痕愈合率、侵袭细胞数均显著低于siRNA-对照组和空白对照组,差异有显著意义(F=62.696~136.852,P<0.05)。见表4、图3。
3 讨论
食管癌是临床常见的恶性肿瘤,不易早期诊断,加之肿瘤转移能力强,病人临床确诊时多数已处于中晚期,错失最佳治疗时机[15-16]。尽管近年来食管癌的临床诊疗手段不断提高,但病人5年生存率依然较低,不足30%[17]。因此,近年来食管癌研究重点集中在发现影响肿瘤侵袭、转移及复发的相关基因或分子机制,以期为食管癌治疗干预提供靶标。SATB1基因位于人染色体3p23区,与核基质结合区结合后,在调控基因转录、翻译中发挥重要的作用[18]。有研究表明,SATB1基因在多种恶性肿瘤组织中呈高表达,可作为一种基因调节因子参与肿瘤发生、进展、侵袭及转移过程[19]。有研究指出,SATB1可以通过调控影响肿瘤发生、进展的多个基因靶位,如Bcl-2、C-myc、基质金属蛋白酶(MMP)等,而改变肿瘤细胞侵袭性,从而加速肿瘤侵袭、转移[20]。本研究结果显示,食管鳞癌组织SATB1蛋白阳性表达率较癌旁组织高,表明SATB1蛋白可能发挥癌基因的作用而参与了食管鳞癌的发生。
本研究结果还显示,SATB1蛋白在中低分化、TNM分期Ⅲ~Ⅳ期和发生淋巴结转移组织中的阳性表达率明显升高,表明SATB1蛋白高表达与食管鳞癌恶性程度及转移有关,提示SATB1高表达可能增强了食管鳞癌的侵袭、转移能力。为进一步探讨SATB1对食管鳞癌Eca109细胞系的影响,本研究将SATB1基因特异性沉默,观察SATB1基因沉默后食管鳞癌Eca109细胞增殖和运动能力的变化情况。结果显示,siRNA-SATB1组的SATB1 mRNA相对表达量较其他各组均有明显的降低,提示siRNA-SATB1组细胞SATB1基因表达被成功抑制。siRNA-SATB1组细胞培养24、48、72和96 h时的A值均较siRNA-对照组和空白对照组显著降低,提示抑制SATB1基因表达后,siRNA-SATB1组细胞增殖能力被显著抑制[21]。
本文研究结果还显示,siRNA-SATB1组迁移细胞数和侵袭细胞数较siRNA-对照组和空白对照组均明显降低,说明沉默SATB1基因表达后,细胞迁移和侵袭能力明显降低[22],提示SATB1基因可能与食管鳞癌细胞迁移及侵袭过程关系密切。
综上所述,食管鳞癌组织中SATB1蛋白呈高表达,且参与肿瘤恶性进展,沉默SATB1基因可减少食管鳞癌细胞增殖,抑制鳞癌细胞迁移和侵袭,有望为食管鳞癌机制研究及基因治疗提供新的靶位。
[参考文献]
[1]曹广文. 我国恶性肿瘤防治研究和实践需要技术、管理和观念的创新[J]. 中华流行病学杂志, 2017,38(1):3-12.
[2]殷英,杨林. 放疗联合靶向药物治疗食管癌的研究进展[J]. 安徽医药, 2016,20(7):1225-1229.
[3]LIANG He, FAN Jinhu, QIAO Youlin. Epidemiology, etiology, and prevention of esophageal squamous cell carcinoma in China[J]. Cancer Biology & Medicine, 2017,14(1):33-41.
[4]张瑜,陈秀玮. 核基质结合蛋白SATB1在肿瘤侵袭转移中的研究进展[J]. 实用医学杂志, 2014,30(19):3189-3192.
[5]WU Dongmei, ZENG Liangtao, LIU Fanrong, et al. Special AT-rich DNA-binding protein-1 expression is associated with liver cancer metastasis[J]. Oncology Letters, 2016,12(6,A):4377-4384.
[6]WANG Shuxiang, WANG Le, ZHANG Yu, et al. Special AT-rich sequence-binding protein 1:a novel biomarker predicting cervical squamous cell carcinoma prognosis and lymph node metastasis[J]. Japanese Journal of Clinical Oncology, 2015,45(9):812-818.
[7]MENG W J, PATHAK S, DING Z Y, et al. Special AT-rich sequence binding protein 1 expression correlates with response to preoperative radiotherapy and clinical outcome in rectal cancer[J]. Cancer Biology & Therapy, 2015,16(12):1738-1745.
[8]吴剑,戴天阳,张敏,等. MACC1在人食管鳞癌中的表达及对侵袭的影响[J]. 第三军医大学学报, 2014,36(21):2196-2200.
[9]李大刚,李辉宗,康乐. Vav3在小细胞肺癌组织中的表达及对细胞迁移和侵袭能力的影响[J]. 中国现代医学杂志, 2018,28(24):32-37.
[10]朱倩,桂芬芳,罗子华,等. 胃癌组织LncRNA-MALAT1表达与癌细胞增殖和侵袭潜能相关性[J]. 中华肿瘤防治杂志, 2018,25(11):767-772.
[11]徐晓芳,贾晓威,梁立中. miR-30d在舌鳞状细胞癌组织中表达及反义miR-30d对细胞增殖、侵袭能力的影响[J]. 口腔医学研究, 2017,33(12):1262-1265.
[12]岳斌,岳佳胜,苏忠,等. X染色体耦联锌指蛋白在胰腺癌中的表达及其机制研究[J]. 广东医学, 2018,39(13):1966-1970.
[13]李国彬,张占成,王新颜. 上调miR-200b对人喉癌Hep-2细胞增殖、迁移和侵袭能力的影响[J]. 山东大学耳鼻喉眼学报, 2018,32(4):53-57.
[14]余俊,劉彤鸥,李晓兰. 小分子干扰RNA沉默黏着斑激酶基因对人宫颈癌Hela细胞生物学特征的影响[J]. 新乡医学院学报, 2018,35(4):266-271.
[15]詹文明,陈芳洁,贾勇士,等. 营养风险筛查工具(NRS-2002)对不可手术的食管鳞癌患者同步放化疗疗效和不良反应的相关性分析[J]. 中华放射肿瘤学杂志, 2018,27(8):734-739.
[16]许涛,景红霞,曹风军,等. 调强放疗联合替吉奥同步治疗非手术老年食管癌的临床疗效[J]. 中国老年学杂志, 2018,38(5):1090-1093.
[17]SOHDA M, KUWANO H. Current status and future prospects for esophageal cancer treatment[J]. Annals of Thoracic and Cardiovascular Surgery, 2017,23(1):1-11.
[18]KITAGAWA Y, OHKURA N, KIDANI Y, et al. Guidance of regulatory T cell development by Satb1-dependent super-enhancer establishment[J]. Nature Immunology, 2017,18(2):173-183.
[19]ZHENG Minying, XING Wancai, LIU Yabing, et al. Tetramerization of SATB1 is essential for regulating of gene expression[J]. Molecular and Cellular Biochemistry, 2017,430(1/2):171-178.
[20]WU Qiang, WU Gang, LI Jingxiang, et al. Effect of hypoxia on expression of placental trophoblast cells SATB1 and β-catenin and its correlation with the pathogenesis of preeclampsia[J]. Asian Pacific Journal of Tropical Medicine, 2016,9(6):548-552.
[21]HUANG Bo, XIONG Fei, WANG Siwang, et al. Effect of SATB1 silencing on the proliferation, invasion and apoptosis of TE-1 esophageal cancer cells[J]. Oncology Letters, 2017,13(5):2915-2920.
[22]闫大勇,王伟. 富集AT序列的特异性结合蛋白1通过激活核糖核苷酸还原酶小亚基M2促进非霍奇金淋巴瘤的恶性进展[J]. 中南大学学报(医学版), 2016,41(11):1155-1162.
(本文编辑 马伟平)

