天津厚蟹与褶痕相手蟹对杭州湾北岸典型盐沼植物的摄食偏好
骆蓓菁 李翔 罗鼎晖 徐平 陈雪初 由文辉



摘要:在奉贤潮滩样地调查的基础上,通过开展室内喂食实验分析了天津厚蟹(llelice tientsi-nensis)与褶痕相手蟹(Sesa'rma plicata)两种优势蟹类对典型盐沼植物互花米草(Spartinaalterniflora)和芦苇(Phragmites australis)的摄食偏好性及相关影响因子,为进一步揭示蟹类摄食作用下互花米草和芦苇竞争生长的控制机制提供参考.结果显示:两种蟹对不同植株部位的偏好性均为叶片>细根>茎秆:但对不同植物的偏好有所差异,天津厚蟹偏好摄食芦苇叶片,而褶痕相手蟹更偏好互花米草叶片;对茎秆和细根的摄食量均是互花米草>芦苇.蟹类的摄食偏好除了受蟹重和种类的影响,还与植物中的粗蛋白质含量成正相关.
关键词:天津厚蟹;褶痕相手蟹;互花米草; 芦苇;摄食偏好
中图分类号:Q958.1
文献标志码:A
DOI: 10.3969/j.issn.1000-5641.2019.06.012
收稿日期:2018-11-02
基金项目:国家重点研发项目(2017YFC0506002)
第一作者:骆蓓菁,女,硕士研究生,研究方向为湿地生态学.E-mail: miss_lbj@163.com.
通信作者:由文辉,男,教授,博士生导师,研究方向为城市生态学、水域生态学.
E-mail: whyou@admin.ecnu.edu.cn.
0 引言
蟹类作为盐沼湿地中最典型的大型底栖动物,被誉为“生态系统工程师”,是湿地生态系统最重要的初级消费者之一,通常是植食性为主的杂食性动物,其对植物叶片、繁殖体及幼苗的大量摄食,会对盐沼植物群落的结构产生深刻的影响[1-2].传统生态学理论认为,植物群落的构建及生产力的维持仅受诸如盐度、水分、养分等上行因子的调控[3-4],但诸如捕食和植食等下行调控因子亦是植物群落构建过程中不可忽视的重要驱动力[5-7].研究表明,植食性动物摄食偏好的差异导致不同植物所受到的摄食压力不同,进而可以影响甚至改变植物种间关系[8-9].杭州湾北岸是我国典型的侵蚀岸段,奉贤、金山一线海堤外侧潮滩往往存在互花米草和芦苇交错生长的情况,在此条件下蟹类摄食作用对于植物种群增长和种间竞争是否存在控制作用值得深入研究.
目前,国内外对于盐沼蟹类的植食性研究主要采用胃含物解剖法和喂食法.现有天津厚蟹和无齿螳臂相手蟹(Chiromantes dehaani)的胃含物解剖实验结果证实,在蟹类所食的植物性材料中,植物叶片是蟹类摄食最多的部分,占总蟹类植物性材料总摄食量的98.75%,其次是盐沼植物的根茎部分[10].天津厚蟹的胃含物分析发现,其含有植物、动物残体、沙粒和碎屑.其中,植物组分所占比例最大,占到的46.4%,动物残体含量为14.1%[11].可见,植物是天津厚蟹和无齿螳臂相手蟹食物来源中最重要的部分.盛强的蟹类摄食偏好性实验发现,蟹类更喜食用莎草科植物,无齿螳臂相手蟹对莎草科植物的平均摄食量是芦苇的3倍;天津厚蟹对莎草科植物的平均摄食量是芦苇的2倍[12].王金庆在无齿螳臂相手蟹摄食性偏好研究中发现其摄食互花米草的量要高于摄食芦苇的量;新鲜植物的损失也显著高于枯萎的植物[13].本文在现有的研究基础上,通过喂食不同植株的不同部位,分析天津厚蟹与褶痕相手蟹在食物选择上的摄食偏好性,为探讨大型底栖动物蟹类如何在盐沼湿地中通过下行效应对植物竞争性生长起到控制作用提供参考依据.
1 研究区域与方法
1.1 研究区域概况
本研究区域位于我国典型的侵蚀岸段杭州湾北岸奉贤潮滩(见图1),该区域处湿润的亚热带季风气候区,受冷暖空气交替影响,四季分明.潮位受潮汐影响,属于非正规的浅海半日潮型,一天之内有二高二低潮汐现象,月之中有大、小潮的变化,大潮潮高可达4.66~5.17 m(数据参考自中国海事服务网).奉贤潮滩位于海堤外侧,植被呈条带状分布,植被带宽度约为20,-30 m,优势种为互花米草和芦苇,其中互花米草主要分布于潮滩中下部,面积占80%以上;芦苇呈斑块状分布于潮滩中上部,两种植物在潮滩中部交错生长.天津厚蟹与褶痕相手蟹是奉贤潮滩盐沼湿地的优势蟹类.
1.2 样地布设及样品采集
本实验的样地布设与样品采集于2018年6月进行.在样地中分别设置了单一互花米草群落、单一芦苇群落、芦苇互花米草交错带以及裸地这4種研究区域.并根据高程差异,分别在每种研究区域高潮带,中潮带以及低潮带布设了21个样方.利用诱捕法收集每个样方内的天津厚蟹和褶痕相手蟹,并放于饲养盒中带回实验室,采集芦苇与互花米草的地上植株部分以及地下根茎带回实验室用于室内喂食实验.
1.3 室内喂食实验
在实验室中进行天津厚蟹和褶痕相手蟹的喂食实验,实验在室温26~28℃C,自然光照周期(大约12 h)的条件下开展.选取30只不同体型大小(5—15g),性比1:1,附肢完好健全的天津厚蟹和褶痕相手蟹放入小号(19 cm×12.5 cm×7.5 cm)的饲养盒中.为保持实验系统湿润,在每个饲养盒中加入2 cm深从奉贤潮滩取回的海水,水体溶解氧6.45—8.13 mg /L.待其适应48 h后,投喂定量的互花米草和芦苇根茎叶.为保证投喂量足够蟹类摄食,根据预实验的结果在每个饲养盒中投喂质量为(0.85±0.50)g的叶片、长度为(3.00±0.10) cm的茎秆以及质量为(0.45±0.50)g的细根.待24 h后,取出剩余的植物,在60 ℃的烘箱内放置ld烘干至恒重.通过无蟹对照情况下植物理论干重鲜重比的参照值,来计算蟹类的摄食量及摄食率.
1.4 蟹类摄食量影响因子分析
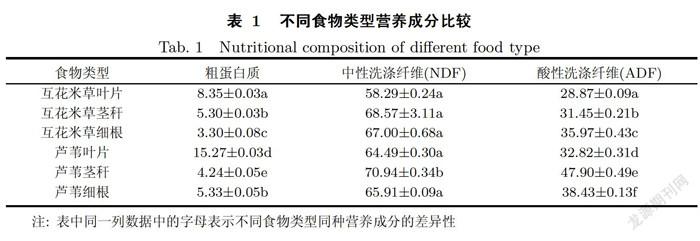
为了确定蟹类摄食偏好与蟹类自身特征以及植物营养成分是否存在相关性,本实验对所有实验所用蟹均进行了形态指标测定.并采用了GB/T 6432-1994、GB/T 208062006和NY/T 14592007分析法分析了互花米草和芦苇不同部位的营养成分,包括粗蛋白质含量、酸性洗涤纤维(ADF)含量以及中性洗涤纤维(NDF)含量.
1.5 计算与数据处理
摄食量(g)=理论干鲜重比×鲜重剩余干重;摄食率(%)=摄食量/理论干重×1OO%
所有实验数据采用统计软件(IBM SPSS Statistics 23)进行数据处理,对数据先进行方差齐性检验,采用单因素方差分析(one-way ANOVA)对不同生境类型的蟹洞密度,以及蟹类多度进行显著性分析,再用最小显著差法(LSD)进行多重比较.对两种蟹类摄食量和摄食率进行显著性分析,当数据不符合正态分布时,采用非参数统计方法Kruskal-Wallis进行检验以及非参数多重比较.不同植物类型的营养成分与摄食量相关性分析使用Pearson相关分析.运用R软件(R i386 3.5.1)中的“vegan”程序包对蟹类自身特征对摄食量的影响进行RDA分析.
2 结果与分析
2.1 不同生境蟹洞分布及蟹类多度
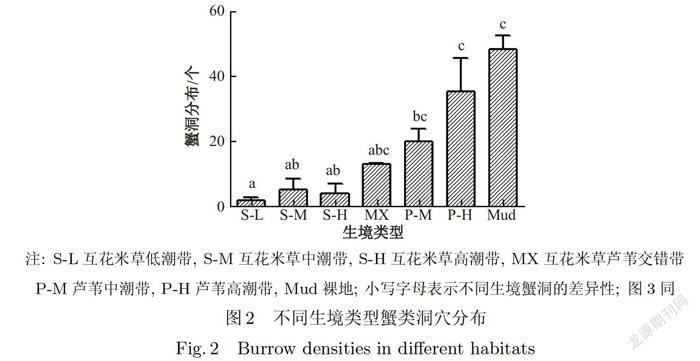
在不同种生境中,蟹洞数量存在较大差异.各生境蟹洞数量如图2所示.裸地生境内蟹洞的分布密度最高,平均蟹洞密度为(48±4.33)个/1112;在有植被覆盖的互花米草、芦苇和互芦交错带3种生境中芦苇群落的蟹洞密度较高,芦苇高潮带蟹洞密度为(35±10.20)个/m2,芦苇中潮带蟹洞密度为(20±4.16)个/m2;其次是互花米草与芦苇交错带,平均蟹洞密度为(13±0.33)个/m2.而互花米草群落蟹洞密度较低,其中互花米草低潮带洞穴密度最低仅为(2±1.00)个/m2.从高程角度分析可得,潮间带蟹洞的分布由低潮带至高潮带呈上升趋势,这可能是受到每日潮汐冲刷的影响.如图2所示,生境类型对蟹洞分布存在极显著影响(P<0.01),但不同生境之间两两对比存在差异.
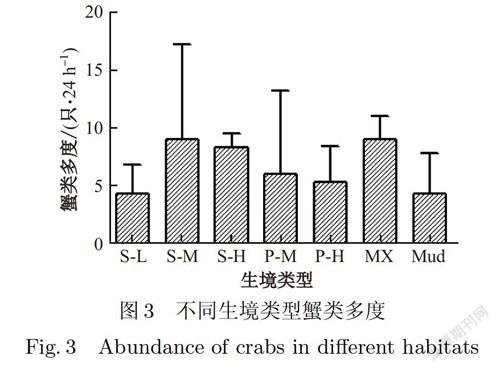
蟹类多度如图3所示,虽然不同生境下蟹类多度总体不存在显著差异,但两两之间比较仍存在差异.蟹类捕获数最多的是生境是互花米草中潮带,平均捕获量为(9±4.73)只/24 h,其次是互花米草芦苇交错带,平均捕获量为(9±1.16)只/24 h.而蟹洞分布最多的裸地捕获量却较少,为(4±2.03)只/24 h.
调查期间共捕获157只螃蟹,带回实验室鉴定.鉴定结果主要由3种蟹类组成,分别为天津厚蟹、褶痕相手蟹和無齿螳臂相手蟹.不同调查区域蟹类调查结果显示,夏季植被区与裸地的优势蟹类均为褶痕相手蟹,捕获量最大,占总捕获数的86.62%.其次是天津厚蟹,占总捕获数的9.55%;而无齿螳臂相手蟹仅发现少量,只占3.82%.
2.2 天津厚蟹与褶痕相手蟹的摄食偏好
如图4所示,天津厚蟹对每种食物类型均有摄食,对两种典型盐沼植物不同部位的摄食量大小为叶片>茎秆>细根.其对互花米草叶片的摄食量与互花米草细根的摄食量存在极显著差异(P<0.01),与互花米草茎秆的摄食量差异不显著;对芦苇叶片的摄食量与芦苇茎秆和芦苇细根的摄食量都存在极显著差异(P<0.01);对互花米草和芦苇叶片、茎秆与细根之间的摄食量差异不显著.图4反映出天津厚蟹对两种植物叶片的摄食量要明显高于根茎的摄食量,对芦苇叶片的摄食量最高,为0.15 g/24 h,占所投喂总食物量的41.91%,对互花米草细根的摄食量最低,仅占总摄食量的3.78%.
从摄食量所占每种食物类型总投喂量的百分比分析,可以更直观地反应两种蟹类的摄食偏好程度.如图4所示,当3种食物类型同时可取的情况下,天津厚蟹对两种植物新鲜叶片的摄食率最高,分别达到46.70%与76.80%;其次是对两种植物细根的摄食率分别为27.75%与21.25%,茎秆的摄食率最低仅为4.29%与7.53%;对互花米草叶片的摄食率与互花米草茎秆存在极显著差异(P<0.01),与互花米草细根存在显著差异(P<0.05);对芦苇叶片的摄食率与芦苇茎秆存在极显著差异(P<0.01),与芦苇细根差异不显著;对芦苇茎秆的摄食率与芦苇细根的摄食率差异不显著;对互花米草叶片的摄食率与芦苇叶片的摄食率存在显著差异(P<0.05).
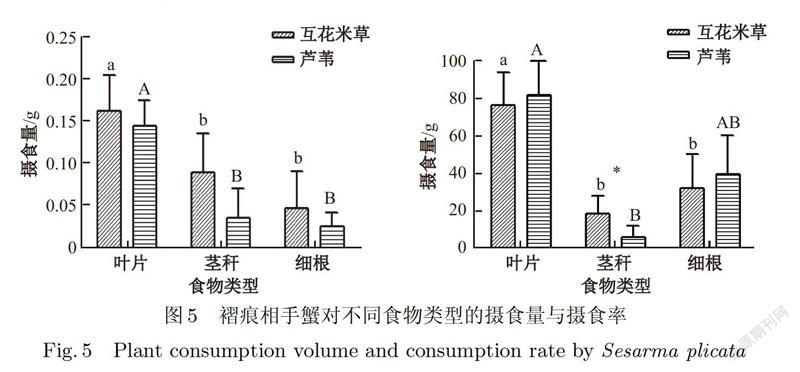
褶痕相手蟹对每种食物类型的摄食量均比天津厚蟹高.总体而言,对互花米草的摄食量要大于芦苇.对两种典型盐沼植被不同部位的摄食量大小同样为叶片>茎秆>细根.其对互花米草叶片的摄食量与互花米草茎秆、细根的摄食量都存在极显著差异(P<0.01);对互花米草茎秆与互花米草细根的摄食量差异不显著;对芦苇叶片的摄食量与芦苇茎秆、细根都存在极显著差异(P <0.01);对芦苇茎秆与芦苇细根的摄食量差异不显著;对互花米草茎秆与对芦苇茎秆的摄食量存在显著差异(P<0.05).图5中可以反映出褶痕相手蟹对两种植物叶片的摄食量要明显高于根茎的摄食量,且对互花米草叶片的摄食量最高,为0.16 g/24 h,占所投喂总食物量的31.91%,对芦苇细根的摄食量最低,仅占总摄食量的5.29%.
从褶痕相手蟹对所投食物的摄食率分析结果可以看出,褶痕相手蟹对两种植物新鲜叶片与细根的摄食率要明显高于植物的茎秆.其中对芦苇叶片的摄食率高达81.61%,互花米草叶片其次为75.86%;而对互花米草与芦苇茎秆的摄食率较低,仅为6.26%和5.64%.褶痕相手蟹对互花米草叶片的摄食率与互花米草茎秆、细根都存在极显著差异(P<0.01);对芦苇叶片的摄食率与芦苇茎秆存在极显著差异(P<0.01),与芦苇细根差异不显著;对芦苇茎秆的摄食率与芦苇细根的摄食率差异不显著;对互花米草茎秆的摄食率与芦苇茎秆的摄食率存在显著差异(P<0.05). 2.3 蟹类摄食量影响因子分析
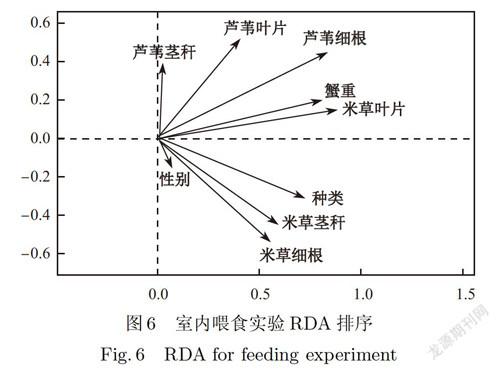
室内喂食实验选取蟹种类、蟹重和性别这3个指标解释蟹类自身特征对摄食量的影响.经DCA去趋势对应分析显示,排序轴最大梯度长度为0.55,表明性状沿排序轴趋于线性分布,因此选用RDA线性模型进行分析.如图6所示,蟹类对不同植物的摄食量受蟹重影响最大,蟹种类对互花米草摄食的影响较芦苇更大,而影响因子性别所占比较低,说明其对植物的摄食影响不大.
植物能给蟹类提供生长所需的不同营养成分,不同类型植物的营养成分均有所差异(见表1).从粗蛋白质含量来看,芦苇叶片>互花米草叶片>芦苇细根>互花米草茎秆>芦苇茎秆>互花米草细根;两种植物不同部位的中性洗涤纤维含量均显示茎秆>细根>叶片;酸性洗涤纤维含量测定结果为芦苇茎秆>芦苇细根>互花米草细根>芦苇叶片>芦苇茎秆>互花米草叶片.
结合室内喂食实验结果,蟹的摄食量与植物粗蛋白质含量存在正相关关系(r1=0.87,P<0.05);与植物中性洗涤纤维含量(r2=-0.72)及酸性洗涤纤维含量(r3=-0.66)不存在显著相关性.
3 讨论
普遍认为盐沼湿地植物的群落结构和生长繁殖等受盐度、潮汐、水分、养分等上行因子的调控,近年来也有一些研究表明,诸如蟹类等小型植食性动物,同样可以对盐沼植被产生强烈的下行调控作用[14-18].在西大西洋沿岸地区,盐沼植被的大面积消亡曾引起生态学家的广泛关注[17],在造成盐沼植被大面积消亡的众多假说中,植食作用依然是一个核心的因素.Holdredge等在新英格兰科德角(Cape Cod)开展的一项研究表明,相手蟹的密度及摄食强度与米草植物的被摄食量呈显著的正相关,并指出植食作用是导致当地盐沼植被大面积消亡的重要因素[19].本研究区域蟹洞调查结果表明,蟹洞密度在潮滩不同高程位置上具有显著差异,蟹洞密度随高程的升高而增加.这可能是受研究区域一日两潮的影响,随着高程升高,水淹频率和时间都会减少使得与潮永相关的环境压力降低.此外,除了水淹环境,盐沼植物分布会对蟹洞的分布起到至关重要的影响,植株地下部分的根系发达程度也会影响掘穴动物的分布[20].蟹洞的分布可以为蟹类活动范围起到一定的启示作用,Crichton曾在其研究中提到科德角所有植被消亡区的蟹洞密度都在(10~25)个/m2[21].对比本研究区域的蟹洞密度,中高程芦苇带,交错带的蟹洞密度已远高于此数值,所以,本样地蟹类的植食行为也可能对植被生长存在一定控制作用,而这就需要通过一些野外实验来进一步论证.本研究不同生境蟹类多度结果显示,蟹类捕获量与蟹洞密度的高低并不完全一致.蟹洞密度低的生境蟹类多度并不一定低.盛強的蟹类摄食偏好性实验[12]表明,在盐沼高程较高的位置,蟹类密度高,对植物摄食量更大.因此,处于较低程的植物很有可能因为高程植物的存在而避免被摄食,进而使得植物间的促进作用增强或竞争作用减弱.本研究中,互花米草与芦苇不同的生态位差异同样也可能因蟹类密度高低产生的植食差异,对植物种间竞争产生影响.
蟹类是盐沼湿地中最重要的初级消费者之一,其摄食行为会消耗大量的盐沼植物的新老叶片、凋落物和幼苗等[22-23],从而影响植物的群落结构.英格兰盐沼湿地的动态分析指出,相手蟹对植物地下部分(根、根状茎等1的摄食也是促使该地区盐沼植被大面积消亡的因素之一[24].本研究通过喂食实验,证实了天津厚蟹和褶痕相手蟹这两种杭州湾北岸的盐沼优势蟹类对互花米草和芦苇的地上地下部分均有摄食,并存在一定的摄食偏好.两种蟹对不同植株部位的摄食偏好性均为叶片>细根>茎秆,但对不同植物的摄食偏好有所差异,天津厚蟹偏好摄食芦苇叶片,而褶痕相手蟹更偏好互花米草叶片.对茎秆和细根的摄食量均是互花米草>芦苇.就总体的摄食量而言,褶痕相手蟹对所投植物的摄食量要高于天津厚蟹.由此结果得出,蟹类对盐沼植被可能存在的破坏主要表现为两方面:一是对植物叶片的摄食,通过喂食实验观察发现蟹会先用螯将叶片撕裂,然后进行一部分的摄食;二是对植物地下根系的摄食,在盐沼湿地中,这种摄食方式会显著减缓植物的生长甚至导致消亡,所以下行效应对盐沼植物生长的负面影响不容忽视.
本研究还针对蟹类不同的摄食偏好结果进行了影响因子分析,发现蟹类摄食偏好主要受到蟹类自身特征以及植物特征的影响.蟹类对植物的摄食量存在一定差异,通过冗余分析表明,夏季蟹的种类以及蟹的体重都对摄食量产生了重要影响.此外,在已有的研究中还发现,螯的大小也与摄食能力有一定的关系[25-26].除了不同蟹类自身特征之外,植物自身特征也是影响摄食作用的重要因子.以往对植物营养成分的研究大多集中在植物碳氮比和单宁含量的分析,认为碳氮比和单宁含量是影响蟹类摄食偏好的原因[27- 29].而本实验发现蟹类摄食偏好与食物类型中粗蛋白质含量、中性洗涤纤维含量和酸性洗涤纤维含量也有一定的相关性.两种蟹类的摄食偏好与粗蛋白质含量存在正相关关系,检测结果显示奉贤潮滩夏季芦苇叶片与细根的粗蛋白质含量要明显高于互花米草,因此蟹类对两种植物叶片及细根的摄食上也表现出对芦苇的偏好性.虽然研究结果显示摄食量与植物中的中酸性洗涤纤维含量没有显著相关性,但NDF的组成会影响到食物的消化率,NDF越低摄食率越高[30].而ADF通常由纤维素和木质素组成,食物的适口性与木质素含量的高低有一定关系,木质素含量高,茎秆较硬,适口性就差[31],这与本喂食实验的结果也较为一致,两种蟹类对互花米草茎秆的摄食都高于对芦苇茎秆的摄食.本实验结果充分验证了蟹类在植物营养成分上的选择偏好性,即优先选择营养价值高、适口性好的食物.在不同季节,由于植物处于不同的生长阶段,其营养成分势必会存在一定变化,那么蟹类的摄食偏好会不会随之改变,这种改变是否与下行效应相联系,对盐沼植物种间竞争有何影响,还有待后续进一步的研究.
4 结论
(1)奉贤潮滩蟹洞的分布由低潮带至高潮带呈上升趋势,不同蟹洞分布存在极显著差异(P<0.01),裸地平均蟹洞密度最高,可达(48±4.33)个/m2.中高潮带互花米草群落的蟹类捕获数要高于芦苇群落,互花米草申潮带捕获数最高,平均捕获量为(9±4.73)只/24 h.
(2)天津厚蟹与褶痕相手蟹对每种食物类型均有摄食,对两种植物不同部位的摄食偏好均为叶片>细根>茎秆;天津厚蟹偏好摄食芦苇叶片,而褶痕相手蟹更偏好互花米草叶片;褶痕相手蟹对植物的总摄食量要高于天津厚蟹;蟹类的摄食量除了受蟹重及种类的影响,还与植物营养成分有关,并与粗蛋白质含量存在正相关关系.
[参考文献]
[1] GREEN P T,DOWD D J o,LAKE P s.Control of seedling recruitment by land crabs in rain forest ona remoteoceanic island [J]. Ecology, 1997,78:2474-2486.
[2] GUEBAS F D,KAIRO J G,JAYATISSA L P,et al.An ordination study to view vegetation structure dynamicsin disturbed and undisturbed mangrove forests in Kenya and Sri Lanka [J]. Plant Ecology, 2002, 161: 123-135.
[3] TEAL J M.Energy flow in the salt marsh ecosystem of Georgia [J]. Ecology, 1962, 43(4): 614-624.
[4] ODUM E P,BARRETT G W. Fundamentals of Ecology [M]. Philadelphia: Saunders, 1971.
[5] MALKINSON D,TIELBOERGER K.What does the stress-gradient hypothesis predict? Resolving the discrep-ancies [J].Synthesising Ecology, 2010, 119(10): 1546-1552.
[6] BADANO E I,PEREZ D,VERGARA c H.Love of nurse plant is not enough for restoring oak forests in aseasonally dry tropical environment [J]. Restoration Ecology, 2009, 17(5): 571-576.
[7]PADILLA F M,PUGNAIRE F I The role of nurse plants in the restoration of degraded environments [J].itiers in Ecology and the Environment, 2006, 4(4): 196-202.
[8] BERTNESS M D, ELLISON A M. Determinants of pattern in a New England salt marsh plant community [J].Ecological Monographs, 1987, 57(2): 129.
[9] CALLAWAY R M: KIKODZE D, CHIBOSHVILI M. Unpalatable plants protect neighbors from grazing andincrease plant community diversity [J]. Ecology, 2005, 86(7): 1856-1862.
[10]QIN H M, CHU T J,XU W. Effects of invasive cordgrass on crab distributions and diets in a Chinese salt marsh[J]. Marine Ecology Progress Series, 2010, 415: 177-187.
[11]KURODA M. Factors influencing coexistence of two brachyuran crabs Helicet fidens and Parasesarma plicatumin an estuarine salt marsh [J]. Journal of Crustacean Biology, 2005, 25: 146-153.
[12] 盛強.崇明东滩不同高程上蟹类对植物种间关系的影响[D].上海:复旦大学,2011.
[13] 王金庆.长江口盐沼优势蟹类的生境选择与生态系统工程师效应[D].上海:复旦大学,2008.
[14] ADAM P.Salt Marsh Ecology[M]. New York: Cambridge University Press, 1990.
[15] BERTNESS M D, CALLAWAY R. Positive interactions in communities [J]. lYends in Ecology&Evolution,1994(9): 191-193.
[16] HE Q, SILLIMAN B R. Consumer control as a common driver of coastal vegetation worldwide [J]. EcologicalMonographs, 2016, 86: 278-294.
[17]BERTNESS M D, SILLIMAN B R. Consumer control of salt marshes driven by human disturbance [J]. Conser-vation Biology, 2008, 22: 618-623.
[18]ALTIERI A H, BERTNESS M D, COVERDALE T C, et al.A trophic cascade triggers collapse of a salt marshecosystem with intensive recreational fishing [J]. Ecology, 2012, 93: 1402-1410.
[19]HOLDREDGE C, BERTNESS M D, ALTIERI A H. Role of crab herbivory in die-off of New England salt marshes[J]. Conservation Biology, 2009, 23: 672-679.
[20] 杨泽华,童春富,陆健健.长江口湿地三个演替阶段大型底栖动物群落特征[J].动物学研究,2006, 27(4): 411-418.
[21]CRICHTON o W. Marsh crab: Intertidal tunnel-maker and grasseater [J]. Estuarine Bulletin, 1960(5): 3-10.
[22]WANG J Q, ZHANG x D, NIE M. Exotic Spartina alternifZora provides compatible habitats for native estuarinecrab Sesa-rma dehaani in the Yangtze River Estuary [J]. Ecological Engineering, 2008, 34(1): 57-64.
[23]BORTOLUS A P,IRIBARNEO. Crab-mediated phenotypic changes in Spartina densiflora Brong [J]. EstuarineCoastal and Shelf Science, 2004, 59: 97-107.
[24] COVERDALE T C, ALTIERI A H, BERTNESS M D. Belowground herbivory increases vulnerability of NewEngland salt marshes to die-off [J]. Ecology, 2012, 93(9): 2085-2094.
[25] KYOMO J.Variations in the feeding habits of males and females of the crab Sesarma intermedia [J]. MarineEcology Progress, 1992, 83: 151-155.
[26]BROUSSEAU D J,FILIPOWICZ A, BAGLIVO J A. Laboratory investigations of the effects of predator sex andsize on prey selection by the Asian crab Hemigrapsus sanguzneus [J]. Journal of Experimental Marine Biologyand Ecology, 2001, 262: 199-210.
[27]KWOK P W, LEE s Y. The growth performances of two mangrove crabs Chiromanthes bide-ns and Parasesarmaplicata under different leaf litter diets [J]. Hydrobiologia, 1995, 295: 141-148.
[28]CAMILLERI J. Leaf choice by crustaceans in a mangrove forest in Queensland [J]. Marine Biology, 1989, 102(4):453-459.
[29]KWOK P W, LEE s Y. The growth performances of two mangrove crabs Chiromanthes bidens and Parasesarmaplicata under different leaf litter diet [J]. Hydrobiologia, 1995, 295(3): 141-148.
[30] 紀一帆,吴宝镭,丁玉华,等.大丰野放麇鹿生境中芦苇和互花米草的营养对比分析[J].生态学杂志,2011, 30(10): 2240-2244.
[31] 闫志坚,高雪峰,高天明.6种优势固沙植物饲用养分含量及动态研究[J]饲料工业,2007, 8(11): 21-23.
(责任编辑:张晶)

