河道修复中常见植物种类对淡色库蚊产卵行为的影响
肖冰 马明海 黄民生 陈奇 冷培恩 何岩



摘要:比较研究了石菖蒲、香菇草、鱼腥草、粉绿狐尾藻和绿薄荷5种植物及其挥发性物质对淡色库蚊产卵行为的影响.结果表明,石菖蒲的蚊虫产卵活性指数(OAI)值为+0.58,抑制率为O%,具有较强的引诱作用;香菇草、鱼腥草和粉绿狐尾藻的OAI值分别为-0.70、-0.64和-0.16,抑制率分别为82.46%、78.36%和27.05%,其中香菇草和鱼腥草的OAI值均小于-0.30,可作为抑制剂;5种植物中,绿薄荷的抑制作用最强(OAI=-1.OO,ER=1OO.OO%),最适合作为驱蚊植物.挥发性有机物中苯类化合物与OAI值呈显著正相关(r=0.09,p<0.05),萜烯类中的单萜烯类与OAI值呈显著负相关(r=-0.09,p<0.05).本文为河道修复及蚊虫防治的协同发展提供了理论依据.
关键词:植物化学物质;淡色库蚊;产卵选择性
中图分类号:Q965
文献标志码:A
DOI: 10.3969/j.issn.1000-5641.2019.06.013
0 引言
蚊虫是疟疾、黄热病、登革热和寨卡等疾病的主要传播媒介,不仅会骚扰人类生活,造成社会经济财产损失,还严重威胁公众健康.预防优于治疗,对于尚没有疫苗预防和药物治疗的蚊媒病而言,其防控的关键措施为蚊虫控制.然而,蚊虫的控制面临着各种各样的挑战:杀虫剂的大量使用、滥用导致蚊虫产生抗药性[1-3],蚊虫种群结构的复杂性[4],蚊虫生态习性的遗传变异[5],以及环境的改变[6]对蚊虫生态的动态变化产生了影响.雌蚊通过接收化学、视觉、嗅觉、触觉等信息选择产卵地,并通过吸收环境中的各种资源完成其生命周期[3],因此选择合适的产卵地对蚊幼的生长和存活起着至关重要的作用,同时影响着传播效能,因此研究蚊虫的产卵地选择行为能为蚊虫的防治开拓新思路[7].
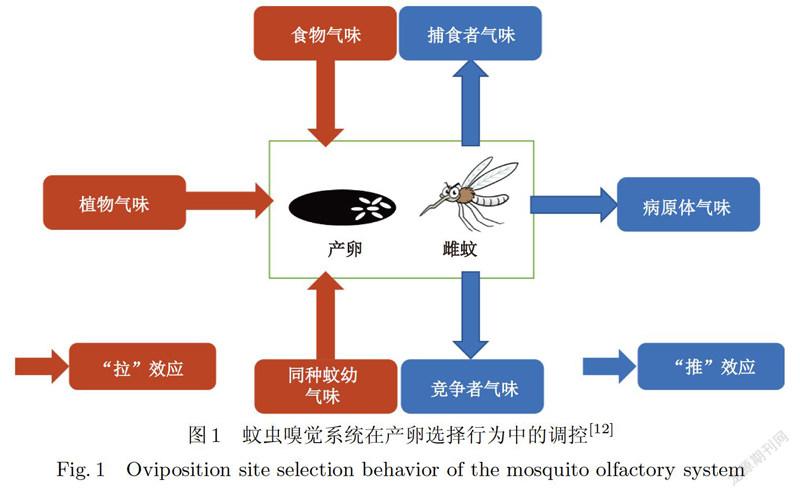
蚊虫具有独特的个体生态学,特别是其嗜血性等特征,确保了蚊虫病原体宿主之间相互作用:寻找宿主、吸食血液、病原体的繁殖发育和疾病的有效传播等[8].嗅觉系统在这些过程中起着主导作用[9]:自然环境中被称为化学信息素的挥发性有机物与蚊虫嗅觉系统中的气味结合蛋白融合后,被嗅觉受体神经元接收,这些化合物被嗅觉受体识别后,通过大脑解码气味,并产生相应的行为[10],蚊虫通过化学信息素完成其种内和种间的交流及与自然环境的相互作用[11].蚊虫嗅觉系统对其产卵地选择行为的调控如图1所示,在雌蚊产卵前,从生境中散发出的挥发性有机物与雌蚊嗅觉受体作用,能够以“推一拉”(“Push-pull”)方式[12]吸引或排斥雌蚊产卵.
城市河道治理中,植物作为河道生态修复的一个重要手段,不仅能净化水体中的污染物,还能增加水体的生物多样性,使城市河道恢复近自然条件,提高其自净能力.但由于水生植物的种植为蚊虫提供栖息场所并躲避天敌捕食,大大增加了河道孳生蚊虫的可能性[13];同时由于植物能够合成并散发出大量的挥发性有机物质,而这些植物挥发性物质具有靶标专一性、环境友好、易生物降解、经济效益高、对非靶标生物无副作用、不易产生抗药性等优点,可能替代化学杀虫剂,近年来受到广泛关注[14-15].本文以5种河道生态修复中常用的植物:菖蒲、香菇草、鱼腥草、粉绿狐尾藻和绿薄荷[16]为研究对象,研究近自然条件下这5种植物及其挥发性成分对雌蚊产卵行为的影响,筛选出对蚊虫有吸引或驱避作用的挥发性成分,为植物源蚊虫引诱剂和驱避剂的研发提供参考依据[3],为河道治理及蚊虫防治的协同发展提供理论支撑.
1 材料与方法
1.1 供试生物
植物:石菖蒲、香菇草、鱼腥草、粉绿狐尾藻和绿薄荷.
昆虫:淡色库蚊.
1.2 植物种类及其挥发性成分对蚊虫产卵行为的影响
采用蚊帐试验(见图2),200 cm(L) x180 cm(W) x150 cm(H),设3个平行组,每组分别种有5种植物及无植物的透明水箱(L 66 cmxW 44 cmxH40 cm),水箱中盛有0.05 m3的脱氯水,水箱中植物使用硬质塑料网固定,植株间距为20 cm,密度约为40株/m2.每个蚊帐内放入12只同批次饱吸血1-2d的待产雌蚊,血源由小白鼠提供,期间饲以5%葡萄糖水作为碳源,放入蚊帐2~4 d后计算水箱内湿产卵纸上的蚊卵数量.
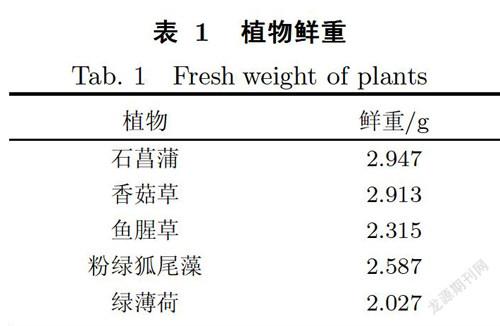
采用固相微萃取(SPME)技术结合气相色谱/质谱(GC/MS)方法对植物叶片中的挥发性物质进行提取、分离、鉴定[17].不同植物各选取2株,每株植物剪取成熟叶片3-4片(带叶柄)并称重(见表1).叶片剪裁成长约0.5 cm的碎屑,放入20 mL顶空样品瓶中,密封加热.采用CORNING PC-420D型加热设备,40 ℃下预热10 min,然后放入样品瓶加熱30 min.采用经250 ℃活化完成的固相微萃取纤维头萃取5 min,萃取完成后,直接插入GC-MS进样口中分析.
1.3 数据分析方法
产卵选择性:产卵反应是以对照组及实验组中蚊卵的数量作为测量基础的[18].蚊虫产卵活性指数(Oviposition activity index,OAI)按式l计算[19].式中,NT为试验水箱中蚊卵(幼)的数量,单位为个;Nc为空白对照组水箱中蚊卵(幼)的数量,单位为个.
OAI值范围在-1至+1之间,OAI为正,表明实验组中蚊卵数量更多,实验组具有引诱作用;相反,OAI为负,表明实验组具有产卵抑制作用.其中,当OAI≥+0.3,实验组被认为是引诱物;OAI≤-0.3,则为抑制物[19].
抑制作用用抑制效率(Effective repellency,ER)来计算(见式2).ER值越大,说明其抑制蚊虫产卵效果越好.
挥发性有机物的鉴定:总离子流色谱图中的各峰经质谱扫描后得到相应的质谱图,经计算机质谱数据系统检索(NIST08.L和RTLPEST3.L),结合保留时间及相关文献资料,确定其归属.在默认积分设置下,利用峰面积归一化法计算各成分在总挥发物中的相对百分含量[20].
使用SPSS19.0软件对试验数据进行相关性分析,显著性水平α=-0.05.
2 结果与讨论
2.1 植物种类对淡色库蚊产卵选择性的影响
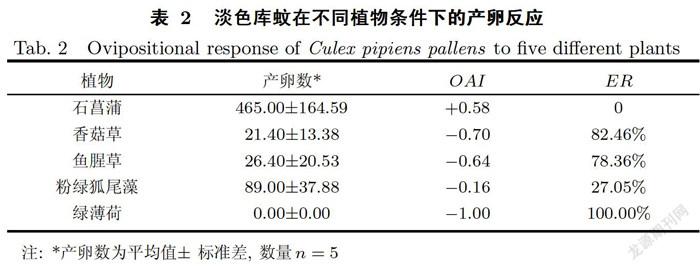
5个实验组中,淡色库蚊吸血雌蚊的产卵情况(见表2)表明,淡色库蚊在不同植物条件下产卵数量为石菖蒲>粉绿狐尾藻>鱼腥草>香菇草>绿薄荷.其中,3組平行样中绿薄荷组产卵数量均为0.石菖蒲的OAI值为+0.58,大于0.3,可视为淡色库蚊产卵的引诱物.其余4种植物的OAI均小于0,且鱼腥草(-0.64)、香菇草(-0.70)和绿薄荷(-1.00)的OAI值均小于- 0.3,可视为抑制物,其中绿薄荷的抑制性最强,抑制效率高达100%.薄荷属多年生草本植物,是一种具有特种药用价值的芳香植物[21],已有研究将薄荷作为人工湿地植被,发现其对活性磷和总磷的最高去除率可高达95.62%和67.45%,对化学需氧量(Chemical oxygen demand,COD)和总氮(Total nitrogen,TN)也有较好的净化效果,且抗耐性较好,能顺利过冬[22-23],因此在污染河道的植物修复中也可考虑使用绿薄荷,既可以净化水质,又可达到驱蚊的效果.
2.2 植物中挥发性有机物的成分
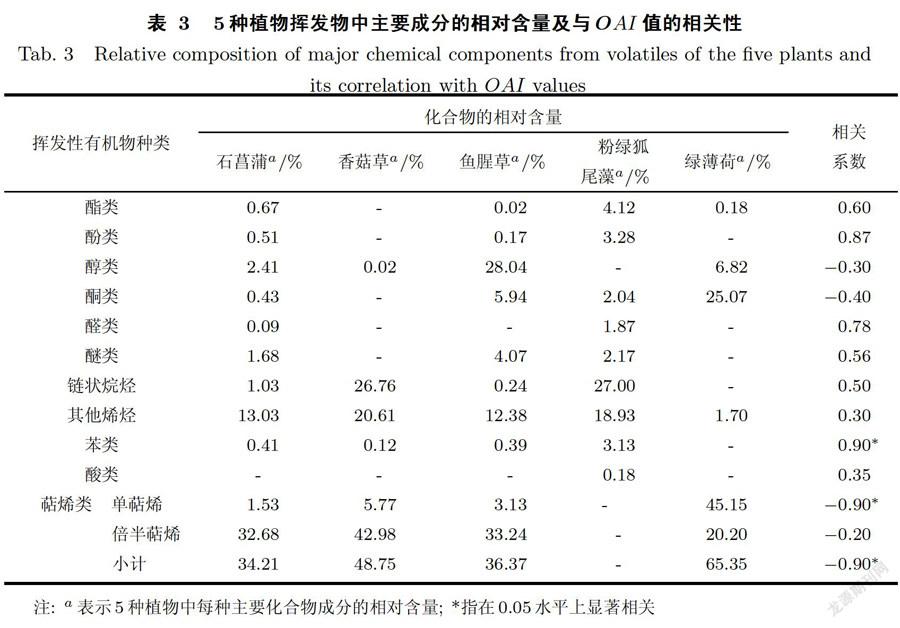
气相色谱分析中,化合物一般按照沸点的高低先后流出色谱柱,柱温是最重要的分离参数.在不考虑相对含量(Relative contents,RC)及匹配度(Match quality, MQ)高低的情况下,结果表明:5种植物可分离出的挥发性有机物(见表3和图31数量分别为石菖蒲124种、香菇草65种、鱼腥草150种、粉绿狐尾藻132种和绿薄荷89种.由于化学物的低相对含量和低匹配度会影响化合物鉴定结果的准确度,故本研究选取相对含量在O.O1%以上,匹配度大于85%的挥发性物质进行分析,结果为石菖蒲62种、香菇草30种、鱼腥草77种、粉绿狐尾藻69种、绿薄荷60种,植物的挥发性有机物主要种类为酯类、酚类、醇类、酮类、醛类、醚类、链状烷烃、苯类、酸类、萜烯类和其他烯类(见表3).
5种植物的挥发性成分中,除粉绿狐尾藻外,都以帖烯类为主,相对含量为34.21%至65.35%,其中绿薄荷的帖烯类含量显著高于其他4种植物(p<0.01),主要成分为单萜烯类的右旋萜二烯(RC=34.59%,MQ=94%),石菖蒲、香菇草和鱼腥草中的萜烯类成分以倍半萜烯类为主.绿薄荷中还含有较丰富的香芹酮(RC=24.53%,MQ=96%)和香芹醇(3.24%,MQ=98%),这些化合物对蚊卵和蚊幼具有较强的致死作用和致突变作用[21].石菖蒲的挥发物中除酸类外,其他类成分均有检出,相对含量最大的成分是倍半萜类的1一石竹烯(RC=14.91%,MQ=99%)和β-金合欢烯(RC=8.08%,MQ=97%).香菇草中1,7-_甲基-7-(4甲基一3一戊烯基)一三环庚烷的相对含量最大,其次是倍半萜类的烯烃,酯类、酚类、酮类、醛类、醚类和酸类未检出.鱼腥草中醇类含量显著高于其他植物(p<0.01),主要为α一松油醇(RC=17.6%,MQ=91%)和桉树脑/桉叶油醇(RC=4.01%,MQ=93%).粉绿狐尾藻中未检出萜烯类和醇类成分,但链状烷烃的相对含量较高,比如正二十一烷(RC=2.03%),其对蚊虫的产卵行为具有较弱的引诱作用[24],其酯类、酚类、醛类和苯类的相对含量显著高于其他植物(p<0.01),酯类主要包括硅酸四乙酯(RC=1.57%,MQ=99%)和甲基-11稀酸甲酯(RC=1.34%,MQ=99%),酚类主要是2,4-_叔丁基苯酚(RC=3.28%,MQ=97%),醛类主要是E-15-庚醛(RC=1.87%,MQ=99%),苯类主要是1一癸氧基-2-硝基苯(RC=1.29,MQ=89%)和均四甲苯(RC=0.88%,MQ=93%).
2.3 挥发性有机物对淡色库蚊产卵选择性的影响
在本研究中,根据相关性分析(见表3),帖烯类化合物与OAI值呈显著负相关关系,且单萜烯类也呈显著负相关,说明萜烯类对蚊虫产卵的抑制效果主要取决于单萜烯类成分的含量,而Matasyoh等[25]研究显示胡椒挥发性成分的杀幼蚊作用主要是由于其倍半萜类的高含量.苯类化合物对蚊虫有较高的致死率,同时对成蚊产卵具有一定的抑制作用[26],而在本研究中,苯化合物与OAI值呈显著正相关关系(p<0.05),即苯类化合物对淡色库蚊的产卵有一定的引诱或刺激作用,可能是由于植物中各类挥发物的组成及相对含量的差异,使得混合后苯类化合物表现出一定的引诱性.绿薄荷提取出的化学物质主要是帖烯类、酮类和醇类,与Govindarajan等研究[21]相近,且这3种挥发性成分在不同的浓度下对蚊幼均有致死作用.Perry等发现含有甲基和乙基短链脂肪酸酯(比如丙酸乙酯和丁酸甲酯)的水体能吸引怀孕的埃及伊蚊[27].对于链长较长的脂肪酸酯,比如十六烷戊酸酯、十四烷庚酸酯和十三烷辛酸酯,在0.001‰和0.01‰浓度时对白纹伊蚊和埃及伊蚊均有趋避作用,而丙基硬脂酸对这两种蚊虫有引诱作用.本研究在香菇草和鱼腥草中发现了柏木脑成分(分别为0.02%、1.46%),柏木脑是倍半萜烯醇,大量存在于松柏类植物的挥发物中,也常见于其他各类植物,能够引诱冈比亚按蚊产卵[28].5种植物中仅检测出两种醛类,分别为粉绿狐尾藻中的庚醛和石菖蒲中的十六醛,而醛类对怀孕雌蚊具有引诱作用[26],而酸类物质仅在粉绿狐尾藻中测出.
已有大量的研究报道不同种植物,甚至同种植物在不同的地理位置能够释放出不同的挥发物[21,25],且不同的蚊虫栖息地中植物挥发物的结构和化学复杂度各不相同,蚊虫根据这些信息选择产卵地,尽管有些成分在各种植物中普遍存在,但由于其组成成分和比例的变化,使得蚊虫产生不同的反馈[29].同种植物挥发物质在不同的浓度下对蚊虫的影响也有差别,比如3一甲基吲哚对于致倦库蚊在0.01μg/L的浓度下具有排斥作用,而在1 μg/L及10μg/L的浓度下具有引诱剂作用[30].甚至在不同的研究中,有些结果可能会相互矛盾,比如4-甲酚在相似浓度下对埃及伊蚊既可能是刺激物又可能是抑制物[24,31].
3 結论
(1)淡色库蚊在不同植物种植条件下,其产卵数量排序为石菖蒲>粉绿狐尾藻>鱼腥草>香菇草/绿薄荷,其中,石菖蒲的OAI值为+0.58,可视为引诱物,而鱼腥草(-0.64)、香菇草(-0.70)和绿薄荷(-1.00)的OAI值均小于-0.3,可视为抑制物,其中绿薄荷的抑制作用最强,在河道修复中种植绿薄荷驱蚊效果最好.
(2)5种植物中可分离出的挥发性有机物数量为石菖蒲62种、香菇草30种、鱼腥草77种、粉绿狐尾藻69种、绿薄荷60种.其中,绿薄荷的帖烯类含量显著高于其他4种植物(p<0.01),主要成分为单萜烯类的右旋萜二烯(RC=34.59%,MQ=94%),还含有较丰富的香芹酮(RC=24.53%,MQ=96%)和香芹醇(3.24%,MQ=98%),是绿薄荷抑制性较强的主要原因.石菖蒲、香菇草和鱼腥草中的萜烯类成分以倍半萜烯类为主.5种植物中,仅在石菖蒲和粉绿狐尾藻中检测出醛类化合物,对淡色库蚊具有引诱产卵作用.
(3) OAI值与苯类化合物呈显著正相关(r=0.90,p<0.05),与帖烯类中的单帖烯类呈显著负相关(r=-0.90,p<0.05).
[参考文献]
[1]RANSON H, LISSENDEN N. Insecticide resistance in African anopheles mosquitoes: A worsening situation thatneeds urgent action to maintain malaria control [J]. Trends in Parasitology, 2016, 32(3): 187-196.
[2]RANSON H, N'GUESSAN R, LINES J, et al. Pyrethroid resistance in African anopheline mosquitoes: Whatare the implications for malaria control? [J]. Trends in Parasitology, 2011, 27(2): 91-98.
[3]MUEMA J M: BARGUL J L, NJERU S N, et al. Prospects for malaria control through manipulation of mosquitolarval habitats and olfactory-mediated behavioural responses using plant-derived compounds [J]. Parasites &Vectors, 2017(10): 184.
[4]RUSSELL T L. GOVELLA N J, AZIZI S, et al. Increased proportions of outdoor feeding among residual malariavector populations following increased use of insecticide-treated nets in rural Tanzania [Jl Malaria Journal,2011(10): 80.
[5] NEAFSEY D E: WATERHOUSE R M, ABAI M R, et al. Highly evolvable malaria vectors: Thegenomes of16Anophelesmosquitoes [J] Science, 2015, 347(6217): 1258522.
[6]RUSSELL T L, BEEBE N W, COOPER R D, et al. Successful malaria elimination strategies require interventionsthat target changing vector behaviours [J]. Malaria Journal, 2013(12): 56.
[7]NAVARRO-SILVA M A, MARQUES F A, DUQUE L J E. Review of semiochemicals that mediate the ovipositionof mosquitoes: A possible sustainable tool for the control and monitoring of Culicidae [J]. Revista Brasileira deEntomologia, 2009, 53(1): 1-6.
[8]MOLLER-JACOBS L L, MURDOCK C C, THOMAS M B. Capacity of mosquitoes to transmit malaria dependson larval environment [J]. Parasites & Vectors, 2014(7): 593.
[9]TAKKEN W, KNOLS B G J. Odor-mediated behavior of afrotropical malaria mosquitoes [J]. Annual Review ofEntomology, 1999, 44(17): 131-157.
[10]WANG G R, CAREY A F., CARLSON J R, et al. Molecular basis of odor coding in the malaria vector mosquitoAnopheles gambiae [J]. Proc Natl Acad Sci USA, 2010, 107(9): 4418-4423.
[11] TUMLINSON J H. The importance of volatile organic compounds in ecosystem functioning [J]. Journal ofChemical Ecology,2014, 40(3): 212.
[12]HERRERA-VARELA M, LINDH J, LINDSAY S W, et al. Habitat discrimination by gravid Anopheles gambiaesensu latoa push-pull system [Jl Malaria Journal, 2014, 13: 133.
[13]MA M H, HUANG M S, LENG P E. Abundance and distribution of immature mosquitoes in urban riversproxi-mate to their larval habitats [J]. Acta Tropica, 2016, 162: 121-129.
[14]RAJKUMAR S: JEBANESAN A. Larvicidal and oviposition activity of Cassia obtusifolia Linn (Family: Legu-minosae) leaf extract against malarial vector, Anopheles stephensi Liston (Diptera: Culicidae) [J]. ParasitologyResearch, 2009, 104(2): 337-340.
[15]GOVINDARAJAN M, MATHIVANAN T, ELUMALAI K, et al. Ovicidal and repellent activities of botanicalextracts against Culex quinquefasciatus, Aedes aegypti and A'nopheles stephensi (Diptera: Culicidae) [J]. AsianPacific Journal of Tropical Biomedicine, 2011: 1(1): 43-48.
[16] 黃民生,马明海,曹承进,等.城市水体环境及治理:析 [M].北京:中国建筑工业出版社, 2017.
[17] 史睿杰,谢寿安,赵薇,等.青海云杉针叶和枝条的挥发性化合物的固相微萃 GC/MS分析 [J].西北林学院学报, 2011, 26(6):95-99.
[18] GANESAN K, MENDKI M J, SURYANARAYANA M V S, et al. Studies of Aedes aegypti (Diptera: Culici-dae) ovipositional responses to newly identified semiochemicals from conspecific eggs [J]. Australian Journal of Entomology, 2006, 45: 75-80.
[19]KRAMER W L, MULLA M S. Oviposition attractants and repellents of mosquitoes: Oviposition responses ofculex mosquitoes to organic infusions [J]. Environmental Entomology, 1979, 8(6): 1111-1117.
[20] GAO Y, JIN Y J, LI H D, et al. Volatile organic compounds and their roles in bacteriostasisin five coniferSpecies [J]. Journal of Integrative Plant Biology, 2005, 47(4): 499-507.
[21] GOVINDARAJAN M, SIVAKUMAR R, RAJESWARI M, et al. Chemical composition and larvicidal activityof essential oil from Mentha spicata (Linn.) against three mosquito species [J]. Parasitology Research, 2012,110(5): 2023-2032.
[22]盛辛辛,蓸谨玲,赵凤岐,等,芦苇和美人蕉及薄荷用作人工湿地植物对中水的净化效果[J],湖南业大学学报(自然科学版),2013, 39(4): 423-428.
[23]霍张丽 ,朱广龙,张江汀,等.模拟人工湿地植物对富营养化水体的修复研究 [J] . 水土保持研究 : 2014, 21(5) : 267-271.
[24] BAAK-BAAK C M, RODRIGUEZ-RAMfREZ A D, GARcfA-REJON J E. et al. Development and laboratoryevaluation of chemically-based baited ovitrap for the monitoring of Aedes aegypti [J] . Journal of Vector Ecology, 2013, 38(1): 175-181.
[25]MATASYOH J C, WATHUTA E M, KARIUKI S T, et al. Chemical composition and larvicidal activity of Piper capense essential oil against the malaria vector: Anopheles gambiae [Jl Journal of Asia-Pacific Entomology, 2011, 14(1) : 26-28.
[26] AUTRAN E S, NEVES I A, DA SILVA C S B: et al. Chemical composition, oviposition deterrent and larvicidal activities against Aedes aegypti of essential oils from Piper marginatum Jacq. (Piperaceae) [J]. Bioresource Technology, 2009, 100(7): 2284-2288.
[27] PERRY A S, FAY R W. Correlation of chemical constitution and physical properties of fatty acid esters with
oviposition response of Ae. aegypti [J]. Mosquito News, 1967, 27(2): 175-183.
[28] SHARMA K R. SEENIVASAGAN T, RAO A N, et al. Oviposition responses of Aedes aegypti and Aedes
albopictus to certain fatty acid esters [J]. Parasitology Research, 2008, 103(5): 1065-1073.
[29] NYASEMBE V 0, TORTO B. Volatile phytochemicals as mosquito semiochemicals [J]. Phytochemistry Letters,2014, 8(1): 196-201.
[30] DU Y J, MILLAR J G. Electroantennogram and oviposition bioassay responses of culex quinquefasciatus andcutex tarsalis (Diptera: Culicidae) to chemicals in odors from bermuda grass infusions [J]. Journal of Medical Entomology, 1999, 36(2): 158-166.
[31] AFIFY A, GALIZIA C G. Gravid females of the mosquito Aedes aegypti avoid oviposition on m-cresol in the presence of the deterrent isomer p-cresol [Jl Parasites & Vectors, 2014(7): 315.
(責任编辑:张晶)
收稿日期:2018-08-07
基金项目:国家自然科学基金(51278192);国家科技重大专项(2013ZX07101012);普陀区高层次人才科研创新项目(普人才2014-A-18)
第一作者:肖 冰,女,硕士研究生,研究方向为城市水环境与蚊虫孳生.
E-mail: xiaobing_19940430@163.com.
通信作者:黄民生,男,教授,博士生导师,研究方向为水环境治理与修复.
E-mail: mshuang@des.ecnu.edu.cn.

