广西巴马小型猪ApoA1基因克隆及其生物信息学分析
张名媛 韦东力 司景磊 郭晓萍 崔悦悦 瞿秋红 綦文晶 兰干球 郭亚芬


摘要:【目的】克隆廣西巴马小型猪载脂蛋白A1(ApoA1)基因并进行生物信息学分析,为后续开展ApoA1基因研究提供基础数据,同时为制作广西巴马小型猪动脉粥样硬化疾病模型打下基础。【方法】以提取的广西巴马小型猪肝脏组织总RNA为模板,运用RT-PCR克隆广西巴马小型猪ApoA1基因序列,以实时荧光定量PCR(qPCR)检测ApoA1基因在广西巴马小型猪心脏、肝脏、脾脏、肺脏和肾脏组织中的表达情况,并利用MegAlign、ProtParam、SOPMA、NetPhos、SignalP和SWISS-MODEL等在线分析软件对广西巴马小型猪ApoA1基因进行生物信息学分析及构建系统发育进化树。【结果】广西巴马小型猪ApoA1基因编码区(CDS)序列长795 bp,与普通猪ApoA1基因序列的同源性为99.9%,仅第630处有1个碱基发生同义突变。ApoA1基因在广西巴马小型猪心脏、肝脏、脾脏、肺脏和肾脏组织中均有表达,且以肝脏中的相对表达量最高、脾脏中的相对表达量最低。广西巴马小型猪ApoA1由264个氨基酸残基构成,其分子式为C1343H2136N376O409S5,蛋白分子量为30254.31 Da,理论等电点(pI)为5.47,属于亲水性蛋白,存在跨膜结构,不存在信号肽,有18处磷酸化位点(丝氨酸磷酸化位点有10处,苏氨酸磷酸化位点有6处,络氨酸磷酸化位点有2处)。广西巴马小型猪ApoA1的二级结构中,α-螺旋占79.92%,β-折叠占2.65%,无规则卷曲占11.12%,延伸链占6.31%,属于全α类蛋白。广西巴马小型猪ApoA1氨基酸序列与普通猪的同源性最高,达99.6%;由基于ApoA1氨基酸序列同源性构建的系统发育进化树也可看出,广西巴马小型猪与普通猪的亲缘关系最近。【结论】广西巴马小型猪ApoA1基因保守性强,以在肝脏中的表达量最高,是广西巴马小型猪抗动脉粥样硬化的重要因子,通过敲除该基因可制作广西巴马小型猪动脉粥样硬化疾病模型。
关键词: 广西巴马小型猪;ApoA1基因;克隆;生物信息学分析;动物模型
中图分类号: S828.89 文献标志码: A 文章编号:2095-1191(2019)06-1339-08
Abstract:【Objective】The aim of this study was to clone the apoliprotein A1(ApoA1) gene of Guangxi Bama mini-pig, and analyze the biological information of ApoA1 gene, which would enrich the basic data for the follow-up study of ApoA1 gene and lay a foundation for the production of the atherosclerosis disease model of Guangxi Bama mini-pig.【Method】Total RNA extracted from the heart and liver of Guangxi Bama mini-pig was as template, and the sequence of ApoA1 gene was cloned by RT-PCR. The expression of ApoA1 gene in heart, liver, spleen, lung and kidney of Guangxi Bama mini-pig was detected by real-time fluorescence quantitative(qPCR). Online analysis softwares including MegAlign, ProtParam, SOPMA, NetPhos, SignalP and SWISS-MODEL were used to analyze the bioinformatics of ApoA1 gene and construct phylogenetic tree. 【Result】The length of coding sequence(CDS) region of ApoA1 gene of Guangxi Bama mini-pig was 795 bp and the homology was 99.9% compared with the ApoA1 gene sequence of pigs with a synonymy mutation on one base at the 630 position. The ApoA1 gene was expressed in heart, liver, spleen, lung and kidney of Guangxi Bama mini-pig with the highest expression in liver and the lowest expression in spleen.The molecular formula of ApoA1 gene encoding 264 amino acid residues in Guangxi Bama mini-pig was C1343H2136N376O409S5, the molecular weight was 30254.31 Da, and the theoretical pI was 5.47, belonging to hydrophilic protein. There was transmembrane structure, no signal peptide. There were 18 phosphorylation sites, including 10 sites of serine, 6 sites of threonine and 2 sites of tyrosine. The secondary structure of coding protein belonged to all-alpha protein, which consisted of α-helix, β-fold, random coil and extended strand, accounting for 79.92%, 2.65%, 11.12% and 6.31%, respectively. It was found that the homology of ApoA1 amino acid sequence between Guangxi Bama mini-pig and ordinary pig was the highest(99.6%). According to phylogenetic tree based on ApoA1 amino acid sequence homology, Guangxi Bama mini-pig had the closest genetic relationship with pig. 【Conclusion】The sequence of ApoA1 gene in Guangxi Bama mini-pig is strongly conservative and expresses the highest in liver. It is an important factor of anti-atherosclerosis in Guangxi Bama mini-pig. The model of atherosclerotic disease in Guangxi Bama mini-pig can be produced by knocking out the ApoA1 gene.
Key words: Guangxi Bama mini-pig; ApoA1 gene; cloning; bioinformatics analysis; animal model
0 引言
【研究意义】动脉粥样硬化是心脑血管疾病中非常严重的一种疾病,但其致病机理尚未完全明确(陈东和严激,2010)。载脂蛋白A1(Apoliprotein A1,ApoA1)是高密度脂蛋白(High density lipoprotein,HDL)的主要组成部分,能激活卵磷脂胆固醇脂酰转移酶(Lecithin-cholesterol acyltransferase,LCAT),参与胆固醇的逆转运,是重要的抗动脉粥样硬化因子(田迪,2013;汤磊乐等,2017),即ApoA1特异性自身抗体在心血管疾病中具有重要价值(Chistiakov et al.,2016)。因此,研究广西巴马小型猪ApoA1基因及其调控机理,可进一步丰富ApoA1基因的基础数据,并为制作广西巴马小型猪动脉粥样硬化疾病模型打下基础。【前人研究进展】血浆中脂蛋白的蛋白部分称为载脂蛋白,ApoA1是载脂蛋白的一种,占蛋白总量的60%~70%(Heinecke,2013;刘培彬等,2014)。ApoA1主要存在于血浆中,其密度为1.063~1.210 g/mL(雷蕾和陈丽,2011),缺乏ApoA1会导致低HDL血症。有研究证实,ApoA1水平与冠脉病变呈负相关,可能具有延缓冠脉病变进展的作用,因此可用于预测冠脉病变进展风险(汤磊乐等,2017),其反义转录本(Apoliprotein A1 Antisense transcript,ApoA1-AS)是诊断冠状动脉疾病的新生物标志物(Zhang et al.,2019)。目前,已有研究报道了人类、黄鳝和鹅的ApoA1基因序列及其在各物种间的核苷酸序列结构差异(麻延峰等,2015;阚延泽等,2016)。关于ApoA1基因的表达,张旭等(2011)研究表明,ApoA1转基因小鼠的血液、肾脏、脾脏、肝脏、心脏和血管等组织中均有ApoA1基因表达;阚延泽等(2016)、赵佳福等(2018)研究证实,ApoA1基因在黄鳝和从江香猪的肝脏中表达量最高。在生产性状的关联性研究中,已有学者分析了ApoA1基因多态性与兔、鸡和鹅生产性状间的关联性,并验证其作为分子育种候选基因的可行性,即可开发成一种辅助选择遗传标记(万洁,2008;熊婷,2012;麻延峰等,2015)。张晶(2012)在筛选分析与猪脂肪沉积相关的关键基因时也发现有ApoA1基因;赵佳福等(2017)对从江香猪ApoA1基因进行亚细胞定位,发现ApoA1基因的表达主要集中在细胞外基质中,该结论为人类因肥胖引起相关疾病的研究奠定了基础。【本研究切入点】广西巴马小型猪是在巴马香猪的基础上培育出的实验动物品系,具有体型矮小、遗传相似性高、与人类相近且遗传稳定性强等特点,是作为实验动物模型的理想材料(李芳芳等,2014;李龙等,2017;Wu et al.,2018;Yan et al.,2018),且诸多基因信息已被深入发掘(吴丹等,2013;宋少锐等,2014;申玉建等,2017;张广杰等,2018),但至今未见广西巴马小型猪ApoA1基因克隆及序列分析的相关文献报道。【拟解决的关键问题】从广西巴马小型猪肝脏中克隆出ApoA1基因,并应用在线生物信息软件对其进行分析学分析,为后续开展ApoA1基因研究提供基础数据,同时为制作广西巴马小型猪动脉粥样硬化疾病模型打下基础。
1 材料与方法
1. 1 试验材料
从广西大学广西巴马小型猪繁育中心采集广西巴马小型猪的心脏、肝脏、脾脏、肺脏和肾脏等组织样品,迅速移到液氮中速冻后置于-80 ℃冰箱保存备用。Taq DNA聚合酶购自南京诺唯赞生物科技有限公司;Biospin胶回收试剂盒购自杭州博日科技有限公司;大肠杆菌DH5α感受态细胞购自北京全式金生物技术有限公司;琼脂糖(Agrose)购自Biowest公司;胰蛋白胨和酵母浸出物购自德国OXIDO公司;氯化钠、异丙醇和无水乙醇购自天津市永大化学试剂有限公司;氨苄青霉素购自北京天根生化科技(北京)有限公司;乙二胺四乙酸二钠(EDTA-2Na)购自山东博盛生物科技有限公司;TRIzol试剂、反转录试剂盒和SYBR® Premix Ex TaqTM II购自TaKaRa公司。
1. 2 引物设计与合成
通过GenBank检索从NCBI已公布的猪基因序列中寻找ApoA1基因序列(登录号NP_999563.1),经比对分析最终获得广西巴马小型猪ApoA1相关基因片段,使用Oligo 6.22设计可用于ApoA1基因克隆及进行实时荧光定量PCR(qPCR)分析的特异引物,委托北京六合华大基因科技有限公司合成,引物序列信息详见表1。
1. 3 RNA提取
采用TRIzol法提取广西巴马小型猪心脏、肝脏、脾脏、肺脏和肾脏组织的总RNA,以核酸仪检测RNA的浓度和纯度,并用1.0%琼脂糖凝胶电泳检测其完整性。
1.4 cDNA合成
以广西巴马小型猪肝脏组织总RNA为模板,参照TransScript First-Strand cDNA Synthesis Supermix反转录说明合成cDNA,用于后续基因克隆。
1. 5 目的基因片段扩增与验证
以廣西巴马小型猪肝脏组织cDNA为模板进行PCR扩增,反应体系20.0 μL:cDNA模板2.0 μL,ApoA1-F/ApoA1-R引物(10 μmol/L)各1.0 μL,Taq DNA聚合酶(5 U/µL)10.0 μL,ddH2O 6.0 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,进行34个循环;72 ℃延伸5 min。PCR产物采用1.0%琼脂糖凝胶电泳进行检测,切胶回收后克隆至pMD18-T载体,然后转化DH5α感受态细胞,挑取阳性克隆进行菌液PCR验证并送至深圳华大基因股份有限公司测序。
1. 6 qPCR检测分析
以广西巴马小型猪的心脏、肝脏、脾脏、肺脏和肾脏组织RNA为模板,参照PrimeScript RT Reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明进行qPCR检测,分析广西巴马小型猪ApoA1基因在各脏器组织中的表达情况。
1. 7 生物信息学分析
利用MegAlign、ProtParam、SOPMA、NetPhos、SignalP、SWISS-MODEL等在线分析软件对广西巴马小型猪ApoA1基因及其编码蛋白的理化性质、蛋白磷酸化位点、前体蛋白信号肽、结构域、二级及三级结构等进行预测分析,并基于ApoA1氨基酸序列同源性构建系统发育进化树。
2 结果与分析
2. 1 广西巴马小型猪ApoA1基因克隆及序列分析结果
以广西巴马小型猪肝脏组织cDNA为模板、ApoA1-F和ApoA1-R为引物进行PCR扩增,扩增产物经1.0%琼脂糖凝胶电泳检测,发现在800 bp附近有一条单一、明亮的条带(图1),与预期结果相符。利用MegAlign对扩增获得的广西巴马小型猪ApoA1基因与普通猪相应基因序列(登录号NP-999563.1)进行比对分析,结果发现广西巴马小型猪ApoA1基因编码区(CDS)序列长795 bp,与普通猪ApoA1基因序列的同源性为99.9%。相对于普通猪,广西巴马小型猪ApoA1基因序列第630处的碱基发生突变(图2),导致密码子CTA突变为CTG。由于密码子具有简并性的特点,广西巴马小型猪ApoA1氨基酸序列与普通猪相比并未发生改变,即该基因突变属于同义突变。
2. 2 广西巴马小型猪ApoA1基因在各脏器组织中的表达情况
采用qPCR对广西巴马小型猪心脏、肝脏、脾脏、肺脏和肾脏组织中的ApoA1基因表达情况进行检测,结果发现ApoA1基因在广西巴马小型猪各主要脏器组织中均有表达,且以肝脏中的相对表达量最高、脾脏中的相对表达量最低(图3),二者差异显著(P<0.05)。
2. 3 广西巴马小型猪ApoA1基因编码蛋白的理化性质预测结果
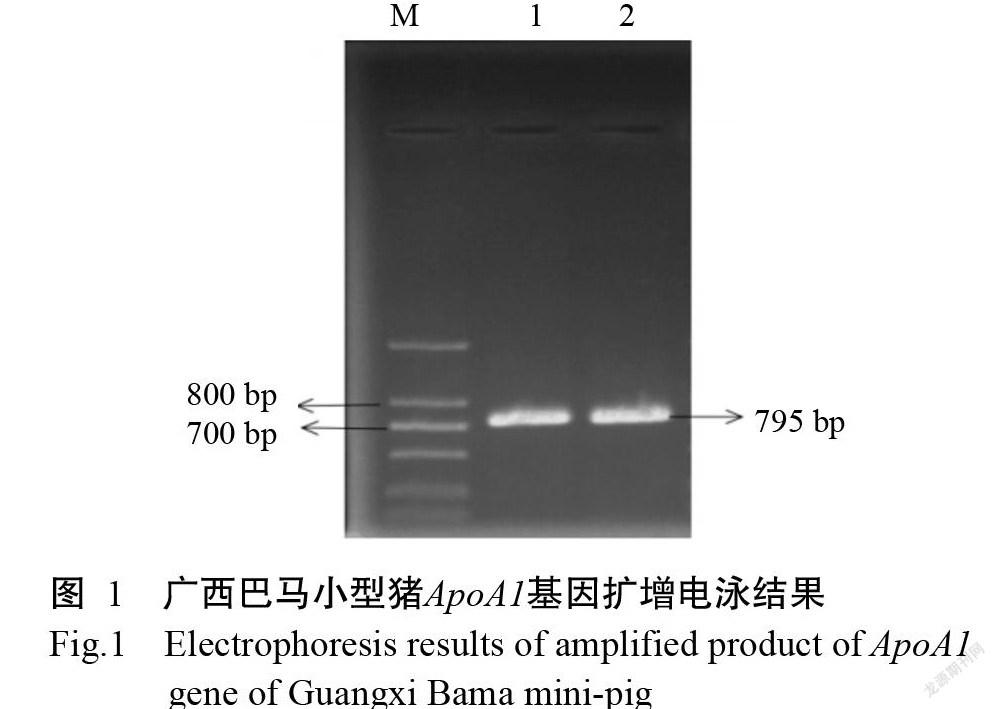
经ProtParam在线预测分析得知广西巴马小型猪ApoA1由264个氨基酸残基构成,其分子式为C1343H2136N376O409S5,蛋白分子量为30254.31 Da,理论等电点(pI)为5.47,表明该蛋白为酸性蛋白,GRAVY为-0.666。采用ProtScale对ApoA1进行亲/疏水性预测分析,结果(图4)表明广西巴马小型猪ApoA1属于亲水性蛋白;以TMHMM对ApoA1进行前体蛋白跨膜螺旋预测,结果(图5)显示广西巴马小型猪ApoA1存在跨膜螺旋,属于跨膜蛋白。
采用NetPhos对广西巴马小型猪ApoA1磷酸化位点的预测结果如图6所示,目标蛋白可能出现的磷酸化位点有18处,包括位于第16、30、47、71、77、115、165、190、211和260位的丝氨酸,对应得分情况为0.70、0.97、0.98、0.58、0.69、0.62、0.92、0.51、0.85和0.79;位于第8、79、82、91、102和138位的苏氨酸,对应得分情况为0.61、0.64、0.73、0.51、0.62和0.75;位于第42和140位的酪氨酸,对应得分情况为0.86和0.92。
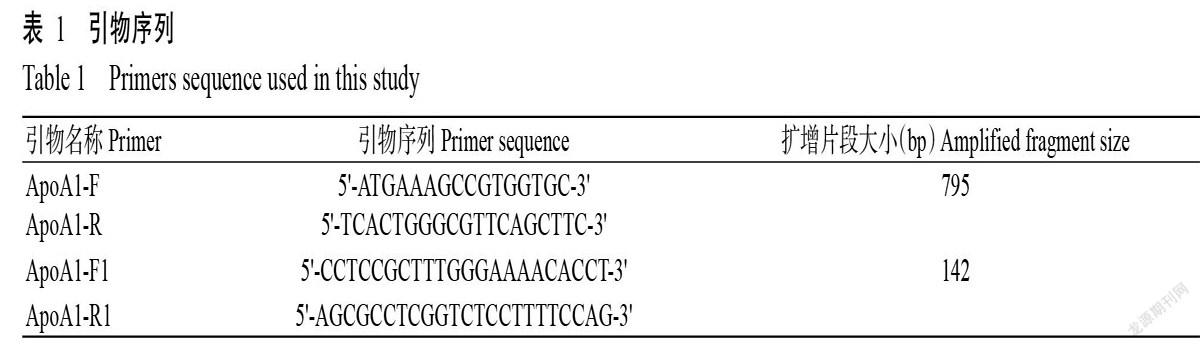
运用SignalP对广西巴马小型猪ApoA1的前体蛋白信号肽进行预测分析,结果(图7)显示,自然分裂的位点分值(C-score)峰值位于第18位,对应分值为0.711;组合分裂的位点分值(Y-score)峰值也位于第18位,对应分值为0.786;但信号肽分值(S-score)在N端没有明显的峰值。综合各分值结果判断,广西巴马小型猪ApoA1中不存在信号肽。
2. 4 广西巴马小型猪ApoA1结构预测分析结果
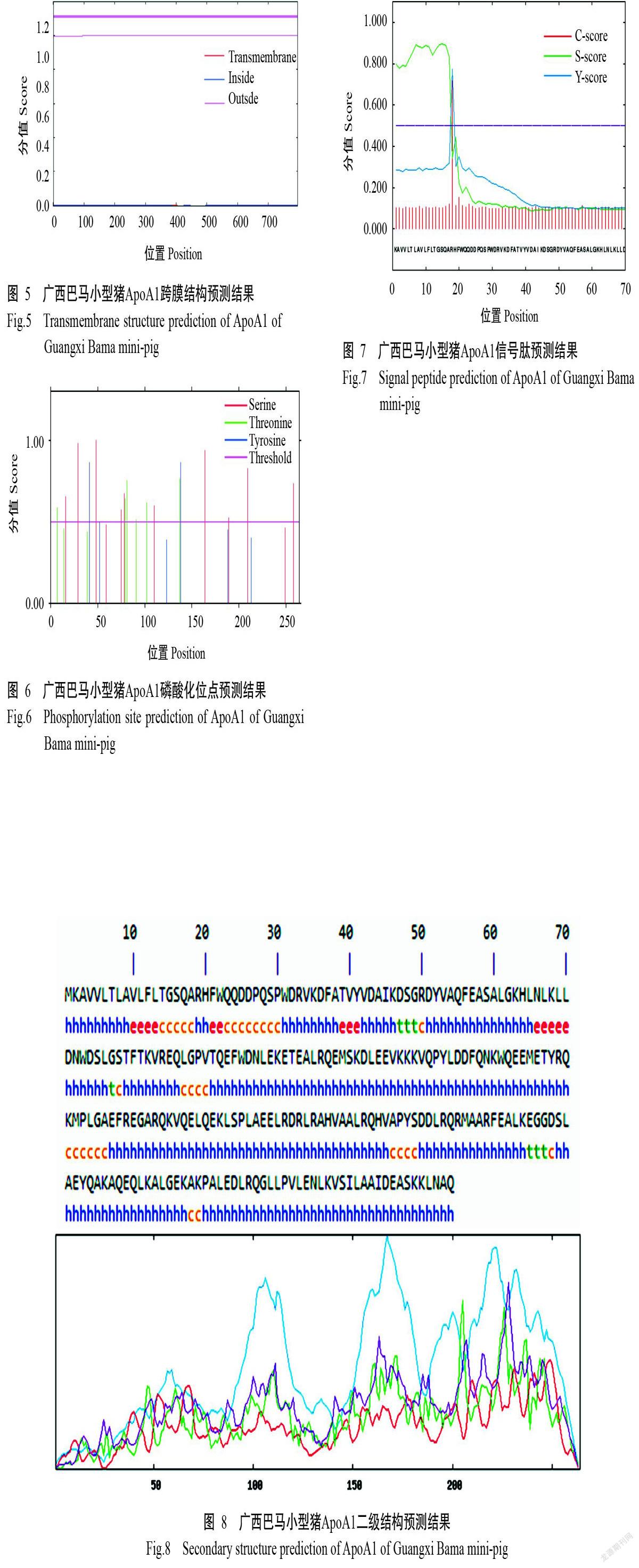
运用SOPMA程序预测广西巴马小型猪ApoA1二级结构,结果(图8)显示,α-螺旋(以h表示)占79.92%,β-折叠(以t表示)占2.65%,无规则卷曲(以c表示)占11.12%,延伸链(以e表示)占6.31%,表明广西巴马小型猪ApoA1主要由α-螺旋和无规卷曲组成。由于α-螺旋占比大于45.00%,同时β-折叠占比小于5.00%,因此推测广西巴马小型猪ApoA1属于全α类蛋白。
运用SWISS-MODEL平台预测广西巴马小型猪ApoA1可能存在的三级结构,结果如图9所示,同源模型为Apolipoprotein A-1(3k2s.1.A),其同源性为80.67%。
2. 5 广西巴马小型猪ApoA1氨基酸序列同源性及系统发育进化分析
利用DNASTAR中的MegAlign对广西巴马小型猪、普通猪(登录号NP_999563.1)、家鼠(登录号NP_033822.2)、兔子(登录号NP_001095157.1)、牛(登录号NP_776667.2)、鸡(登录号NP_990856.1)、猴子(登录号NP_001270674.1)及人类(登录号NP_001304947.1)的ApoA1氨基酸序列进行同源性比对分析,结果表明,广西巴马小型猪ApoA1氨基酸序列与普通猪的同源性最高,为99.6%(图10);与人类和猴子的同源性较低,分别为15.5%和15.1%。由基于ApoA1氨基酸序列同源性构建的系统发育进化树(图11)可看出,广西巴马小型猪与普通猪的亲缘关系最近,与人类和猴子的亲缘关系相对较远,即ApoA1的发育进化符合物种进化规律。
3 讨论
ApoA1对减少胆固醇在血管内壁沉积、降低動脉粥样硬化及冠心病的发病风险具有重要意义(Rader,2006;Ingelsson et al.,2007)。Berisha等(2015)研究表明,表达4WF亚型ApoA1转基因小鼠的HDL丧失抗氧化功能。本研究结果表明,广西巴马小型猪ApoA1由264个氨基酸残基构成,其分子式为C1343H2136N376O409S5,蛋白分子量为30254.31 Da,理论等电点(pI)为5.47,且该蛋白为酸性蛋白,亲水性较强,同时是一种重要的跨膜蛋白,主要承载着物质转运进出细胞的作用,能摄取细胞中游离的胆固醇和磷脂而形成新的HDL(Wang et al.,2017),使血浆中的脂质和胆固醇维持动态平衡。
蛋白磷酸化是经蛋白激酶催化将ATP或GTPγ位磷酸基转移至底物蛋白氨基酸残基(丝氨酸、苏氨酸、酪氨酸)上的过程,是生物体内的一种普通调节方式,在细胞信号转导过程中发挥重要作用(王京兰,2004;Alonzi et al.,2008;Hoofnagle and Heinecke,2009),具体表现为改变蛋白结构,同时激活蛋白活力(Li et al.,2019;Luo et al.,2019)。本研究发现,广西巴马小型猪ApoA1上的丝氨酸磷酸化位点有10处、苏氨酸磷酸化位点有6处、络氨酸磷酸化位点有2处。蛋白磷酸化对蛋白活力及其功能具有极其重要的作用,尤其是通过变构蛋白而激活蛋白活力,对机体内酶活性调节起关键作用;蛋白磷酸化还能为结合蛋白提供结合位点,有利于与其他蛋白相互结合从而形成新的复合体。本研究还发现,广西巴马小型猪ApoA1不存在信号肽,其二级结构预测结果显示,α-螺旋占79.92%,β-折叠占2.65%,无规则卷曲占11.12%,延伸链占6.31%,表明广西巴马小型猪ApoA1主要由α-螺旋和无规卷曲组成。由于α-螺旋占比大于45.00%,同时β-折叠占比小于5.00%,因此推测广西巴马小型猪ApoA1属于全α类蛋白。
同源性在很大程度上能反映各物种间的亲缘关系。相对于普通猪,广西巴马小型猪ApoA1基因序列第630处的碱基发生突变,导致密码子CTA突变为CTG。但由于密码子具有简并性的特点,广西巴马小型猪ApoA1氨基酸序列与普通猪相比并未发生改变,即该基因突变属于同义突变。广西巴马小型猪ApoA1氨基酸序列与普通猪的同源性最高,达99.6%;与人类和猴子的同源性较低,分别为15.5%和15.1%。由基于ApoA1氨基酸序列同源性构建的系统发育进化树也可看出,广西巴马小型猪与普通猪的亲缘关系最近,与人类和猴子的亲缘关系相对较远,即ApoA1的发育进化符合物种进化规律(Hai et al.,2017;Boettcher et al.,2018),说明ApoA1基因编码区在长期生物进化过程中具有一定的保守性。
4 结论
广西巴马小型猪ApoA1基因保守性强,以在肝脏中的表达量最高,是广西巴马小型猪抗动脉粥样硬化的重要因子,通过敲出该基因可制作广西巴马小型猪动脉粥样硬化疾病模型。
参考文献:
陈东,严激. 2010. 动脉粥样硬化中基质金属蛋白酶的研究进展[J]. 安徽医药,14(8):874-876. [Chen D,Yan J. 2010. Progress of matrix metalloproteinase research in atherosclerosis[J]. Anhui Medical and Pharmaceutical Journal,14(8):874-876.]
阚延泽,江翱,孙文秀,李伟. 2016. 黄鳝载脂蛋白A1的基因结构及表达谱分析[J]. 水产科学,35(6):697-701. [Kan Y Z,Jiang A,Sun W X,Li W. 2016. Gene structure and expression of ApoA1 gene from swamp eel[J]. Fisheries Science,35(6):697-701.]
雷蕾,陳丽. 2011. 血浆载脂蛋白与冠心病的相关性研究[J]. 当代医学,17(12):13-14. [Lei L,Chen L. 2011. Study on the correlation between plasma apolipoprotein and coro-nary heart disease[J]. Contemporary Medicine,17(12):13-14.]
李芳芳,郭亚芬,兰干球,潘堂峰. 2014. 广西巴马小型猪GHRH成熟肽真核表达质粒对小鼠生长效应的影响[J]. 南方农业学报,45(12):2264-2269. [Li F F,Guo Y F,Lan G Q,Pan T F. 2014. Eukaryotic expression plasmid of GHRH mature peptide from Guangxi Bama Mini-pig and its influence on mouse growth effect[J]. Journal of Southern Agriculture,45(12):2264-2269.
李龙,司景磊,夏攀洁,何剑雄,吴延军,程晓芳,吴敏,徐文文,兰干球. 2017. 广西巴马小型猪Neuritin基因克隆与生物信息学分析及真核表达载体的构建[J]. 基因组学与应用生物学,36(2):557-563. [Li L,Si J L,Xia P J,He J X,Wu Y J, Cheng X F,Wu M,Xu W W,Lan G Q. 2017. Cloning and bioinformatics analysis of Neuritin gene from Guangxi Bama Mini-pig and construction of its eukaryotic expression vector[J]. Genomics and Applied Biology,36(2):557-563.]
刘培彬,叶子璐,蔡潭溪,戴绍军,杨福全. 2014. 脂蛋白质组学研究进展[J]. 生物化学与生物物理进展,41(12):1197-1206. [Liu P B,Ye Z L,Cai T X,Dai S J,Yang F Q. 2014. The research advances in lipoproteinomics[J]. Progress in Biochemistry and Biophysics,41(12):1197-1206.]
麻延峰,方倩倩,王宏艳,田勇,唐军旺,邵荣益,卢立志.2015. 鹅ApoA1、CD36和DGAT2基因的cDNA克隆与序列分析[J]. 浙江农业学报,27(10):1710-1719. [Ma Y F,Fang Q Q,Wang H Y,Tian Y,Tang J W,Shao R Y,Lu L Z. 2015. cDNA cloning and sequence analysis of ApoA1,CD36 and DGAT2 genes from goose[J]. Acta Agriculturae Zhejiangensis,27(10):1710-1719.]
申玉建,方程,邱庆庆,司景磊,吴延军,杨祝良,杨秀荣,郭亚芬,蒋和生. 2017. 广西巴马小型猪PPARγ基因克隆及组织表达差异分析[J]. 南方农业学报,48(10):1884-1890. [Shen Y J,Fang C,Qiu Q Q,Si J L,Wu Y J,Yang Z L,Yang X R,Guo Y F,Jiang H S. 2017. Cloning of gene PPARγ from Guangxi Bama mini-pig and tissue expre-ssion difference analysis for it[J]. Journal of Southern Agriculture,48(10):1884-1890.]
宋少锐,吴延军,蒋世强,张名媛,郭亚芬,兰干球,蒋钦杨. 2014. 广西巴马小型猪MCP-1基因克隆及序列分析[J]. 南方农业学报,45(9):1669-1673. [Song S R,Wu Y J,Jiang S Q,Zhang M Y,Guo Y F,Lan G Q,Jiang Q Y. 2014. Cloning and analysis of MCP-1 gene in Guangxi Bama mini-pig[J]. Journal of Southern Agriculture,45(9):1669-1673.]
汤磊乐,黄卓山,郑坚锐,陈璘. 2017. 载脂蛋白A1和载脂蛋白B100在冠脉病变进展中的作用[J]. 中山大学学报(医学科学版),38(3):395-400. [Tang L L,Huang Z S,Zheng J R,Chen L. 2017. Effects of APOA1 and APOB100 on progression of coronary artery lesion[J]. Journal of Sun Yat-sen University (Medical Sciences),38(3):395-400.]
田迪. 2013. 辛伐他汀联合载脂蛋白A-I模拟肽L-4F对apoE基因缺失小鼠高密度脂蛋白抗炎抗氧化功能和动脉粥样硬化的影响[D]. 广州:南方医科大学. [Tian D. 2013. Simvastatin combination with ApoA-I mimetic peptide L-4F improve the anti-oxidant and anti-inflammatory pro-perties of high density lipoprotein and reduce atherosclerosis in apoE knockout mice[D]. Guangzhou:Southern Me-dical University.]
萬洁. 2008. 兔Apo-A1基因多态性及其与部分生产性状的关联研究[D]. 雅安:四川农业大学. [Wan J. 2008. Correlation analysis of production trait and the polymorphism of Apo-A1 gene in rabbits[D]. Ya’an:Sichuan Agricultural University.]
王京兰. 2004. 磷酸化蛋白质分析方法研究及其在人胎肝磷酸化蛋白质组研究中的应用[D]. 北京:中国人民解放军军事医学科学院. [Wang J L. 2004. Analysis of phosphorylated protein and its application in human fetal he-parin[D]. Beijing:Academy of Military Medical Sciences.]
吴丹,兰干球,郭亚芬,陈宝剑,陈少梅,蒋钦杨. 2013. 广西巴马小型猪α干扰素基因克隆及其真核表达载体的构建[J]. 南方农业学报,44(9):1558-1563. [Wu D,Lan G Q,Guo Y F,Chen B J,Chen S M,Jiang Q Y. 2013. Clo-ning interferon-α gene of Guangxi Bama mini-pig and constructing its eukaryotic expression vector[J]. Journal of Southern Agriculture,44(9):1558-1563.]
熊婷. 2012. 鸡ApoA-1和ApoA-V基因多态性与胆固醇含量及繁殖性状的关联研究[D]. 雅安:四川农业大学. [Xiong T. 2012. Polymorphisms of chicken ApoA-1 and ApoA-V gene and its association with cholesterol content and reproductive traits[D]. Ya’an:Sichuan Agricultural University.]
張广杰,崔悦悦,邱庆庆,夏琴,李龙,司景磊,夏攀杰,邹辉,兰干球. 2018. 广西巴马小型猪SP1基因克隆测序及其真核表达载体的构建[J]. 南方农业学报,49(2):360-366. [Zhang G J,Cui Y Y,Qiu Q Q,Xia Q,Li L,Si J L,Xia P J,Zou H,Lan G Q. 2018. Cloning sequencing of gene SP1 in Guangxi Bama mini pig and construction of its eukaryotic expression vector[J]. Journal of Southern A-griculture,49(2):360-366.]
张晶. 2012. 猪脂肪沉积关键基因的初步筛选[D]. 郑州:河南农业大学. [Zhang J. 2012. Preliminary screening of the key genes of pig fat depositio[D]. Zhengzhou:Henan A-gricultural University.]
张旭,高昆,张海涛,高翔,葛文平,张小娟,张连峰,董伟.2011. 人载脂蛋白A1 基因转基因小鼠的建立[J]. 中国实验动物学报,19(6):461-464. [Zhang X,Gao K,Zhang H T,Gao X,Ge W P,Zhang X J,Zhang L F,Dong W. 2011. Establishment of a human ApoA1 transgenic mouse model[J]. Acta Laboratorium Animalis Scien-tia Sinica,19(6):461-464.]
赵佳福,段志强,杨远青,嵇辛勤,王圆圆,孙成娟. 2017. 从江香猪ApoA1基因的克隆及亚细胞定位研究[J]. 中国畜牧兽医,44(7):1954-1960. [Zhao J F,Duan Z Q,Yang Y Q,Ji X Q,Wang Y Y,Sun C J. 2017. Cloning and subcellular localization of ApoA1 gene in Congjiang Xiang pig[J]. Chinese Animal Husbandry & Veterinary Medicine,44(7):1954-1960.]
赵佳福,杨远青,段志强,阮涌,倪萌萌,嵇辛勤. 2018. 从江香猪ApoA1、ApoC3、ApoE基因在组织器官中表达差异分析[J].黑龙江畜牧兽医,(3):132-136. [Zhao J F,Yang Y Q,Duan Z Q,Ruan Y,Ni M M,Ji X Q. 2018. The analysis on the different expressions of ApoA1,ApoC3,ApoE genes in tissues and organs of Congjiang xiang pig[J]. Heilongjiang Animal Science and Veterinary Medicine,(3):1954-1960.]
Alonzi T,Mancone C,Amicone L,Tripodi M. 2008. Elucidation of lipoprotein particles structure by proteomic analysis[J]. Expert Review of Proteomics,5(1):91-104.
Berisha S Z,Brubaker G,Kasumov T,Hung K T,Dibello P M,Huang Y,Li L,Willard B,Pollard K A,Nagy L E,Hazen S L,Smith J D. 2015. HDL from apoA1 transgenic mice expressing the 4WF isoform is resistant to oxidative loss of function[J]. Journal of Lipid Research,56(3):653-664.
Boettcher A,Loving C,Cunnick J,Tuggle C K. 2018. Deve-lopment of severe combined immunodeficient(SCID) pig models for translational cancer modeling:Future insights on how humanized SCID pigs can improve preclinical cancer research[J]. Frontiers in Oncology,8:559. doi: 10.3389/fonc.2018.00559.
Chistiakov D A,Orekhov A N,Bobryshev Y V. 2016. ApoA1 and ApoA1-specific self-antibodies in cardiovascular di-sease[J]. Laboratory Investigation,96(7):708-718.
Hai T,Guo W,Yao J,Cao C,Luo A,Qi M,Wang X,Wang X,Huang J,Zhang Y,Zhang H,Wang D,Shang H,Hong Q,Zhang R,Jia Q,Zheng Q,Qin G,Li Y,Zhang T,Jin W,Chen Z Y,Wang H,Zhou Q,Meng A,Wei H,Yang S,Zhao J. 2017. Creation of miniature pig model of human Waardenburg syndrome type 2A by ENU mutagenesis[J]. Human Genetics,136(11-12):1463-1475.
Heinecke J W. 2013. HDL’s protein cargo:Friend or foe in cardioprotection?[J]. Circulation,127(8):868-869.
Hoofnagle A N,Heinecke J W. 2009. Lipoproteomics:Using mass spectrometry-based proteomics to explore the a-ssembly,structure,and function of lipoproteins[J]. Journal of Lipid Research,50(10):1967-1975.
Ingelsson E,Schaefer E J,Contois J H,Mcnamara J R,Sullivan L,Keyes M J,Pencina M J,Schoonmaker C,Wilson P W,D'Agostino R B,Vasan R S. 2007. Clinical utility of different lipid measures for prediction of coronary heart disease in men and women[J]. The Journal of the American Medical Association,298(7):776-785.
Li Y,Cheng Y W,Zhu T Y,Zhang H,Li W,Guo Y S,Qi Y L,Chen X,Zhang J,Sha J H,Zhou Z M,Zhu H,Guo X J. 2019. The protein phosphorylation landscape of mouse spermatids during spermiogenesis[J]. Proteomics,19(11). doi: 10.1002/pmic.201900055.
Luo F,Wang M,Liu Y,Zhao X M,Li A. 2019. DeepPhos:Prediction of protein phosphorylation sites with deep learning[J]. Bioinformatics. doi: 10.1093/bioinformatics/bty1051.
Rader D J. 2006. Molecular regulation of HDL metabolism and function:Implications for novel therapies[J]. The Journal of Clinical Investigation,116(12):3090-3100.
Wang X P,He J,Guo H,Mu L,Hu Y H,Ma J L,Yan Y Z,Ma R L,Li S G,Ding Y S,Zhang M,Niu Q,Liu J M,Zhang J Y,Guo S X. 2017. Interactions of six SNPs in APOA1 gene and types of obesity on low HDL-C disease in Xinjiang pastoral area of China[J]. Lipids in Health and Disease,16:187.
Wu Y J,Zhang L,Liang J,Jiang Q Y,Guo Y F,Lan G Q. 2018. Comparative analysis on liver transcriptome profiles of different methods to establish type 2 diabetes mellitus models in Guangxi Bama mini-pig[J]. Gene,673:194-200.
Yan X Y,Wu Y J,Zhong F J,Jiang Q Y,Zhou T T,Guo Y F,Yang X R,Liang J,Liao J D,Lan G Q. 2018. iTRAQ and PRM-based quantitative proteomics in T2DM-susceptible and -tolerant models of Bama mini-pig[J]. Gene,675:119-127.
Zhang Y,Zhang L,Wang Y,Ding H,Xue S,Yu H,Hu L,Qi H,Wang Y,Zhu W,Liu D,Li P. 2019. KCNQ1OT1,HIF1A-AS2 and APOA1-AS are promising novel biomarkers for diagnosis of coronary artery disease[J]. Cli-nical and Experimental Pharmacology and Physiology,46(7):635-642.
(責任编辑 兰宗宝)

