叠氮化钠诱导细胞线粒体损伤及mtDNA的释放
胡好 江亭 方义军 傅雅娟



摘 要:线粒体是真核细胞中具有重大作用的细胞器,在调控细胞凋亡等方面也发挥着重要作用。一旦线粒体受到损伤且无法发挥其正常功能,将会导致细胞内环境变化,最终导致组织、器官损伤病变,尤其对能量要求较高的一些组织或者器官影响很大。希望探索线粒体损伤机制,减少线粒体损伤及其影响。通过叠氮化钠建立线粒体损伤模型,并通过检测叠氮化钠刺激后细胞中腺嘌呤核苷三磷酸水平以及线粒体膜电位变化情况等方法证实建立的线粒体损伤模型是有效的,可用于线粒体损伤机制的研究。成功使用叠氮化钠刺激L929细胞系建立线粒体损伤模型,并在离体线粒体损伤中检测到mtDNA的释放。叠氮化钠使用的最佳质量浓度会对线粒体产生损伤,并影响其正常功能,且对细胞活率影响不大。
关键词:叠氮化钠;线粒体损伤;线粒体
线粒体是真核生物细胞中一种重要的细胞器,通过有氧呼吸为细胞活动提供能量,维持细胞内离子平衡,产生活性氧,通过与内质网等合作维持细胞中钙离子的动态平衡[1],通过控制膜电位调控细胞增殖、凋亡。所以一旦线粒体损伤会对细胞的生命活动造成很大的影响,会影响腺嘌呤核苷三磷酸(Adenosine Triphosphate,ATP)的产生,从而产生过多的氧自由基,使得线粒体膜电位发生变化、功能紊乱,引发细胞凋亡。在植物中,线粒体功能障碍与细胞质雄性不育有直接联系[2]。植物线粒体中的物质运输、呼吸作用等对能量需求极高,能量的供应直接影响整个植物的生命活动[3]。目前研究发现,线粒体涉及细胞生长、增殖、分化和凋亡等各个方面。线粒体功能衰退导致氧自由基大幅度增加,使得细胞衰老;线粒体的结构、功能以及数目的异常会引发心肌能量代谢异常[4],线粒体自噬在心肌缺血的作用也逐渐引起研究学者的注意;1996年,Varming[5]利用叠氮化钠诱发的线粒体损伤模型筛选潜在的神经保护的化合物。在细胞环境中加入叠氮化钠希望造成线粒体损伤,成功建立线粒体损伤模型,有利于了解线粒体损伤发生的机制、了解线粒体疾病发病机制,筛选治疗线粒体损伤疾病的治疗药物。
1 材料与方法
1.1 主要试剂
主要试剂如表1所示。
1.2 细胞生存率的测定
将L929细胞以合适密度铺在96孔板中,过夜培养,12 h后加入10 µL不同质量浓度叠氮化钠刺激,对照组加10 µL磷酸缓冲盐溶液(Phosphate Buffer Saline,PBS)。放入培养箱一段时间后,使得叠氮化钠进入细胞并造成损伤,每孔各添加20 µL MTT溶液,孵育4 h,有活性的琥珀酸脱氫酶可将MTT还原得到甲瓒,蓝紫色结晶沉淀。之后吸取上清,在96孔板中每孔添加200 µL DMSO用于溶解甲瓒。最后使用酶标仪读取波长490处甲瓒的OD值。死细胞中没有还原甲瓒,通过这种方式判断细胞生存率。
1.3 线粒体膜电位的测定
同上步骤,将载玻片洗干净固定并加入细胞过夜培养使细胞贴壁。第二天更换培养基并加不同质量浓度叠氮化钠刺激。空白对照加同等体积PBS缓冲液,阳性对照加入碳酰氰基-对-氯苯腙(CCCP),共孵育6 h,用PBS洗涤一次后,加入1 mL新鲜培养基和1 mL的JC-1染色工作液,37 ℃孵育20 min完成后,使用染色缓冲液清洗,最后使用多聚甲醛固定,用荧光共聚焦显微镜观察。若是观察到大批红光,判断线粒体膜电位正常;若观察到绿光,则判断线粒体膜电位不正常。
1.4 三磷酸腺苷含量的测定
首先,将L929细胞铺于6孔板中,饥饿处理12 h后,加入不同质量浓度叠氮化钠刺激细胞,刺激6 h后破碎细胞,从上清中提取其中ATP,并使用试剂盒中裂解缓冲液稀释ATP标准品,将样品和标准品混匀,保持低温,用酶标仪检测相对光单位(relative light unit,RLU)值。最后计算ATP质量分数。
1.5 小鼠肝脏线粒体体外损伤
本实验选择易于得到的小鼠肝脏作为线粒体来源,肝脏细胞内含有大量线粒体。将小鼠麻醉,快速取出肝脏,剪掉多余组织,用手术刀快速切成小的薄片,使用匀浆缓冲液冲洗表面血色,在Dounce匀浆器中制备组织匀浆。匀浆结束后,1 300 g离心10 min,取上清,再次离心,重复几次后,吸出上清,置于冰上保存,最后使用17 000 g高速离心15 min使线粒体沉淀,弃去上清,用缓冲液漂洗线粒体3遍。
实验需要得到纯线粒体,需要上步得到的线粒体去掉杂质,首先将线粒体储液低速离心,此时沉淀是含有大量杂质的线粒体,使用15%的percoll溶液重悬,使用吸管小心加到40% percoll上,利用密度梯度离心5 000 g离心25 min,纯线粒体位于15%和40% percoll界面之间,小心吸出,17 000 g离心10 min,使用少量测试缓冲液重悬沉淀,得到的即是纯线粒体。将纯线粒体均分成3份,分别加入PBS缓冲液和叠氮化钠(50 mmol/L)置于37 ℃培养箱反应15 min,取出后将线粒体离心沉淀,检测上清液中核DNA和mtDNA的表达。
2 结果与讨论
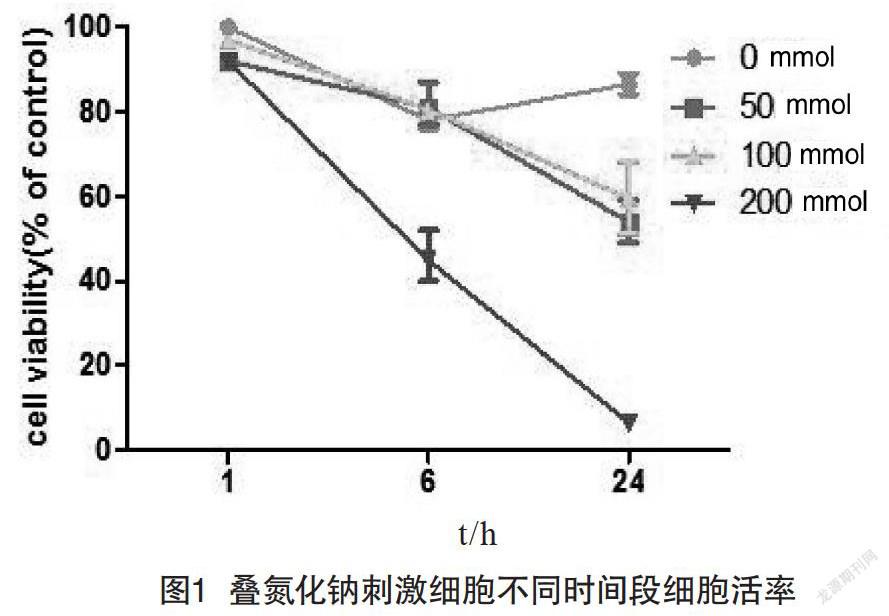
2.1 叠氮化钠刺激L929细胞后降低细胞活率
使用MTT的传统方法检测叠氮化钠刺激细胞后细胞数量的变化。通过加入不同质量浓度的叠氮化钠与L929细胞共孵育,在不同时间检测叠氮化钠对L929细胞的影响,判断叠氮化钠质量分数过低,则无法对线粒体造成损伤,若质量分数过高,则细胞死亡过多。通过结果可以看出,200 mmol/L的叠氮化钠与L929细胞共孵育6 h后,细胞存活率几乎降到10%,50 mmol/L和100 mmol/L叠氮化钠刺激对细胞活率的影响较为接近。
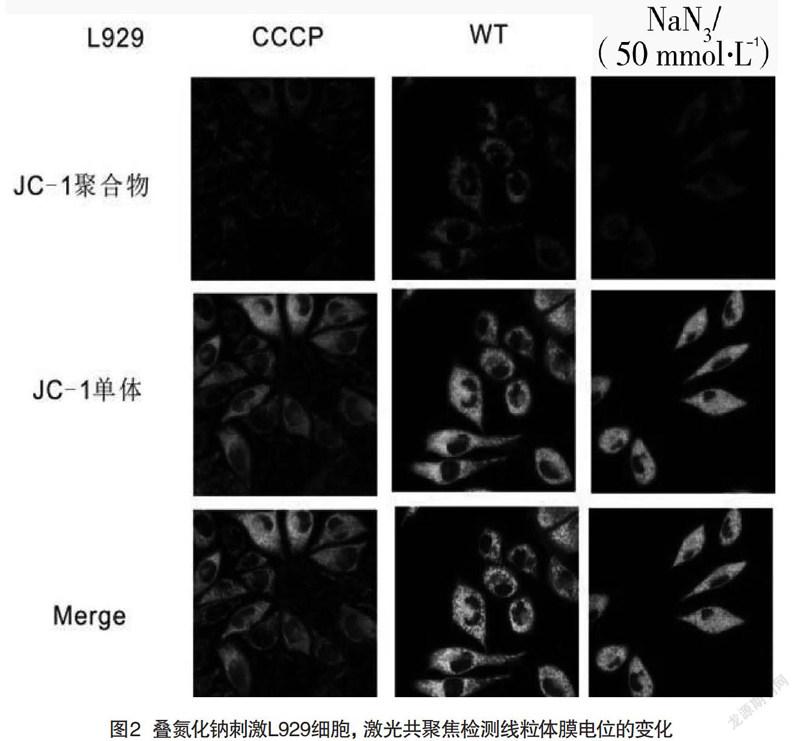
2.2 NaN3刺激L929細胞后线粒体膜电位的变化
线粒体功能的正常实施必须具备有效的线粒体膜电位,使用JC-1探针检测使用叠氮化钠刺激后细胞膜电位是否变化,其中,CCCP为阳性刺激物,可在较短时间内显著性损伤线粒体膜电位。由图2可以看出control组JC-1聚合物比列较高,观察到强烈红光,而CCCP对照组和50 mmol/L叠氮化钠处理组的红光都很弱,判断叠氮化钠对线粒体的膜电位造成了显著性损伤。
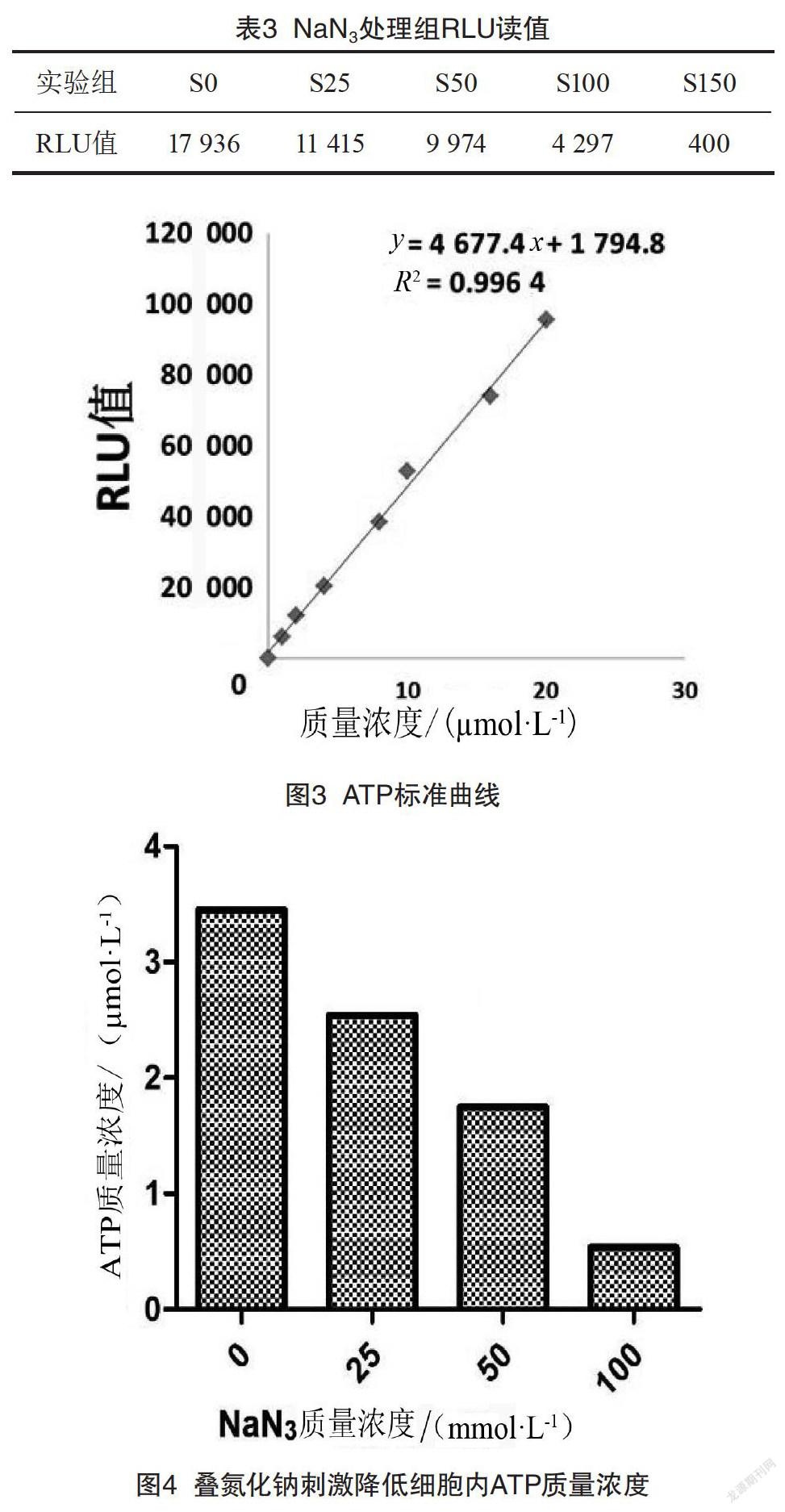
2.3 NaN3刺激L929细胞后细胞内ATP质量分数的变化
本实验采用ATP检测试剂盒检测不同质量浓度叠氮化钠处理后细胞内ATP总量的变化。表2—3分别为ATP标准品和叠氮化钠处理组的RLU读数。从图3—4可以看出,随着叠氮化钠刺激质量浓度的升高,L929细胞ATP的合成能力下降。
2.4 NaN3刺激离体线粒体
经percoll分离获得的小鼠肝脏线粒体,均分两份,并重悬于缓冲溶液中,分别加入叠氮化钠和等体积PBS。如图5—6所示,用50 mmol/L的叠氮化钠处理离体线粒体后,有大量的mtDNA释放到线粒体外。
3 结语
线粒体作为真核细胞中重要的细胞器,一旦线粒体损伤,无法正常发挥功能,对细胞的自身影响巨大。有研究报道,在过去的20年中,线粒体DNA(mtDNA)的突变已成为人类遗传疾病的主要原因。临床上,这种疾病在10 000名成年人中有1名,但在200个背景人群中有1个发现了致病性突变。已有大量研究证实,叠氮化钠可以有效抑制线粒体呼吸链复合物IV,抑制ATP合成、超氧化歧化酶和DNA合成酶的活性。
使用叠氮化钠进行线粒体损伤模型,使用叠氮化钠刺激后会对细胞活率造成影响,使用MTT法检测不同质量浓度的叠氮化钠对细胞活率的影响,在使用叠氮化钠刺激时减小对细胞活率的影响;通过检测细胞ATP的方法观察随着叠氮化钠的浓度升高,细胞内ATP含量显著下降;激光共聚焦显示,50 mmol/L质量浓度叠氮化钠对细胞造成了线粒体的明显损伤,膜电位极性不正常。以上证实线粒体损伤模型的建立是成功的。另外,在损伤模型中发现,线粒体损伤后,会有mtDNA释放到胞质中,这是因为mtDNA没有组蛋白的保护,对氧自由基引发的氧化损伤极为敏感,线粒体损伤会导致电子传递链中电子泄露,电子泄露引起氧自由基释放,mtDNA没有组蛋白的保护在高变区极易断裂进而释放到线粒体外。本实验探索了一个合适的线粒体损伤条件,这对研究线粒体损伤机制尤为重要。
[参考文献]
[1]MARCHI D,BONORA E M,GIORGI C,et al.The mitochondrial permeability transition pore is a dispensable element for mitochondrial calcium efflux[J].Cell Calcium,2014,56(1):1-13.
[2]CHEN L,LIU Y G.Male sterility and fertility restoration in crops[J].Annual Review of Plant Biology,2014,65(1):579-606.
[3]宋海泉.植物线粒体的物质运输[J].长沙水电师院学报,1988(3):95-101.
[4]LIU T,TAKIMOTO E,DIMAANO V L,et al.Inhibiting mitochondrial Na+/Ca2+ exchange prevents sudden death in a guinea pig model of heart failure[J].Circulation Research,2014,115(1):44-54.
[5]VARMING T,DREJER J,FRANDSEN A,et al.Characterization of a chemical anoxia model in cerebellar granule neurons using sodium azide:Protection by nifedipine and MK-801[J].Journal of Neuroscience Research,1996,44(1):40-46.

