益肺饮联合CIK细胞对肺癌A549细胞免疫逃逸干预的研究
孙凯廷 蔡美 曾梅艳
〔摘要〕 目的 通過对肺癌细胞增殖和凋亡的分析以及肺癌细胞TGF-β、VEGF的表达情况,从分子水平上观察益肺饮和CIK细胞联合应用时对肺癌细胞免疫逃逸的影响。方法 将肺癌细胞分为6组进行干预,A:10% FBS组、B:无药血清组、C:CIK+无药血清组、D:益肺饮组、E:CIK组、F:益肺饮+CIK组。采用CCK-8法、流式细胞仪检测A549细胞的增殖、凋亡情况,运用ELISA法检测A549细胞TGF-β、VEGF的表达情况。结果 (1)与A、B组比较,益肺饮和CIK单用或联用时有明显的增殖抑制、诱导细胞凋亡的作用(P<0.05);E组与F组比较,肺癌细胞的增殖、凋亡情况无明显差异(P>0.05)。(2)相比于A、B组,D、E、F组对TGF-β、VEGF的分泌均有抑制作用(P<0.05)。与D、E组比较,F组对TGF-β的抑制效果最明显(P<0.05),但VEGF的表达情况无明显差异(P>0.05)。结论 益肺饮与CIK细胞联合应用能增强对肺癌细胞TGF-β的抑制效果,但对VEGF的抑制效果无明显增强作用;不能增强对A549细胞增值抑制和诱导凋亡的作用。
〔关键词〕 益肺饮;肺癌;CIK;细胞凋亡;免疫逃逸
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.09.007
Study on Intervention of Yifei Decoction Combined with CIK Cells in Immune
Escape of Lung Cancer A549 Cells
SUN Kaiting1, CAI Mei2*, ZENG Meiyan1
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The Affiliated Hospital of Hunan
Academy of Traditional Chinese Medicine, Changsha, Hunan 410006, China)
〔Abstract〕 Objective To observe the effects of Yifei Decoction combined with CIK cells in immune escape of lung cancer cells at molecular level, through analysis of proliferation and apoptosis of lung cancer cells and expressions of transforming growth factor-β (TGF-β) and VEGF in the lung cancer cells. Methods The lung cancer cells were divided into 6 groups for intervention. A: 10% FBS group, B: drug-free serum group, C: CIK + drug-free serum group, D: Yifei Decoction group, E: CIK group, and F: Yifei Decoction + CIK group. The proliferation and apoptosis of A549 cells were detected by CCK-8 method and flow cytometry. ELISA was used to detect the expressions of TGF-β and VEGF in A549 cells. Results (1) Compared with the group A and the group B, single use of Yifei Decoction or CIK, or their combination showed significant effects of inhibition on proliferation and induction of apoptosis (P<0.05). There was no significant difference in proliferation and apoptosis of lung cancer cells between the group E and the group F (P>0.05). (2) Compared with the groups A and B, there was an effect of inhibition on the secretion of TGF-β and VEGF in the groups D, E and F (P<0.05). Compared with the groups D and E, there was the most obvious inhibitory effect on TGF-β in the group F (P<0.05), but there was no significant difference in the expression of VEGF (P>0.05). Conclusion Yifei Decoction can enhance the inhibitory effect on TGF-β in lung cancer cells when combined with CIK cells, but it has no obvious enhancement effect on the inhibition of VEGF. And it can not enhance the inhibition of proliferation and induction of apoptosis in A549 cells.
〔Keywords〕 Yifei Decoction; lung cancer; CIK; cell apoptosis; immune escape
由于肿瘤免疫逃逸机制的存在,肿瘤细胞可以通过一系列手段避开免疫系统的监视和杀伤,从而使肿瘤发生进展、转移。基于此,随着对肿瘤免疫机制的研究逐渐深入,肿瘤的免疫治疗成为了当今研究的一大热点,越来越多的免疫治疗策略面世,为肿瘤患者带来了新的福音,如过继免疫治疗、肺癌疫苗、免疫检查点抑制等[1]。细胞因子诱导杀伤(cytokine induced killer, CIK)细胞是将游离人体的外周血单个核细胞加入多种细胞因子后培养一段时间后获得的细胞。CIK具有抗肿瘤活性强,杀瘤谱广,且具有很强的体外扩增能力等特点,作为过继免疫治疗的代表,具有明确的抗肿瘤效应[2]。
肿瘤的免疫逃逸机制非常复杂,而其分泌相关的免疫抑制因子是其中重要的机制之一,如转化生长因子-β(transforming growth factor-β,TGF-β)[3]、血管内皮生长因子(vascular endothelial growth,VEGF)[4]等,能够改变肿瘤微环境,抑制肿瘤免疫反应。作为肿瘤免疫逃逸的头号主导者,大量实验证明TGF-β通过多条途径来发挥免疫抑制作用,如抑制免疫细胞的增殖和活化、调节细胞表型、抑制淋巴细胞分化、促进Treg细胞(一类能发挥重要肿瘤免疫抑制作用的调节性T细胞)的产生等[5-6]。VEGF能够刺激内皮细胞的增殖和存活,导致新血管的形成,除此之外,VEGF能够通过多种途径发挥免疫抑制的作用,包括促进抑制性免疫细胞亚群的扩增[7]。同时针对VEGF的免疫抑制剂也一直是研究的热点,联合VEGF免疫抑制剂的抗肿瘤治疗有望在未来成为新的治疗策略[8]。
诸多研究表明,中医药可以下调TGF-β、VEGF等免疫抑制因子的表达[9]。因此,以提高患者生存质量,改善患者症状,调节患者免疫功能的生物免疫联合中医药治疗模式可能成为肺癌治疗的趋势。
中药复方益肺饮临床用于治疗老年肺癌有一定的疗效,我们前期的实验研究表明益肺饮具有良好的抑制肺癌细胞增殖诱导凋亡的作用。本研究通过益肺饮含药血清联合CIK细胞,观察对肺癌细胞增殖、凋亡以及免疫逃逸相关因子VEGF、TGF-β的影响,以进一步探索益肺饮的抗肿瘤机制。
1 材料与方法
1.1 实验动物
20只SD大鼠,雄性,体质量为(200±20)g,SPF级,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2016-0002。
1.2 实验细胞
人肺癌细胞A549,由中国科学院干细胞库提供。外周血单个核细胞(peripheral blood mononuclear cell, PBMC):CIK细胞的前体细胞,由健康志愿者获得知情同意后捐献。
1.3 实验药材
益肺饮:黄芪15 g,臭牡丹15 g,党参15 g,茯苓10 g,土鳖虫5 g,白术10 g,土贝母5 g,陈皮10 g,淫羊藿10 g,法半夏10 g,白花蛇舌草15 g,补骨脂10 g,瓜蒌壳10 g,半枝莲15 g,甘草5 g。以上饮片采购于湖南省中医药研究院名医堂中药房,由湖南省中医药研究院中药师彭伟鉴定。
1.4 主要试剂与仪器
PRMI 1640培养基、FBS 胎牛血清、L-Glutamine、200 mmol/L Solution均购自美国 Gibco 公司;Ficoll淋巴细胞分离液(美国GE Healthcare Bioscience公司);人IFN-γ、IL-1α、IL-2均购自美国Peprotech公司;抗CD3单克隆抗体Anti-Human CD3(eBioscience公司);Annexin V FITC/PI Kit、Anti-Human CD56, APC、Anti-Human CD8,PE、Anti-Human CD3, FITC均购自杭州联科生物技术股份有限公司;CCK-8试剂盒(上海七海复泰生物科技有限公司)。流式细胞仪(BDFACSJazz碧迪医疗器械有限公司);酶标仪(MK3上海赛默生物科技发展有限公司)。
1.5 主要试剂配制
CIK培养基:1640培养基,加1 000 U/mL的IL-2,1%的L-谷氨酰胺,10%的FBS。
1.6 方法
通过前期的浓度筛选,益肺饮含药血清浓度在15%时,对肺癌A549细胞的增殖、凋亡都有较好的作用。故本实验取15%浓度进行试验。
1.6.1 含药血清制备 将益肺饮药物煎煮好后,减压浓缩(减压薄膜浓缩法:浓缩温度80 ℃,浓缩转速30 r/min),浓缩至432 mL,浓度约为2.22 g/mL,密封后4 ℃保存备用。将大鼠20只,分为2组,每组10只,设实验组予益肺饮灌胃,对照组予等量生理盐水灌胃。益肺饮方,按人和动物体表面积折算的等效剂量比率表计算,200 g大鼠等效量为160/60×6.25×4=66.7(g/kg),大鼠灌胃体积按1.5 mL/100 g,每日2次,连续3 d,第4天1次服用全天剂量,灌胃2 h后,麻醉解剖,腹主动脉采血,离心分离血清,获得实验组血清(含药血清)及对照组血清(无药血清),标记后,-40 ℃储存备用。
1.6.2 CIK细胞培养 收集健康志愿者外周血,采用Ficoll-Hypaque密度梯度离心法[10]分离PBMC,取15 mL Ficoll淋巴细胞分离液加入至50 mL离心管中,加入1∶1盐水稀释的30 mL血液稀释液沿管壁缓慢加至Ficoll淋巴细胞分离液面上;离心;可见离心管中出现明显的分层,从上到下依次为稀释的血浆混合液层、單核细胞层、分离液层、红细胞层。小心吸取单核细胞层,置于新的离心管中,加入适量的生理盐水。再次离心;重复上述步骤离心洗涤2次,获得细胞。
将获得的PBMC用1 640培养基(含10% FBS)按照1×106个/mL密度种入T25培养瓶后,加入1%
L-谷氨酰胺,3 000 U/mL的IFN-γ,置于37 ℃,5%CO2培养箱中培养;培养24 h后,加入1 000 U/mL的IL-2,2 000 U/mL的IL-1α,300 ng/mL的CD3单克隆抗体;每天观察细胞并计数,通过补充含1 000 U/mL IL-2,1%的L-谷氨酰胺,10%的FBS的CIK培养基,使细胞密度不超过2×106个/mL。约2周后即可收获CIK细胞。
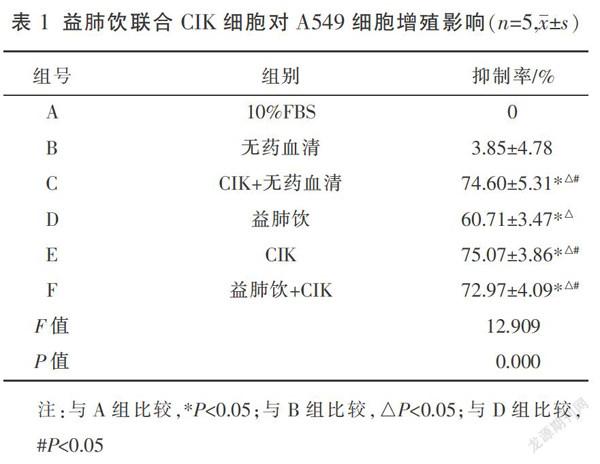
1.6.3 CCK-8法检测益肺饮联合CIK细胞对A549细胞增殖影响 共设置6个分组,A:10%FBS组(10%FBS)、B:无药血清组(10%无药血清)、C:CIK+无药血清组(CIK+10%无药血清)、D:益肺饮组(15%含药血清)、E:CIK组、F:益肺饮+CIK组(15%含药血清+CIK)
根据实验设计,取生长良好的肺癌A549细胞计数,将A549细胞以3 000个/孔种入96孔板,CIK细胞以20∶1的效靶比铺板,每组设置4个复孔。12 h后,根据分组进行干预。干预24 h后,吸弃孔板中原液,加入新鲜培养基,再加入CCK-8试剂,用酶标仪测定在450 nm处各孔的吸光度。抑制率按以下公式计算:
抑制率=(1-实验组OD值均数/10%FBS组OD值均数)×100%
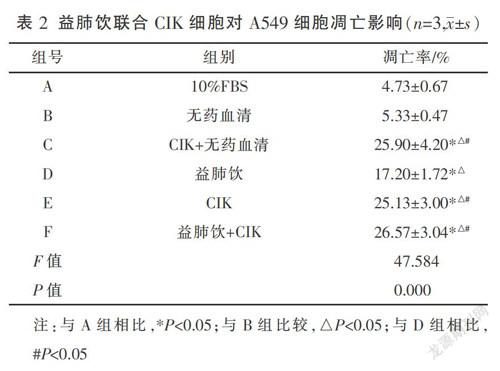
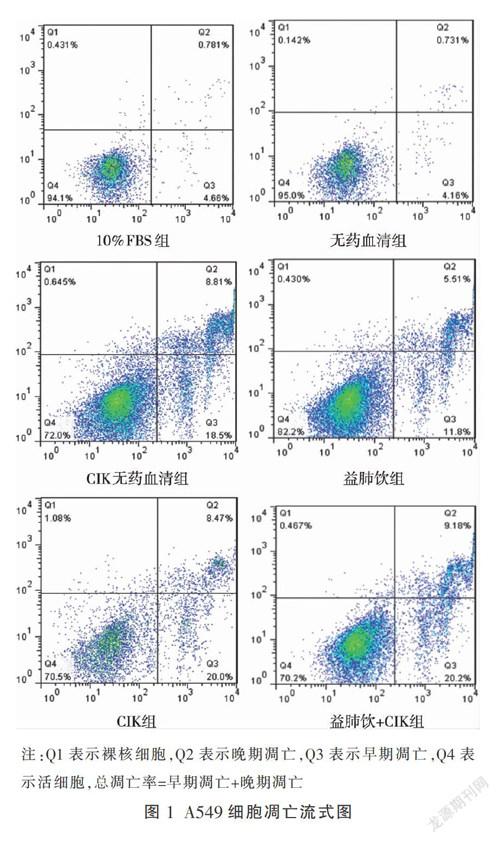
1.6.4 流式细胞仪检测益肺饮联合CIK细胞对A549细胞凋亡影响 分组同前,根据实验设计,取生长良好的肺癌A549细胞,按照实验分组进行干预,其中CIK细胞效靶比为20∶1。24 h后收集细胞,离心洗涤细胞2~3次。根据Annexin V FITC/PI Kit说明书,每管取500 μL流式缓冲液重悬细胞,分别加入5 μL Annexin V FITC/10 μL PI,室温避光孵育5 min后上机检测。
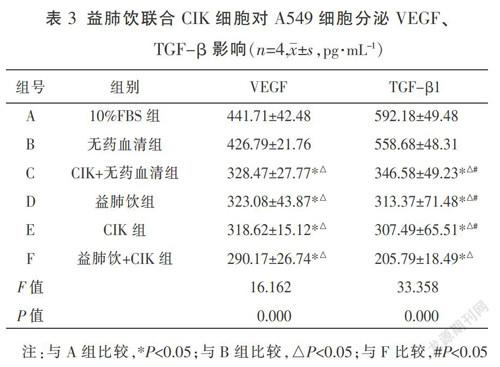
1.6.5 ELISA法检测A549细胞免疫逃逸相关因子TGF-β1、VEGF 取生长良好的A549细胞,根据实验要求,分别进行干预。干预24 h后,吸取细胞上清液,加入至离心管中,800 g,5 min,离心后吸取上清,按照实验分组进行标记,根据ELISA试剂盒所示步骤(双抗夹心法),分别检测TGF-β、VEGF的OD值,各组每个指标设3个复孔,取平均OD值根据标准曲线计算细胞因子的表达水平。
1.7 统计方法
实验数据均以“x±s”表示,用SPSS 20.0软件进行统计分析。数据进行正态分布及组间方差齐性检验,组间比较采用单因素方差分析,两两比较采用独立t检验,若不符合方差齐性,采用Wilconxon秩和检验,检验水平采用a=0.05。
2 结果
2.1 CCK-8法检测细胞增殖活性
通过CCK-8实验,各组对A549细胞的抑制率见表1。根据实验结果,益肺饮和CIK细胞单用及联用其抑制率与A组、B组相比有明显差异(P<0.05)。E组增殖抑制最明显,平均抑制率可达75.07%,C、E、F组之间比较抑制率无明显差异,但均优于D组(P<0.05)。
2.2 流式细胞仪检测益肺饮联合CIK细胞对A549细胞凋亡影响
通过流式检测,实验结果显示(见表2、图1):D组的凋亡率可达(17.20±1.72)%,E组的凋亡率可达(25.13±3.00)%,F组凋亡率可达(26.57±3.04)%,均明显优于A、B组(P<0.05)。C、E、F组促凋亡作用明显优于D组(P<0.05),但是3组两两比较无明显差异(P>0.05)。
2.3 ELISA法检测免疫逃逸相关因子TGF-β1、VEGF
ELISA法檢测结果表明(见表3),与A组和B组相比,D组和E组对TGF-β、VEGF的分泌均有一定的抑制作用(P<0.05),但D、E两组比较无明显差异(P>0.05)。各组间两两比较,F组对TGF-β的抑制效果最明显(P<0.05),F组VEGF浓度最低290.17 pg/mL,但与D、E组比较无统计学差异(P>0.05)。
3 讨论
正常机体的免疫系统可识别恶变的肿瘤细胞,并通过特异性免疫应答来清除肿瘤细胞。然而,因为免疫逃逸机制的存在,使得机体免疫系统无法有效及时地清除异变细胞。肿瘤免疫逃逸的机制是如今研究的热点,这有助于进一步寻找有效的药物靶点。
李宏良等[11]的研究显示天冬、薏苡仁、北沙参等中药有助于提高CIK细胞活性,促进其增殖,为CIK联合中药治疗方法提供了实验依据。孟祥林等[12]的研究显示中医扶正固本法结合CIK细胞过继免疫在改善患者CEA、AFP、CA125肿瘤标志物以及CD3、CD4免疫功能方面能更好地降低患者肿瘤标志物水平,改善患者的免疫功能。郑心等[13]研究报告了肺抑瘤膏联合DC-CIK细胞可降低血清VEGF水平。由此可见中医药联合CIK治疗恶性肿瘤不失为一种新的治疗方向和思路。
基于此,通过益肺饮联合CIK细胞对肺癌细胞免疫逃逸干预的实验研究,以期在细胞及分子水平上研究益肺饮含药血清联合CIK细胞的抗肿瘤活性及免疫调节效应。通过CCK-8、流式细胞检测,我们发现益肺饮联合CIK细胞时对A549细胞的增殖抑制及促凋亡并没有明显的协同作用,考虑原因可能是含药血清对CIK细胞活性有影响。通过ELISA法检测经药物干预后的A549细胞上清液,结果表明,益肺饮含药血清能够有效地降低A549细胞分泌TGF-β1、VEGF的浓度。益肺饮联合CIK细胞组对TGF-β浓度抑制显得更为有效,但益肺饮联合CIK细胞并不能对VEGF产生更为有效的抑制效果。TGF-β的分泌可因不同的刺激诱导,包括类固醇、维甲酸、表皮生长因子(epidermal growth factor, EGF),神经生长因子(nerve growth factor, NGF)、淋巴细胞活化剂等。而VEGF可由多种信号分子包括低氧、肿瘤坏死因子、NO、成纤维细胞生产因子、白细胞介素-1及胰岛素生长因子等诱导产生。益肺饮与CIK细胞联用时对TGF-β1及VEGF的分泌产生不同抑制效果的原因,或许与其抑制机制有关,这需要之后进一步的深入研究。
通过本研究,我们虽然未取得预期的实验结果,益肺饮联合CIK细胞并不能增强对肺癌A549细胞的增殖抑制及抗凋亡效应,同时也没有对VEGF的分泌产生更明显的抑制效果。但是我们证实了益肺饮联合CIK可以有效降低A549细胞分泌TGF-β。这为我们临床使用益肺饮治疗肺癌患者提供了实验数据支持,同时为进一步研究益肺饮对免疫逃逸干预的机制提供了研究方向。
近年来,肿瘤的免疫治疗是最具有前景也是最热门的研究之一。免疫检查点抑制剂的出现,为肿瘤的免疫治疗打开了一扇新的大门,越来越多的免疫检查靶点被发现,如CTLA-4、PD-1、TIM3、LAG-3、CD122等[14-15]。关于肺癌的免疫治疗一直是研究热点,免疫治疗联合化疗已经成为治疗非小细胞肺癌一线方案[16]。大量的研究表明,中药能够通过多种机制来调节肺癌细胞免疫抑制[17],因此,中医药联合免疫治疗是一个很有价值的研究方向,同时面对越来越丰富的免疫治疗,如何避免免疫治疗耐药,又将为中医药的研究提供一个新的思路。
参考文献
[1] 郭寒菲,丁 筱,崔久嵬.肺癌免疫治疗的研究进展[J].山东医药,2018,58(12):101-104.
[2] KIM J S, KIM Y G, LEE H K, et al. Cytokine-induced killer cells hunt individual cancer cells indroves in a mouse model[J].Cancer Immunol Immunother, 2017,66(2):193-202.
[3] 程吉华,赵德强.肿瘤免疫调节机制研究进展[J].卫生研究,2018,47(2):330-334.
[4] HANSEN W, HUTZLER M, ABELS, et al. Neuropilin1 deficiency on CD4+Foxp3+ regulatory T cells impairs mouse melanoma growth[J]. Journal of Experimental Medicine, 2012,209(11):2001-2016.
[5] 马肖静,周慧婷,董 熠,等.肿瘤发生与免疫逃逸相关机制的研究进展[J].肿瘤学杂志,2018,24(11):1046-1050.
[6] KIM Y S, SAYERS T J, COLBURN N H, et al. Impact of dietary components on NK and Treg cell function for cancer prevention[I]. Molecular Carcinogenesis, 2015,54(9):669-678.
[7] OTT PATRICK A, HODI F S, BUCHBINDER E I. Inhibition of immune checkpoints and vascular endothelial growth factor as combination therapy for metastatic melanoma: an overview of rationale, preclinical evidence, and initial clinical data[J]. Frontiers in Oncology, 2015,5:1-7.
[8] APTE RAJENDRA S, CHEN DANIEL S, FERRARA NAPOLEONE, VEGF in Signaling and Disease: Beyond Discovery and Development[J]. Cell, 2019,176:1248-1264.
[9] 錢芳芳,罗 斌,阙祖俊,等.中医药调控免疫功能防治肺癌的研究进展[J].辽宁中医杂志,2018,45(5):1098-1101.
[10] 陈 娟.CIK细胞对肿瘤细胞长时间细胞毒性的研究[D].长沙:中南大学,2014:9-10.
[11] 李宏良,黄泳立,杨耀林,等.肺积方扶正组份对中晚期肺癌患者自体CIK细胞生物学活性的影响[J].中医临床研究,2017,9(23):1-4.
[12] 孟祥林,李海雷,徐玉玲,等.扶正固本法联合CIK细胞过继免疫治疗中晚期恶性肿瘤70例[J].中医研究,2013,26(5):19-22.
[13] 郑 心,李雪妮.肺抑瘤膏联合树突状细胞-细胞因子诱导的杀伤细胞治疗晚期肺腺癌23例[J].安徽中医学院学报,2013,32(6):30-33.
[14] 胡晓儒,杨 向.免疫检查点LAG-3在肿瘤中的研究进展[J].现代肿瘤医学,2019,27(5):870-873.
[15] SUN L, CHEN L X, LI H. Checkpoint-modulating immunotherapies in tumor treatment: Targets, drugs, and mechanisms[J]. International Immunopharmacology, 2019,67:160-175.
[16] 涂海燕,胥冰菲,吴一龙.2018年肺癌临床研究进展[J].循证医学,2019,19(1):4-9.
[17] 钱芳芳,罗 斌,阙祖俊,等.中医药调控免疫功能防治肺癌的研究进展[J].辽宁中医杂志,2018,45(5):1098-1101.

