柠檬酸钠提高酿酒酵母谷氨酸合成效率
汤超,刘立聪,陈雄,代俊,李欣,姚娟,郑国斌,王志*
1(发酵工程教育部重点实验室,湖北省食品发酵工程技术研究中心,工业发酵湖北省协同创新中心,工业微生物湖北省重点实验室,湖北工业大学,湖北 武汉,430068)2(湖北省酵母功能重点实验室,安琪酵母股份有限公司,湖北 宜昌,443003)
酵母抽提物富含多肽、氨基酸、呈味核苷酸、VB族及微量元素,具有纯天然、营养丰富、味道醇厚等诸多优点[1-2],在各类食品、保健品、调味品生产过程中应用广泛[3],但其鲜度不够突出(主要是谷氨酸含量偏低)[4-5]。

作为TCA循环中重要的中间产物,柠檬酸还是调控中心碳代谢途径的效应物之一[12],具有调控EMP途径磷酸果糖激酶和丙酮酸激酶活性的功能[13-14],可以降低EMP途径丙酮酸节点的碳溢流,减少或抑制乙醇、有机酸等溢流产物的合成[15-17]。而目前基于降低Crabtree效应(以乙醇合成效率降低为特征和指标)来提高酿酒酵母胞内谷氨酸含量的策略还未见报道。
为提高酿酒酵母的生物量和胞内谷氨酸含量,本文优化了柠檬酸钠-糖蜜补料策略,研究了其对酿酒酵母代谢及胞内谷氨酸合成积累的影响,为富谷氨酸酵母工业化生产提供理论依据和技术指导。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
酿酒酵母(Saccharomycescerevisiae)J-5,由安琪酵母股份有限公司提供。
1.1.2 培养基
斜面培养基(g/L):蔗糖50,酵母浸粉20,MgSO4·7H2O 1,KH2PO41,pH 4.8~5.0,115 ℃灭菌20 min。
种子培养基(YS培养基) (g/L):蔗糖100,酵母浸粉20,MgSO4·7H2O 1,KH2PO41,pH 4.9,250 mL三角瓶装液量100 mL,115 ℃灭菌20 min。
发酵培养基:糖蜜(含总糖质量分数35.8%)100 mL/L、酵母浸粉 10 g/L、工业蛋白胨 20 g/L、MgSO4·7H2O 1 g/L、KH2PO40.5 g/L、FeSO4·7H2O 2 g/L,115 ℃灭菌20 min。
补料培养基:糖蜜和柠檬酸钠混合液。
1.1.3 仪器
高压灭菌锅,上海博讯实业有限公司医疗设备厂;DZF-6020电热鼓风干燥箱,重庆银河实验仪器有限公司;SPX-150B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;电子分析天平,北京赛多利斯天平有限公司;TG18M台式高速离心机,长沙平凡仪器仪表有限公司;HNY-211B恒温摇床,天津市欧诺仪器仪表有限公司;CJ-1D洁净工作台,天津市泰斯特仪器有限公司;容声BCD-560WD11HY冰箱,海信容声冰箱有限公司;pH计,赛默飞世尔科技有限公司;高效液相色谱U3000,安捷伦公司;10 L发酵罐,上海保兴生物工程设备有限公司。
1.2 试验方法
1.2.1 种子培养方法
将斜面菌种用接种环勾出一环在新鲜斜面培养基上划满整个表面,30 ℃培养12 h;再向培养好的斜面中每支倒入15 mL无菌水洗脱表面菌体,并用移液枪吹打均匀成菌悬液,然后转接至摇瓶,每瓶接种量为10%(5 mL菌悬液),放置摇床180 r/min,30 ℃培养10 h。
1.2.2 发酵控制
10 L发酵罐控制:制备5 L摇瓶种子液,种子液合瓶后于4 ℃静置8 h,后弃上清液,浓缩的合瓶种子液体积约1 L,接入10 L发酵罐(定容5 L发酵培养基),接种后混合体系体积为6 L。发酵温度30 ℃,用10%(质量分数)H2SO4和浓氨水控制pH在5.3左右。
1.2.3 流加补料策略
补料1:糖蜜流加补料发酵,第3~14 h流加糖蜜,初始流速50 mL/h,随后每2 h增加补料速率,增加梯度为30 mL/h。如:第5~7 h为80 mL/h,第7~9 h为110 mL/h等,总量为1 300 mL,糖蜜含总糖质量分数为35.8%。
补料2:糖蜜-柠檬酸钠流加补料发酵,程序同补料1,糖蜜中混入48 g柠檬酸钠。
补料3:第3~14 h流加糖蜜,初始流速50 mL/h,随后每2 h增加补料速率,增加梯度为50 mL/h,总量为1 800 mL,糖蜜中混合48 g柠檬酸钠。
补料4:优化后的糖蜜-柠檬酸钠流加补料发酵,补料程序同补料3,糖蜜中混入72 g柠檬酸钠。
1.2.4 酵母胞内谷氨酸测定
样品预处理:取发酵培养24 h后的发酵液2.5 mL,6 500 r/min离心5 min,倒掉上清,水洗菌体2次,再用5 mL去离子水重悬菌体,-20 ℃冻1.5 h,80 ℃水浴15 min,反复冻融4次。冻融好的菌悬液6 500 r/min离心5 min,取上清600 μL于2 mL离心管再向其中加入2倍体积(1.2 mL)冰冻后的无水乙醇,10 000 r/min,4 ℃离心5 min,0.22 μm的滤头过滤上清于样品瓶,-20 ℃保存。胞内游离谷氨酸含量采用HPLC检测[5,18-19]。
HPLC分析条件:色谱柱为安捷伦ZORBAX SB-Aq column(150 mm×4.6 mm×5 μm),Aglient USA;柱温30 ℃;进样量20 μL;紫外检测波长210 nm;采用10 mol/L pH 1.8的K2HPO4(磷酸调pH)作为流动相;流速0.6 mL/min。根据所测标品,谷氨酸的保留时间为4.6 min。胞内谷氨酸含量计算如公式(1):
(1)
1.2.5 菌体干重测定
取发酵液7 mL,6 500 r/min离心5 min,倒掉上清水洗菌体2次,80 ℃烘箱连续烘干24 h,取出放入干燥器冷却后称质量,得到细胞干重(g/L)。
1.2.6 总糖测定方法
总糖质量浓度测定采用硫酸蒽酮法[20]。
1.2.7 乙醇测定方法
乙醇质量浓度通过生物分析传感仪测定[21]。
1.3 数据处理
所有试验数据至少3个平行试验,采用Origin 8.5对试验数据分析。
2 结果与分析
2.1 柠檬酸钠对酿酒酵母摇瓶发酵合成谷氨酸的影响
由图1可知,摇瓶中菌体干重约在8.8 g/L,柠檬酸钠未对酿酒酵母生物量产生显著影响。但是,随着柠檬酸钠浓度的增加,胞内谷氨酸含量呈先升后降的趋势,柠檬酸质量浓度为2 g/L时含量胞内谷氨酸质量分数达到峰值(2.96%),比对照组(2.55%)提高了16.1%,因此选择2 g/L为最适添加量。
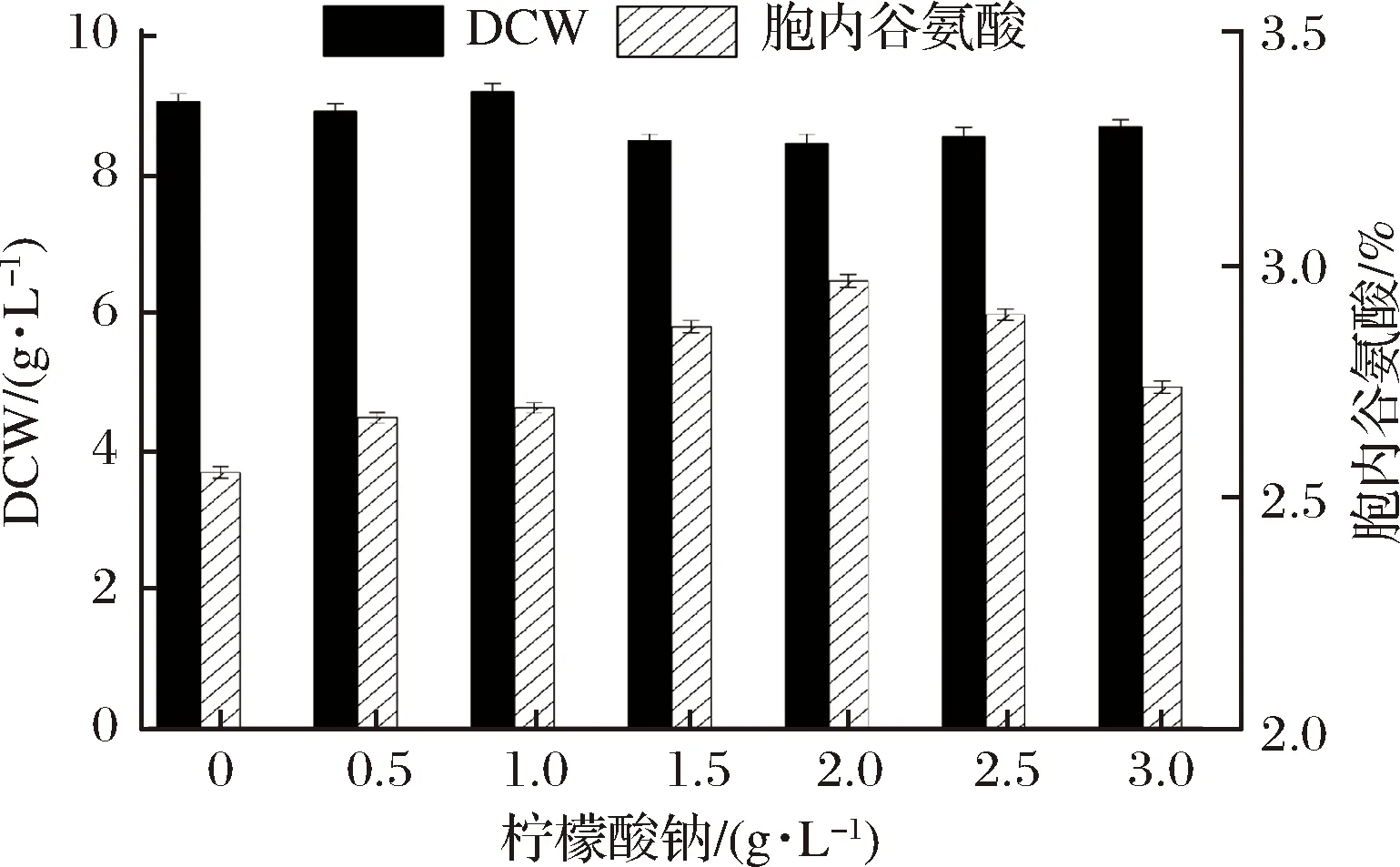
图1 柠檬酸钠对酿酒酵母生物量和胞内谷氨酸的影响Fig.1 Effects of sodium citrate addition on biomass andglutamate production in Saccharomyces cerevisiae J-5
2.2 补料策略1对酵母产胞内谷氨酸合成的影响
根据补料1的设置,在3~14 h流加1 300 mL糖蜜,酵母胞内谷氨酸、菌体生长代谢的影响如图2。补料期间总糖含量在2.5~10 g/L,细胞以近线性状态增长至12 h(细胞干重为28.08 g/L,平均比生长速率接近0.069 h-1)。3~14 h补糖过程中,经丙酮酸溢流合成的乙醇质量浓度由16 g/L缓慢升至22 g/L,而胞内谷氨酸质量分数则在1.5%波动。说明补料期间细胞发生了Crabtree效应(乙醇溢流)[23]。虽然酵母适应于溢流代谢(乙醇发酵)而快速生长,但TCA循环的碳流量下调与增强TCA中间产物α-酮戊二酸前体供量、促进谷氨酸合成的发酵目标相矛盾,使得谷氨酸的合成和积累处于低水平的平衡状态中。
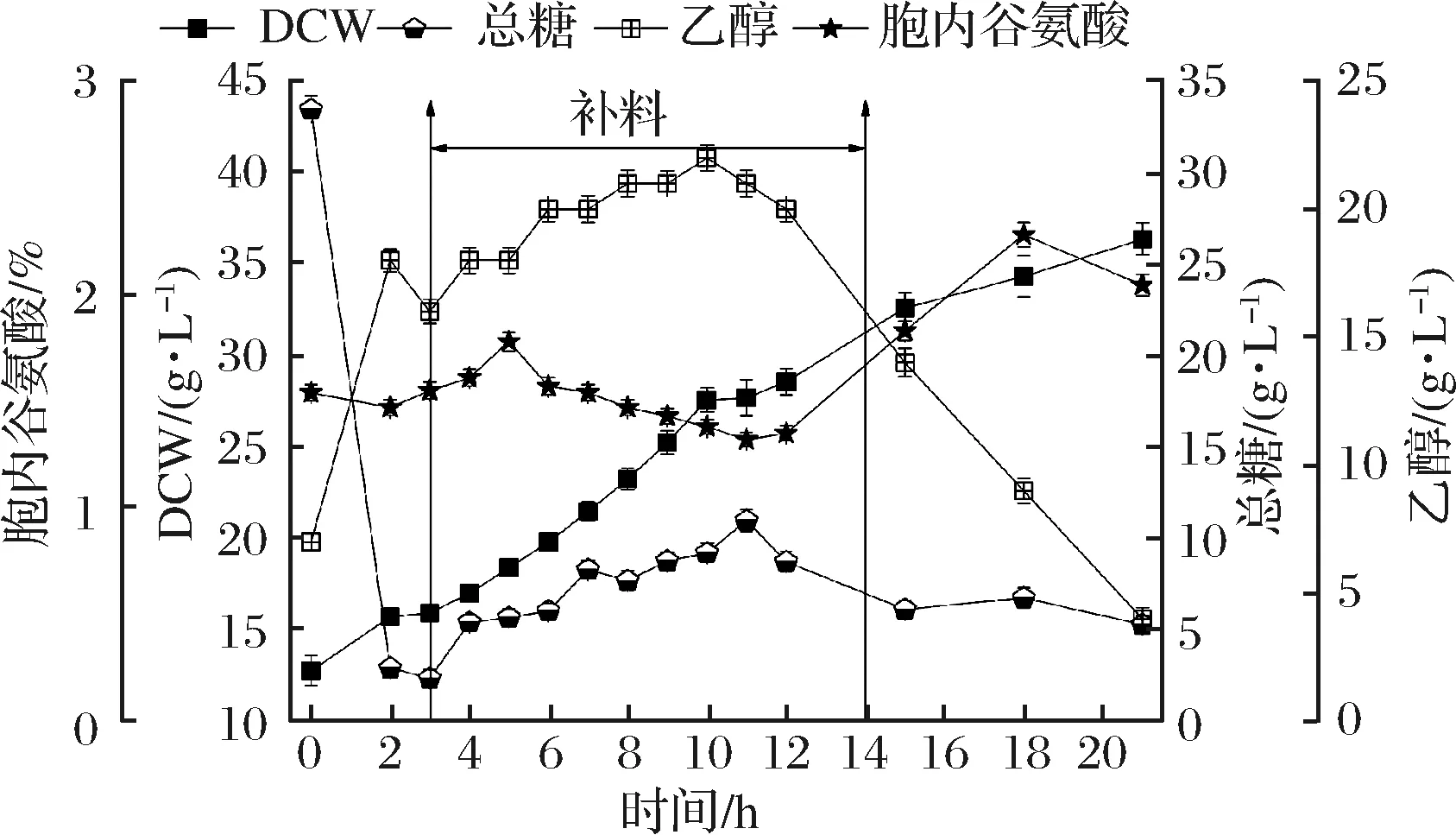
图2 10 L罐补料策略1对酿酒酵母J-5发酵的影响Fig.2 Effect of feeding strategy 1 on the fermentation ofSaccharomyces cerevisiae J-5 in a 10 L bioreactor
补糖结束后,总糖由12 h的8.73 g/L被快速利用至15 h的6.11 g/L,后维持在5 g/L左右,而乙醇由12 h的18 g/L被快速利用至21 h的1.0 g/L,说明12~21 h随着还原糖的利用,Crabtree效应减弱或消失,乙醇作为储备碳源经乙酰CoA回补TCA循环和乙醛酸循环[22],维持了细胞的近线性的二次生长,其平均比生长速率约为0.019 h-1,仅为1次生长期间的27.5%,细胞干重在21 h达到36.36 g/L。
虽然细胞以乙醇为碳源的生长效率低于利用糖蜜的,但由于Crabtree效应减弱或解除,TCA循环的碳通量增大促进了胞内谷氨酸的积累[23],并在18 h达到峰值(2.28%)。另外,在以乙醇为主要碳源进行二次生长期间,由于其比生长速率相比于一次生长期间大幅度下降,细胞对谷氨酸“氮库中转”的生理需求[11]降低,“谷氨酸合成加速和中转需求降低”是胞内谷氨酸积累的主要原因。而18 h后被降解利用,这可能与18 h以后碳源不足、谷氨酸做碳源在GDH2催化下回补TCA循环[5],以满足细胞生长的需要有关。
0~12 h发酵体系内碳源充足,EMP途径通量大,远高于TCA循环通量,Crabtree效应使得谷氨酸的合成和积累处于低水平的平衡状态中,因此,发酵过程中要适度抑制EMP途径碳代谢流量,避免中间产物(丙酮酸)过剩造成碳源溢流。由于柠檬酸能显著地降低磷酸果糖激酶和丙酮酸激酶活性,因而能适当地减缓EMP途径的代谢流量[15-17]。因此,需要考虑补料与柠檬酸钠的综合作用对谷氨酸、菌体生长代谢的影响。
2.3 补料策略2对酵母产胞内谷氨酸发酵过程的影响
根据补料1的生长特点,峰值细胞干重达到了36.36 g/L,是摇瓶发酵的4.13倍。由于柠檬酸钠调控代谢的对象是单个细胞,因此,按细胞干重比例调整柠檬酸钠终质量浓度为8 g/L(48 g柠檬酸钠),形成补料2策略。该补料模式对酵母产胞内谷氨酸、菌体生长和主要代谢的影响如图3。
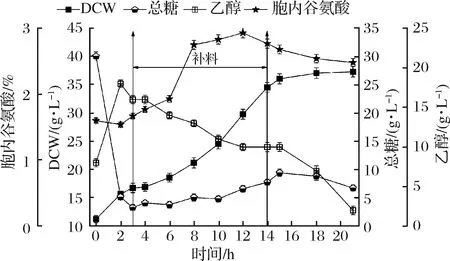
图3 10 L罐补料策略2对酿酒酵母J-5发酵的影响Fig.3 Effect of feeding strategy 2 on the fermentation ofSaccharomyces cerevisiae J-5 in 10 L bioreactor
由图3可知,3~14 h酵母生物量近线性生长到14 h(34.56 g/L),平均比生长速率约0.069 h-1,与补料策略1(0.069 h-1)相同,说明添加的柠檬酸钠对细胞的生长未产生负面影响。0~3 h溢流分子(乙醇)大量积累维持在17 g/L左右,与图2(18 g/L)接近。但是,补料期间(3~14 h),乙醇持续下降到10 g/L。这说明柠檬酸钠的调控作用使丙酮酸溢流生成乙醇的效率降低,并转化乙醇为乙酰CoA进入TCA循环乙醛酸循环[24]。期间,谷氨酸合成效率>生长的“氮库中转需求”而在细胞内积累,持续从3 h的1.67%(质量分数)上升到12 h的2.93%(质量分数),比补料策略1谷氨酸峰值浓度提高近29%。
补料结束后(14~21 h),细胞进入稳定期。而乙醇仍在被迅速利用,由14 h的10 g/L降至21 h的2 g/L。而胞内谷氨酸也在缓慢地被“中转”转化(21 h其质量分数降至2.38%)。对比补料策略1(图2)说明在策略2条件下,发酵后期碳源不足(乙醇质量浓度仅为10 g/L,是图2的55.6%),其代谢产生的中间产物和能量不足以维持高细胞浓度条件的生理需求,细胞开始利用胞内的游离谷氨酸,因此胞内含量下降是必然结果。
但补料期间的谷氨酸峰值比补料策略1(18 h,质量分数2.28%)高出了29%。这一现象说明了添加柠檬酸钠有效地减缓了EMP途径生成丙酮酸的速率,通过减少乙醇溢流途径,来增大TCA循环的通量,提高了α-酮戊二酸的供给,促进了谷氨酸的合成效率。另外,可以考虑增加糖蜜的补料量以增加碳源的供应。
2.4 补料策略3对酵母产胞内谷氨酸发酵过程的影响
基于2.3中的分析,在策略2的基础上提高补料组分中糖蜜的量(柠檬酸钠量不变)形成补料策略3,该补料模式对酵母产胞内谷氨酸、菌体生长和主要代谢的影响如图4。

图4 10 L罐补料策3对酿酒酵母J-5发酵的影响Fig.4 Effect of feeding strategy 3 on the fermentation ofSaccharomyces cerevisiae J-5 in 10 L bioreactor
由图4中可知,补料期间平均比生长速率为约0.076 h-1,较策略2(0.069 h-1)提高了9%,14 h时干重达35.6 g/L,这说明同阶段增加补糖可以提高比生长速率。乙醇质量浓度在3~8 h处于下降趋势,在8 h降到补料期最低点(10 g/L)后逐渐升高至14 h的19 g/L,说明8~14 h发生了二次溢流现象。增加糖的供应后,柠檬酸钠的调控作用不足以缓解此条件下EMP途径生成丙酮酸的速度,致使乙醇溢流途径加强,乙醇溢流途径增强会减少TCA循环的通量[25-26],这种情况对于谷氨酸合成是不利的,需要考虑继续增加柠檬酸钠的添加量。但即使如此,谷氨酸质量分数在10 h也达到了峰值(3.54%),进一步比策略2提高了20.8%。随后因乙醇溢流而减弱了TCA循环的碳流,导致谷氨酸合成效率降低。而细胞仍保持着高比生长速率生长,对谷氨酸的“氮库中转”需求旺盛,致使谷氨酸质量分数持续下降到14 h(3.03%)。补料结束时,二次溢流使乙醇积累至 14 h 的19 g/L,14~18 h细胞二次生长的主要碳源和能源是乙醇,期间乙醇的利用效率是1.4 g/(L·h),平均二次生长速率约为0.018 h-1,仅为补料期间的23.9%,但与补料策略1接近(图2)。
2.5 补料策略4对酵母产胞内谷氨酸发酵过程的影响
基于2.4的分析,在策略3的基础上提高补料组分中的柠檬酸钠至72 g,形成补料策略4,该补料模式对酵母产胞内谷氨酸、菌体生长代谢的影响如图5。
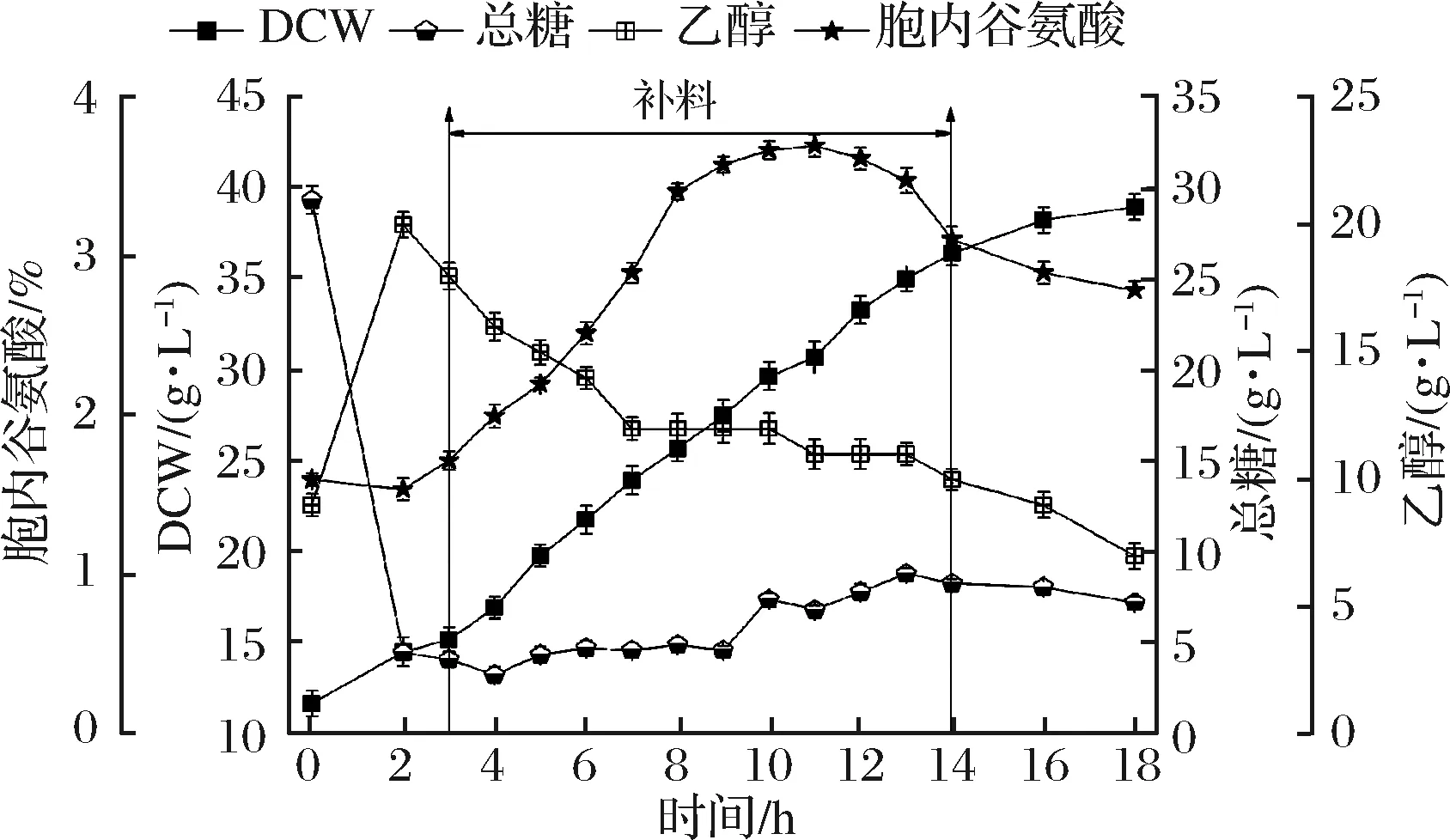
图5 10 L罐补料策略4对酿酒酵母J-5发酵的影响Fig.5 Effect of feeding strategy 4 on the fermentation ofSaccharomyces cerevisiae J-5 in 10 L bioreactor
3~14 h细胞的平均比生长速率约为0.076 h-1,这与策略3中生长速率一致,14 h细胞干重达36.44 g/L。增加柠檬酸钠加量后,总糖在2~9 h维持在4.5 g/L左右,比策略3中残糖(3 g/L左右)提高50%,说明在流加糖速率相同的情况下,增加柠檬酸钠可以降低菌体对糖的利用速率。乙醇在3~7 h缓慢下降,并在7~14 h维持在11 g/L左右,胞内谷氨酸质量分数快速升至8 h的3.41%,后缓慢地于11 h达到峰值(3.7%)。此过程中生物量由25.72 g/L增加到35.04 g/L,但胞内谷氨酸几乎没有减少,保持着胞内游离谷氨酸高含量状态。此外,9 h后总糖质量浓度上升了2.81 g/L,但乙醇质量浓度由12 g/L缓慢下降至10 g/L,说明在柠檬酸钠的作用下,糖代谢基本不存在乙醇溢流现象,甚至乙醇还代谢回补TCA循环。碳源有效代谢并流向谷氨酸合成方向,使得峰值胞内谷氨酸质量分数较策略1~3分别提高了62.3%、26.3%、4.52%,虽然该策略相较策略3峰值提高不足一成,但是,就谷氨酸质量浓度(干重质量浓度×谷氨酸质量分数)而言,该策略达到了1.14 g/L,比策略1~3分别提高了45.3%、30.2%、21.1%。14~18 h菌体二次生长,平均比生长速率约0.024 h-1,比策略3同期高 32.1%,原因可能是,罐内残糖浓度高于策略3,菌体还在缓慢利用残糖生长。
2.6 柠檬酸钠添加浓度/峰值菌体浓度对谷氨酸积累的影响
既然柠檬酸钠对谷氨酸的积累有显著地促进作用,需要考虑在工业放大生产中如何使用这一参数。有关柠檬酸钠添加质量浓度/峰值菌体浓度(Cit/DW)的数据如表1所示。策略3流加的柠檬酸不足以抑制溢流代谢(图4),虽然比策略2的胞内谷氨酸提高了20.4%,但是增加柠檬酸钠后(策略4),溢流代谢得到了有效地抑制(图5),谷氨酸浓度比发酵2提高了25.9%,也比策略3提高4.5%。说明就抑制溢流代谢促进谷氨酸合成而言,柠檬酸钠的添加量以摇瓶发酵、策略2和策略4较为合适。显然,该数据在3者中不谋而合,均为0.237左右,因此0.238±0.007可以作为工业生产放大实验的依据之一。
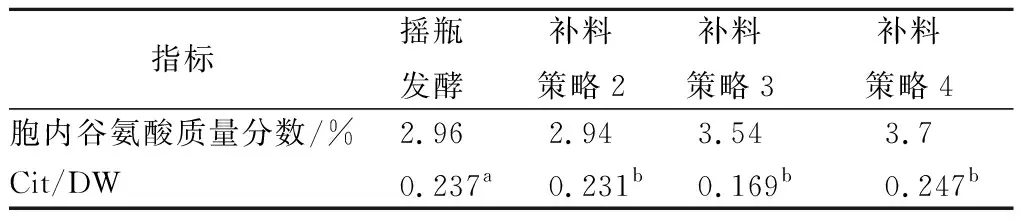
表1 柠檬酸钠添加浓度/菌体浓度对谷氨酸积累的影响Table 1 Effect of sodium citrate addition concentration/bacterial concentration on glutamate accumulation
注:a摇瓶发酵结束的干重;b补料结束时的干重。
3 结论
本文优化了柠檬酸钠-糖蜜补料策略,研究了其对酿酒酵母代谢及胞内谷氨酸合成积累的影响,结论如下:
(1)酿酒酵母J-5在糖蜜补料发酵过程中,存在碳分解代谢阻遏效应。发酵后期菌体能利用乙醇二次生长,但二次生长效率仅为以糖蜜为碳源的生长效率的27.5%。这使得细胞对以谷氨酸为核心的胞内“氮库中转”的生理需求降低,促进了谷氨酸的积累。说明促进胞内谷氨酸积累的积极因素包括一定条件下适时地调低生长速率。
(2)发酵过程乙醇溢流对胞内谷氨酸的积累存在消极影响,但适时地添加柠檬酸钠可以减弱乙醇溢流代谢,促进胞内谷氨酸的积累,可提高62.3%以上。
(3)柠檬酸钠添加质量浓度(Cit,g/L)可根据补料结束时菌体干重(DW)来决定,当Cit/DW在0.238±0.007时能有效抑制乙醇溢流、提高谷氨酸合成效率,可作为指导工业化放大生产的参考依据。

