DNA甲基化参与调控马铃薯干旱胁迫响应
李鹏程 毕真真 梁文君 孙 超 张俊莲 白江平,*
DNA甲基化参与调控马铃薯干旱胁迫响应
李鹏程1,2,**毕真真1,2,**梁文君1,2孙 超1,2张俊莲1白江平1,2,*
1甘肃省干旱生境作物学重点实验室 / 甘肃省作物遗传改良与种质创新重点实验室, 甘肃兰州 730070;2甘肃农业大学农学院, 甘肃兰州 730070
非生物胁迫下表观遗传对调控植物基因表达起重要作用, 但是有关马铃薯干旱胁迫下的表观遗传研究甚少。本研究以马铃薯品种大西洋、费乌瑞它、C119、C16和青薯9号为试验材料, 以MS培养基为对照以及分别添加200 mmol L-1甘露醇、60 μmol L-1甲基化抑制剂(5-azadC)和60 μmol L-1甲基化抑制剂+200 mmol L-1甘露醇, 处理24 d后对试管苗表型性状和生理指标进行综合分析。结果发现, 不同品种马铃薯对甘露醇和甲基化抑制剂响应程度趋势类似。在干旱和DNA甲基化抑制剂分别处理下, 马铃薯植株干鲜重、株高、叶片数和叶绿素含量均显著减少(<0.05), SOD、POD、CAT活性和Pro、MDA含量均显著增加(<0.05), 而分枝数、根长、平均根粗均无明显变化, 表明马铃薯不同性状指标在响应干旱胁迫和DNA去甲基化时, 受到的调控通路可能不同。进一步比较干旱胁迫和DNA去甲基化共同处理与分别处理下表型性状和生理指标的差异发现, 共同处理使马铃薯植株表型性状受到进一步抑制, 同时活化了SOD、POD、CAT, 并且使Pro、MDA含量增加, 表明马铃薯在响应干旱胁迫过程中, 部分表型的形成与DNA甲基化调控相关。这将为深入研究马铃薯干旱胁迫响应与表观遗传学之间的调控网络通路提供初步的理论基础。
马铃薯; 干旱胁迫; DNA甲基化; 形态生理; 综合评价
马铃薯(L.)是茄科一年生草本块茎植物, 其栽培范围遍布全球。中国的马铃薯种植区域主要分布在西北干旱和半干旱地区, 总产量位居全国第一, 现已发展成为这些地区的重要支柱产业[1], 但是其单产却低于全国平均水平[2], 主要是因为马铃薯在块茎形成及膨大期间的水分缺失严重影响了马铃薯植株的正常生长发育[3]。因此, 可通过提高马铃薯对水分缺失的耐受性, 进而提高马铃薯的产量。
对表观遗传机理的解析可以作为作物抗逆遗传改良的重要途径之一[4-5]。植物中的DNA甲基化分布具有物种、组织、器官、位点特异性和时空特异性[6-7], 在植物生长发育过程中具有十分重要的调控作用[8]。非生物胁迫会引起植物体内DNA甲基化水平的改变, 激活胁迫相关基因的表达、转座子的活性以及调控启动子区域的开关, 以增强植物适应及抵御胁迫的能力[9]。潘雅姣等[10]发现, 水稻在干旱胁迫处理下, 降低其叶和根的甲基化程度有利于激活基因的表达, 从而提高水稻耐旱性。研究DNA甲基化常用的方法是通过高分辨率的参考基因组装配和亚硫酸氢盐测序绘制基因组中现有的甲基化模式。这种方法富有成效, 但它是描述性的, 而不是试验性的。另一种方法是通过试验来改变其甲基化水平[11], 植物中常用5-Aza-2’-脱氧胞苷(5-azadC)来抑制其甲基化程度。5-azadC是胞嘧啶的类似物,不可逆地与DNA甲基转移酶结合, 使基因组难以维持甲基化状态, 从而引起DNA的去甲基化[12]。毛锐涛[13]用DNA甲基化抑制剂处理马铃薯品种大西洋试管苗, 发现DNA去甲基化处理严重影响其生长发育。在小麦中, 5-氮杂胞苷通过降低小麦基因组DNA甲基化水平来提高耐盐性[14]。以上研究表明甲基化变异在抗旱研究中存在潜在的应用价值, 可通过发掘与作物抗旱相关的表观遗传调控相关基因, 对作物的抗旱性进行遗传改良。
目前, 相对于模式植物拟南芥以及水稻、小麦、玉米等主要农作物, 国内外学者有关马铃薯DNA甲基化的研究主要集中在离体培养及胁迫环境下DNA甲基化的变化方面[15-18]。但有关DNA甲基化在调控马铃薯响应干旱胁迫下生长发育和生理生化的研究却少见报道。本研究主要通过甲基化抑制剂处理不同干旱敏感的马铃薯品种, 并比较在干旱胁迫下去甲基化对马铃薯试管苗表型性状及生理生化的响应, 为进一步解析马铃薯干旱胁迫响应的表观遗传学机理提供初步的表型基础及实验思路, 为开辟研究马铃薯抗旱分子育种的新方法提供一定的理论依据。
1 材料与方法
1.1 试验材料
大西洋(Atl)和费乌瑞它(Fav)为干旱敏感型品种; C119 (CIP编号为398098.119)为抗旱中间型材料; C16 (CIP编号为397077.16)和青薯9号(QS9)为抗旱品种。其中C16和C119引自国际马铃薯中心(CIP), 其余由甘肃省作物遗传改良与种质创新重点实验室提供。5-azadC (5-aza-2’-deoxycytidine)购于Sigma公司。
1.2 试验方法
1.2.1 试验设计 分别将5个品种的马铃薯试管苗茎段接种于4种不同的培养基上。即正常的MS培养基(对照, T0)、含200 mmol L-1甘露醇的MS培养基(干旱处理, T1)、含60 μmol L-15-azadC的MS培养基(去甲基化处理, T2)、含60 μmol L-15-azadC与200 mmol L-1甘露醇的MS培养基(去甲基化与干旱共同处理, T3)。培养条件为温度(22±2)℃, 光强25.0~37.5 μmol m-2s-1, 光照16 h d-1。处理24 d后, 从每个处理随机挑选10株较为一致的试管苗分析形态指标, 同时取3份样品供生理生化指标的测定。
1.2.2 指标测定 (1)形态指标测定。株高、叶片数和分枝数直接观察测量, 使用根系扫描仪(EPSON Scan 2 12000XL 2.2)和根系形态与结构分析仪(WinRHIZO 2017a)测定马铃薯试管苗总根长和平均根粗等主要根系参数。使用佳能单反相机(Canon EOS 5D Mark II)进行植株形态拍照(图1)。(2)植株干鲜重测定。将试管苗用无菌水清洗, 吸去表面的水分, 称量鲜重; 然后将植株放入锡箔纸中于105℃杀青40 min, 85℃烘直至恒重, 称量干重。(3)生理生化指标测定。叶绿素含量采用80%丙酮浸泡法[19], 超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光还原法[20], 过氧化物歧化酶(POD)活性测定采用愈创木酚法[20], 过氧化氢酶(CAT)活性测定采用紫外吸收法[20], 丙二醛(MDA)含量测定采用硫代巴比妥酸法[20], 游离脯氨酸(Pro)含量测定采用酸性茚三酮比色法[20]。所有生理生化指标均3次重复, 取平均值。
1.3 数据分析
使用Genstat 19.0进行方差分析、主成分分析和聚类分析; GraphPad Prism 7.0数据作图, 利用隶属函数对5个马铃薯品种分别进行干旱及去甲基化响应性综合评价。
不同处理下的所有性状数据均采用相对值。

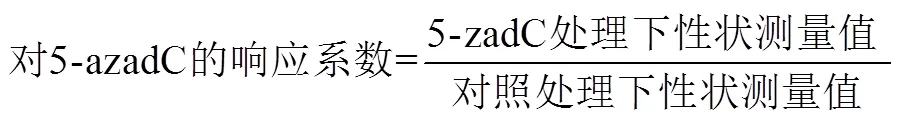
= 1, 2, 3, …,(3)

A~E分别为大西洋、费乌瑞它、C119、C16和青薯9号处理24 d后结果。T0: CK; T1: 5-azadC; T2: 甘露醇; T3: 5-azadC+甘露醇。每个处理选取3株用于照相。标尺为2 cm。
A–E are the phenotype of Atl, FAV, C119, C16, and QS9 after 24 days of treatment. T0: CK; T1: 5-azadC; T2: mannitol; T3: 5-azadC+mannitol. Three plantlets of each treatment were selected for photography. Bar = 2 cm.
式(4)中,(X)指第个综合指标的隶属函数值,X指第个综合指标值,max指第个综合指标的最大值,min指第个综合指标的最小值。
各综合指标权重的计算:

式(5)中,W表示第个综合指标在所有综合指标中的重要程度及权重;P为各品种第个综合指标的贡献率。
综合评价值的计算:

式(6)中,表示不同马铃薯品种抗旱性和对5-azadC的响应性的综合评价值。通过计算加权隶属函数值所得值。值越大表明抗旱性越强以及对5-azadC的响应性越大。
2 结果与分析
2.1 干旱胁迫对马铃薯试管苗生长的影响
2.1.1 表型性状和生理生化指标分析 马铃薯试管苗在甘露醇模拟干旱胁迫下各表型性状(图1)和生理生化特性(图2)均存在差异, 一般利用相对值来反映不同品种的抗旱性。各个性状抗旱系数由高到低依次为丙二醛、过氧化氢酶、游离脯氨酸、过氧化物酶、超氧化物歧化酶、平均根粗、叶绿素、总根长、叶片数、干重、分枝数、株高、鲜重, 变化范围在0.4175~2.3830 (表1)。表明参试马铃薯品种不同性状的抗旱性存在明显差异。各品种对干旱的综合响应系数CRC值介于0.9515~1.3897, 马铃薯品种的抗旱性由强到弱依次为青薯9号>C16>费乌瑞它>C119>大西洋。
2.1.2 主成分分析 由表2和表3可知, 与抗旱性相关的前3个主成分的累计贡献率为98.26%, 其中PC1的特征值是8.595, 贡献率为66.12%, 其较大的特征向量是分枝数和叶片数; PC2的特征值是2.46, 贡献率为18.92%, 载荷较高的是株高和游离脯氨酸; PC3的特征值是1.719, 贡献率为13.22%, 载荷较高的是丙二醛。这样可以分别把抗旱系数的13个单项指标转化为3个相互独立的综合指标, 同时也可以代表原始数据的大部分信息。
2.1.3 综合评价 根据对抗旱性的主成分分析分别得到的3个相互独立的综合指标, 利用公式(4)计算不同品种各综合指标的隶属函数值(X)。从表4可以看出, 干旱胁迫处理下, 同一综合指标CI(1)中, 青薯9号(1)最大, 为1.0000, 表明青薯9号在CI(1)综合指标上的抗旱性最强。根据各综合指标贡献率, 利用公式(5)计算其权重W, 计算得到与抗旱性相关的3个综合指标权重分别为0.6729、0.1926、0.1345。进一步利用公式(6)计算抗旱性的综合评价值, 根据值, 抗旱性为青薯9号>C16> C119>大西洋>费乌瑞它。

图2 不同处理下马铃薯试管苗表型和生理生化指标的变化
显著性分析使用Duncan’s法进行多重比较(< 0.05)。Multiple comparisons were performed with Duncan’s method (< 0.05).

表1 不同品种马铃薯各指标对甘露醇和5-azadC分别处理的响应程度

(续表1)
FW: fresh weight; DW: dry weight; SH: shoot height; NB: number of branches; NL: number of leaves; RL: root length; ARD: average root diameter; SOD: superoxide dismutase; POD: peroxidase; CAT: catalase; Pro: proline; MDA: malonaldehyde; Chl: chlorophyll; CRC: comprehensive response coefficient.
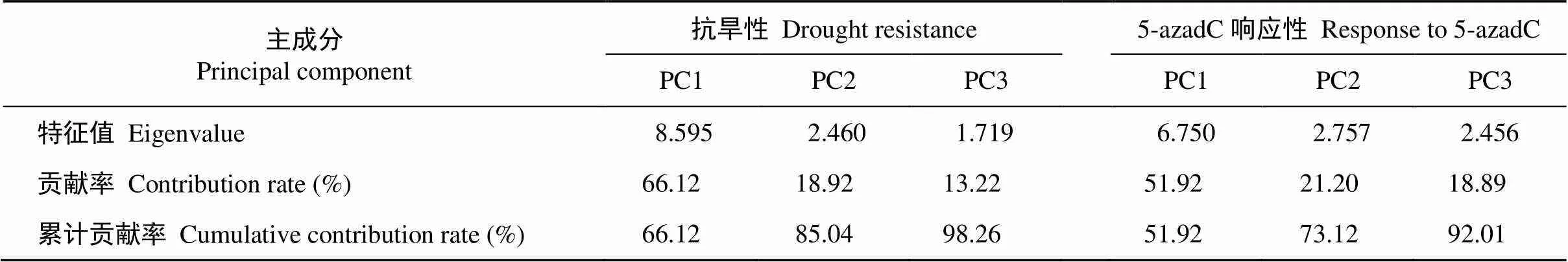
表2 各综合指标特征值及贡献率

表3 各表型因子载荷矩阵
缩写同表1。Abbreviations are the same as those given in Table 1.
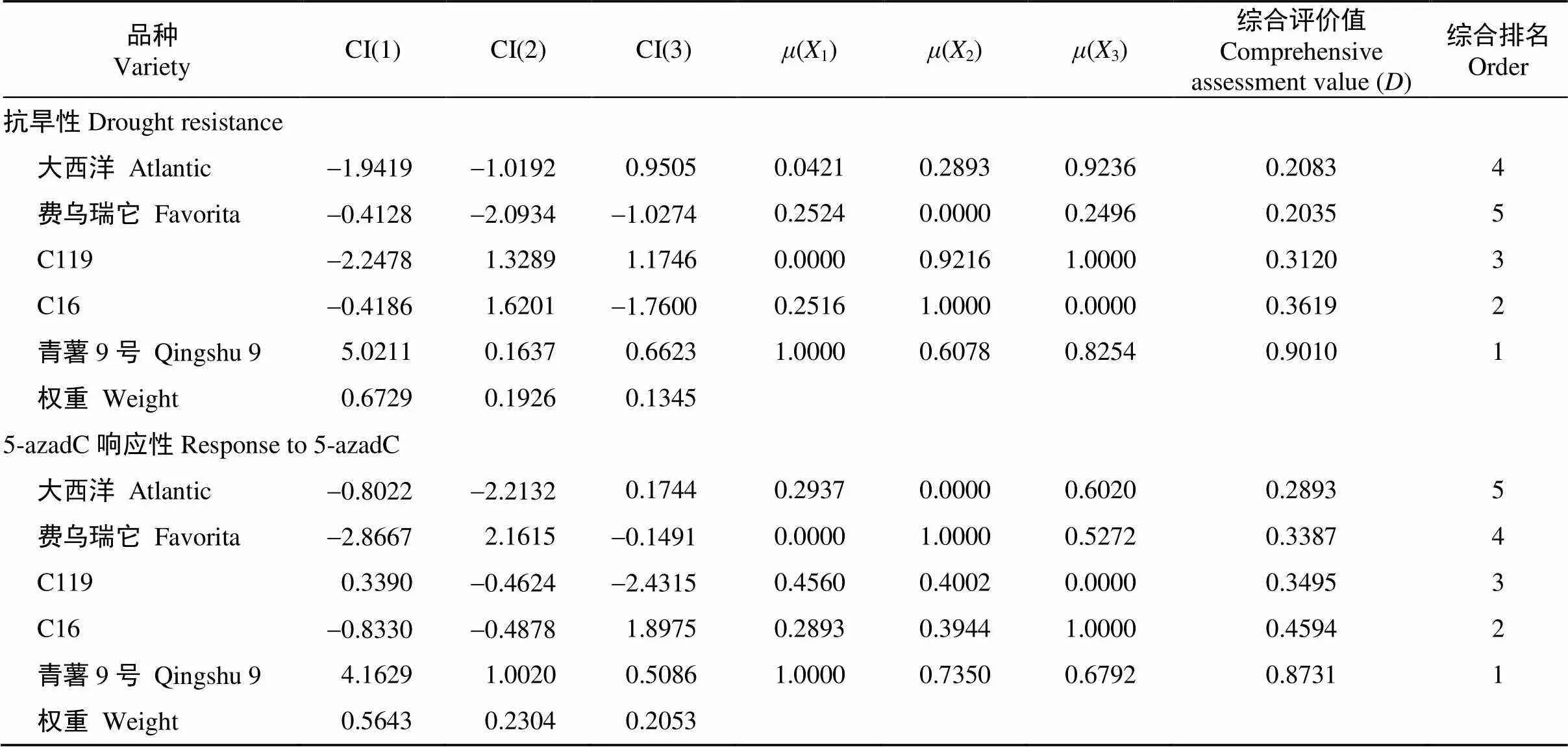
表4 供试品种的综合性状指标、权重、μ(X)及综合评价值(D)
2.2 DNA甲基化抑制剂对马铃薯试管苗生长的影响
2.2.1 表型性状和生理生化指标分析 马铃薯试管苗在5-azadC处理下各表型性状(图1)和生理生化特性(图2)也存在明显差异, 由表1可知, 各个考察性状对5-azadC响应系数的变化范围为0.9902~1.0797, 由高到低依次为丙二醛、超氧化物歧化酶、分枝数、干重、过氧化氢酶、过氧化物酶、株高、平均根粗、鲜重、叶绿素、叶片数、游离脯氨酸、总根长。利用公式(3)计算各品种对5-azadC综合响应系数的CRC值介于0.8753~1.1114。根据5-azadC综合响应系数对供试马铃薯进行排序, 响应程度为青薯9号>C16>费乌瑞它>大西洋>C119。
2.2.2 主成分分析 由表2和表3可知, 与5-azadC响应性相关的前3个主成分的累计贡献率为92.01%, 其中PC1的特征值是6.750, 贡献率为51.92%, 对应较大的特征向量是SOD、POD、CAT、Pro; PC2的特征值是2.757, 贡献率为21.20%, 载荷较高的是平均根粗; PC3的特征值是2.456, 贡献率为18.89%, 载荷较高的是总根长、叶片数、Chl和株高。这样可以把对5-azadC响应系数的13个单项指标转化为3个相互独立的综合指标, 同时也可以代表原始数据的大部分信息。
2.2.3 综合评价 根据对5-azadC响应性的主成分分析分别得到的3个相互独立的综合指标, 利用公式(4)计算不同品种各综合指标的隶属函数值(X)。从表4可以看出, 同一综合指标CI(1)中, 青薯9号(1)最大, 为1.0000。表明青薯9号在CI(1)综合指标上对5-azadC的响应最弱。根据各综合指标贡献率, 利用公式(5)计算其权重W, 计算得到与对5-azadC的响应性相关的3个综合指标权重分别为0.5643、0.2304、0.2053。进一步利用公式(6)计算对5-azadC的响应性的综合评价值, 并根据值对5-azadC的响应性为青薯9号>C16>C119>费乌瑞它>大西洋。
2.3 干旱胁迫及DNA甲基化抑制剂对马铃薯试管苗生长影响的差异比较
从图2可以看出, 干旱和DNA去甲基化处理下, 不同基因型马铃薯试管苗的干鲜重、株高和总根长显著减少(<0.05), 而青薯9号和费乌瑞它的分枝数无显著变化。C16分枝数在去甲基化处理下无显著变化, 而干旱处理下显著减少(<0.05)。青薯9号叶片数在干旱处理下无显著变化, 而去甲基化处理下显著减少(<0.05)。平均根粗除C16在干旱处理下显著减少(<0.05)外, 其余均无显著变化。SOD、POD在干旱胁迫下均显著增加(<0.05), 除C119 SOD无明显变化外, 而去甲基化处理下青薯9号显著增加(<0.05), 其余均无差异。CAT在干旱处理下均显著增加(<0.05), 而去甲基化处理下大西洋、C119和C16无显著变化, 费乌瑞它和青薯9号显著增加(<0.05)。Pro在干旱处理下均显著增加(<0.05), 而去甲基化处理下除大西洋和费乌瑞它无显著变化外, 其余均显著增加(<0.05)。MDA在干旱处理下均显著增加(<0.05), 而去甲基化处理下均无显著变化。大西洋、费乌瑞它、C16和青薯9号的叶绿素含量在去甲基化处理下显著增加(<0.05), 而干旱处理下大西洋和费乌瑞它显著减少(<0.05), C16和青薯9号无差异。C119在2种处理下的叶绿素含量均显著减少(<0.05)。
从表5可以看出, 干旱处理与5-azadC处理相比, 使马铃薯植株干鲜重、株高、叶片数和叶绿素含量均显著减少(<0.05), 其中叶片数和叶绿素含量减少幅度最大, 分别为33.35%和37.00%; SOD、POD、CAT活性和Pro、MDA含量均显著增加(<0.05), MDA含量增加幅度最大, 为121.01%; 而分枝数、根长、平均根粗均无明显变化。
2.4 干旱胁迫及DNA甲基化抑制剂共同处理对马铃薯试管苗生长的影响
以上结果表明, 甲基化抑制剂对马铃薯试管苗生长的影响与干旱胁迫的影响非常相似, 为了进一步分析DNA去甲基化与马铃薯响应干旱胁迫响应的关系, 比较了5-azadC和甘露醇共同处理与分别单独处理24 d后各马铃薯植株形态和生理生化指标。从图2可以看出, 与5-azadC和甘露醇单独处理相比, 共同处理下, 除QS9的干鲜重和株高外, 其余马铃薯试管苗的表型性状均呈下降趋势(图1); 而5种基因型马铃薯品种的SOD、POD、CAT活性、Pro和MDA含量呈增加趋势, 其中响应5-azadC和甘露醇越强的品种(如大西洋、费乌瑞它), 其SOD、POD、CAT活性以及Pro含量增加幅度越大, 而MDA含量则反之。
通过二因素方差分析对干旱处理/对照处理(T1/T0)、5-azadC处理/对照处理(T2/T0)、共同处理/对照处理(T3/T0)之间的差异性进行分析, 由表5可知, 与5-azadC处理相比, 5-azadC和甘露醇共同处理下, 马铃薯试管苗干鲜重、株高、叶片数、分枝数、总根长和叶绿素含量均显著减少(<0.05), 其中分枝数和叶片数减少幅度最大, 分别为51.37%和52.41%; SOD、POD、CAT活性和Pro、MDA含量均显著增加(<0.05), MDA含量增加幅度最大, 为139.82%, 而平均根粗则无明显变化。与甘露醇处理相比, 两者共同处理下马铃薯试管苗的干鲜重、株高、叶片数和总根长均显著减少(<0.05), 其叶片数减少幅度最大, 为28.39%, SOD、POD活性和叶绿素含量均显著增加(<0.05), 其中叶绿素含量增加幅度最大, 为46.54%, 而分枝数、平均根粗、CAT活性和Pro含量无明显变化。

表5 甘露醇和5-azadC单独与共同处理下马铃薯试管苗各指标比较分析
显著性分析使用Duncan’s法进行多重比较(< 0.05)。缩写同表1。
The significance analysis was performed by multiple comparisons using the Duncan’s method (< 0.05). Abbreviations are the same as those given in Table 1.
3 讨论
干旱是影响植物正常生长发育的一个最重要的非生物因素。在长期进化中, 植物形成了系统的抗旱机制[21]。一些研究发现, 植物通过基因组DNA的甲基化、去甲基化过程快速地应对外界干旱环境, 表明DNA甲基化在植物响应干旱胁迫中起重要作用[22]。而目前有关马铃薯抗旱性与DNA甲基化之间的研究较少。本研究利用DNA甲基化抑制剂、甘露醇模拟干旱胁迫分别处理不同品种马铃薯试管苗, 分析对其形态和生理生化的影响, 来初步预测DNA甲基化与马铃薯响应干旱胁迫之间的关系。
植物暴露于外源5-azadC, 可通过限制DNA甲基化来诱导表型和发育性状变异。许多植物已经显示出这种现象, 例如造成水稻株高降低以及马铃薯花和叶片形态的异常发育[23-24]。研究发现, 去甲基化处理显著抑制了马铃薯的生长和发育。植物对不同处理的响应程度往往受多种因素影响。为了减少不同品种间各自的遗传背景差异, 使评价更具有代表性, 往往用多种相关指标综合评价及分析[25-27]。本试验分别选取了马铃薯在5-azadC、甘露醇处理下的13个指标用于综合评价。通过主成分分析可将13个单项指标转换成3个新的相对独立的综合指标, 进一步对3个新的综合指标利用隶属函数分析法得到响应5-azadC和干旱的综合评价值。根据综合评价值, 5种马铃薯品种对干旱和DNA甲基化抑制剂响应程度趋势类似。同时, 对干旱胁迫及DNA甲基化抑制剂差异比较发现, 马铃薯植株干鲜重、株高、叶片数和叶绿素含量均显著减少(<0.05); SOD、POD、CAT活性和Pro、MDA含量均显著增加(<0.05), 而分枝数、根长、平均根粗均无明显变化。这说明马铃薯不同指标对响应干旱胁迫和DNA甲基化抑制的调控通路可能有所差异。
为了进一步研究DNA甲基化与马铃薯响应干旱胁迫之间的关系。本研究比较了5-azadC和甘露醇共同处理与分别处理下, 不同马铃薯植株的表型性状和生理特性差异, 发现虽然不同马铃薯品种响应5-azadC和甘露醇的强弱不同, 但是共同处理使其表型性状均受到抑制, 同时活化了SOD、POD、CAT活性, 增加了Pro、MDA的含量。通过二因素方差分析消除品种间差异, 比较不同处理下的表型和生理生化指标差异。与5-azadC、甘露醇单独处理相比, 二者共同处理下马铃薯植株干鲜重、株高、叶片数、总根长均显著降低, 而SOD、POD活性均显著升高, 说明干旱胁迫与去甲基化可能相互作用, 通过不同调控途径最终来影响植株的这些表型性状和生理指标; 而平均根粗无明显变化, 说明干旱胁迫与去甲基化可能通过相同的途径调控这些性状。在研究5-azaC对苜蓿耐盐性中发现, 5-azaC可能对植物生长有一些副作用, 导致生长明显受到抑制, 表现为幼苗株高和干重减少。这表明DNA甲基化对苜蓿的耐盐性是必要的, 并且与MSAP (methylation sensitive amplification polymorphism, MSAP)的结果相一致[28]。本研究也发现DNA去甲基化显著抑制马铃薯的生长发育。虽然去甲基化影响植物的表型生长, 但植物却可以同时通过DNA去甲基化来调控体内相关基因表达、外源基因的防御及基因表达模式的改变等过程, 参与植物对干旱胁迫的响应, 从而使植物更加快速地应对外界干旱环境[29]。钟兰[30]在研究发现, 5-氮杂胞可通过参与活化小麦体内响应逆境胁迫的抗氧化酶系统, 来显著缓解盐胁迫对小麦生长所造成的抑制作用。本研究结果也说明, 5-azadC可能通过DNA去甲基化参与马铃薯对干旱胁迫的响应, 提高马铃薯SOD、POD的活性, 最终显著增强马铃薯体内响应干旱胁迫的抗氧化酶系统活性, 来缓解干旱胁迫对马铃薯植株造成的影响。
[1] 陈利洪, 舒帮荣, 李鑫. 中国干旱半干旱地区农牧业废弃物资源量评价. 干旱区资源与环境, 2018, 32(11): 9–14. Chen L H, Shu B R, Li X. Evaluation of agricultural and animal husbandry waste resources in arid and semi-arid areas of China., 2018, 32(11): 9–14 (in Chinese with English abstract).
[2] 张绪成, 马一凡, 于显枫, 侯慧芝, 王红丽, 方彦杰. 西北半干旱区深旋松耕作对马铃薯水分利用和产量的影响. 应用生态学报, 2018, 29: 3293–3301. Zhang X C, Ma Y F, Yu X F, Hou H Z, Wang H L, Fang Y J. Effects of vertically rotary sub-soiling tillage on water utilization and yield of potato in semi-arid area of northwest China., 2018, 29: 3293–3301 (in Chinese with English abstract).
[3] Ramírez D A, Yactayo W, Rens L R, Rolando J L, Palacios S, De Mendiburu F, Mares V, Barreda C, Loayza H, Monneveux P, Zotarelli L. Defining biological thresholds associated to plant water status for monitoring water restriction effects: stomatal conductance and photosynthesis recovery as key indicators in potato., 2016, 177: 369–378.
[4] 杜康兮, 沈文辉, 董爱武. 表观遗传调控植物响应非生物胁迫的研究进展. 植物学报, 2018, 53: 581–593. Du K X, Shen W H, Dong A W. Advances in epigenetic regulation of abiotic stress response in plants., 2018, 53: 581–593 (in Chinese with English abstract).
[5] Ma C, Liang B, Chang B, Liu L, Yan J, Yang Y, Zhao Z. Transcriptome profiling reveals transcriptional regulation by DNA methyltransferase inhibitor 5-Aza-2’-deoxycytidine enhancing red pigmentation in bagged “Granny Smith” apples ()., 2018, 19: 3133.
[6] 黄韫宇, 张海军, 邢燕霞, 齐艳, 孙倩倩, 周春蕾, 赵冰, 郭仰东. NaCl胁迫对黄瓜种子萌发的影响及DNA甲基化的MSAP分析. 中国农业科学, 2013, 46: 1646–1656. Huang W Y, Zhang H J, Xing Y X, Qi Y, Sun Q Q, Zhou C L, Zhao B, Guo Y D. Effects of NaCl stress on seed germination and DNA methylation status detected by MSAP analysis in cucumber., 2013, 46: 1646–1656 (in Chinese with English abstract).
[7] Kawakatsu T, Huang S S, Jupe F, Sasaki E, Schmitz R J, Urich M A, Castanon R, Nery J R, Barragan C, He Y, Chen H. Epigenomic diversity in a global collection ofaccessions., 2016, 166: 492–505.
[8] Rathore M S, Jha B. DNA methylation and methylation polymorphism in genetically stable in vitro regenerates ofL. using methylation-sensitive AFLP markers., 2016, 178: 1002–1014.
[9] Khan A, Yadav N S, Morgenstern Y, Zemach A, Grafi G. Activation of Tag1 transposable elements indedifferentiating cells and their regulation by CHROMOMETHYLASE 3-mediated CHG methylation., 2016, 1859: 1289–1298.
[10] 潘雅姣, 傅彬英, 王迪, 朱苓华, 黎志康. 水稻干旱胁迫诱导DNA甲基化时空变化特征分析. 中国农业科学, 2009, 42: 3009–3018. Pan Y J, Fu B Y, Wang D, Zhu L H, Li Z K. Spatial and temporal profiling of DNA methylation induced by drought stress in rice., 2009, 42: 3009–3018 (in Chinese with English abstract).
[11] Kottler E J, Vanwallendael A, Franks S J. Experimental treatment with a hypomethylating agent alters life history traits and fitness in., 2018, 2018: 1–10.
[12] 许嵘, 张文州, 陈琳琳, 丁小明, 谢志新, 林阳君, 辛军. DNA去甲基化药物作用机制的研究进展. 现代药物与临床, 2017, 32(1): 152–157. Xu R, Zhang W Z, Chen L L, Ding X M, Xie Z X, Lin Y J, Xin J. Research progress on action mechanism of DNA demethylating agents., 2017, 32(1): 152–157 (in Chinese with English abstract).
[13] 毛锐涛. 马铃薯甲基转移酶和去甲基化酶预测及表达研究. 内蒙古大学硕士学位论文, 内蒙古呼和浩特, 2014. Mao R T. Phylogenetics and Expression of Methyltransferases and Demethylases in Potato. MS Thesis of Inner Mongolia University, Hohhot, Inner Mongolia, China, 2014 (in Chinese with English abstract).
[14] Zhong L, Xu Y H, Wang J B. The effect of 5-azacytidine on wheat seedlings responses to NaCl stress., 2010, 54: 753–756.
[15] Law R D, Suttle J C. Transient decreases in methylation at 5'-CCGG-3' sequences in potato (L.) meristem DNA during progression of tubers through dormancy precede the resumption of sprout growth., 2003, 51: 437–447.
[16] 李媛媛, 程鹏, 熊兴耀, 洪亚辉. 干旱胁迫下马铃薯幼苗DNA甲基化变化研究. 中国马铃薯, 2012, 26: 11–16. Li Y Y, Cheng P, Xiong X Y, Hong Y H. DNA methylation in potato under drought stress., 2012, 26: 11–16 (in Chinese with English abstract).
[17] 李媛媛. 干旱胁迫下马铃薯苗基因组甲基化变化情况及生理生化变化研究. 湖南农业大学硕士学位论文, 湖南长沙, 2011. Li Y Y. Studies on Methylation and Physiological Alterations under Drought Stress in Potato. MS Thesis of Hunan Agricultural University, Changsha, China, 2011 (in Chinese with English abstract).
[18] 王芳, 石茹, 王舰. 马铃薯茎尖玻璃化法超低温保存后DNA甲基化的遗传变异. 分子植物育种, 2013, 11: 351–357. Wang F, Shi R, Wang J. Genetic variation of DNA methylation in potato shoot tips after the cryopreservation by vitrification approach., 2013, 11: 351–357 (in Chinese with English abstract).
[19] Arnon D I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris., 1949, 24: 1–15.
[20] 王学奎, 黄见良. 植物生理生化实验原理与技术(第3版). 北京: 高等教育出版社, 2015. pp 131–287. Wang X K, Huang J L. Principles and Techniques of Plant Physiological Biochemical Experiment, 3rd edn. Beijing: Higher Education Press, 2015. pp 131–287 (in Chinese).
[21] Zhang H, Lang Z, Zhu J K. Dynamics and function of DNA methylation in plants., 2018, 19: 489–506.
[22] 李艳, 钱伟强. 植物中DNA甲基化及去甲基化研究进展. 生命科学, 2017, (3): 302–309. Li Y, Qian W Q. Mechanisms of DNA methylation and demethylation in plants., 2017, (3): 302–309 (in Chinese with English abstract).
[23] Akimoto K, Katakami H, Kim H J, Ogawa E, Sano C M, Wada Y, Sano H. Epigenetic inheritance in rice plants., 2007, 100: 205–217.
[24] Marfil C F, Asurmendi S, Masuelli R W. Changes in micro RNA expression in a wild tuber-bearing Solanum species induced by 5-azacytidine treatment., 2012, 31: 1449–1461.
[25] 郝小琴, 姚鹏鹤, 高峥荣, 吴子恺. 低温胁迫对微胚乳超甜超高油玉米耐寒性生理生化特性的影响. 作物学报, 2014, 40: 1470–1484. Hao X Q, Yao P H, Gao Z R, Wu Z K. Effects of low temperature stress on the physiological and biochemical characteristics of cold tolerance in micro-endosperm super sweet and super high oil maize., 2014, 40: 1470–1484 (in Chinese with English abstract).
[26] 徐宁, 陈冰嬬, 王明海, 包淑英, 王桂芳, 郭中校. 绿豆品种资源萌发期耐碱性鉴定. 作物学报, 2017, 43: 112–121. Xu N, Chen B R, Wang M H, Bao S Y, Wang G F, Guo Z X. Identification of alkali tolerance of mungbean germplasm resources during germination., 2017, 43: 112–121 (in Chinese with English abstract).
[27] 杨宏羽, 平海涛, 王蒂, 王丽, 刘玉汇, 白江平, 余斌, 张俊莲. 不同倍性马铃薯品种的抗旱性. 中国沙漠, 2016, 36: 1041–1049. Yang H Y, Ping H T, Wang D, Wang L, Liu Y H, Bai J P, Yu B, Zhang J L. Drought resistance of different ploidy potato varieties., 2016, 36: 1041–1049 (in Chinese with English abstract).
[28] Al-Lawati A, Al-Bahry S, Victor R, Al-Lawati A H, Yaish M W. Salt stress alters DNA methylation levels in alfalfa (spp.).2016, 15: 15018299.
[29] 黄玉兰, 殷奎德, 向君亮, 徐业梅, 刘兆兵, 丰经书, 任海娟. 干旱胁迫下植物生理生化及DNA甲基化的研究进展. 玉米科学, 2016, 24(2): 96–102. Huang Y L, Yin K D, Xiang Y L, Xu Y M, Liu Z B, Feng J S, Ren H J. Research progress on physiological reaction and DNA methylation under drought stress in plant., 2016, 24(2): 96–102 (in Chinese with English abstract).
[30] 钟兰. 盐胁迫下小麦幼苗的生理生化特性及表观遗传学研究. 武汉大学博士学位论文, 湖北武汉, 2009. Zhong L. Studies on the Physio-biochemical Properties and Epigenetics of Seedlings of Wheat under Salt Stress. PhD Dissertation of Wuhan University. Wuhan, Hubei, China, 2009 (in Chinese with English abstract).
DNA methylation involved in regulating drought stress response of potato
LI Peng-Cheng1,2,**, BI Zhen-Zhen1,2,**, LIANG Wen-Jun1,2, SUN Chao1,2, ZHANG Jun-Lian1, and BAI Jiang-Ping1,2,*
1Gansu Provincial Key Lab of Aridland Crop Science / Gansu Key Lab of Crop Improvement & Germplasm Enhancement, Lanzhou 730070, Gansu, China;2College of Agronomy, Gansu Agricultural University, Lanzhou 730070, Gansu, China
Although epigenetics is essential for regulating gene expression in plant under abiotic stress, there are few reports regarding the epigenetics of potato under drought stress. In this study, five potato cultivars including Atlantic, Favorita, C119, C16, and Qingshu 9, were used to verify that DNA methylation is involved in potato drought stress response. The plantlets were cultured for 24 days on MS medium, MS medium supplemented with 60 μmol L-1methylation inhibitor (5-azadC), 200 mmol L-1mannitol, and 60 μmol L-1methylation inhibitor combined with 200 mmol L-1mannitol, respectively. Phenotypes, and physiological and biochemical traits were recorded and comprehensively analyzed. The response of five potato cultivars to mannitol and 5-azadC was similar.With treatments of mannitol or 5-azadC, the dry/fresh weight, shoot height, leaf number and chlorophyll content decreased significantly (< 0.05), while the activities of SOD, POD, CAT, and contents of proline and MDA increased significantly (< 0.05). No significant changes were observed in branch number, root length and average root diameter, indicating that potato traits might have different regulatory pathways in response to drought stress and DNA demethylation. Compared with the individual treatment, combined-treatment further inhibited the growth of plantlets, and increased activities of SOD, POD, CAT, and contents of MDA and Pro under drought stress and 5-azadC treatment, indicating that the formation of some phenotypes (not all) in response to drought was regulated through the DNA methylation. The results provide preliminary data for further study on epigenetics regulatory pathway of potato under drought stress.
potato; drought stress; DNA methylation; morphological physiology; comprehensive analysis
本研究由国家自然科学基金项目(31660432, 31460369), 国家现代农业产业技术体系(马铃薯)建设专项(CARS-09-P14), 甘肃省马铃薯产业体系(GARS-03-P1), 中国科学院“西部之光”人才培养计划(2014-01), 兰州市科技发展计划项目(2015-3-62), 甘肃省科技厅项目(18JR3RA170)和甘肃省教育厅高校科研项目(2018A-040)资助。
This study was supported by the National Natural Science Foundation of China (31660432, 31460369), the China Agriculture Research System (CARS-09-P14), the Gansu Potato Industry System (GARS-03-P1), the “Light of the West” Talent Training Program of the Chinese Academy of Sciences (2014-01), the Lanzhou Science and Technology Development Plan (2015-3-62), the Gansu Science and Technology Fund (18JR3RA170), and the Gansu Provincial Department of Education University Research Project (2018A-040).
白江平, E-mail:baijp@gsau.edu.cn
**同等贡献(Contributed equally to this work)
李鹏程, E-mail:526040572@qq.com; 毕真真, E-mail: bizhen925@sina.com
2019-02-16;
2019-05-12;
2019-06-06.
10.3724/SP.J.1006.2019.94024
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190605.1800.006.html

