浅谈高中化学实验探究题的一些常见思路与方法

在高中化学的教学中,培养学生了解基础化学规律,培养学生思辨能力,探究能力,无疑是核心目标。因此,在高考的化学试题命题过程中,会着重考察学生对于已有知识的迁移能力,以及分析问题的能力。也同样因为这个原因,高考化学试题中的“实验探究题”孕育而生了。
实验探究题是理综,化学部分的压轴题,在解题过程中有一定的难度,也是同学们失分的大项。本文将以高考北京卷真题以及各区县模拟题为例,简述此类问题的一些考点与题设特点:
1.在本题的开始部分,会考察课内化学方程式的书写以及对课内常见热点知识的考察。如:酸性条件下亚铁离子被氧气氧化(2017北京);氯气的实验室快速制备(2018北京)。在本部分,往往十分简单,同学们只需认真审题,书写即可。
2.接下来,往往需要同学们运用化学原理解释实验现象,考察知识点为氧化还原反应相关知识和化学平衡与反应速率相关知识。通常要求同学们书写陌生反应方程式,以及运用已学知识解释异常现象。在此类问题中,需要同学们认真阅读题设,理解原实验思路,具体问题具体分析,切勿“想当然”地答题。
3.在整题的最后,会让同学们总结上述实验,概括结论等。在完成全部实验报告的填写后,同学们只需要分解上述实验,分条,完整地总结好结论即可。
除此之外,不得不说,实验探究题的重中之重,即实验设计部分。在本部分中,常要求同学们填补空缺的实验报告,或直接设计实验验证某种性质。在这一部分中,需要同学们深度思考与阅读理解,也是失分的关键所在。为此,我们来讨论一下实验涉及部分两种常见思路及解题方法。
浅谈实验设计题的思路与方法
1.根据题目所给新条件(通常为陌生物质或陌生性质)设计验证及对比实验。
以2015海淀二模(删改)为例
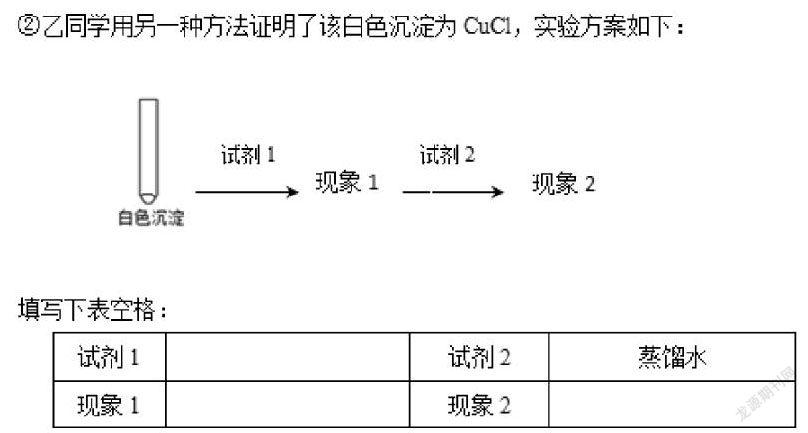
(3)同学们对白色沉淀的成分进行探究。
查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸,存在平衡CuCl+2Cl-CuCl3-。
在这道小题中,我们要探究的是CuCl这个十分陌生的物质。在课内,我们从未接触过这样一个物质,也从未接触过亚铜离子这个离子。因此我们所主观认为的,想象出来的该物质应具有的性质都不能作为解题的方向。那我们不妨研究题设与已知信息。
“CuCl为白色固体,难溶于水,能溶于浓盐酸”,这是我们从已知中得到的该物质的一条性质,那么我们为了验证白色沉淀的组成,应该与已知CuCl的性质进行比较,若二者性质相同,即为同一物质。那么试剂1自然是“浓盐酸”,现象1自然是“白色沉淀溶解”。
继续讨论,我们还需要试剂2才能完成这个对比,那么我们自然需要得知CuCl的第二条化学性质,去反观已知信息,存在平衡:CuCl+2Cl-CuCl3-。在高中化学的学习中,我们对化学平衡是应该敏感的,那么“存在该化学平衡”也正应是氯化亚铜具有的第二条性质。联系题干,试剂2是蒸馏水,反应物一方被稀释后对反应商的影响比生成物方更大,由反应商与平衡常数的关系,平衡逆向移动,会生成更多的CuCl。因此,现象2应为有白色沉淀析出。
通过对该小题的一些分析,我们不难看出,对于陌生物质,陌生性质,我们在设计验
证实验的根本思路是完全对照题目已知信息,简而言之即:“若被检验物质和某已知物质的多个化学性质一致,则二者为相同物质”。
这种分析问题的方法在本题的下一问中依然有应用。
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,______,则说明砖红色沉淀是Cu2O。
在该小题中,我们要研究的Cu2O与二氧化硫的反应依然是一个陌生反应,那么按照上面的解题思路,我们要完全去对比题目已知信息。通过表格实验信息,我们不难得知,在实验1中我们制备了一个疑似氧化亚铜的物质,它所具有的性质是通入一段时间二氧化硫后“砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色”。那么如果该物质就是氧化亚铜的话,二者对于相同反应条件,所具有的性质应当相同。因此我们即可得出答案,实验操作为:“加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同)。”
2.设计空白对照组验证性质
在分析之前,先對“空白对照组”的概念进行阐述。
空白对照是指不给予任何处理的对照。举个例子。我们要用硝酸银通过沉淀反应测定一些白色晶体中氯离子的含量(用高成本的硝酸银测定氯离子含量是不合适的,此处只做举例)。实验应用蒸馏水溶解白色粉末后再用硝酸银滴定,现假设实验室中没有蒸馏水,而用自来水进行溶解,那么自来水中氯离子势必对测定结果有影响。为了排除溶剂自来水中原有氯离子干扰,我们设计空白实验组,即先用硝酸银测定等量自来水的氯离子含量,再设计实验组,按上述操作,二者的差值,即为待测物中氯离子含量。
可见,空白实验组排除的是体系内,除待研究组份以外的其他部分对反应的干扰。同理,设计空白实验的方法即为模拟体系内除待测组份以外的其他组份。该思路在实验探究题经常考察。
下面以两题为例。
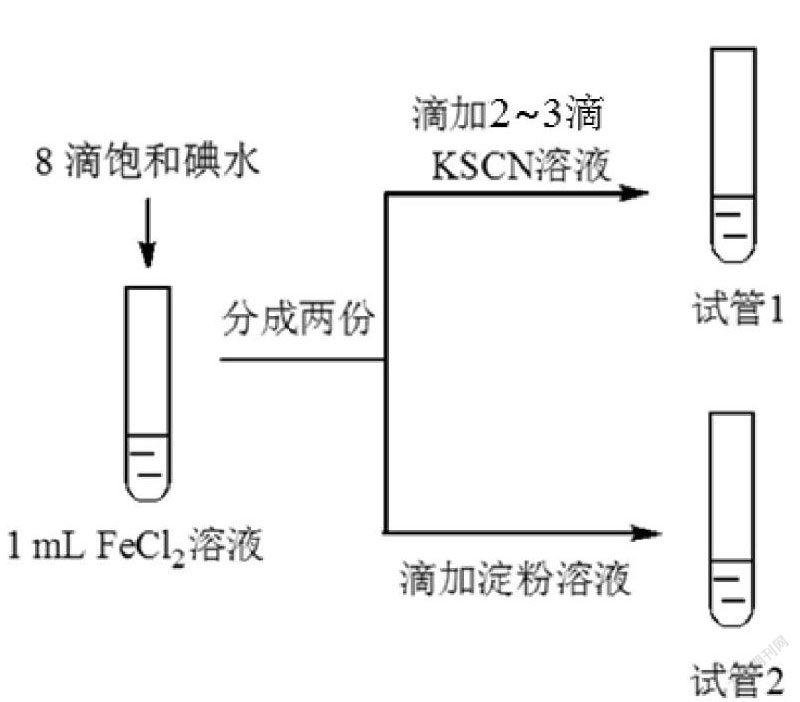
2018朝阳期中,19(删改)
实验现象:试管1溶液变红,试管2溶液呈较浅的蓝色。
实验结论:I2能够氧化FeCl2。
①有的同学认为FeCl2可能被空气中的O2氧化,不足以得出上述结论。
②欲证实实验结论,再次设计对比实验。实验方案和相应的现象是______。
观察实验内容,我们要研究的是碘水氧化亚铁离子的过程,但是空气中的氧气会干扰实验的现象。那么根据空白对照组的思想,一个存在空气的反应条件就是我们的“空白条件”,那么在此空白条件中,我们可以观察得到氧气氧化亚铁离子的“反应程度”,在与存在碘水时“反应程度”对比,二者差值即为碘水的作用效果。而本题只为探究碘水是否氧化了二价铁,那么只需比较实验组现象与空白对照组现象是否一致即可。
故答案为:“取1mLFeCl2溶液,滴入8滴蒸馏水,分成两份。其中一份滴加2~3滴KSCN溶液,与试管1对比,观察溶液变红的时间长短和溶液红色的深浅。”
下面我们通过一道北京市的真题,加深一下对空白对照思想的理解。
2016北京理综,28(删改)
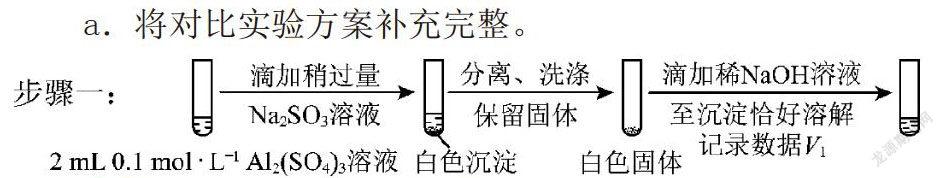
亚硫酸钠溶液与硫酸铝溶液反应生成某白色沉淀。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱。
①推测沉淀中含有亚硫酸根和氢氧根。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
步骤二:(按上图形式呈现)。
b.假设ii成立的实验证据是。
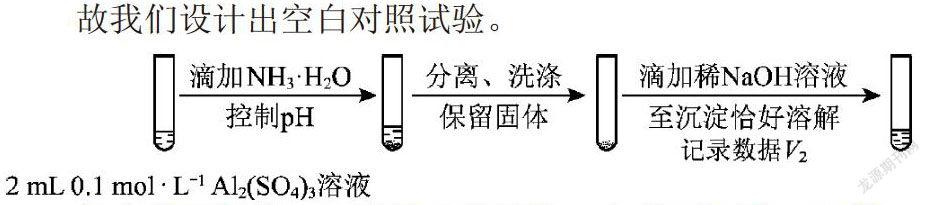
这类流程较长的实验设计问题,我们不妨从结论出发。既然假设ii成立,我们不如认为该白色固体就是碱式亚硫酸铝(当然其中很可能含有氢氧化铝)。那么其空白对照组,就可以认为是其对立的一种组份,即只含有氢氧化铝的组份。因此我们不难设计出空白对照组,只需模仿原实验,制备出氢氧化铝即可,考虑到氢氧化铝的两性,我们用氨水制备氢氧化铝。
故我们设计出空白对照试验。
与实验组相比,二者的实验现象一定是不同的,虽然二者最后都会与氢氧化钠反应而溶解,但是V1,V2的量一定是不同的。那么具体分析二者不同。由高中元素化学知识,碱式盐往往可以看做金属正盐与金属氢氧化物的混合形式(参考碱式碳酸铜),那么我们可以把碱式亚硫酸铝看做亚硫酸铝与氢氧化铝混合的形式。那么该混合物与氢氧化钠反应的过程,應当是亚硫酸铝先与氢氧化钠发生复分解而全部转化为氢氧化铝,然后所有氢氧化铝再与氢氧化钠溶液反应而溶解。因此我们不难得到假设ii成立的实验证据:“V1明显大于V2”
通过上述对实验设计部分答题思路的分析,我们不难看出实验设计的核心思想就是对比。无论是通过与题目新信息的对比,还是空白对照组的设立,无不体现着这一思想,这也是同学们在解题是应该注意的。
以上是对于高中化学实验探究题的一些分析,希望能帮助大家一起更好的理解此类问题的命题思路以及答题方法,望大家有所得!
作者简介:李清杨(2001.01.14——),性别:男,民族:汉,籍贯:北京,北京市第十二中学,

