江口萝卜猪UCP2基因启动子变异分析
吴雪 张继 邱淦远 刘鹏程 杨茂林 刘若余





摘要:【目的】研究江口蘿卜猪UCP2基因启动子变异,并对其进行生物信息学分析,为江口萝卜猪品种选育及开发利用提供理论依据。【方法】利用江口萝卜猪基因组DNA构建混合DNA池,PCR产物直接测序后采用DNASTAR等生物软件分析筛选出SNP位点,然后采用Neural Network Promoter Prediction、TFsitescan、WebGene等生物信息学分析软件预测单核苷酸突变前后的UCP2基因启动子核心区域、转录因子结合位点和CpG岛。【结果】在江口萝卜猪UCP2基因启动子上共筛选到3个SNPs位点,分别是G-84>A、G-161>C和T-366>A。利用生物信息学分析软件分析单核苷酸突变对UCP2基因启动子核心区域、转录因子结合位点及CpG岛的影响,结果发现,从江口萝卜猪UCP2基因启动子上筛选到的3个SNPs位点均不在预测到的启动子核心区域,但靠近转录起始点;3个SNPs位点也不在预测得到的CpG岛内,且不会影响UCP2基因启动子的甲基化水平;3个SNPs位点能在不同程度上导致转录因子结合位点消失或产生新的转录因子结合位点,其中G-161>C突变对转录因子结合位点的影响最大。【结论】从江口萝卜猪UCP2基因启动子上筛选到3个SNPs位点,分别为G-84>A、G-161>C和T-366>A,虽然这3个SNPs位点均不在启动子核心区域及CpG岛内,但不同程度造成转录因子结合位点消失或产生,其中G-161>C的影响最大,可能是调控UCP2基因表达的重要功能突变位点。
关键词: 江口萝卜猪;UCP2基因;启动子;SNP位点;生物信息学
中图分类号: S828.89 文献标志码: A 文章编号:2095-1191(2019)10-2314-08
UCP2 gene promoter variation in Jiangkou Luobo pigs
WU Xue1, ZHANG Ji1, QIU Gan-yuan1, LIU Peng-cheng1,
YANG Mao-lin2, LIU Ruo-yu1*
(1College of Animal Sciences, Guizhou University/Key Laboratory of Animal Genetics, Breeding and Reproduction in the Plateau Mountainous Region (Guizhou University), Ministry of Education, Guiyang 550025, China; 2Science and Technology Bureau of Jiangkou County, Tongren, Guizhou 554400, China)
Abstract:【Objective】The promoter variation of UCP2 gene in Jiangkou Luobo pigs was studied and bioinformatics analysis was conducted to provide reference for breeding and development of Jiangkou Luobo pigs. 【Method】The genomic DNA of Jiangkou Luobo pigs were used to construct a mixed DNA pool. The SNPs sites were screened by PCR direct sequencing and analyzed by DNASTAR and other bioinformatics softwares like Neural Network Promoter Prediction, TFsitescan and WebGene which were used to predict the UCP2 gene core promoter before and after single nucleotide mutation region, transcription factor binding site and CpG island. 【Result】Three SNPs sites were screened in the UCP2 promoter region of Jiangkou Luobo pigs, which were G-84>A, G-161>C and T-366>A, respectively. Bioinformatics analysis software was used to analyze the effect of single nucleotide mutation on the core region of UCP2 gene promoter, transcription factor binding site and CpG island in Jiangkou Luobo pigs. It was demonstrated that the three SNPs sites were not located in the core promoter regions predicted but close to the transcription start site by many kinds of software. The three SNPs were not existed in the predicted CpG island and did not affect the methylation level of the UCP2 promoter region. The three SNPs could cause the transcription factor binding site to disappear or produce a new transcription factor binding site in which the G-161>C mutation had the greatest effect on the transcription factor binding site. 【Conclusion】Three SNPs are screened from the promoter of UCP2 gene in Jiangkou Luobo pigs, which are G-84>A, G-161>C and T-366>A, respectively. Although these three SNPs are not in the core promoter region and the CpG island, but can lead to the transcription factor binding site disappear or produce, and G-161>C has the greatest influence, which may be an important functional mutation site regulating gene expression.
Key words: Jiangkou Luobo pig; UCP2 gene; promoter; SNP site; bioinformatics
0 引言
【研究意义】江口萝卜猪是在贵州特殊自然环境下选育获得的优良地方猪品种,是我国地方猪种遗传资源保护品种之一,主要分布在贵州铜仁市江口县及其毗邻的松桃和碧江等县。江口萝卜猪具有早熟易肥、皮薄骨细及肉味香浓等特点,深受当地群众的喜爱;但同时存在生长缓慢和瘦肉率低等缺陷(惠嫣婷等,2014)。解耦联蛋白(Uncoupling protein,UCPs)是线粒体阴离子转运家族(Mitochondrial anion carrier family,MACF)成员(Pennacchio et al.,2001,2002),UCPs家族共有6个成员,分别是UCP1、UCP2、UCP3、UCP4、UCP5和UCP6(Sokolova and Sokolov,2005)。UCPs是一种线粒体内膜蛋白,其主要功能是在氧化磷酸化过程中发挥解耦联作用,能以质子漏方式实现氧化磷酸化电子传递过程中的质子回流,可降低质子电化学梯度(Ricquier and Bouilaud,2000),使呼吸链与腺嘌呤核苷三磷酸(ATP)合成过程解耦联,进而致使氧化磷酸化合成ATP的效率下降,以热能的形式散发能量(张雷等,2010)。可见,UCPs对氧化磷酸化反应是生成ATP还是产热散能具有决定性作用(陈亦婷和曾其毅,2016),因此,深入研究UCPs基因家族的调控机制有利于揭示其在畜禽生长发育过程中的功能作用。【前人研究进展】UCP2是至今发现对动物能量代谢具有最直接影响的功能蛋白,且不同于UCPs家族中的其他蛋白,其广泛分布于动物的各种组织器官中,如白色脂肪组织、中枢神经系统及骨骼肌等(周辉和张旭家,2008)。UCP2可调节ATP的合成而减少活性氧生成。已有研究证实,UCP2基因在β细胞上调表达的同时伴有β细胞内ATP储备减少现象(Chan et al.,2001),且局部的解耦联可降低线粒体内NADH/烟酰胺腺嘌呤二核苷酸磷酸(NAD)的比例,加快底物氧化,进而促使底物氧化还原反应过程中产生的活性氧减少(Echtay et al.,2001)。Brand和Esteves(2005)研究表明,UCP2通过降低ATP/ADP比例而抑制钙离子内流,从而减少葡萄糖对胰岛素分泌的刺激作用,最终负向调节胰岛素分泌。UCP2基因在多个组织器官中均有表达,除在β细胞中对胰岛素分泌起负调节作用外,在脂肪酸代谢中也发挥着负调节作用(Liu et al.,2013)。由于UCP2基因在能量平衡、脂肪代谢及体重调节方面均发挥着重要作用,因此与动物的生长发育密切相关。Sherman等(2008)研究表明,肉牛UCP2基因外显子和内含子上的突变与瘦肉量、干物质采食量和背膘厚相关;陈翠等(2012)研究发现,西门塔尔牛UCP2基因上的C161T和C305T两个SNPs位点与其饲料转化率、平均日增重、胸围和腹围显著相关;刘文超(2014)研究发现,UCP2基因c.72G>A位点与家兔的生长性状、屠体性状及部分肉质性状间存在关联性;蒋秋斐等(2016)研究发现,UCP2基因第一外显子SNP位点T632C对西门塔尔牛各生长性状存在显著效应,且AA基因型可作为后期品种选育的目的基因型;Wang等(2016)通过对441头秦川牛进行直接测序分析,结果发现UCP2基因5'UTR区(SNP1:g.C-754G)的一个单核苷酸多态性与其背脂肪厚度、腰肌面积和肌内脂肪含量等肉质性状相关;张娟等(2018)通过研究黑安格斯牛UCP2基因多态性,并对其多态位点不同基因型和生长性状进行关联性分析,结果证实UCP2-655G>C位点对黑安格斯牛生长性状无显著影响。此外,刘建华等(2015)研究揭示了UCP2基因在绵羊脂肪组织中呈季节性表达差异。【本研究切入点】目前,针对猪UCP2基因的研究主要集中在特异组织或特定生理状态下的表达规律及其调控等方面,且已证实猪UCP2基因在不同品种间存在表达差异(Damon et al.,2000;Katsumata et al.,2004;Mostyn et al.,2004)。说明UCP2基因可能是影响畜禽生长性状的主效基因或与主效基因紧密连锁的标记基因,但国内有关UCP2基因的研究主要集中在牛和羊等动物上,在猪上的研究报道甚少。【拟解决的关键问题】以UCP2基因为目的基因,提取基因组DNA并构建江口萝卜猪DNA池,直接测序后采用DNASTAR等生物软件分析筛选出SNP位点,并对其突变前后的启动子进行生物信息学分析,预测单核苷酸突变对UCP2基因啟动子核心区域、转录因子结合位点和CpG岛的影响,为江口萝卜猪品种选育及开发利用提供理论依据。
1 材料与方法
1. 1 试验材料
56份江口萝卜猪耳组织样品均采自贵州省江口县,采用Ezup柱式动物基因组DNA抽提试剂盒[生工生物工程(上海)股份有限公司]提取其基因组DNA。基因组DNA浓度使用NanoDrop 2000超微量紫外分光光度计进行测量,重复3次,取平均值;然后以1.0%琼脂糖凝胶电泳检测提取效果,并将所有样本DNA浓度调至100 ng/μL,各取5.0 μL混合,构建DNA池,4 ℃冰箱保存备用。
1. 2 引物设计合成及DNA扩增
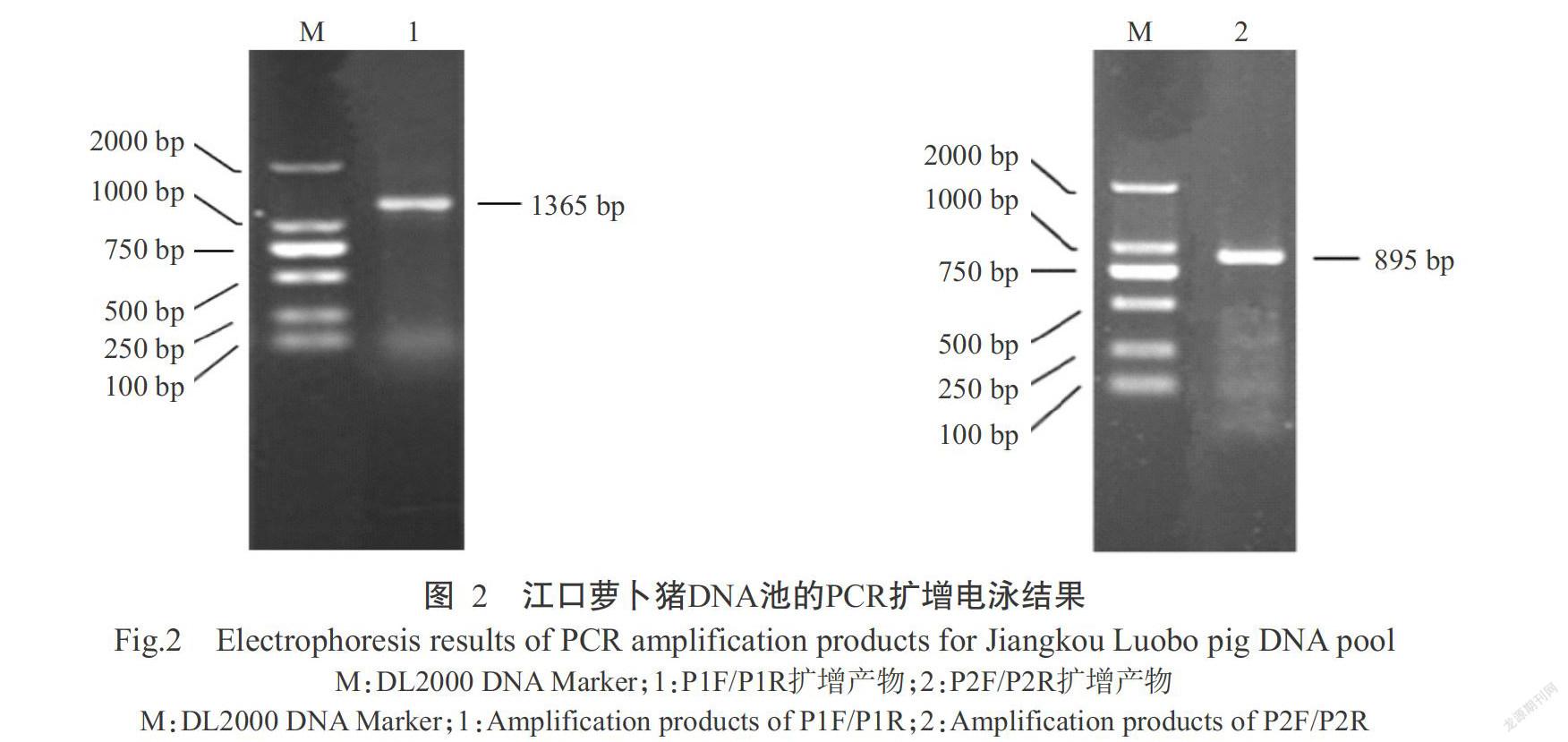
参考猪UCP2基因DNA序列(GenBank登录号NC_010451.4),利用Primer Premier 5.0设计2对特异性引物(表1),扩增外显子上游2000 bp启动子序列(图1);引物委托生工生物工程(上海)股份有限公司合成。PCR反应体系20.0 μL:DNA模板2.0 μL,2×Taq PCR Master Mix 10.0 μL,上、下游引物(10 pmol/μL)各2.0 μL,ddH2O 4.0 μL。扩增程序:95.0 ℃预变性5 min;95.0 ℃ 30 s,退火温度退火30 s,72.0 ℃ 30 s,进行35个循环;72.0 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳后采用荧光成像系统进行观察拍照。取电泳条带单一、特异性好且无拖带的PCR扩增产物送至北京诺赛基因组研究中心有限公司进行双向测序。
1. 3 序列分析
测序结果采用DNASTAR中的SeqMan分析测序峰图,并结合MegAlign和BLAST与参考序列进行序列比对分析,筛选出SNP位点。
1. 4 生物信息学分析
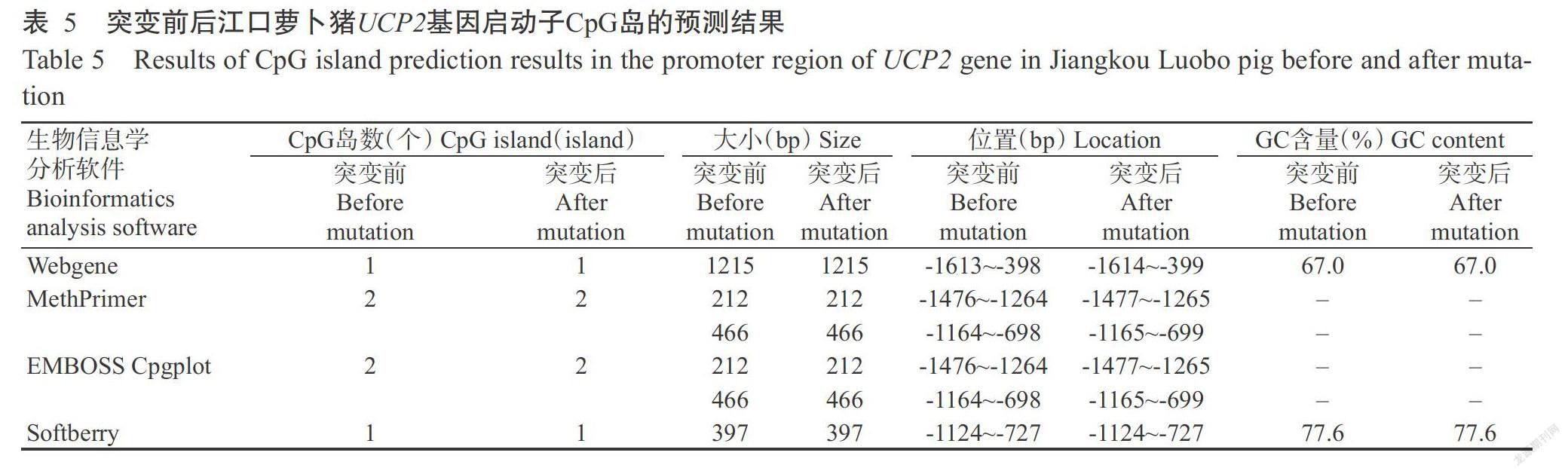
将江口萝卜猪UCP2基因突变前后的序列提交至相关在线软件进行比对分析,尽可能提高预测结果的准确性。采用Neural Network Promoter Prediction、Promoter 2.0和Promoter SCAN进行启动子核心区域预测,使用TFsitescan、Ali Baba 2.1和LASAGNA-Searching 2.0进行转录因子结合位点预测,运用WebGene、MethPrimer、EMBOSS Cpgplot及Soft-berry进行CpG岛预测。各在线分析软件的网址详见表2。
2 结果与分析
2. 1 PCR扩增结果
由图2可看出,PCR扩增产物的电泳条带单一、明亮清晰、特异性良好,且无杂带、无拖带等情况,与预期结果相符,可用于直接测序。
2. 2 测序分析结果
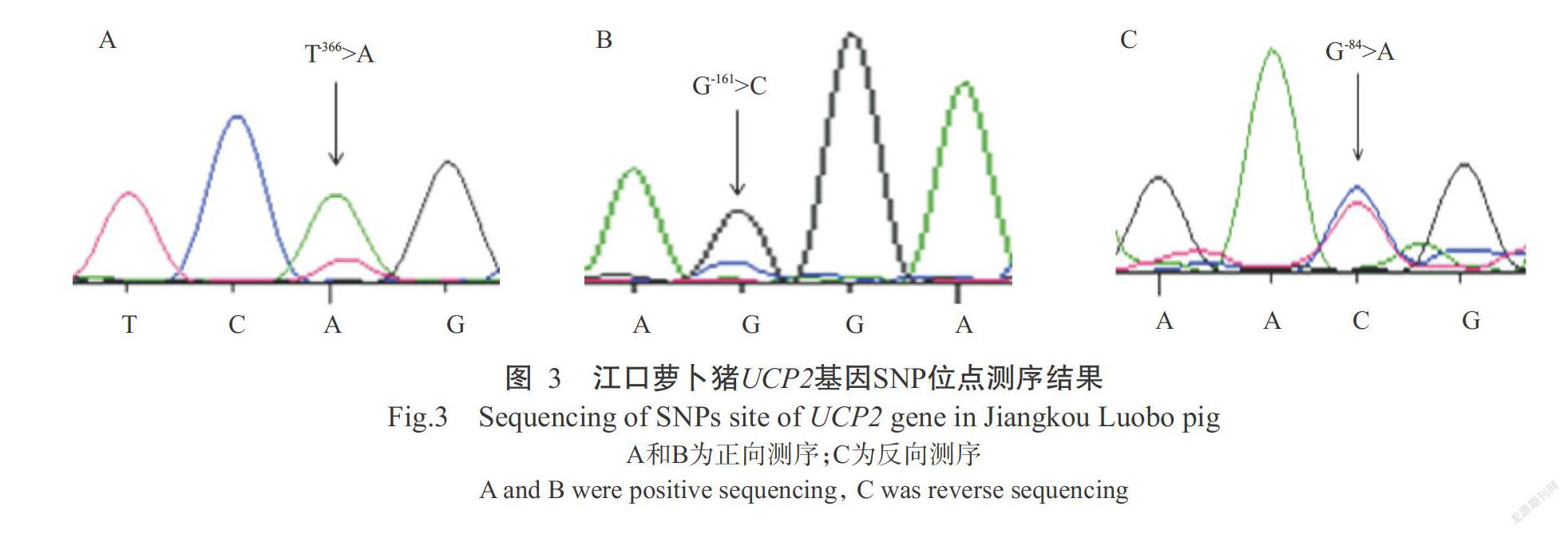
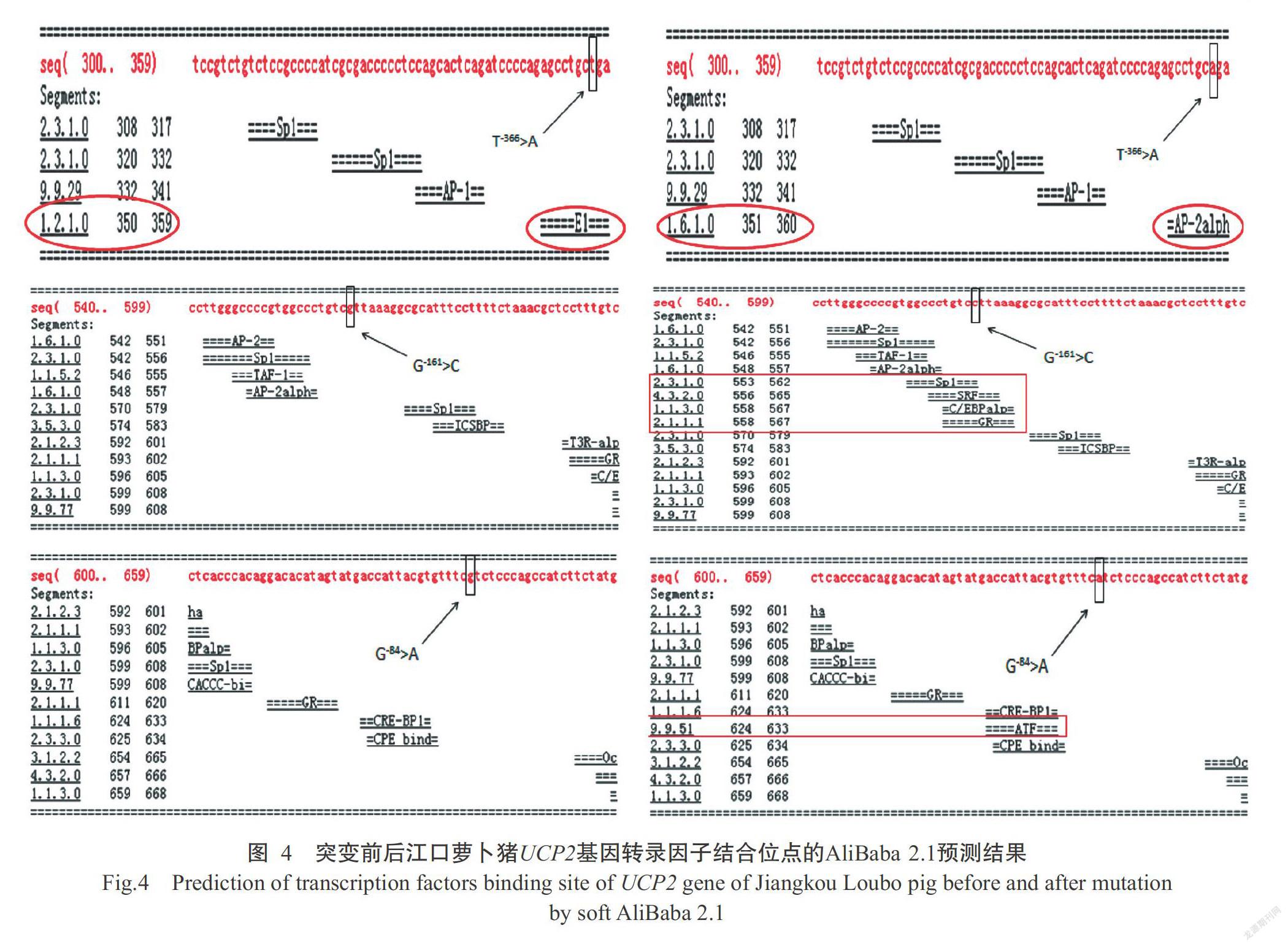
选取电泳条带单一、特异性好且无拖带的PCR扩增产物送至北京诺赛基因组研究中心有限公司进行双向测序,通过DNASTAR和BLAST等分析软件与参考序列进行比对分析,结果发现其与GenBank已公布的猪UCP2基因序列吻合,即确定为猪UCP2基因序列。将所得序列与参考序列进行比对分析,筛选出3个SNPs位点(图3)。以UCP2基因第一外显子第1位碱基位定义为+1,3个SNPs位点分别为G-84>A、G-161>C和T-366>A。
2. 3 UCP2基因启动子核心区域预测结果
采用3种不同的生物信息学分析软件对江口萝卜猪UCP2基因调控序列启动子进行预测,然后选取评分最高的预测结果(表3)。Neural Network Promoter Prediction预测发现存在4个可能的启动子核心区域,评分均在0.80以上,其中-1745~-1695 bp的评分达0.96。Promoter 2.0预测结果评分均较低,最高为0.71,启动子核心区域起始位点为-1600 bp。Promoter SCAN預测到1个启动子核心区域,位于 -1273~-1023 bp处。测序发现的3个SNPs位点均未在预测的启动子核心区域内,但这3个SNPs位点靠近转录起始点,因此是否在UCP2基因的表达调控中发挥重要作用还需进一步探究。
2. 4 UCP2基因启动子区转录因子结合位点预测结果
利用3种不同的生物信息学分析软件对江口萝卜猪UCP2基因启动子突变前后的转录因子结合位点进行预测,具体预测结果详见表4。其中,TFsitescan预测发现,T-366>A突变会导致-370 bp处有1个转录因子结合位点消失,G-161>C突变会导致-166 bp和 -164 bp处2个新的转录因子结合位点产生;AliBaba 2.1预测发现,3个SNPs位点的突变会导致1个转录因子结合位点改变,并产生5个新的结合位点(图4);LASAGNA-Searching 2.0预测发现,3个SNPs位点的突变会导致1个高分结合位点消失、3个高分结合位点产生。说明从江口萝卜猪UCP2启动子上筛选到的3个SNPs位点均能不同程度地造成转录因子结合位点改变,促使UCP2基因转录因子结合效率增高。
2. 5 UCP2基因启动子CpG岛预测结果
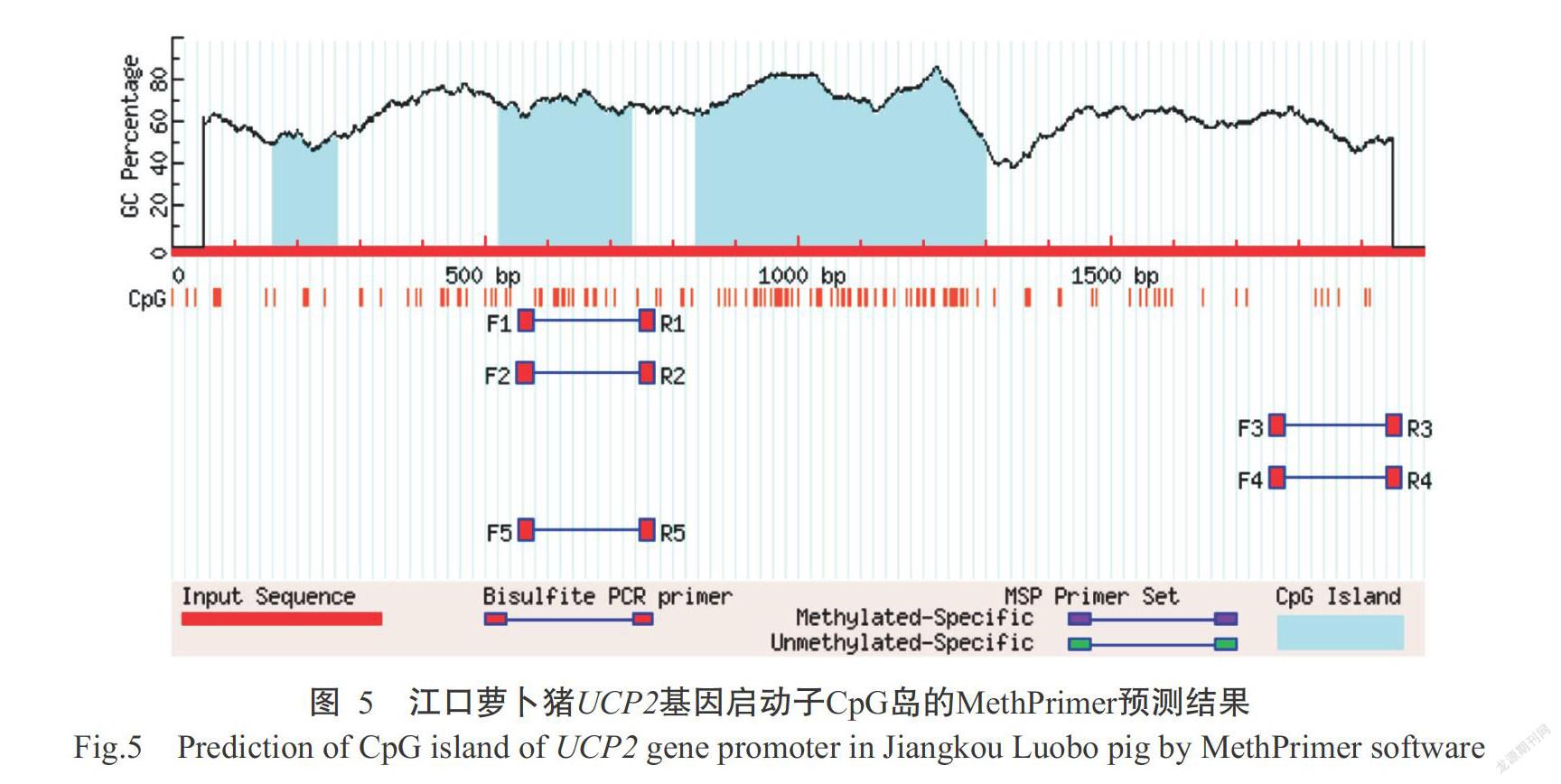
以Obs/Exp值大于0.6,GC含量大于50.0%和CpG岛范围大于200 bp为标准,采用Webgene、MethPrimer、EMBOSS Cpgplot和Softberry等4种不同的生物信息学软件预测江口萝卜猪UCP2基因启动子突变前后的CpG岛,均发现有CpG岛存在(表5)。其中,MethPrimer和EMBOSS Cpgplot的预测结果一致,在相同位置(-1476~-1264 bp和-1164~-698 bp)发现2个CpG岛(图5)。虽然4个生物信息学分析软件所预测到的CpG岛大小和位置不完全相同,但在-1200~ -700 bp的区域内4个生物信息学分析软件的预测结果均表明极有可能存在1个CpG岛。从江口萝卜猪UCP2启动子上筛选到的3个SNPs位点均不在预测得到的CpG岛内,且不会影响UCP2基因启动子的甲基化水平,说明SNP位点以此调控基因表达的可能性较小。
3 讨论
启动子是决定基因活动的开关,但同时受各种转录因子及甲基化水平等因素的调节。当葡萄糖含量增加时,通过不同转录因子(PPARs和SREBP1c)和核因子(HNF和C/EBPβ)可促进UCP2基因mRNA的表达(Chan and Harper,2006)。UCP2通过氧化磷酸化的解耦联作用而调节ATP合成,限制活性氧产生,进而调节胰岛素的分泌及脂肪酸的氧化,广泛参与生物体的生长发育调控。Yu等(2005)研究表明,UCP2基因启动子-886 bp处的G/A单核苷酸多态性可调节胰腺β细胞和脂肪细胞中UCP2基因的表达,从而影响血浆中甘油三酯和胆固醇的水平,即与人类的糖尿病和肥胖症有密切关系。目前,在畜禽品种上针对UCP2基因的研究主要集中在外显子变异上。李维等(2015)以比利时兔、加利福尼亚兔和新西兰兔为研究对象,从第三外显子上筛选到1个错义突变Exon3-A63>C,并证实该突变会导致基因编码mRNA二级结构及其蛋白二、三级结构改变。蒋秋斐等(2016)在宁夏西门塔尔杂种牛群体UCP2基因第一外显子中检测到3个SNPs位点,且发现AA基因型个体在不同月龄体高、胸围显著或极显著高于BB基因型。本研究通过混合DNA池测序的方法,从江口萝卜猪UCP2基因启动子序列上筛选得到3个SNPs位点,均属首次在江口萝卜猪上获得,因此是否在不同猪种中普遍存在尚需进一步探究验证。
启动子核心区采用不同生物信息学分析软件预测其结果也不同。本研究为了最大程度地提高预测准确性,选取了多个预测结果较可信的软件预测江口萝卜猪UCP2基因启动子核心区域,但本研究筛选得到的3个SNPs位点均不在预测所得的启动子核心区域内,说明这些SNPs位点通过影响核心调控元件而调控基因表达的可能性较小。这3个SNPs位点对转录因子结合位点影响较大,能在不同程度上导致转录因子结合位点消失或产生新的转录因子结合位点,其中G-161>C突变对转录因子结合位点的影响最大,说明该突变可能通过影响转录因子结合位点而影响UCP2基因的表达。此外,Webgene等生物信息学分析软件均能在江口萝卜猪UCP2基因启动子上预测到不同大小的CpG岛,虽然不同生物信息学分析软件的预测结果不完全相同,但均包含 -1200~-700 bp区域内的一段序列,说明此区域很有可能是1个CpG岛,UCP2基因通过甲基化水平调节基因表达的可能性较大。在从江口萝卜猪UCP2启动子上筛选到的3个SNPs位点中,G-161>C可能是重要的功能突变位点,其对UCP2基因启动子的影响最大,但对UCP2基因表达的影响还需进一步研究验证。
4 结论
从江口萝卜猪UCP2基因启动子上筛选到3个SNPs位点,分别为G-84>A、G-161>C和T-366>A,虽然这3个SNPs位点均不在启动子核心区域及CpG岛内,但不同程度造成转录因子结合位点消失或产生,其中G-161>C的影响最大,可能是调控UCP2基因表达的重要功能突变位点。
参考文献:
陈翠,张立敏,陈晓杰,刘喜冬,张猛,李姣,袁峥嵘,张路培,高雪,高会江,李俊雅,许尚忠. 2012. UCP2基因遗传多态性与西门塔尔牛生长相关性状的遗传效应分析[J]. 畜牧兽医学报,43(5):708-716. [Chen C,Zhang L M,Chen X J,Liu X D,Zhang M,Li J,Yuan Z R,Zhang L P,Gao X,Gao H J,Li J Y,Xu S Z. 2012. Associations of UCP2 gene polymorphisms with growth traits in Simental[J]. Acta Veterinaria et Zootehnica Sinica,43(5):708-716.]
陳亦婷,曾其毅. 2016. 解偶联蛋白2调控机制及实验研究进展[J]. 国际儿科学杂志,43(9):700-703. [Chen Y T,Zeng Q Y. 2016. Uncoupling protein 2 in regulatory mechanisms and basical experiments[J]. International Journal of Pediatrics,43(9):700-703.]
惠嫣婷,杨永强,刘若余. 2014. 猪APOA5和APOC3基因mRNA的表达差异及与肌内脂肪沉积的相关性分析[J]. 基因组学与应用生物学,33(1):94-99. [Hui Y T,Yang Y Q,Liu R Y. 2014. Analysis of mrna expression diffe-rence and relationship with intramus-cular fat content of APOA5 and APOC3 genes in pig[J]. Genomics and Applied Biology,33(1):94-99.]
蒋秋斐,罗晓瑜,洪龙,李欣,封元,巫亮,韩丽云,顾亚玲. 2016. 宁夏西门塔尔杂种牛UCP2基因多态性及其与生长性状的关联性分析[J]. 中国畜牧兽医,43(7):1843-1849. [Jiang Q F,Luo X Y,Hong L,Li X,Feng Y,Wu L,Han L Y,Gu Y L. 2016. Correlation analysis between UCP2 gene and growth traits in Ningxia hibrid simmental cattle[J]. China Animal Husbandry & Veterinary Me-dicine,43(7):1843-1849.]
李维,刘若余,冯艳青,李思,杜雪琴,谢海强,肖超能,林家栋. 2015. 家兔UCP2基因多态性的筛选和生物信息学研究[J]. 基因组学与应用生物学,34(4):700-705. [Li W,Liu R Y,Feng Y Q,Li S,Du X Q,Xie H Q,Xiao C N,Lin J D. 2015. Study on the SNPs of rabbit UCP2 gene and bioinformatics research[J]. Genomics and Applied Biology,34(4):700-705.]
刘建华,乔利英,郭云雁,贾夏丽,刘文忠. 2015. 绵羊UCP2基因的克隆及其在脂肪组织中的季节性差异表达[J]. 畜牧兽医学报,46(7):1114-1121. [Liu J H,Qiao L Y,Guo Y Y,Jia X L,Liu W Z. 2015. Cloning of ovine UCP2 gene and its seasonally differential expression in adipose tissues[J]. Acta Veterinaria et Zootehnica Sinica,46(7):1114-1121.]
刘文超. 2014. 家兔POMC和UCP2基因对生长性状、屠体性状和部分肉质性状的遗传效应研究[D]. 成都:四川农业大学. [Liu W C. 2014. Genetic effects of POMC and UCP2 genes on growth,carcass,and partial meat quality traits in rabbits[D]. Chengdu:Sichuan Agricultural University.]
張娟,母童,蔡正云,顾亚玲,刘丽元,王瑜,封元,蒋秋斐,国鹏. 2018. UCP基因多态性及与黑安格斯牛生长性状的关联分析[J]. 农业生物技术学报,26(7):1195-1202. [Zhang J,Mu T,Cai Z Y,Gu Y L,Liu L Y,Wang Y,Feng Y,Jiang Q F,Guo P. 2018. The polymorphisms of UCP gene and its association with growth traits of black Angus cattle[J]. Journal of Agricultural Biotechnology,26(7):1195-1202.]
张雷,文生萍,谷大海,李志刚,曹振辉,荣华,葛长荣,贾俊静. 2010. UCPs基因多态性与脂肪代谢的相关性研究[J]. 中国畜牧兽医,37(8):78-83. [Zhang L,Wen S P,Gu D H,Li Z G,Cao Z H,Rong H,Ge C R,Jia J J. 2010. The polymorphisms of UCPs genes associated with fat metabolism[J]. China Animal Husbandry & Veterinary Medicine,37(8):78-83.]
周辉,张旭家. 2008. 线粒体解偶联蛋白UCP2的研究进展[J]. 生命科学,20(4):549-559. [Zhou H,Zhang X J. 2008. Advances in the study of mitochondrial uncoupling protein 2[J]. Chinese Bulletin of Life Sciences,20(4):549-559.]
Brand M D,Esteves T C. 2005. Physiological functions of the mitochondrial uncoupling proteins UCP2 and UCP3[J]. Cell Metabolism,2(2):85-93.
Chan C B,Harper M E. 2006. Uncoupling proteins:Role in insulin resistance and insulin insufficiency[J]. Current Diabetes Reviews,2(3):271-283.
Chan C B,Leo D D,Joseph J W,McQuaid T S,Ha X F,Xu F,Tsushima R G,Pennefather P S,Salapatek A M,Wheeler M B. 2001. Increased uncoupling protein-2 le-vels in β-cells are associated with impaired glucose-sti-mulated insulin secretion mechanism of action[J]. Diabetes,50(6):1302-1310.
Damon M,Vincent A,Lombardi A,Herpina P. 2000. First evidence of uncoupling protein-2(UCP-2) and -3(UCP-3) gene expression in piglet skeletal muscle and adipose ti-ssue[J]. Gene,246(1-2):133-141.
Echtay K S,Winkler E,Frischmuth K,Klingenberg M. 2001. Uncoupling proteins 2 and 3 are highly active H+ transporters and highly nucleotide sensitive when activated by coenzyme Q(ubiquinone)[J]. Proceedings of the Natio-nal Academy of Sciences of the United States of America,98(4):1416-1421.
Katsumata M,Matsumoto M,Kawakami S,Kaji Y. 2004. Effect of heat exposure on uncoupling protein-3 mRNA abundance in porcine skeletal muscle[J]. Journal of Animal Science,82(12):3493-3499.
Liu J,Li J,Li W J,Wang C M. 2013. The role of uncoupling proteins in diabetes mellitus[J]. Journal of Diabetes Research. doi:10.1155/2013/585897.
Mostyn A,Litten J C,Perkins K S,Alves-Guerra M C,Pecqueur C,Miroux B,Symonds M E,Clarke L. 2004. Influence of genotype on the differential ontogeny of uncoupling protein 2 and 3 in subcutaneous adipose tissue and muscle in neonatal pigs[J]. Journal of Endocrinology,183(1):121-131.
Pennacchio L A,Olivier M,Hubacek J A,Cohen J C,Cox D R, Fruchart J C,KraussR M,RubinE M. 2001. An apolipoprotein influencing triglycerides in humans and mice revealed by comparative sequencing[J]. Science,294(5540):169-173.
Pennacchio L A,Olivier M,Hubacek J A,Krauss R M,Rubin E M,Cohen J C. 2002. Two independent apolipoprotein A5 haplotypes influence human plasma triglyceride levels[J]. Human Molecular Genetics,11(24):3031-3038.
Ricquier D,Bouillaud F. 2000. Mitochondrial uncoupling proteins:From mitochondria to the regulation of energy ba-lance[J]. The Journal of Physiology,529(1):3-10.
Sherman E L,Nkrumah J D,Murdoch B M,Li C,Wang Z,Fu A,Moore S S. 2008. Polymorphisms and haplotypes in the bovine neuropeptide Y,growth hormone receptor,ghrelin,insulin-like growth factor 2,and uncoupling proteins 2 and 3 genes and their associations with measures of growth,performance,feed efficiency,and carcass merit[J]. Journal of Animal Science,86(1):1-16.
Sokolova I M,Sokolov E P. 2005. Evolution of mitochondrial uncoupling proteins:Novel invertebrate UCP homologues suggest early evolutionary divergence of the UCP family[J]. FEBS Letters,579(2):313-317.
Wang Y,Yang W,Gui L,Zan L. 2016. Association and expression analyses of the UCP2 and Ucp3 gene polymorphisms with body measurement and meat quality traits in Qinchuan cattle[J]. Journal of Genetics,95(4):939-946.
Yu X H,Jr J D,Schreiner P J,Gross M D,Steffes W M,Fornage M. 2005. The uncoupling protein 2 Ala55Val polymorphism is associated with diabetes mellitus:The CARDIA study[J]. Clinical Chemistry,51(8):1451-1456.
(責任编辑 兰宗宝)

