金铁锁转录因子ptMYC2的克隆和生物信息学分析
孟文俊 张爱丽 蒋乐晓 朱文杰 段丽 钱子刚



摘 要:金铁锁是 “云南白药”等多种中成药的重要组成,其有效成分为三萜皂苷,MYC类转录因子在调节植物三萜类次生代谢积累中有重要作用。为研究ptMYC2 基因在金鐵锁三萜皂苷合成代谢途径的调控机制,该研究基于金铁锁转录组测序数据,克隆得到ptMYC2转录因子的两个全长基因;通过生物信息学软件对两条转录因子的同源性、理化性质、疏水性、跨膜结构、亚细胞定位、结构域、靶基因结合位点等进行初步预测分析。结果表明:两条转录因子所编码的蛋白属于亲水性蛋白,不存在跨膜区域,均是非分泌蛋白质,且不存在信号肽;两条转录因子的亚细胞定位于细胞核;结构域分析显示,两个基因都含有bHLH家族结构域;预测得到金铁锁三萜皂苷合成途径中HMGR、FPS、SE、β-AS等基因的启动子可能存在与MYC2结合的E-box特异性结合位点。该研究结果将为进一步研究ptMYC2基因在金铁锁三萜皂苷合成代谢途径的调节机制奠定基础。
关键词: 金铁锁, 转录因子, MYC2, 三萜皂苷, 生物合成途径, 生物信息学分析
MENG Wenjun, ZHANG Aili, JIANG Lexiao, ZHU Wenjie, DUAN Li , QIAN Zigang*
( Certer for Reproducing Fine Varieties of Chinese Medicinal Plants, Yunnan University of Traditional Chinese Medicine, Kunming 650500, China )
Abstract:Psammosilene tunicoides is an important component of various Chinese patent medicines such as “Yunnan Baiyao”, and its active ingredient is triterpenoid saponin. MYC2 is an important transcription factor, which plays an important role in regulating the secondary metabolic accumulation of triterpenoids in plants. In this study, we cloned two transcription factors( ptMYC2-1 and ptMYC2-2 ) of Psammosilene tunicoides based on transcriptome sequencing. Meanwhile, the homology, physical and chemical parameters, hydrophobicity, transmembrane helices, subcellular location, domain, target gene binding site were predicted through bioinformatics software. The experimental results showed that the proteins encoded by the two transcription factors belonged to the hydrophilic protein and did not exist the transmembrane region, and both of them were non-secreted proteins, and without signal peptide. The subcellular of two transcription factors localizes to the nucleus. Domain analysis revealed that both genes contained the bHLH family domain. We predicted that the promoter of these genes( HMGR, FPS, SE and β-AS), which involved the triterpenoid saponin synthesis pathway of Psammosilene tunicoides, contained the E-box binding domain. This study provides the basic information for stu-dying the regulatory mechanisms of the ptMYC2 gene in the metabolic pathway of triterpenoid saponins.
Key words: Psammosilene tunicoides, transcription factor, MYC2, triterpenoid saponin, biosynthetic pathway, bioinformatics analysis
金铁锁(Psammosilene tunicoides)是云南道地的濒危药用植物,是“云南白药”等多种中成药的重要组成。其活性成分是齐墩果烷型三萜皂甙,具有显著的镇痛和抗炎等药理活性(Zhang et al.,2012)。由于其显著的药理活性,该药药用资源已开始匮乏。因此,揭示相关转录因子在金铁锁三萜皂苷合成途径的调控机制,定向增加金铁锁三萜皂苷的积累,显得尤为重要。
茉莉酸(JAs)是植物中重要的植物激素(包括JA及其甲酯衍生物MeJA),它是植物响应生物或非生物胁迫的重要信号转导分子(Devoto & Turner,2010;王云锋等,2019)。其通过在次生代谢过程中调节相关酶基因,可以合成次生代谢产物,如类黄酮和萜类化合物,从而提高植物的抗逆性。其中MYC2转录因子是茉莉酸(JAs)信号途径中的重要转录因子,其可以通过和靶基因的启动子结合,调节下游基因的表达(Nims et al.,2009)。当植物处于正常状态下,植物体内的核蛋白JAZ(Jasmonate-ZIM Domain)及一些共同抑制物(如TOPLESS或TPL-related proteins TPLs)能够抑制JA信号途径中的转录因子,使其不能正常和靶基因的启动子结合,从而抑制转录因子激活下游基因的表达(Chini et al.,2007)。相反,当植物受到胁迫时,JA可以与异亮氨酸共轭以形成茉莉酸异亮氨酸共轭物JA-Ile。 JA-Ile具有一定的生物活性,能使 JAZ蛋白与 Skp1/ Cullin1/ F-box protein COI1( SCF COI1)形成共轭复合体,该复合物被26 S蛋白酶降解,其释放转录因子并调节下游应激基因的表达,促进次生代谢产物的积累(Thines et al.,2007)。目前,已有一些关于MYC2转录因子调节植物次生代谢产物合成的研究报道,如烟草中尼古丁的合成需要NtMYC2的参与,NtMYC2a和NtMYC2b可与抑制因子NtJAZ1形成核配合物,并调节茉莉酸诱导的尼古丁生物合成的多个步骤(Zhang et al.,2012)。 Hong et al.(2012)发现MYC2通过直接结合到倍半萜合酶TPS21和TPS11的启动子区激活表达,调节萜类合酶基因表达和挥发性倍半萜的合成。在长春花中,CrMYC2作为早期茉莉酸甲酯响应因子,通过调节ORCA基因表达进而调控一系列吲哚类生物碱(TIAs) 合成酶基因的表达(Zhang et al.,2011)。但是,对金铁锁转录因子的研究尚未见有报道。目前,课题组前期已经克隆了金铁锁齐墩果烷型三萜皂苷生物合成途径中多个关键酶基因,但转录因子对这些基因的转录调控机制尚不清楚。鉴于此,本研究克隆了金铁锁中相关的ptMYC2基因,并进行了生物信息学分析,预测可能与克隆的ptMYC2相互作用的靶基因。为揭示金铁锁三萜皂苷代谢途径的转录因子调控机制奠定一定的基础。
1 材料与方法
1.1 植物材料
金铁锁采集于云南省丽江市,经云南中医学院钱子刚教授鉴定为石竹科金铁锁属植物金铁锁(Psammosilene tunicoides)。
1.2 主要仪器
高速冷冻离心机(eppendorf);电泳仪(BIO-RAD 公司);DYC-33A 微型电泳槽(BIO-RAD 公司);凝胶成像系统(BIO-RAD 公司); PCR反应扩增仪(BIO-RAD 公司);移液枪(eppendorf);常用耗材均购自昆明鼎国生物技术有限公司。
1.3 主要试剂
TaKaRa Minibest Universal RNA Extraction Kit RNA提取试剂盒(TaKaRa生产批号为AK1602);TaKaRa PrimeScriptTM11st cDNA Synthesis Kit(TaKaRa 生产批号为AK4501 )反转录试剂盒;TaKaRa MiniBEST Agarose Gel DNA Extracyion Kit Ver 4.0割胶回收试剂盒(TaKaRa 生产批号为AK1901)aKaRa MiniBEST Plasmid Purification Kit Ver 4.0 质粒提取试剂盒;DL2000 DNA Marker( TaKaRa 生产批号为A2101A)等。
1.4 方法
1.4.1 引物设计 依据金铁锁转录组中调控因子ptMYC2的两条基因序列分别设计一对扩增引物(表1)。
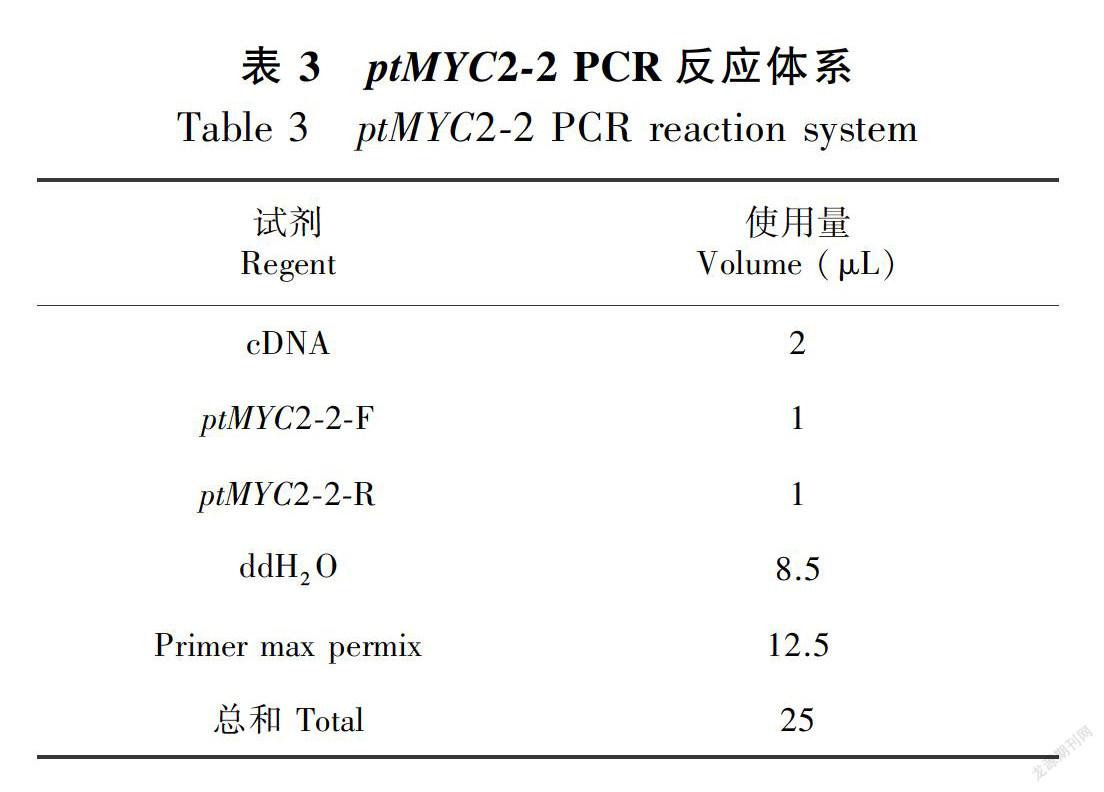
1.4.2 转录因子ptMYC2的克隆 采用总RNA提取试剂盒提取金铁锁根中总RNA;采用Takara 的PrimeScriptTM11st cDNA Synthesis Kit试剂盒将总RNA反转得到第一链cDNA,以该cDNA为模板,利用设计的引物进行两条ptMYC2的全长扩增。其中PCR体系如表2和表3。
经过多次筛选,确定的ptMYC2-1的体系:98 ℃、1 min,98 ℃、10 s,48 ℃、15 s,72 ℃、45 s共32个循环;72 ℃、10 min,4 ℃终止。ptMYC2-2的体系:98 ℃、 1 min,98 ℃、10 s,55 ℃、15 s,72 ℃、45 s共32个循环;72 ℃、10 min,4 ℃终止。PCR产物用1.0%琼脂糖凝胶电泳后,使用试剂盒(TaKaRa)割胶回收并纯化,经过测序得到序列信息。
1.4.3 转录因子ptMYC2的T克隆载体构建 将纯化后的产物与1 μL PMDTM 18-T vector cloning Kit构建10 μL连接体系,连接后转化至酵母感受态细胞中,涂布于LB固体培养基(氨苄青霉素抗性)上,37 ℃温育培养,后挑单克隆过夜培养,使用质粒提取试剂盒按说明提取质粒,进行PCR验证后进行测序。
1.4.4 转录因子ptMYC2的生物信息学分析 对金铁锁的转录调控因子ptMYC2的两个基因进行生物信息学分析。在NCBI(https: //www.ncbi.nlm.nih.gov/) 网站上通过 BLAST程序进行序列同源性比对;使用ORF Finder(https: //www.ncbi.nlm.nih.gov/orffinder/ )寻找其开放阅读框;通过ProtParam(https://web.expasy.org/protparam/)预测蛋白质的理化性质。使用ProtScale(https: //web.expasy.org/protscale/)软件进行疏水性分析;在TMHMM(http: //www.cbs.dtu.dk/services/TMHMM/)网站预测蛋白的跨膜区域;运用在线工具SignalP3.0(http: //www.cbs.dtu.dk/services/SignalP-3.0/)服务器进行蛋白质信号肽預测分析;通过TargetP 1.1 Server(http: //www.cbs.dtu.dk/services/TargetP/)和Cell-PLoc 2.0(http: / /www. csbio. sjtu. edu. cn/bioinf/Cell-PLoc-2/) 预测蛋白质的亚细胞定位情况;使用 SMART(http://smart.embl-heidelberg.de/)软件对 ptMYC2-1和 ptMYC2-2的保守结构域进行预测;应用在线软件CFSSP(http: //www.biogem.org/tool/chou-fasman/index.php)对蛋白质的二级结构进行预测。通过SWISS-MODEL(https: //swissmodel.expasy.org/interactive)进行三级结构预测;应用 MEGA 5. 0 软件构建系统进化树;在NCBI中使用 Blast来搜索目标基因的相似性,参照最高相似物种的序列搜索该序列的基因组序列,并下载目标基因上游2 000 bp的区域作为该目标基因的启动子序列,采用JASPAR2016 server预测可能与ptMYC2互作的靶基因及结合信息位点。
2 结果与分析
2.1 金铁锁转录因子ptMYC2的克隆
提取金铁锁根的总RNA进行1.0%琼脂糖凝胶电泳检测,得到的RNA条带清晰,表明提出金铁锁RNA。将RNA反转为cDNA,PCR扩增后经过1.0%琼脂糖凝胶电泳检测并测序验证。将全长构建入T克隆载体,测序后结果表明扩增序列与转录组序列基本一致。
2.2 金铁锁转录因子基因的生物信息学分析
2.2.1 转录因子基因同源性分析 通过NCBI Blast进行同源性分析,由结果可知,两个转录因子ptMYC2与其他植物的MYC2转录因子具有同源性,根据结果推测扩增出金铁锁ptMYC2-1和ptMYC2-2基因。
2.2.2 转录因子基因编码蛋白质理化性质分析 ptMYC2-1转录因子的蛋白理化性质由Protparam在线工具预测后,分析结果显示ptMYC2-1转录因子开放阅读框1 713 bp,编码了570个氨基酸;预测分子式为C2779H4407N787O885S23;分子量为6 374.68;理论等电点为6.06;在组成的氨基酸当中,丝氨酸(Ser)占比达11.4%,相对较高;不稳定参数为47.66,推测ptMYC2-1蛋白为不稳定蛋白; 脂肪族指数为76.91。使用相同的方法来预测ptMYC2-2转录因子的理化性质,ptMYC2-2的开放阅读框长度为1 902 bp,转录因子编码663个氨基酸;推测蛋白质分子式为C3018H4763N863O972S20;分子量为69 330.42;理论等电点为5.33;在组成的氨基酸当中,也是丝氨酸(Ser)占比最高,达到10.6%;不稳定参数为52.4,推测ptMYC2-2 的蛋白为不稳定的蛋白;脂肪指数为70.88。
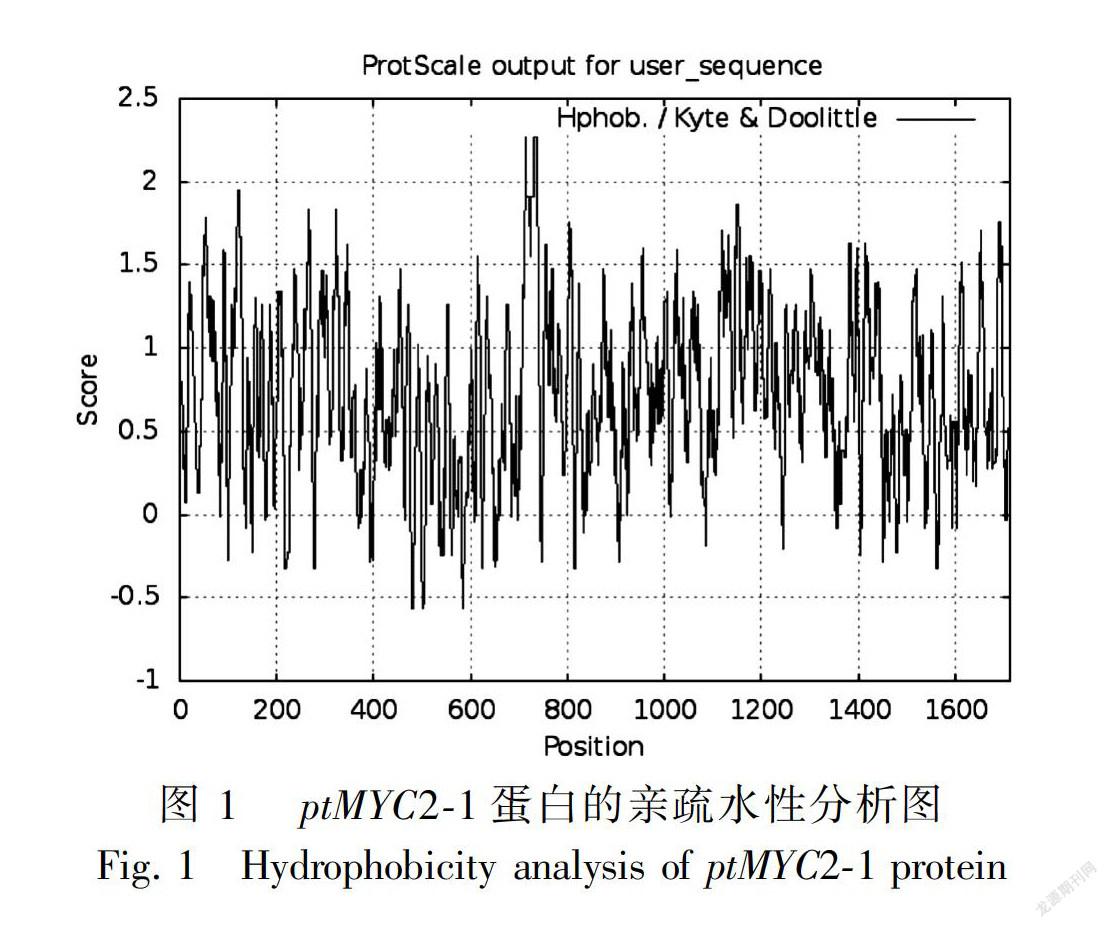
2.2.3 转录因子基因编码蛋白质的疏水性分析 采用 ProtScale 对金铁锁转录因子ptMYC2-1和ptMYC2-2的氨基酸序列的疏水性/亲水性进行分析,从结果可知 (图1,图2), 在379 bp左右位置ptMYC2-1蛋白有一个典型的亲水性区域;在89 bp左右位置ptMYC2-2蛋白有一个典型的亲水性区域。
2.2.4 转录因子基因编码蛋白质的跨膜区分析 通过TMHMM2.0对两个转录因子进行蛋白跨膜结构分析,预测结果显示,这两个基因编码的蛋白均不存在跨膜区域,都不属于跨膜蛋白。
2.2.5 转录因子基因编码蛋白质的信号肽、亚细胞定位预测分析 ptMYC2-1 和ptMYC2-2使用 SignalP 3. 0 软件进行信号肽预测,从神经网络模型分析,可以判断两种蛋白质都没有信号肽。隐马尔福模型进一步证实,金铁锁ptMYC2-1和ptMYC2-2编码的蛋白质均是非分泌蛋白质,并且不存在信号肽。由在线细胞定位分析工具TargetP1.1服务器分析ptMYC2-1和ptMYC2-2编码的蛋白的定位情况,结果显示都定位在其他细胞器,再由Cell-PLoc 2.0进行具体定位分析,两个因子均定位在细胞核。
2.2.6 转录因子基因结构域分析 使用 SMART软件对 ptMYC2-1和 ptMYC2-2的保守结构域进行预测,结果得知ptMYC2-1从39到218位置之间存在一个高度保守的结构功能域 bHLH(图3)。ptMYC2-2从 28到 208位置之间存在一个高度保守的结构功能域bHLH(图4)。即 bHLH家族成员共有的典型结构域。
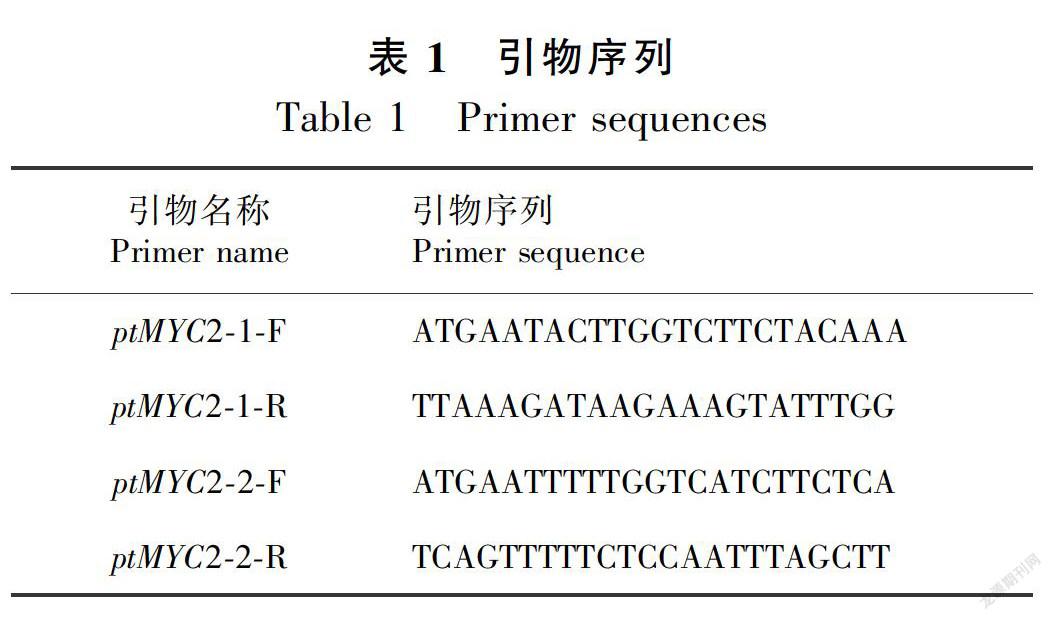
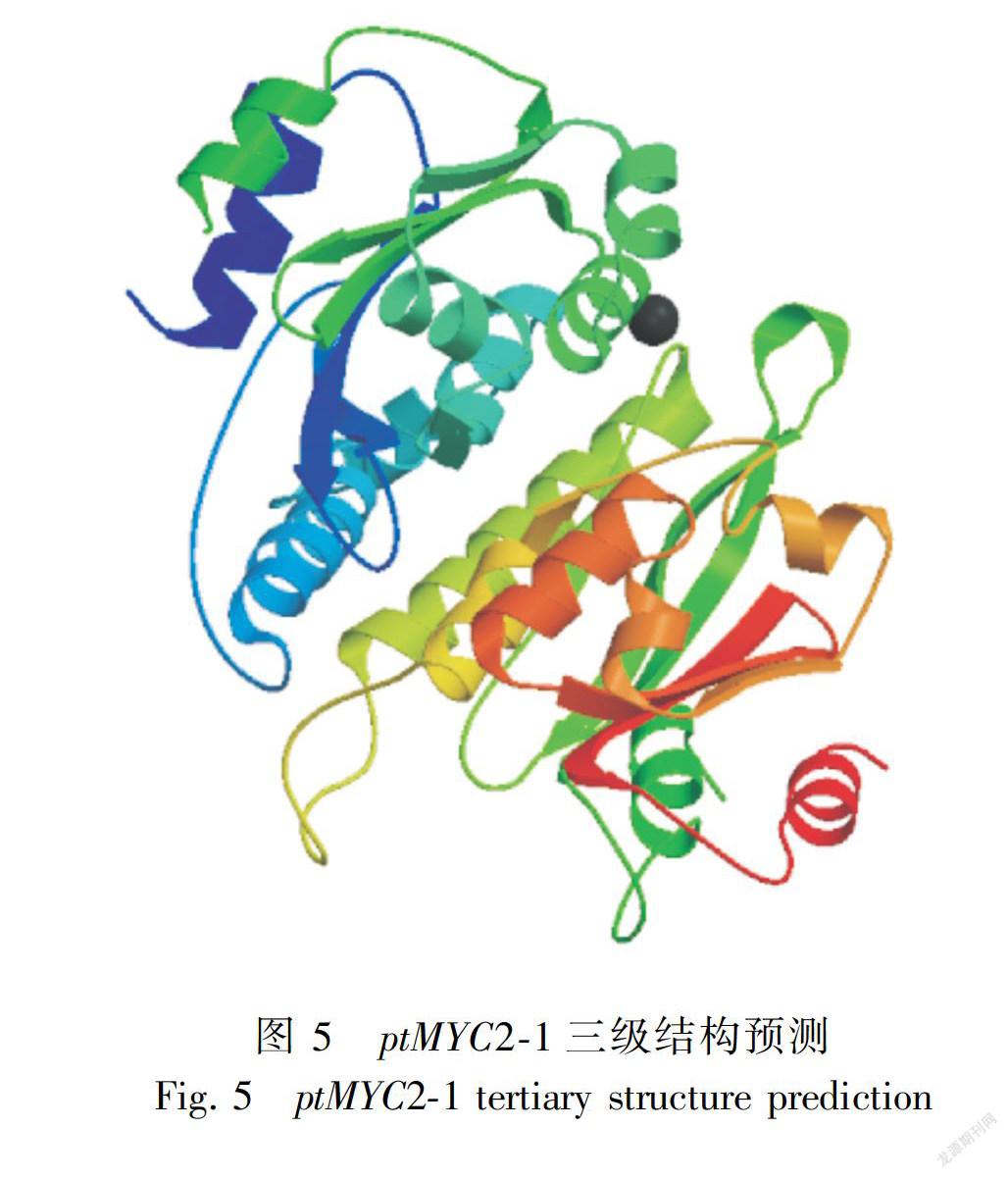
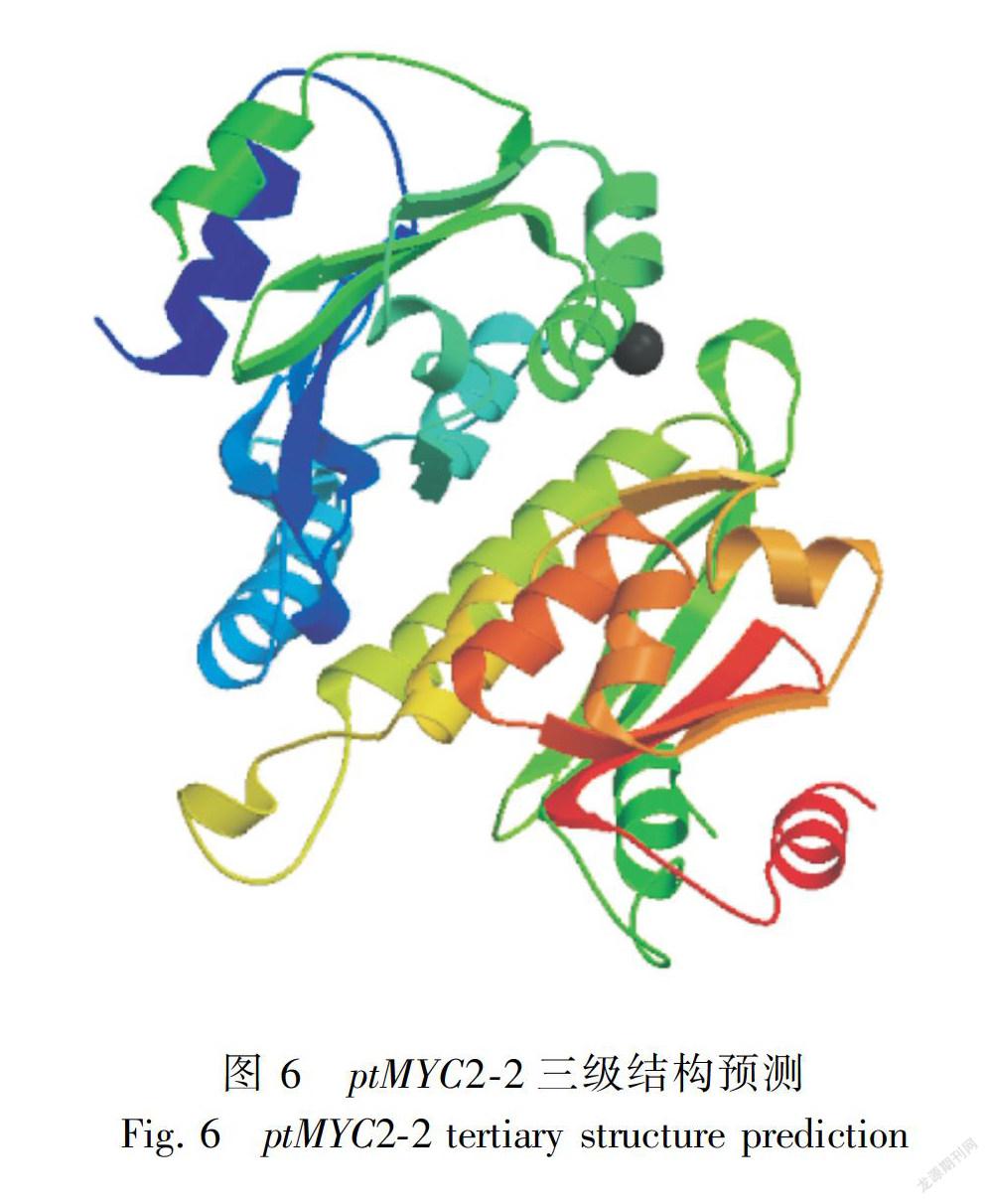
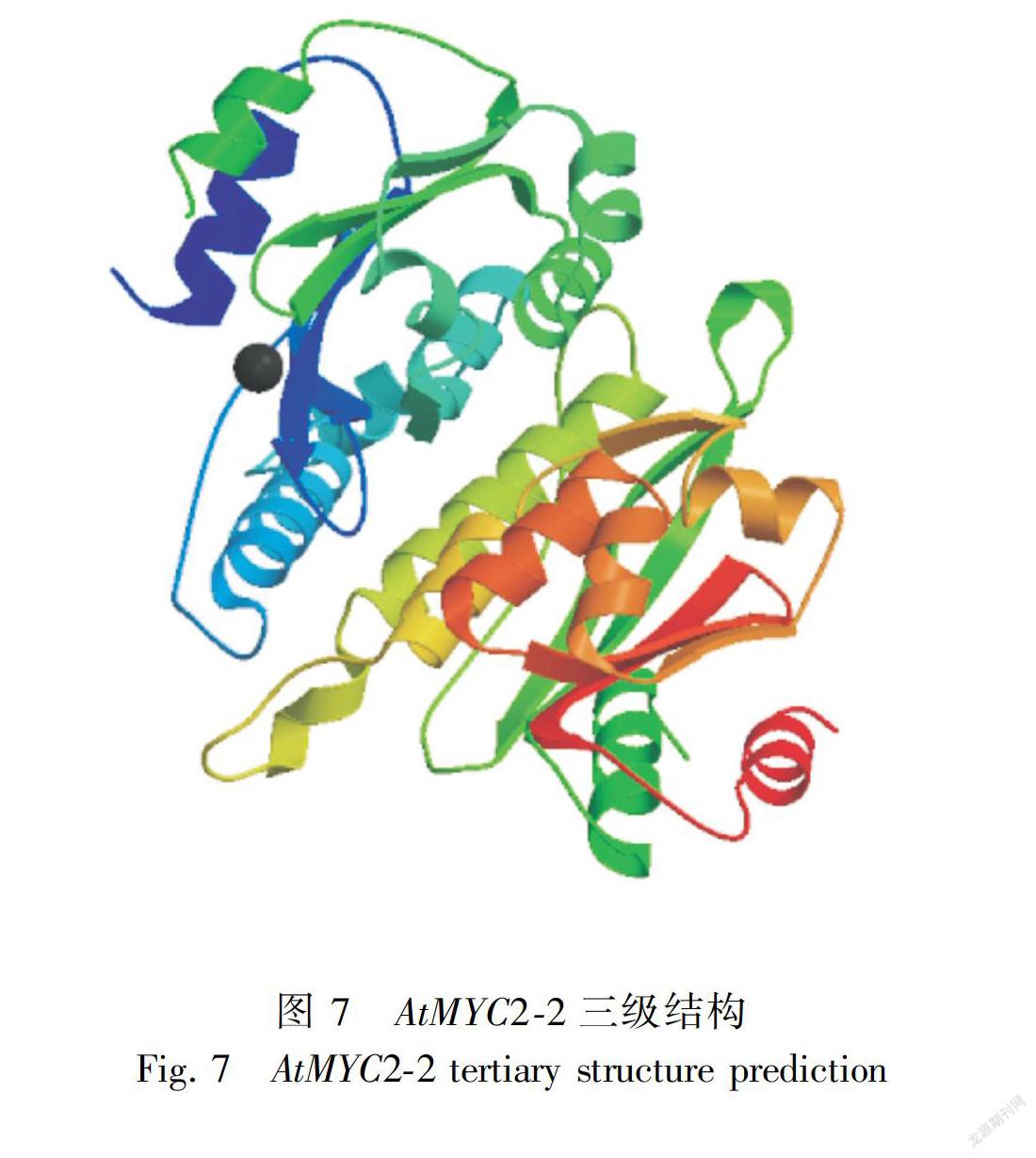
2.2.7 转录因子基因编码蛋白质的二级结构及三级结构预测 通过二级结构在线预测软件CFSSP对ptMYC2-1和ptMYC2-2分别进行分析,结果如下图所示,ptMYC2-1编码蛋白二级结构中,α-螺旋(H)占70%,β折叠(E)占57.2%,转角(T)占14.0%。ptMYC2-2编码蛋白二级结构中,α-螺旋(H)占65.9%,β折叠(E)占51.3%,转角(T)占14.4%。两个基因编码的蛋白质的二级结构均是混合型。以拟南芥 AtMYC2蛋白(登录号 NM-102998.3)为参比模板,利用 SWISS-MODEL对 ptMYC2-1和 ptMYC2-2的蛋白质三维立体结构进行预测。结果如下图所示(图5、图6和图7),金铁锁ptMYC2蛋白的bHLH区域与拟南芥AtMYC2蛋白的bHLH区域结构结构相似。相同bHLH和不同bHLH转录因子的α-螺旋之间可以相互作用,形成同源或异源二聚体从而与靶基因启动子的不同部位结合,发挥转录调控作用。
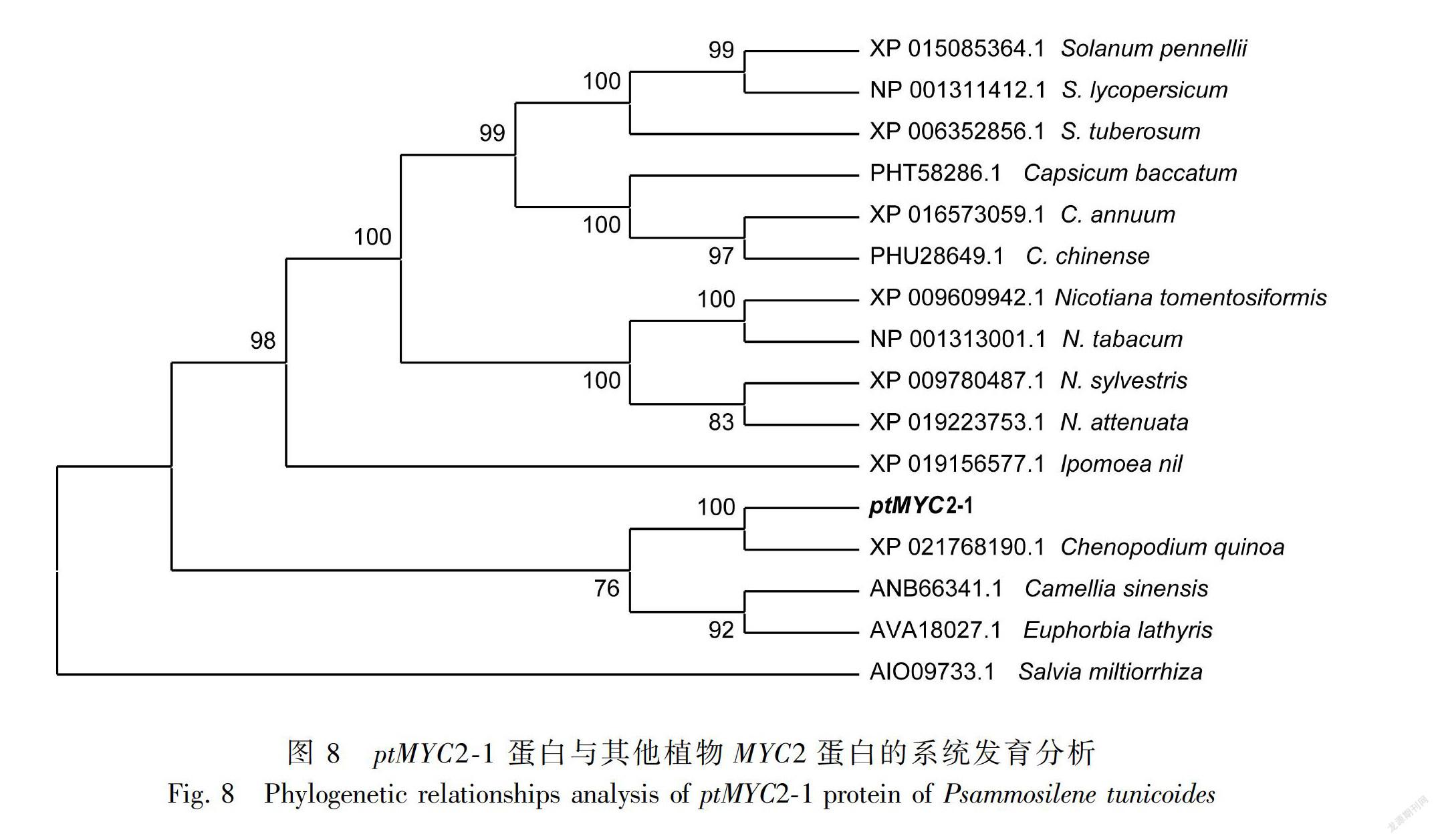
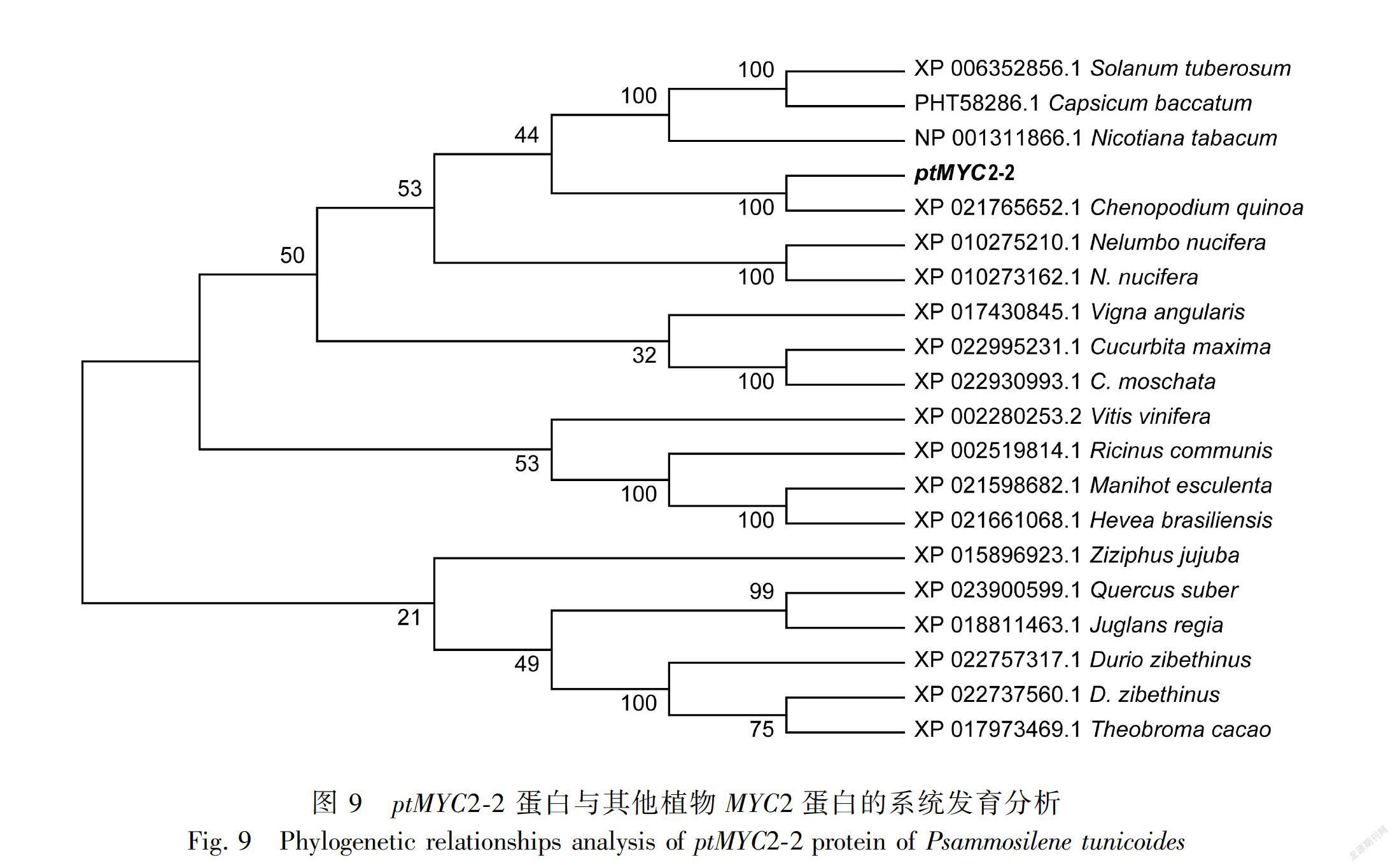
2.2.8 转录因子基因系统进化树的构建 将金铁锁 ptMYC2-1和ptMYC2-2与 GenBank 数据库中多种植物的转录因子进行比对分析后,选取相似性高的植物的MYC2转录因子,利用 MEGA 5. 0中的 Neighbor-Joining 方法,构建系统进化树。结果表明ptMYC2-1與藜麦的MYC2亲缘关系接近(图8)。ptMYC2-2也与藜麦中的MYC2 亲缘关系接近(图9)。由于藜麦属于藜科,金铁锁属于石竹科,藜科与石竹科均属于较原始的类群,亲缘关系较近,所以本研究克隆得到的金铁锁ptMYC2与藜麦的cqMYC2聚为一类。
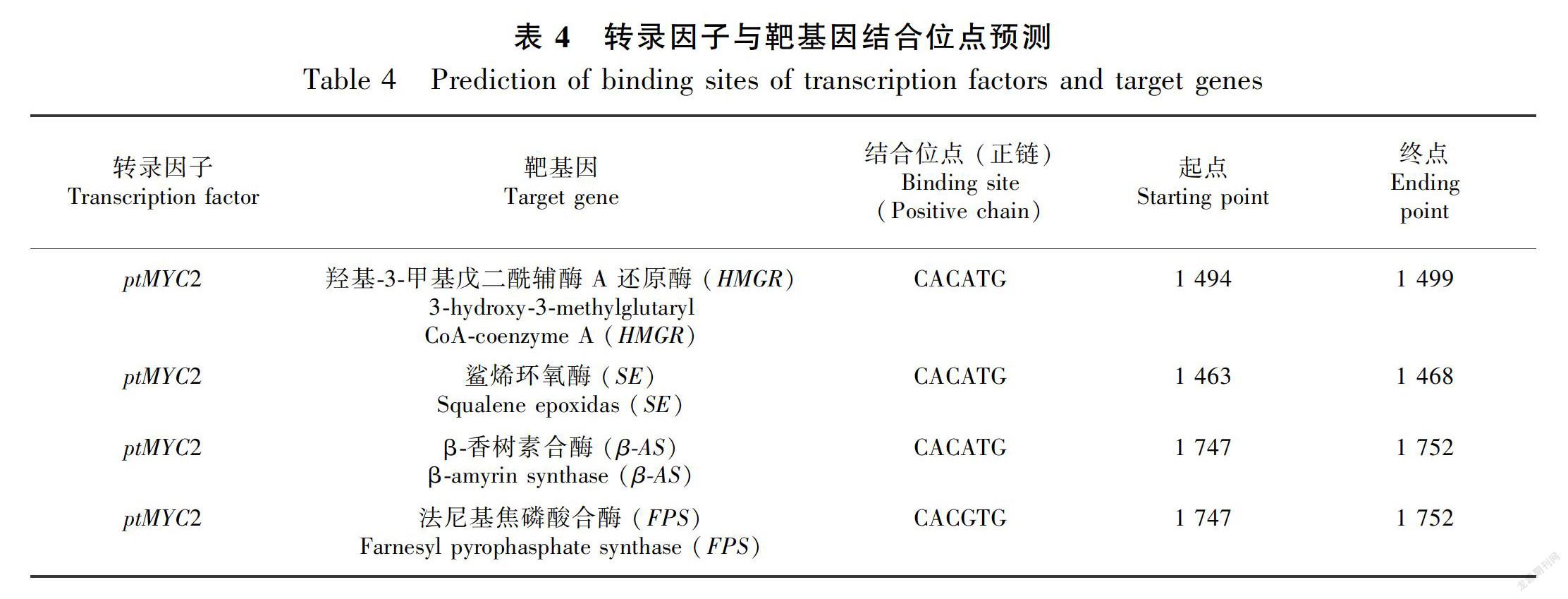
2.2.9 转录因子与靶基因结合位点信息分析 MYC类转录因子对目的基因的调控,是通过与目的基因启动子的E-box特异性结合域的结合实现的。由于金铁锁还未进行过全基因组测序,本研究通过Blast软件对金铁锁三萜皂苷合成途径上的关键酶基因HMGR、SE、FPS、β-AS分别进行相似性搜索,其中,金铁锁HMGR的基因序列与胡杨(Populus euphratica)的相似性最高,SE1与甜菜 (Beta vulgaris subsp.)的相似性最高,SE2、FPS、β-AS的序列与藜麦(Chenopodium quinoa)的相似性最高,分别下载相似性最高物种基因上游2 000 bp的区域作为该基因的启动子序列(启动子序列见附录),分析预测可能与ptMYC2互作的靶基因及结合信息位点,结果如表4所示。
3 讨论
金铁锁是西南地区的珍稀濒危药材, 为多种著名中成药的重要组成,其有效成分为五环三萜皂苷。由于其显著的药理活性,金铁锁资源遭到大量的挖掘破坏,已处于濒危状态,目前已被IUCN收录为濒危种。MYC类转录因子是植物茉莉酸类激素响应途径中的核心转录因子,近年来,在烟草(Zhang et al.,2012)、拟南芥(Hong et al.,2012)、长春花(Hedhili et al.,2010)、红豆杉(Lenka et al.,2015)等植物中克隆得到的MYC2转录因子,研究发现其都参与调节了次生代谢产物的合成。在发现的众多MYCs转录因子中,MYC2是研究较多的一类转录因子。鉴于此,本研究开展对金铁锁转录因子ptMYC2的研究,以期能够获得参与金铁锁有效成分调控的ptMYC2转录因子,为后期完成金铁锁有效成分的定向积累奠定基础。
本研究克隆得到兩条具有完整开放阅读框ORF的ptMYC2转录因子,ptMYC2-1与 ptMYC2-2的 ORF长度分别为1 713 bp和1 902 bp,分别编码570个和633个氨基酸残基,分子量为63.75 kD和69.33 kD。 通过SMART软件分析,ptMYC2-1与ptMYC2-2都存在一个高度保守的结构功能域bHLH,具有bHLH家族成员共有的典型结构域。从三级结构预测图可以看出,所获得的两条ptMYC2基因与拟南芥的AtMYC2有相似的三级结构,都具有bHLH家族共有的α螺旋1-环-α螺旋2( helix-loop-helix)保守结构域,该 helix-loop-helix结构可以与靶基因启动子相结合,从而发挥对基因的调控作用(Stevens et al.,2010)。同时,将该两条序列与其他氨基酸序列进行BlastX同源比对发现,本研究克隆得到的两条MYC2编码的蛋白与烟草(Nicotiana tabacum)的NtMYC2编码蛋白同源性在50%以上,烟草中该转录因子主要是参与调控了烟草中尼古丁的生物合成(Zhang et al.,2012),故推测该两条ptMYC2转录因子也可能与金铁锁次生代谢产物的调控有关。
MYC2转录因子主要是通过与目的基因DNA的结合来调控基因的表达。而这些与目的基因的特异性结合区域,一般都存在于目的基因的启动子上(沈乾等,2012)。因此,预测MYC2启动子与靶基因的特异性结合区域是研究转录因子调控的前提。bHLH蛋白可分为A,B,C,D,E和F,这取决于bHLH的基本DNA结合模式。B类 bHLH可与具有5′-CACGTG-3′特征的E-box结合,其中包括 MYC家族(Ledent & Vervoort,2001)。因此,本研究以E-box作为结合片段,选取课题组前期研究三萜皂苷合成途径中的几个关键酶基因作为靶基因,通过Blast软件对这些关键酶基因进行相似性搜索,以搜索到的相似性最高的物种为参考,选取参考基因上游2 000 bp作为启动子,分析与ptMYC2靶基因的结合信息位点。预测结果显示,金铁锁三萜皂苷合成途径中的3-羟基-3-甲基戊二酰辅酶 A 还原酶(HMGR)、鲨烯环氧酶(SE)、法尼基焦磷酸合成酶(FPS)、β-香树素合酶(β-AS)等基因启动子中都有可能具有E-box的特异结合位点,ptMYC2转录因子有可能与这些基因互作从而对其进行调控。沈乾等(2016)在对青蒿MYC类转录因子的研究中发现,转录因子AaMYC2能与青蒿素生物合成途径中的P450基因CYP71AV1和DBR2基因的启动子结合,进而参与调控青蒿素的生物合成过程。本研究通过对ptMYC2与靶基因结合位点的预测分析,为后续开展的实验提供了丰富的基因资源。
综上所述,本研究克隆得到了两条ptMYC2转录因子,并对其进行生物信息学分析,为后期即将开展的酵母双杂等验证该两条转录因子功能的实验提供了科学依据。
参考文献:
CHINI A, FONSECA S, FERNANDEZ G, et al., 2007. The JAZ family of repressors is the missing link in jasmonate signalling[J]. Nature, 448(7154): 666-671.
DEVOTO A, TURNER JG, 2010. Jasmonate-regulated Arabidopsis stress signaling network[J]. Physiol Plant, 123(2): 161-172.
HEDHILI S, MATTEI MVD, COUDERT Y, et al., 2010. Three non-autonomous signals collaborate for nuclear targeting of CrMYC2, a Catharanthus roseus, bHLH transcription factor[J]. BMC Res Notes, 3(1): 301-309.
HONG GJ, XUE XY, MAO YB, et al., 2012. Arabidopsis MYC2 interacts with DELLA proteins in regulating sesquiterpene synthase gene expression[J]. Plant Cell, 24(6):2635-2648.
LEDENT V, VERVOORT M, 2001. The basic helix-loop-helix protein family: Comparative genomics and phylogenetic analysis[J]. Genome Res, 11(5): 754-770.
LENKA SK, NIMS NE, VONGPASEUTHK, et al., 2015. Jasmonate-responsive expression of paclitaxel biosynthesis genes in Taxus cuspidata cultured cells is negatively regulated by the bHLH transcription factors TcJAMYC1, TcJAMYC2, and TcJAMYC4[J]. Front Plant Sci, 6: 115.
NIMS E, VONGPASEUTH K, ROBERTS SC, et al., 2009. WITHDRAWN: TcJAMYC: A bHLH transcription factor that activates paclitaxel biosynthetic pathway genes in yew[J]. J Biol Chem, 290(33): 1-19.
SHEN Q, LU X, YAN T, et al., 2016. The jasmonate-responsive AaMYC2 transcription factor positively regulates artemisinin biosynthesis in Artemisia annua[J]. New Phytol, 210(4): 1269-1281.
SHEN Q, LU X, ZHANG L, et al., 2012. Advances in research on the function of MYC2 transcription factors in plants [J]. J Shanghai Jiaotong Univ (Agric Sci Ed), 30(6): 51-57.[沈乾, 陆续, 张凌, 等, 2012. 植物中 MYC2 转录因子功能研究进展 [J]. 上海交通大学学报(农业科学版), 30(6):51-57. ].
STEVENS JD, ROALSON EH, SKINNER MK, 2010. Phylogenetic and expression analysis of the basic helix-loop-helix transcription factor gene family: Genomic approach to cellular differentiation [J]. Differentiation, 76(9): 1006-1022.
THINES B, KATSIR L, MELOTTO M, et al., 2007. JAZ repressor proteins are targets of the SCF(COI1) complex during jasmonate signalling[J]. Nature, 448(7154): 661-665.
WANG YF, LI CQ, HAN GY, et al., 2019. Effect of different treatments of jasmonic acid on rice blast disease control and its effect on rice defense system [J]. J S Agric,50(3):562-569. [王云鋒, 李春琴, 韩光煜,等, 2019. 茉莉酸不同方式处理水稻对稻瘟病的防控效果及对水稻防御体系的影响[J]. 南方农业学报, 50(3):562-569.]
ZHANG H, HEDHILI S, MONTIEEL G, et al., 2011. The basic helix-loop-helix transcription factor CrMYC2 controls the jasmonate-responsive expression of the ORCA genes that regulate alkaloid biosynthesis in Catharanthus roseus[J]. Plant J, 67(1): 61-71.
ZHANG HB, BOKOWIEC MT, RUSHTON PJ, et al., 2012. Tobacco transcription factors NtMYC2a and NtMYC2b form nuclear complexes with the NtJAZ1 repressor and regulate multiple jasmonate-inducible steps in nicotine biosynthesis[J]. Mol Plant, 5(1): 73-84.
ZHANG J, CAO W, TIAN J, et al., 2012. Evaluation of novel saponins from Psammosilene tunicoides and their analogs as immunomodulators[J]. Int Immunopharmacol, 14(1): 21-26.

