罗汉果多糖对环磷酰胺所致的免疫抑制小鼠免疫功能的影响
张海全 黄勤英 郑广进 曾振芳 许丹妮 农克良

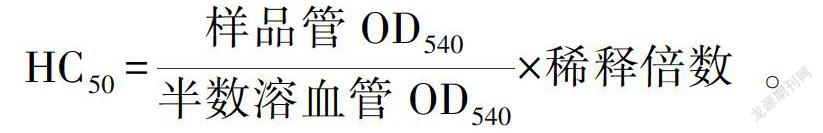
摘 要:該研究将小鼠随机分成正常组,模型组,罗汉果多糖低、中、高剂量组(25、50、100 mg·kg-1)和左旋咪唑组,采用腹腔注射环磷酰胺(20 mg·kg-1)建立免疫抑制小鼠模型,连续灌胃给药14 d后,测定各组小鼠的免疫器官指数、廓清指数(K)、吞噬指数(α)、T和B淋巴细胞增殖水平、耳肿胀度、半数溶血值(HC50)以及免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、IL-2、IL-4、IL-6、TNF-α的含量,并观察脾组织病理形态变化,考察罗汉果多糖对免疫抑制小鼠免疫功能的影响。结果表明:罗汉果多糖各剂量组(25、50、100 mg·kg-1)均能显著提高免疫抑制小鼠的免疫器官指数、半数溶血值(HC50)、B淋巴细胞增殖能力,明显降低耳肿胀度,显著增加IgG、IgM、IL-2、IL-4、IL-6、TNF-α的含量。罗汉果多糖中、高剂量组(50、100 mg·kg-1)能显著增强T淋巴细胞增殖能力,明显增加廓清指数(K)、吞噬指数(α)。脾组织病理学观察结果表明,罗汉果多糖可以减轻免疫抑制小鼠脾脏的病理损伤。这表明罗汉果多糖能明显增强环磷酰胺所致免疫抑制小鼠的免疫功能。
关键词:罗汉果, 免疫抑制, 小鼠, 环磷酰胺, 多糖
中图分类号:Q946.3, R932
文献标识码:A
文章编号:1000-3142(2019)11-1573-10
Abstract:In order to study the activity of Siraitia grosvenorii polysaccharides(SGP), specially its immunoregulatory activity, Kunming mice were randomized into six groups, including normal group, model group, SGP groups(25, 50, 100 mg·kg-1) and levamisole group. Mice were injected with cyclophosphamide(20 mg·kg-1) to establish the immunosuppressive model, then all groups of mice were treated for sequential 14 d by giving different dose of SGP. Effects of SGP on immune function of immunocompromised mice was studied by detecting many indices, such as thymus and spleen index, carbon clearance index, phagocytic index. Some indexes liked ear edema, the concentration causing 50% hemolysis(HC50), the proliferation ability of T cells and B cells, the contents of IgG, IgM, IL-2, IL-4, IL-6 , TNF-α were also be very important parameters to measure immune function. Histopathological examination of spleen tissue also was observed. We found that SGP groups(25, 50, 100 mg·kg-1) was significantly in improving the thymus and spleen indexes. The concentration causing 50% hemolysis(HC50) was increased effectively. The level activity of serum hemolysin was rising compared to model group. Data also showed that SGP groups(25, 50, 100 mg·kg-1) could significantly reduce ear edema. Experiments showed that the proliferation ability of B cells, the contents of IgG, IgM, IL-2, IL-4, IL-6,TNF-α were improving. SGP middle and high groups(50, 100 mg·kg-1)also could significantly increase the carbon clearance index and phagocytic index, and enhance the proliferation ability of T cells. Spleen tissue damage induced by cyclophosphamide was ameliorated according to the histopathological examination. This indicates that SGP can significantly improve immune function of immunocompromised mice.
Key words:Siraitia grosvenorii, immunodepression, mice, cyclophosphamide, polysaccharides
罗汉果是广西特色植物,其味甘性凉,为药食两用的中药材,被人们誉为“神仙果”。罗汉果富含多糖、黄酮、维生素、蛋白质及多种微量元素等成分(Li et al.,2014),研究表明其具有抑菌(梁硕等,2016)、降血糖(郑楚等,2011)、抗肿瘤(符毓夏等,2016)等功效。李俊等(2008)研究发现罗汉果多糖(SGPS1)对正常小鼠具有一定免疫增强作用。王勤等(2001)探讨了罗汉果甜甙对小鼠细胞免疫功能的调节作用,结果表明罗汉果甜甙对环磷酰胺免疫抑制小鼠的细胞免疫功能具有一定的正调节作用。前人的研究表明罗汉果对正常小鼠具有免疫增强作用,但对免疫低下的小鼠是否具有免疫增强作用尚不明确(李俊等,2008;王勤等,2001)。
建立免疫抑制动物模型研究药物对免疫功能的影响更能说明情况,为更深入研究罗汉果多糖的免疫效果,在前人研究(李俊等,2008;王勤等,2001)的基础上,本研究采用腹腔注射环磷酰胺建立免疫抑制小鼠模型,研究罗汉果多糖对免疫抑制小鼠免疫功能的影响,为开发罗汉果多糖提供重要理论依据,使中药罗汉果的价值得到更充分利用。
1 材料与方法
1.1 实验动物与材料
昆明小鼠,SPF级,雌雄各半,体重18~22 g,购于广西医科大学实验动物中心,许可证号:SCXK(桂)2014-0001,在恒温(21~25 ℃)、恒湿(40%~65%)下饲养,自由进食和饮水。
罗汉果购于湘君大药房,经农克良教授鉴定为葫芦科植物罗汉果(Siraitia grosvenorii)的成熟果实,加工方式为新鲜果实采收后晾数天,低温干燥,阴凉处存放,质量要求符合2015版《中国药典》的要求;环磷酰胺(萨恩化学技术(上海)有限公司,批号为13061215);盐酸左旋咪唑(山东仁和堂药业有限公司,批号为150702);2,4-二硝基氟苯(DNFB)(国药集团化学试剂有限公司);IgG、IgM、IL-2、IL-4、TNF-α、IL-6 Elisa试剂盒(南京建成生物工程研究所);刀豆蛋白A(ConA)、脂多糖、四甲基偶氮唑盐(MTT)(上海康朗生物科技有限公司)。
1.2 实验仪器
UV-6100S紫外可见分光光度计(上海元析仪器有限公司);分析天平(华志科学仪器有限公司);GL-21M高速离心机(长沙湘仪离心机有限公司);培养箱(型号Sanyo MCO-15AC,上海复昌科技有限公司);AMR-100全自动酶标分析仪(杭州奥盛仪器有限公司);waters1525高效液相色谱;Spectrum 65 型傅里叶红外光谱仪(美国 Perkin Elmer 公司)。
1.3 方法
1.3.1 罗汉果多糖的制备、红外光谱分析、单糖组分分析及含量测定
罗汉果多糖制备工艺:罗汉果粉碎过40目筛沸水提取减压浓缩→醇沉→Sevage法除蛋白质→AB-8树脂和Sephadex G-100葡聚糖凝胶柱分离纯化→冷冻干燥→精制罗汉果多糖。罗汉果多糖经KBr压片后进行红外光谱扫描,扫描范围400~4 000 cm-1。采用王海英等(2015)的色谱条件,运用 PMP 柱前衍生高效液相色谱法测定罗汉果多糖的单糖组成。采用苯酚—硫酸法测定罗汉果多糖含量,具体操作参考韦晓洁等(2018)的方法。
1.3.2 造模与给药 实验小鼠随机分成正常组、模型组,左旋咪唑组及罗汉果多糖低、中、高剂量组,除正常组外,其他组小鼠连续5 d腹腔注射新鲜配置的环磷酰胺溶液(20 mg·kg-1),建立免疫抑制小鼠模型(Manepalli et al.,2013)。造模成功后左旋咪唑组小鼠灌胃给药左旋咪唑,剂量为20 mg·kg-1;罗汉果多糖低、中、高剂量组分别以25、50、100 mg·kg-1灌胃给药;模型组和正常组小鼠给予等体积蒸馏水。各组小鼠给药每天1次,连续给药14 d。
1.3.3 小鼠免疫器官指数的测定 各实验组随机取10只小鼠,末次给药24 h后,脱颈椎处死小鼠,称量体重,无菌条件下迅速取出脾脏和胸腺器官清洗干净并称重,计算脾指数和胸腺指数,脾指数=脾重量/小鼠体重;胸腺指数=胸腺重量/小鼠体重。
1.3.4 小鼠T、B淋巴细胞增殖能力的测定 将1.3.3 实验中称重后的无菌脾脏研磨,过200目筛,无菌条件下制备脾细胞悬液,调整细胞浓度到每毫升2×106 个。在96孔细胞培养板上加入每孔100 μL的脾脏淋巴细胞悬液,实验孔和对照孔设3个重复,实验孔加入ConA(质量浓度为5 mg·L-1)每孔50 μL,对照孔加入每孔50 μL RPMI-1640培养液,置于37 ℃、5% CO2 培养箱培养44 h 后,加入MTT溶液每孔20 μL,继续培养4 h 后终止反应,以酶标仪测各孔OD570值。测定B淋巴细胞增殖能力,则是将ConA换成脂多糖溶液(浓度为10 mg·L-1),按上述操作进行测定。计算T、B淋巴细胞刺激值(stimulation index,SI),SI=实验孔OD值/对照孔OD值。
1.3.5 小鼠碳廓清指数和吞噬指数的测定 各实验组随机取10只小鼠,末次给药24 h后,每只小鼠的尾部静脉按0.1 mL·10 g-1的量注入10%墨汁,在不同的时间里两次眼眶取血20 μL,各加入2 mL 0.1% NaCO3溶液中,摇匀,于680 nm测定吸光度A。将小鼠脱颈椎处死,取免疫器官称重,计算碳廓清指数(K)和吞噬指数(α)。
K=lgA1-lgA2t2-t1; α=
3K×体重肝重+脾重。
式中,t1 、t2为前后两次注射墨汁的时间。
1.3.6 小鼠皮肤迟发型超敏反应的指标测定 各实验组随机取10只小鼠,末次给药24 h后,腹壁按3 cm × 3 cm进行脱毛,次日用50 μL 1%的2,4-二硝基氟苯在脱毛处涂抹,過5 d后用移液枪取10 μL的2,4-二硝基氟苯匀抹右耳。涂抹24 h后,颈椎脱臼处死小鼠,用6 mm的打孔器取左右两片耳,比较重量差异。
1.3.7 小鼠血清溶血素水平及血清中IgG、IgM的测定 各实验组随机取10只小鼠,末次给药24 h后,取0.2 mL 5%鸡血红细胞混悬液注入小鼠腹腔。免疫7 d后,取小鼠血清,用生理盐水稀释100倍,取1 mL,加入0.5 mL 5%鸡红细胞悬液、0.5 mL补体,在体外37 ℃下反应30 min后冰水浴终止反应,离心取上清液,于540 nm处测定OD值。另取5% 生理盐水鸡红细胞混悬液0.20 mL ,用生理盐水稀释至2 mL,作为半数溶血管随试验管共同温育,同法测光密度OD值,计算半数溶血值(HC50)(宫强等,2016;李厚兵等,2012)。血清中其他指标的检测:IgG、IgM(参照1.3.8的实验操作,其他操作严格按照IgG、IgM Elisa试剂盒的说明书进行)。
HC50=样品管OD540半数溶血管OD540×稀释倍数。
1.3.8小鼠血清中IL-2、IL-4、IL-6、TNF-α的含量测定 各实验组随机取10只小鼠,末次给药24 h后,眼眶取血,离心取血清,采用ELISA法测定IL-2、IL-4、IL-6、TNF-α的含量。将酶标包被板分为空白孔、标准孔和待测血清样品孔,空白孔加标准品稀释液50 μL,标准孔依次加不同稀释浓度的标准品溶液50 μL,样品孔加样品稀释液40 μL,再加各实验组待测血清10 μL,避光37 ℃温育30 min,用浓缩洗涤液洗板,重复5次,拍干。除空白孔外每孔加入酶标试剂50 μL,避光37 ℃ 温育30 min,洗板5次后拍干,每孔先后各加入50 μL的显色剂A和显色剂B,轻震混匀,37 ℃避光显色30 min后终止反应。以空白孔调零,于450 nm波长处测吸光度,绘制标准曲线,计算IL-2、IL-4、IL-6、TNF-α的含量。
1.3.9小鼠脾组织切片观察 小鼠取脾脏,10%甲醛溶液固定,石蜡包埋,切片,HE 染色后,观察脾组织的病理变化。
1.3.10统计学处理 实验数据采用SPSS17.0软件进行处理,以平均值±标准差(x±s)表示数值,采用t检验分析处理,P<0.05表明差异具有统计学意义。
2 结果与分析
2.1 罗汉果多糖的红外光谱分析、单糖组分分析及含量测定结果
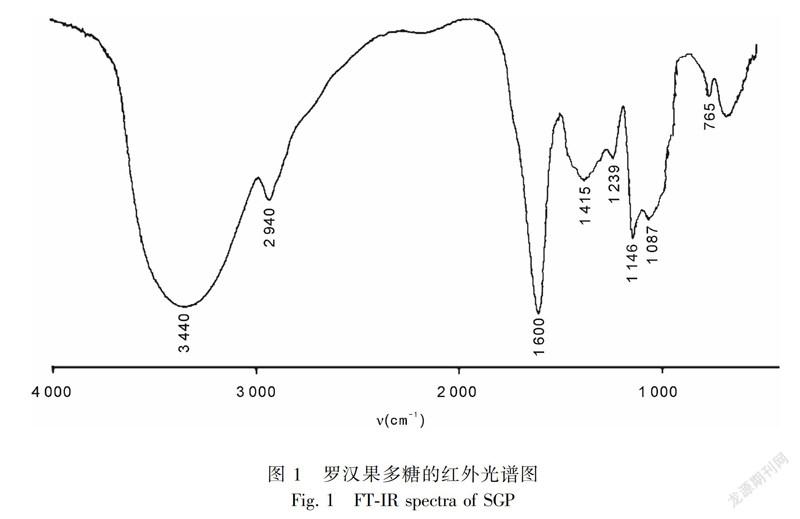
2.1.1 罗汉果多糖的红外光谱分析结果 图1结果表明,SGP具有多糖典型的吸收峰,3 440 cm-1为糖的O-H伸缩振动,2 940 cm-1为C-H伸缩振动,1 600 cm-1 为糖醛酸的COO-非对称伸缩振动,1 415 cm-1的吸收峰归属于C=O的非对称伸缩振动峰,1 300 ~1 000 cm-1处出现吸收峰是吡喃环的伸缩振动,765 cm-1的存在表明有D-木糖。
2.1.2 罗汉果多糖的单糖组分分析及含量测定结果 采用苯酚—硫酸法测定罗汉果多糖含量为98.2%。由图2可知,罗汉果多糖样品中峰1、峰3、峰4、峰5分离程度较好,且与标准单糖中对应单糖的保留时间相同,提示罗汉果多糖中含有甘露糖、葡萄糖、阿拉伯糖和木糖,其中葡萄糖的含量较高。此结果与王海英等(2015)报道的有一定差异。
2.2 罗汉果多糖对免疫抑制小鼠免疫器官指数的影响
胸腺和脾脏是非常重要的免疫器官,对机体的免疫功能至关重要;吞噬细胞在免疫应答中主要依靠吞噬功能发挥作用,机体可通过吞噬细胞吞噬外来细菌或病毒起到防御作用(Bing et al.,2013)。免疫器官指数客观反映免疫抑制小鼠免疫器官功能的强弱。由表1可知,罗汉果多糖各剂量组和左旋咪唑组小鼠的脾指数、胸腺指数与模型组比较有明显提高且差异显著(P<0.05或P<0.01),罗汉果多糖高剂量组(100 mg·kg-1)和左旋咪唑组差異极显著(P<0.01);罗汉果多糖中、高剂量组(50、100 mg·kg-1)和左旋咪唑组与正常组比较差异显著(P<0.05)。结果显示罗汉果多糖能提高免疫抑制小鼠脾脏、胸腺指数,其作用机制可能是罗汉果多糖可以修复免疫抑制小鼠脾脏、胸腺中被破坏的细胞,刺激和促进受损细胞的再生和发育。
2.3 罗汉果多糖对免疫抑制小鼠T、B淋巴细胞增殖能力的影响
由表2可知,与模型组相比较,罗汉果多糖中、高剂量组(50、100 mg·kg-1)和左旋咪唑组差异显著(P<0.05或P<0.01),表明一定剂量的罗汉果多糖能增强免疫抑制小鼠T淋巴细胞增殖能力。表2结果显示,与模型组相比较,罗汉果多糖各剂量组和左旋咪唑组差异显著(P<0.05或P<0.01),说明罗汉果多糖对免疫抑制小鼠B淋巴细胞增殖能力具有促进作用。
2.4 罗汉果多糖对免疫抑制小鼠碳廓清指数和吞噬指数的影响
廓清指数(K)和吞噬指数(α)可反映吞噬细胞的吞噬能力。由表3可知,罗汉果多糖各剂量组和左旋咪唑组小鼠的碳廓清指数和吞噬指数与模型组相比有所提高。罗汉果多糖中剂量组差异显著(P<0.05),高剂量组和左旋咪唑组差异极显著(P<0.01);罗汉果多糖中、高剂量组(50、100 mg·kg-1)和左旋咪唑组与正常组比较差异显著(P<0.05)。表3结果还显示,罗汉果多糖能显著提高廓清指数(K)和吞噬指数(α)、增加免疫抑制小鼠吞噬细胞数量、提高吞噬细胞的活力、增强吞噬功能,对免疫抑制小鼠固有免疫有一定促进作用。
2.5 罗汉果多糖对免疫抑制小鼠皮肤迟发型超敏反应水平的影响
迟发型超敏反应中,T淋巴细胞介导的细胞免疫起着重要作用(Venarske et al.,2003;Dale et al.,2003)。选用2,4-二硝基氟苯诱发迟发型过敏反应,通过测定耳部肿胀度,可以反映小鼠细胞免疫能力的强弱。如表4所示,与模型组相比,罗汉果多糖各剂量组和左旋咪唑组小鼠的耳肿胀度差异显著(P<0.05或P<0.01),罗汉果多糖高剂量组(100 mg·kg-1)和左旋咪唑组差异极显著(P<0.01);罗汉果多糖高剂量组(100 mg·kg-1)和左旋咪唑组与正常组比较差异显著(P<0.05)。这说明罗汉果多糖能明显降低其耳肿胀度,使之恢复或接近正常水平。
2.6 罗汉果多糖对免疫抑制小鼠血清溶血素水平及血清中IgG、IgM的影响
机体受到抗原刺激后,可产生大量的免疫球蛋白(Ig) ,与抗原发生特异性结合,增强机体免疫功能。测定血清上清液的吸光度值、HC50以及抗体IgG、IgM含量,衡量机体的体液免疫强度。由表5可知,与模型组比较,罗汉果多糖各剂量组和左旋咪唑组小鼠的溶血素OD值、HC50以及IgG、IgM含量有所提高。其中,罗汉果多糖高、中剂量组溶血素OD值、HC50值与模型组比较差异显著(P<0.05);罗汉果多糖低剂量组(25 mg·kg-1)小鼠的IgG、IgM含量与模型组比较差异显著(P<0.05);罗汉果多糖中、高剂量组(50、100 mg·kg-1)的IgG、IgM含量与模型组和正常组比较差异显著(P<0.05或P<0.01)。这表明罗汉果多糖可以提高免疫抑制小鼠血清中抗体水平,增强机体免疫功能。
2.7 罗汉果多糖对免疫抑制小鼠血清中IL-2、IL-4、IL-6,TNF-α含量的影响
IL-2、IL-4、IL-6是细胞免疫分泌的细胞因子,可促进免疫细胞的增殖与分化,增强免疫细胞的免疫能力。TNF-α具有广泛生物学作用,是机体免疫防护的重要介质,可促进细胞增殖分化,增强T细胞及其他杀伤细胞的杀伤能力。由表6可知,与模型组相比,罗汉果多糖各剂量组和左旋咪唑组小鼠血清中的IL-2、IL-4、IL-6、TNF-α含量均提高。罗汉果多糖各剂量组和左旋咪唑组IL-2、IL-4、IL-6、TNF-α的含量与模型组比较差异显著(P<0.05或P<0.01),罗汉果多糖中、高剂量组(50、100 mg·kg-1)和左旋咪唑组与正常组比较差异显著(P<0.05)。实验结果表明罗汉果多糖能促进细胞因子分泌水平。
2.8 罗汉果多糖对免疫抑制小鼠脾组织形态的影响
从图3可以看出,正常组小鼠脾组织细胞排列整齐,结构完整,无炎症细胞浸润。模型组小鼠脾细胞排列紊乱,结构破损,伴有炎症细胞浸润,可见坏死斑点。左旋咪唑组小鼠脾细胞排列较整齐,细胞大小较一致,结构较完整,部分细胞肿胀并有少许胞浆疏松和炎症细胞浸润,说明左旋咪唑对免疫抑制小鼠脾细胞具有较好的治疗作用。罗汉果多糖各剂量组小鼠脾细胞排列有些紊乱,细胞肿胀、炎症细胞浸润及坏死情况均有不同程度的减轻。病理学观察表明罗汉果多糖能够有效恢复免疫抑制小鼠受损的脾细胞。
3 讨论与结论
近年来,中药多糖成分调节免疫功能方面的研究取得了较大进展(Sun et al.,2015;Gong et al.,2015),中医药治疗疾病侧重在于发挥与调动机体的抗病能力,调整机体的免疫功能状态。尚庆辉等(2015)发现中药多糖可通过修复免疫器官受损的免疫细胞;促进淋巴细胞分泌细胞因子并提高细胞因子的活性;增强巨噬细胞吞噬活性; 提升自然杀伤细胞的杀伤水平;加快免疫细胞增殖分化水平等,使得机体的免疫功能增强。
胸腺和脾脏是动物机体重要的免疫器官, T、B淋巴细胞在此增殖分化,故胸腺和脾脏是机体免疫功能调节的重要场所。病理学观察表明罗汉果多糖能够有效恢复免疫抑制小鼠受损的脾细胞。本研究结果表明,罗汉果多糖能够显著提高免疫抑制小鼠的免疫器官指数,其作用机制可能是罗汉果多糖可以修复免疫抑制小鼠免疫器官中被破坏的细胞,刺激和促进萎缩的脾脏和胸腺的再生和发育。同时,罗汉果多糖能够增强免疫抑制小鼠T、B淋巴细胞的增殖转化能力,提高细胞免疫功能。
碳廓清实验结果显示,中、高剂量的罗汉果多糖能显著提高廓清指數(K)和吞噬指数(α),提高免疫抑制小鼠固有免疫水平,作用机制可能是增加机体吞噬细胞数量,提高吞噬细胞的活力,增强吞噬功能,有效吞噬外来抗原,并提高NK细胞杀伤力,起到增强固有免疫功能的作用。
IgG 、IgM及细胞因子含量的检测有助于从分子水平阐明体液免疫调节作用。本研究结果表明,罗汉果多糖能提高血清溶血素水平,显著增加IgG、IgM含量,有利于机体清除有害抗原,抑制炎症反应,并激活补体系统;此外罗汉果多糖能促进免疫抑制小鼠淋巴细胞分泌IL-2、IL-4、IL-6、TNF-α等细胞因子,提高细胞因子的活性,可促进免疫细胞的增殖和分化,还能增强免疫细胞及其他杀伤细胞的杀伤能力,故能增强免疫抑制小鼠体液免疫功能。
本研究结果表明,罗汉果多糖能拮抗环磷酰胺所致的免疫抑制作用,对免疫抑制小鼠的固有免疫、细胞免疫、体液免疫能力具有较好的促进作用,恢复机体的抗病能力,显著增强免疫抑制小鼠的免疫功能,为罗汉果多糖作为免疫增强剂的开发应用提供了一定的理论依据。
参考文献:
BING Z, DU XG, XIAN YZ, 2013. Immunomodulatory functions and relevant therapeutic potentials of astragalus extract[J]. Chin J Antibiot, 38(9):652-655.
DALE TU, OMID A, ROSEMARIE HD, et al., 2003. Regulatory T cells control the development of a allergic disease and asthma[J]. J Allergy Clin Immunol, 113(3):480-487.
FU LX, WANG L, LI DP, 2016. Activity and mechanism of anticancer properties of mogrol[J]. Guihaia, 36(11):1369-1375.[符毓夏, 王磊, 李典鹏, 2016. 罗汉果醇抗肿瘤活性及其作用机制研究[J]. 广西植物, 36(11):1369-1375.]
GONG Y, WU J, LI ST, 2015. Immuno-enhancement effects of Lycium ruthenicum Murr polysaccharides on cyclophosphamide-induced immunosuppression in mice[J]. Int J Clin Exp Med, 8(11):20631-20637.
GONG Q, RUAN MD, MA LP, et al., 2016. Effect of inulin on modulating immune function in mice[J]. Food Sci, 37(7):204-207.[宫强, 阮梦蝶, 马丽苹, 等, 2016. 菊粉对小鼠的免疫调节作用[J]. 食品科学, 37(7):204-207.]
LI C, LIN LM, SUI F, et al., 2014. Chemistry and pharmaco-logy of Siraitia grosvenorii[J]. Chin J Nat Med, 12(2):89-102.
LIANG S, YANG ZP, FEI ZH, et al., 2016. The study on antimicrobial properties of Siraitia grosvenorii[J]. Food Ind, 37(7):207-209.[梁硕, 杨志萍, 费振鸿, 等, 2016. 罗汉果抑菌性能的研究[J]. 食品工业, 37(7):207-209.]
LI J, HUANG Y, LIAO RQ, et al., 2008. Effect of Siraitia grosvenorii polysaccharide on immunity of mice[J]. Chin Pharmacol Bull, 24(9):1237-1240.[李俊, 黄艳, 廖日权, 等, 2008. 罗汉果多糖对小鼠免疫功能的影响[J]. 中国药理学通报, 24(9):1237-1240.]
LI HB, RENG AN, PENG YR, et al., 2012. Regulatory effect of Chrysanthemum indicum polysaccharide on immune function in mice with hypoimmunity[J]. Chin J Exp Trad Med Form, 18(13):223-225.[李厚兵, 任爱农, 彭蕴茹, 等, 2012. 野菊花多糖对小鼠免疫功能低下的保护作用[J]. 中国实验方剂学杂志, 18(13) :223-225.]
MANEPALLI S, GANDHI JA, EKHAR VV, et al., 2013. Characterization of a cyclophosphamide-induced murine model of immunosuppression to study acinetobacter baumannii pathogenesis[J]. J Med Microbiol, 62(11):1747-1754.
SUN WJ, MENG K, QI CH, et al., 2015. Immune-enhancing activity of polysaccharides isolated from Atractylodis macrocephalae Koidz[J]. Carbohyd Polym, 126(1):91-96.
SHANG QH, XIE YH, ZHANG GG, et al., 2015. Immune re-gulation roles of phytogenic polysaccharides and its mechanisms[J]. Chin J Anim Nutr, 27(1):49-58.[尚慶辉, 解玉怀, 张桂国, 等, 2015. 植物多糖的免疫调节作用及其机制研究进展[J]. 动物营养学报, 27(1):49-58.]
VENARSKE D, DESSHAZO RD, 2003. Molecular mechanisms of allergic disease[J]. South Med J, 96(11):1049-1054.
WANG Q, WANG K, DAI SM, et al., 2001. Regulation on the immunological effect of mogrosides in the mice[J]. J Chin Med Mat, 24(11):811-812.[王勤, 王坤, 戴盛明, 等, 2001. 罗汉果甜甙对小鼠细胞免疫功能的调节作用[J]. 中药材, 24(11):811-812.]
WANG HY, MA XJ, MO CM, et al., 2015. Determination of sugarcomponents and contents in fruit flesh of Siraitia grosvenorii[J]. Guihaia, 35(6):775-781.[王海英, 马小军, 莫长明, 等, 2015. 罗汉果果肉中糖类物质组成与含量分析[J]. 广西植物, 35(6):775-781.]
WEI XJ, YIN HH, MENG F, et al., 2018. Supercritical CO2 fluid extraction process optimization for polysaccharides from Ilex kudingcha[J]. Guihaia, 38(5):590-595.[韦晓洁, 银慧慧, 孟菲, 等, 2018. 超临界CO2 流体萃取苦丁茶多糖的工艺优化[J]. 广西植物, 38(5):590-595.]
ZHENG C, TANG JL, YANG DY, et al., 2011. Effects of total flavonoids in Momordica grosvenori on hyperglycemia rat during streptozotocin diabetes[J]. Chin J Exp Trad Med Form, 17(22):194-197.[郑楚, 唐金良, 杨冬业, 等, 2011. 罗汉果总黄酮对实验性糖尿病大鼠的治疗作用[J]. 中国实验方剂学杂志, 17(22):194-197.]

