卡松对柳州白莲洞遗址表面霉菌的抑制作用
黄国霞 叶亮 蓝小凤 陈华英 李佳明 刘成相





摘 要:本文主要探究了白莲洞遗址表面的霉菌的种类,以及卡松对分离的霉菌的抑制作用.将在遗址表面采集的土样配制成土悬液,采用平板涂布法在马铃薯葡萄糖琼脂培养基上培养霉菌并分离纯化得到6种主要的霉菌,分别为地霉属、根霉属、青霉属、毛霉属、曲霉属(黄曲霉、黑曲霉).用滤纸片法考察不同浓度的卡松溶液对霉菌的抑制作用,发现对曲霉、地霉、根霉、青霉的抑菌效果良好,时效长,对毛霉的抑菌效果相对较差.
關键词:白莲洞;土遗址;霉菌;分离;鉴定
中图分类号:Q935 DOI:10.16375/j.cnki.cn45-1395/t.2019.02.015
0 引言
白莲洞遗址位于广西柳州市东南郊12 km的白面山南麓,是华南地区一处罕见的更新世晚期至全新世早期的洞穴文化遗存(距今3.7—0.7万年)[1].1956年由裴文中、贾兰坡教授在广西调查巨猿和人类化石时发现.20世纪70—80年代在考古队全面地清理和发掘后,出土了大量的文化遗物,其中包括人牙化石、动物化石、火坑、石器等[2-3]. 白莲洞遗址面积超过150 m2,所处白面山海拔249.8 m,高出附近的地平面约152 m.洞口朝南,洞口高5~6 m,洞内含文化遗存的堆积物非常丰富,约有3 m多厚,堆积物跨度为旧石器时代晚期、过渡期和新石器时代早、中期3个不同时期,是研究华南地区新旧石器时代演变十分重要、十分珍贵的实证材料[4],也是人们了解远古文化的重要窗口.洞内主要文化层如图1所示.
遗址距今历史久远,被发现之后进行了一些挖掘活动,岩体也逐步受到破坏[5],导致渗水,洞内环境有一定的湿度、温度,空气中含有大量霉菌孢子,所以一些藻类、地衣等低等植物以及霉菌类等在土壤表面快速繁殖生长.尤其霉菌强烈的酸解和络解作用造成土壤松散,影响着对土遗址原始信息的保护以及保存寿命的长短[6-8].因此,弄清楚土壤中霉菌的类别及如何对其进行消杀在对遗址的保护工作中具有重要意义.
卡松属异噻唑啉酮类非氧化性杀菌防腐剂[9],可以透过细胞膜进入细胞中,抑制蛋白的合成,也可以通过与DNA结合阻断核酸的复制来抑制微生物的繁殖,同时还引发基因变异导致细胞最终死亡.卡松具有毒性低,抗菌作用范围广,用量少,效果强,不会改变产品的颜色[10],配伍性能好,较宽的pH适用范围等众多优点,特别是对环境影响小,在自然环境中的降解物主要为低毒或无毒的物质,不会污染环境.目前,在日化、涂料、水处理等行业中已有广泛应用,系国际上公认的安全、高效、广谱性限用防腐剂[11],但在文物保护中的应用未见有相关报道.
本文选取具有代表性的土壤,在实验室中对土壤中所含的霉菌进行培养纯化分离和鉴定,用卡松对分离出来的霉菌进行抑菌实验,旨在对后续的保护工作提供依据.
1 采样与实验方法
1.1 土壤采集
在洞中含文化遗存的堆积层表面,采集具有代表性的少量土壤块.装于无菌封口袋中带回实验室.
1.2 实验方法
1.2.1 培养基的配制
马铃薯葡萄糖琼脂培养基(PDA):称取200 g新鲜马铃薯去皮,切成块加水煮沸约20 min(注意火力的控制,可适当补水),直到马铃薯块能被玻璃棒戳破,用多层纱布过滤,滤液加20.0 g葡萄糖和15.0 g琼脂搅拌均匀,补足水至1 000 mL,分装入三角瓶,加塞,于蒸汽压力灭菌锅中121 ℃灭菌20 min.
1.2.2 制备含菌土悬液
将几份土样分别取2 g加到装有20 mL灭菌水的三角瓶中震摇10 min,使土样均匀地分散成土悬液.吸取1 mL土悬液到9 mL灭菌水中,稀释得到10-2浓度的土悬液.
1.2.3 霉菌的培养
采用平板涂布法,用灭菌移液管分别移取几份配制好的土悬液于不同的无菌平板中央,用无菌涂布棒涂布均匀.将其置于28 ℃恒温箱中培养并每隔一段时间观察生长情况.
1.2.4 霉菌的分离纯化
采用平板划线法,使用接种环,从培养得到的菌落中选取需要纯化的霉菌菌落,沾取少量菌种,在平板上划线分离,再置于28 ℃恒温箱中培养并观察.待霉菌生长成熟后,对每个霉菌继续做平板划线分离并培养,确保得到完全分离纯化的霉菌菌落.
1.2.5 霉菌的鉴别
菌落形态:在分离纯化的培养中,观察菌落中单个霉菌菌落生长时的菌落生长速度、大小形状、表面形状、透明度、质地、正反面颜色及颜色变化特点,并拍照记录.
显微镜结构:先滴一小滴无菌生理盐水于载玻片中央,用接种环从单菌落上挑取少量菌,与无菌生理盐水混合,盖上盖玻片,用滤纸轻轻地吸干盖玻片周围多余的水,置于显微镜下观察.若难以观察出清晰的菌体结构,则需要在制片时滴加一小滴乳酸石碳酸棉兰染液进行染色再观察.观察记录孢子形状、孢子着生方式、孢子梗的特征等,并拍照记录.
根据菌落形态和显微结构,对比《真菌鉴定手册》和相关真菌鉴别的文献,对分离纯化出来的霉菌进行判断鉴别种类[12-14].
1.2.6 抑菌实验
在超净工作台内用接种环挑取纯化的霉菌孢子1~2环,加入无菌生理盐水中,振荡使孢子均匀分散,用血球计数板在显微镜下计数,调节孢子悬浮液浓度约为106~107 cfu/mL.
用灭菌移液管吸取0.1 mL菌悬液于培养基中央,用无菌涂布棒将菌液涂布均匀.用无菌镊子将直径为6 mm的无菌滤纸片放入含菌平板,轻轻按压使滤纸片与培养基紧紧贴附,每个平板放4个滤纸片.然后用移液枪吸取10 μL不同浓度的卡松溶液滴到相应的滤纸片上,使滤纸片充分吸收药品,同时每个平板做一个生理盐水对照组,每个浓度做3组平行.处理好的平板放置在28 ℃培养箱中,观察生长情况,用十字交叉法测量抑菌圈,计算平均值和SD值.
2 结果与分析
2.1 分离得到的霉菌
本次从土壤中分离得到6种比较有代表性的霉菌,分别为地霉属、根霉属、青霉属、毛霉属、曲霉属(黑曲霉、黄曲霉).这6种霉菌均生长速率较快、菌落形态十分鲜明.若在土遗址上生长富集,将会严重破坏土遗址的原貌.
通过对分离得到的6种霉菌在培养基上随时间增长的生长情况、正反面形态和颜色,以及显微镜观察结构特点的分析,结合《真菌鉴定手册》和相关真菌鉴别的文献,得到鉴别结果如下.
2.1.1 1号菌
菌落形态:菌落生长速度较慢,生长局限.菌落大小中等,圆形稍起凸,不透明,表面初为颗粒状,成熟后长出丝呈丝状,边缘整齐,质地干燥.在PDA培养基上菌落正面呈乳白色,背面初为白色,成熟后呈淡粉色.如图2(a)、图2(b)所示.
显微镜结构:观察分生孢子呈长筒形或者链形,末端钝圆,有横隔.分生孢子生长于分生孢子梗上,分生孢子梗短且光滑,无色.见图2(c).由以上信息判断1号菌为真菌门(Fungi),半知菌亚纲(Fungi Imperfect),丛梗孢目(Moniliales),丛梗孢科(Moniliaceae),卵形孢霉族(Oosporeae),地霉属(Geotrichum).
2.1.2 2号菌
菌落形态:菌落生长速度一般,生长蔓延,不生长成定形菌落.菌落大小较小,呈不规则状,不透明,表面粗糙,绒毛状,边缘波状且颜色较淡,质地干燥.在PDA培养基上菌落正面呈亮白色,背面初为白色,成熟后呈淡黄色,与培养基颜色相似.如图3(a)、图3(b)所示.显微镜结构:有假根且假根发达、多分枝.菌丝无横隔,孢囊梗直立或者稍弯曲,顶端长着圆形或球形孢子囊,孢子囊颜色较深.见图3(c).由以上信息判断2号菌为接合菌亚门(Zygomycota),接合菌纲(Zygomycetes),毛霉目(Mucorales),毛霉科(Mucoraceae),根霉属(Rhizopus).
2.1.3 3号菌
菌落形态:菌落生长速度较快,生长局限.菌落大小中等,形状圆形平整,不透明,表面致密呈放射状,边缘整齐、呈白色环状,质地干燥.在PDA培养基上菌落正面初为白色,慢慢变成淡绿色,成熟后呈蓝绿色;背面初为淡黄色,逐渐颜色变深成血红色,渗透到培养基中.如图4(a)、图4(b)所示.
显微镜结构:呈明显的帚状.分生孢子梗呈柱状不分枝,梗基上长出几簇小梗整齐、紧密排列,分生孢子椭圆形呈颗粒状,长于小梗上,形成帚状体.见图4(c).由以上信息判断3号菌为真菌门(Fungi),半知菌亞纲(Fungi Imperfect),丛梗孢目(Moniliales),丛梗孢科(Moniliaceae),曲霉族(Aspergilleae),青霉属(penicillium).
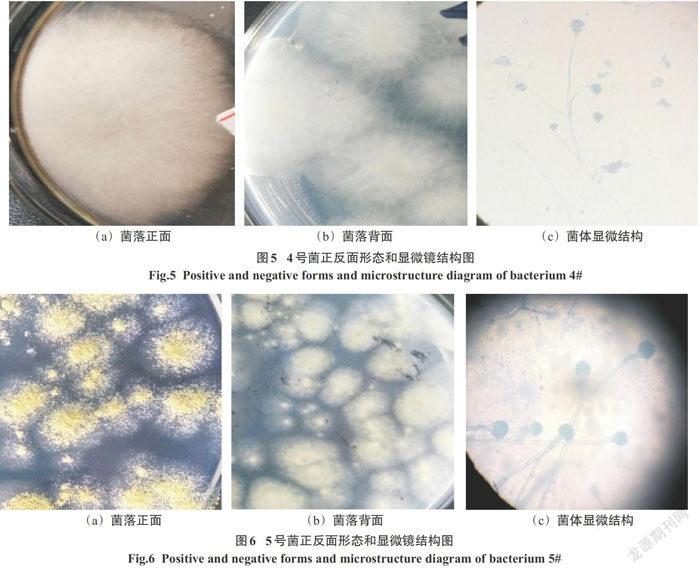
2.1.4 4号菌
菌落形态:菌落生长速度迅速,生长蔓延.菌落大小较大,绒毛状隆起,不透明,表面呈丝状,边缘扩散状,质地干燥.在PDA培养基上菌落正面为白色,背面也为白色,呈发散是丝状.如图5(a)、图5(b)所示.显微镜结构:由菌丝体生长出直立、少量分枝的孢囊梗,无假根,分枝顶部有圆形或椭圆形的孢子囊,孢子囊颜色较深.见图5(c).由以上信息判断4号菌为真菌门(Fungi),接合菌纲(Zygomycetes),毛霉目(Mucorales),毛霉科(Mucoraceae),毛霉属(Mucor).
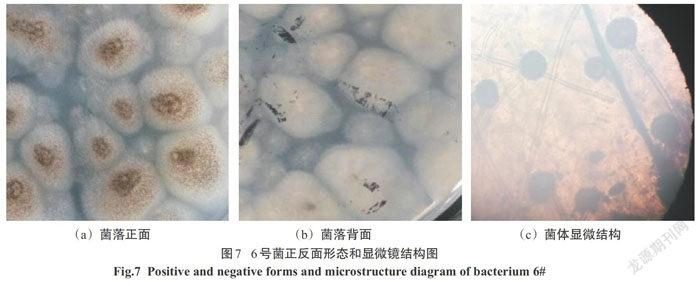
2.1.5 5号菌
菌落形态:菌落生长速度较快,生长局限.菌落大小中等,呈不规则状,中心稍起凸,不透明,表面呈致密颗粒状,边缘呈不规则圆形,白色,质地干燥.在PDA培养基上菌落正面初为淡黄色,逐渐变成黄色,成熟后呈深黄色;背面初为白色,逐渐变淡黄色,与培养基颜色相似.如图6(a)、图6(b)所示.
显微镜结构:菌丝直立、无色,形成分生孢子梗,有隔膜.顶部长出球形或梨形的孢子囊,颜色较深.分生孢子串生.见图6(c).由以上信息判断5号菌为真菌门(Fungi),半知菌亚纲(Fungi Imperfect),丛梗孢目(Moniliales),丛梗孢科(Moniliaceae),曲霉族(Aspergilleae),曲霉属(Aspergillus),黄曲霉.
2.1.6 6号菌
菌落形态:菌落生长速度较快,生长局限.菌落大小中等,椭圆形,中心稍起凸,不透明,表面呈致密绒毛状带有小颗粒,边缘白色丝状,质地干燥.在PDA培养基上菌落正面初为白色,成熟后呈灰褐色;背面初为白色,逐渐变成黄褐色.如图7(a)、图7(b)所示.显微镜结构:菌丝直立、无色,形成分生孢子梗,无隔膜.顶部长出球形或圆形的孢子囊,颜色较深.分生孢子结构大、串生.见图7(c).由以上信息判断6号菌为真菌门(Fungi),半知菌亚纲(Fungi Imperfect),丛梗孢目(Moniliales),丛梗孢科(Moniliaceae),曲霉族(Aspergilleae),曲霉属(Aspergillus),黑曲霉.
2.2 卡松对各种霉菌的抑制结果
不同霉菌对同一浓度卡松的敏感度不同,出现的抑菌圈大小、抑菌时效也不同,需要不同的浓度进行实验对比.在进行培养2 ~5 d后,霉菌刚长出并且发现有抑菌圈出现时立即测量抑菌圈,从第一次测量抑菌圈的时间记起,直到抑菌部分全部长满霉菌时,间隔的这一段时间记为抑菌时效.
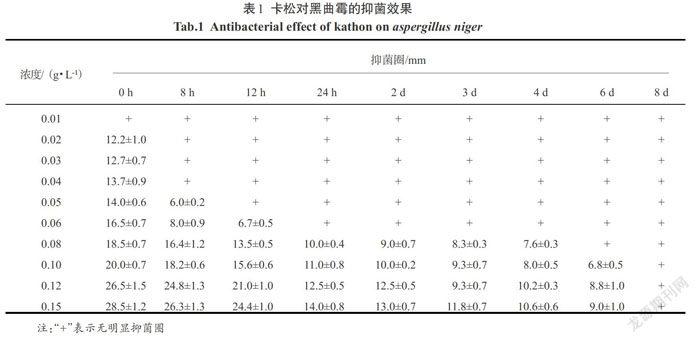
2.2.1 卡松对黑曲霉的抑菌效果
由表1卡松对黑曲霉的抑菌时效中的数据来看,卡松对黑曲霉的抑菌效果较好,仅0.02 g/L的卡松浓度就可以出现直径为12.2 mm的抑菌圈,而且随着卡松的浓度逐渐增大,抑菌圈也逐渐明显.当卡松的浓度达到0.15 g/L时,黑曲霉的培养基上出现直径达到28.5 mm的抑菌圈,尽管卡松的浓度很低,仅为千分之几,但是在黑曲霉的培养基上还是可以出现明显的抑菌圈;卡松对黑曲霉的抑菌时效也随浓度的增大而增长,当卡松的浓度达到0.15 g/L时,抑菌时效可以长达6 d.
2.2.2 卡松對青霉的抑菌效果
由表2可以看出,卡松对青霉的抑菌效果较好.在卡松浓度为0.01 g/L时就出现抑菌圈,虽然此时的抑菌圈不是特别明显,但抑菌圈是随着卡松的浓度逐渐增大而增大,抑菌时效也是随着卡松浓度的增大而增长.当卡松浓度达到0.15 g/L时,抑菌圈直径为27.5 mm,抑菌时效可达10 d以上.
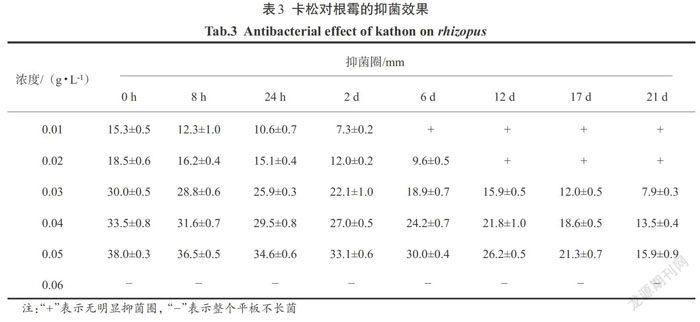
2.2.3 卡松对根霉的抑菌效果
由表3可以看出,卡松对根霉的抑制效果非常好.在根霉的培养基上,仅0.01 g/L的卡松浓度就可以出现很明显的抑菌圈,并且抑菌圈随着卡松的浓度逐渐增大,当卡松的浓度达到0.06 g/L以上时,整个培养基上没有根霉长出;卡松对根霉的抑菌时效也随着卡松的浓度增大而增长,当卡松的浓度达到0.05 g/L时,抑菌时效可以达到21 d以上.
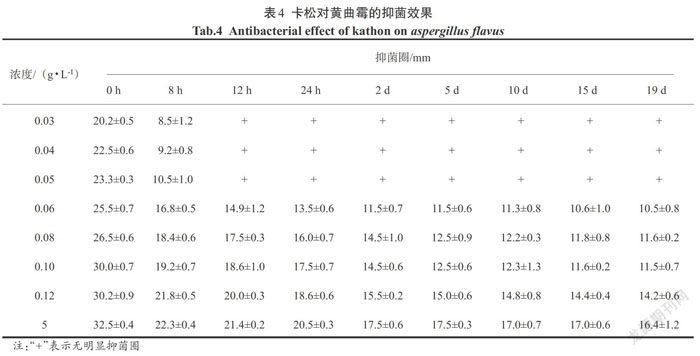
2.2.4 卡松对黄曲霉的抑菌效果
从表4的数据来看,卡松对黄曲霉的抑菌效果较好,0.06 g/L的卡松对黄曲霉的抑制效果随着卡松的浓度增大而增强;卡松对黄曲霉的抑菌时效很长,可以达到19 d以上,并且卡松的浓度越大,抑菌时效越长.
表4 卡松对黄曲霉的抑菌效果
Tab.4 Antibacterial effect of kathon on aspergillus flavus
注:“+”表示无明显抑菌圈
2.2.5 卡松对毛霉的抑菌效果
从表5中可以看出,卡松对毛霉的抑制效果不太理想.当卡松的浓度达到0.06 g/L时才出现较为明显的抑菌圈,虽然毛霉的抑菌圈也是随着卡松的浓度逐渐增大,但卡松对毛霉的抑制时效非常短,即使卡松的浓度达到0.15 g/L,抑菌圈也会在24 h内就长满了毛霉.这应该跟毛霉的生长特性有关,毛霉菌丝体生长迅速,孢子释放较快,生长旺盛.
表5 卡松对毛霉的抑菌效果
Tab.5 Antibacterial effect of kathon on mucor
注:“+”表示无明显抑菌圈
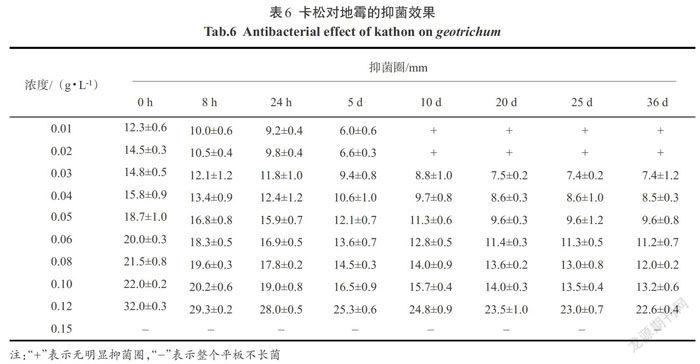
2.2.6 卡松对地霉的抑制效果
由表6中的数据可以看出,卡松对地霉的抑制效果很好.卡松浓度为0.01 g/L时,抑菌圈直径达到 12.3 mm,卡松浓度增加,抑菌圈的直径也随之增大,当卡松浓度达到0.15 g/L时,培养基上没有地霉长出;卡松对地霉的抑菌时效也随着卡松的浓度变化而变化,浓度越大,抑菌时效越长,当卡松浓度达到0.12 g/L时,抑菌时效可长达36 d以上.
表6 卡松对地霉的抑菌效果
Tab.6 Antibacterial effect of kathon on geotrichum
[浓度/(g·L-1) 抑菌圈/mm 0 h 8 h 24 h 5 d 10 d 20 d 25 d 36 d 0.01 12.3±0.6 10.0±0.6 9.2±0.4 6.0±0.6 + + + + 0.02 14.5±0.3 10.5±0.4 9.8±0.4 6.6±0.3 + + + + 0.03 14.8±0.5 12.1±1.2 11.8±1.0 9.4±0.8 8.8±1.0 7.5±0.2 7.4±0.2 7.4±1.2 0.04 15.8±0.9 13.4±0.9 12.4±1.2 10.6±1.0 9.7±0.8 8.6±0.3 8.6±1.0 8.5±0.3 0.05 18.7±1.0 16.8±0.8 15.9±0.7 12.1±0.7 11.3±0.6 9.6±0.3 9.6±1.2 9.6±0.8 0.06 20.0±0.3 18.3±0.5 16.9±0.5 13.6±0.7 12.8±0.5 11.4±0.3 11.3±0.5 11.2±0.7 0.08 21.5±0.8 19.6±0.3 17.8±0.2 14.5±0.3 14.0±0.9 13.6±0.2 13.0±0.8 12.0±0.2 0.10 22.0±0.2 20.2±0.6 19.0±0.8 16.5±0.9 15.7±0.4 14.0±0.3 13.5±0.4 13.2±0.6 0.12 32.0±0.3 29.3±0.2 28.0±0.5 25.3±0.6 24.8±0.9 23.5±1.0 23.0±0.7 22.6±0.4 0.15 - - - - - - - - ]
注:“+”表示无明显抑菌圈,“-”表示整个平板不长菌
3 结论与展望
本次从白莲洞遗址土壤表面经过多次分离纯化得到6种主要的霉菌,通过观察其在PDA培养基上的外观形态和在显微镜下的结构特点得出结论,其属分别是地霉属、根霉属、青霉属、毛霉属、曲霉属.用卡松对分离出来的6种霉菌进行抑菌实验,发现效果较为理想,除了对毛霉的抑菌时效较短外,对其他5种菌的抑菌时效都比较长.今后,在此次实验结果的基础上,将继续对洞中霉菌进行后续研究,采用其他药品或者多种药品复配进行抑菌,针对毛霉的生长特性,寻找对其抑制效果好的药品再进行研究.还要对白莲洞遗址中主要霉菌的病害分布区域、分布面积进行全面统计,对照其生物特性和生存条件,结合该区域的微环境变化,提出有针对性的预防控制措施,最小干预的情况下避免大面积霉菌病害的产生,最大程度地保留白莲洞遗址的原始环境信息. 此外,由于纳米材料具有特殊的尺寸效应和优秀的捕获能力[15-16],在下一步的研究工作中,考虑将对霉菌具有抑制作用的药品融合到纳米材料的制备中,研制新型的纳米防霉材料,以求对遗址达到长效抑菌的作用,使古遗址得到更长期的保护.
参考文献
[1] 沈冠军,王家齐,徐必学,等.广西柳州白莲洞遗址的铀系年龄[J]. 地层学杂志,2001,25(2):89-93,106.
[2] 柳州市博物馆.柳州市白蓮洞旧石器时代晚期文化遗址中的脊椎动物遗骸[J].古脊椎动物与古人类,1975,13(2):137.
[3] 刘文.柳州白莲洞、鲤鱼嘴遗址燧石石器[J].四川文物,2008(6):36-38.
[4] 周国兴.中国广西柳州白莲洞石器时代洞穴遗址——对华南地区旧石器时代晚期文化向新石器时代早期文化过渡的探索[J].东南文化,1986(2):8-13.
[5] 苏文俊,王金海,付敏,等.白莲洞遗址危岩体形成机理及破坏模式[J].煤田地质与勘探,2016,44(2):59-65,72.
[6] 夏寅,李蔓,张尚欣,等.遗址博物馆内土遗址本体可溶性盐和霉菌危害预防与治理的进展[J].文物保护与考古科学,2013,25(4):114-119.
[7] 田金英,王春蕾.霉菌对文物的影响初探[J].中国博物馆,1999(1):82-86.
[8] 李晓华.试谈霉菌对文物的危害及防治[J].东南文化,1996(3):134-137.
[9] 徐卫国,陈勇.2-甲基-4-异噻唑啉-3-酮及其衍生物5-氯-2-甲基-4-异噻唑啉-3-酮的合成[J].浙江化工,2001,32(2):55-57.
[10] 李程碑,解彬. 异噻唑啉酮(卡松)防腐剂的色泽及工艺控制[J]. 应用化工,2012,41(2):286-289,293.
[11] 武婷,王超,王星,等.反相高效液相色谱法测定化妆品中的24种防腐剂[J].分析化学,2007,35(10):1439-1443.
[12] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[13] 中华人民共和国卫生部.食品卫生微生物学检验 常见产毒霉菌的鉴定:GB/T 4789.16-2003[S].北京:中国标准出版社,2003.
[14] 戴芳澜.真菌的形态和分类[M].北京: 科学出版社,1987.
[15] 张文康,梁燕艺,刘瑶,等.CdS/g-C3N4复合材料的制备及其光催化性能研究[J].广西科技大学学报,2018,29(4):66-73.
[16] 罗春林,韦菲,侯蕾,等.T8-NH2/E-44复合涂层的制备及其防腐性能研究[J].广西科技大学学报,2016,27(3):50-54.
Inhibitory effect of Kathon on mold from earthen archaeological site of Bailiandong in Liuzhou City
HUANG Guoxia1,3,4, YE Liang2, LAN Xiaofeng1, CHEN Huaying1, LI Jiaming1, LIU Chengxiang1
(1.School of Biological and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou 545006, China; 2. Liuzhou Bailiandong Site Science Museum, Liuzhou 545005, China;3.Key Laboratory for Processing of Sugar Resources of Guangxi Higher Education Institutes (Guangxi University of Science and
Technology), Liuzhou 545006, China; 4. Guangxi Key Laboratory of Green Processing of Sugar Resources (Guangxi University of Science and Technology), Liuzhou 545006, China)
Abstract: In this paper, the types of molds from the surface of Bailiandong site and the inhibitory effect of kathon on the isolated molds were studied. The collected soils were prepared into soil suspension. The molds contained in suspension were cultured on potato dextrose agar medium by spread plate method, and then purified for several times. Finally, six kinds of major molds were isolated. They were geotrichum, rhizopus, penicillum, mucor, aspergillus(aspergillus flavus and aspergillus niger), respectively. The inhibitory effect of different concentrations of kathon solution on mold was studied by filter paper method. The result indicated that the antibacterial effect on aspergillus, geotrichum, rhizopus, penicillum is good and preserves for a long time, but that on mucor is worse.
Key words: Bailiandong Site; earthen archaeological site; mold; separation; identification

