ICU与非ICU患者不动杆菌属血流感染耐药性及预后分析
仝瀚文 蒋陈晓 刘芸 王芳 王军

【摘 要】目的:對南京鼓楼医院ICU与非ICU患者五年间不动杆菌属血流感染的构成分布、耐药性及预后进行分析,并利用统计学方法找出影响患者预后的独立危险因素,为更好的治疗血流感染,改善患者预后提供参考;方法:回顾2013年08月至2018年08月期间,南京鼓楼医院ICU与非ICU患者不动杆菌属血流感染的资料,从住院起观察患者90天的预后并记录,采用SPSS 22.0软件进行数据分析;结果:ICU病房共收集不动杆菌116株,耐药率最低的是头孢哌酮舒巴坦(5.2%);非ICU病房共收集不动杆菌59株,耐药率最低的依然是头孢哌酮舒巴坦(3.4%)。ICU分离株耐药率显著高于非ICU分离株(P<0.05,头孢哌酮舒巴坦除外),两者之间死亡率有统计学差异(38.8% vs 8.5%,P<0.05)。对ICU血流感染患者进行危险因素分析,结果显示,手术、PICC/CVC、SOFA评分3种因素有统计学差异,进一步分析显示,SOFA评分为影响患者预后的独立危险因素。入院时SOFA评分<2分的患者与SOFA评分≥2分的患者相比,两组间生存时间有统计学差异(79.95±5.37 vs 42±4.38天,P=0.015);结论:与非ICU病房相比,ICU病房来源的不动杆菌耐药更为严重,病死率更高,可选择头孢哌酮舒巴坦作为经验性治疗抗生素。SOFA评分为ICU血流感染患者预后独立危险因素,入院时SOFA评分≥2分的患者预后较差。
【关键词】ICU 不动杆菌属 血流感染 耐药性 预后
【中图分类号】R249 【文献标识码】A 【文章编号】1004-7484(2019)10-0165-02
Drug resistance and prognosis analysis of acinetobacter bloodstream
infection in ICU and non-icu patients
【Abstract】Objective:The composition, distribution, drug resistance and prognosis of acinetobacter bloodstream infection in ICU and non-icu patients of Nanjing Drum Tower Hospital in five years were analyzed,statistical methods were used to identify independent risk factors affecting the prognosis of patients, so as to provide references for better treatment of bloodstream infection and improvement of patients' prognosis;Methods From August 2013 to August 2018, the ICU and non-icu patients with acinetobacter bloodstream infection in Nanjing Drum Tower Hospital were reviewed. The patients' prognosis was observed and recorded at 90 days after admission. SPSS 22.0 software was used for data analysis;Results 116 acinetobacter strains were collected in ICU wards. The lowest drug resistance rate was cefoperazone sulbactam (5.2%).59 acinetobacter strains were collected in non-icu wards, and the lowest drug resistance rate was also cefoperazone sulbactam (3.4%).The drug resistance rate of ICU isolates was significantly higher than that of non-icu isolates (P<0.05,except cefoperazone sulbactam).There was a statistical difference in mortality between the two groups (38.8% vs 8.5%,P<0.05).Analysis of risk factors of ICU patients with bloodstream infection showed that there were statistical differences among the three factors including surgery, PICC/CVC and SOFA score, and SOFA score was an independent risk factor affecting the prognosis of patients.Patients with SOFA score <2 on admission had a statistically significant difference in survival time between the two groups (79.95±5.37 vs 42±4.38 days, P=0.015) compared with patients with SOFA score≥2.Conclusion Compared with non-icu wards, acinetobacter from ICU wards has more serious drug resistance and higher mortality.Cefoperazone sulbactam may be selected as an empirical therapeutic antibiotic.SOFA score is an independent risk factor for the prognosis of ICU patients with bloodstream infection, and patients with SOFA score≥2 upon admission have poor prognosis.
【Key words】 ICU; Acinetobacter; Bloodstream infections; Drug resistance;Prognosis
血流感染是重症感染、感染性休克的重要原因之一,约占院内常见感染类型的第三位,是住院患者死亡率增高、住院时间延长、医疗费用增加的重要因素。近年来[1],细菌耐药性不断增加,尤其是ICU患者,随着大量有创诊疗技术的开展,免疫抑制剂及激素的大量使用,血流感染患者的病死率也在增加。其中,不动杆菌属是重要致病菌,耐药问题严重,碳氢霉烯类耐药鲍曼不动杆菌分离率高达60%-70%。
不动杆菌属为非发酵革兰氏阴性杆菌,主要分为6种,即鲍曼不动杆菌、醋酸钙不动杆菌、溶血不动杆菌、鲁氏不动杆菌、琼氏不动杆菌和约翰逊不动杆菌。不动杆菌属细菌通过不同的耐药机制对抗生素产生天然耐药和获得性耐药。本研究对南京鼓楼医院各专科ICU与非ICU患者5年间(2013.08-2018.08)不动杆菌属血流感染的资料进行构成分布、耐药性及预后分析,并利用统计学方法找出影响患者预后的独立危险因素,为更好地治疗ICU患者的血流感染,改善患者预后提供参考。
1 资料与方法
1.1标本资料采集:回顾性分析2013年08月至2018年08月期间,南京鼓楼医院ICU与非ICU患者不动杆菌属血流感染的资料,记录患者入院时的姓名、性别、年龄、住院时间、伴随疾病、治疗相关有创性操作(机械通气、气管切开、深静脉置管、血液净化、器官替代治疗等)、入院时急性生理学与慢性健康状况评分系统II(APACHEII评分)和序贯器官衰竭评分(SOFA评分)、病原菌构成分布、细菌药敏、患者预后等资料。从住院起观察患者90天的预后并记录,随访终点为患者死亡或者自动出院。
1.2 细菌分类及诊断标准:对三类及以上抗生素耐药定义为多重耐药菌(multi-drug resistant bacteria,MDR),对除多粘菌素及替加环素以外所有类抗生素耐药定义为泛耐药菌(pandrug-resistant bacteria,PDR);
血流感染诊断标准:至少具有下列症状和体征之一:发热(>38℃)或体温<36℃,寒战或低血压,且培养出的病原体与其他部位无关;从一次或多次血样本中培养或通过非培养微生物学检测方法鉴定出一种一致的致病菌[6];
1.3 统计学方法:采用SPSS 22.0软件进行数据分析,组间率及构成比的比较,采用c2检验、似然比检验或者Fisher精确概率法,以P<0.05为差异有统计学意义;对可能影响患者死亡率的危险因素,先进行单因素分析,为了消除混杂因素的作用,进一步阐明各单因素对患者死亡率的影响,将有统计学意义的变量纳入Logistic回归模型进行多因素非条件Logistic回归分析,进入概率α=0.05,剔除概率α=0.10,计算出研究因素的OR值和 95% CI(可信区间),P<0.05 为差异有统计学意义,保留在Logistic回归模型中的因素为确定的有意义的独立危险因素。观察患者90天预后情况,使用Kaplan-Meier生存曲线分析危险因素对90天生存率的影响,并用log-rank检验比较组间生存率有无统计学差异(P<0.05为差异有统计学意义)。
2 结果
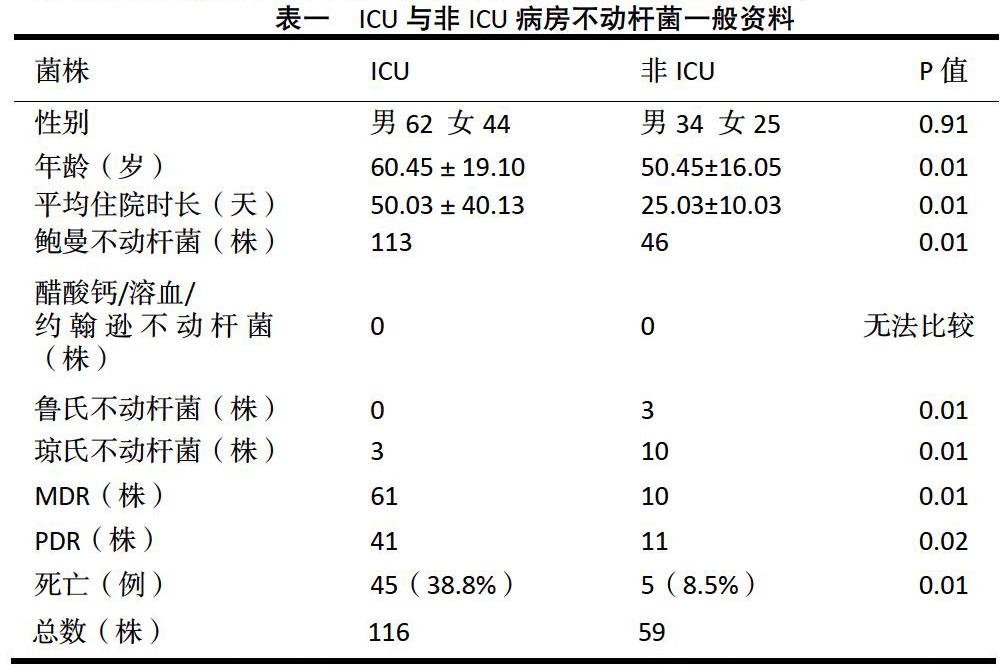
2.1 不动杆菌属来源资料及构成分布:2013年08月至2018年08月,我院ICU病房共收集不动杆菌116株,MDR菌株61株(52.6%),PDR菌株41株(35.3%),其中男性患者62人,女性患者44人,平均年龄60.45±19.10岁,平均住院时长50.03±40.13天,死亡45例,死亡率38.8%;
非ICU病房共收集不动杆菌59株,其中MDR菌株10株(16.9%),PDR菌株11株(18.6%),男性患者34人,女性患者25人,平均年龄50.45±16.05岁,平均住院时长25.03±10.03天,死亡5例,死亡率8.5%,包括3例转入ICU后死亡,2例既往肿瘤病史,自动出院。
ICU及非ICU患者两组间性别无差异,年龄、平均住院时长、不动杆菌及多重耐药菌构成、死亡率有统计学差异(P<0.05),详见表一;
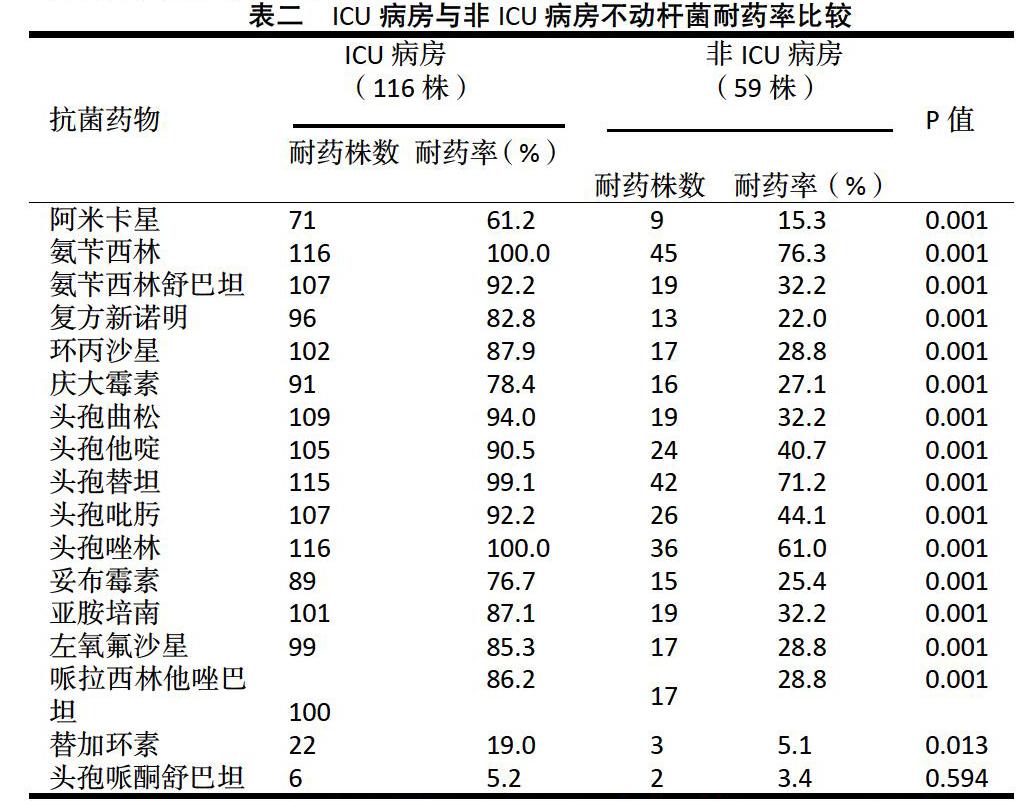
2.2 不动杆菌耐药率比较:ICU分离株中,耐药率最低的是头孢哌酮舒巴坦(5.2%),其次为替加环素(19.0%)。ICU分离株菌株中除头孢哌酮舒巴坦及替加环素外,其余各种抗生素的耐药率均在60%以上,其中对三四代头孢菌素和亚胺培南的耐药率在80%以上。
非ICU分離株中,耐药率最低的依然是头孢哌酮舒巴坦(3.4%),其次为替加环素(5.1%)。非ICU分离菌株普遍耐药率偏低,除氨苄西林、头孢替坦外,对其余各种抗生素的耐药率均为60%左右或以下,其中对阿米卡星、复方新诺明、哌拉西林他唑巴坦、氨基糖苷类以及喹诺酮类的耐药率在30%以下。
总体上来看,除头孢哌酮舒巴坦外,ICU分离株耐药率均显著高于非ICU分离株,差异有统计学意义(P<0.05),详见表二;
2.3 ICU血流感染患者危险因素单因素分析及多因素Logistic回归分析:对ICU血流感染患者进行危险因素分析,选择10个可能影响患者预后的危险因素:性别、年龄、机械通气、手术、气切、PICC/CVC、CRRT/ECMO、糖尿病、APACHEⅡ评分、SOFA评分先进行危险因素单因素分析,结果显示,手术、PICC/CVC、SOFA评分3种因素有显著统计学差异(P<0.05),与患者预后相关,如表三所示。为了消除混杂因素的作用,进一步阐明各单因素对死亡率的影响,将有统计学意义的变量纳入Logistic回归模型进行多因素分析,共产生1个影响血流感染患者预后的独立危险因素,为SOFA评分,说明高SOFA评分的患者,患者死亡风险较高,如表四所示。
2.4 Kaplan-Meire生存曲线:Sofa评分为影响血流感染患者预后的独立危险因素,据文献报道,根据入院时SOFA评分,将患者分为两组:SOFA评分<2分,平均生存时间79.95±5.37天(95%CI 65.24 - 84.78);SOFA评分≥2分,平均生存时间42±4.38天(95%CI 36.57- 53.28);两组生存曲线如图1所示,使用log-rank检验比较两组间生存时间及生存率,结果示两组间差异有统计学意义(P=0.015);
3讨论
不动杆菌属广泛存在于自然界,医疗环境及人体皮肤,为条件致病菌。ICU患者中,多系统部位(呼吸道,胃肠道,尿路,皮肤软组织等)感染均可导致血流感染的发生。近年来,不动杆菌属的临床分离率及多重耐药、泛耐药甚至是全耐药的临床分离株不断增加,且其存活力强,对常用物理及化学消毒方法有较强抵抗性,是导致院内感染的主要病原菌之一。目前,不动杆菌对常见抗生素包括碳青霉烯类、β-内酰胺类、氨基糖苷类和喹诺酮类在内的几乎所有抗生素均有不同程度的耐药性,耐药机制复杂,对碳青霉烯类的主要耐药机制为产碳青霉烯酶、青霉素结合蛋白基因突变、药物外排系统过度表达;对β内酰胺类耐药机制主要为产β-内酰胺酶、膜孔蛋白及外排泵的改变等;对氨基糖苷类的耐药机制主要为产生16SrRNA甲基化酶和修饰酶基因;对喹诺酮类药物的耐药机制与药物主动外排系统的过度表达有关。
本研究显示,ICU分离株中除头孢哌酮舒巴坦及替加环素外,对其余各种抗生素的耐药率均在60%以上,其中对三四代头孢菌素和亚胺培南的耐药率在80%以上,非ICU分离株对大部分常见三代头孢及青霉素类的抗生素的耐药率均在50%以上,反映出不动杆菌属的天然耐药性。本研究药敏显示,除头孢哌酮舒巴坦外,ICU分离株耐药率均高于非ICU,与ICU患者基础疾病较重,机体免疫力低下,接受各种侵袭性医疗操作以及广谱抗生素使用有关。
不动杆菌属MDR及PDR菌株的感染给临床治疗带来了较大难题,ICU中MDR和PDR菌株的分离率均高于非ICU,根据本研究药敏结果提示,不动杆菌属血流感染时,头孢哌酮舒巴坦和替加环素可作为经验性抗生素选用。头孢哌酮舒巴坦的抗菌成分为头孢哌酮,为第三代头孢菌素,其通过抑制细菌细胞壁粘肽的合成,从而达到杀菌作用,而舒巴坦对β-内酰胺酶有不可逆的抑制作用,对不动杆菌属也有直接的抗菌活性,二者组成的复方制剂较单种成分的最低抑菌浓度值至少降低4倍。替加环素为甘氨酰环素类抗生素,其通过与核糖体30S亚单位结合、阻止氨酰化tRNA分子进入核糖体A位而抑制细菌蛋白质合成,具有广谱抗菌活性。
本调查显示,大多数血流感染患者具有高龄、高APACHEⅡ、SOFA评分、侵袭性操作、及基础疾病较多等特征。Suner等曾报道,高龄、严重基础疾病、侵袭性医疗操作、免疫力低下等因素是导致血流感染患者死亡的危险因素。本研究对预后的危险因素进行多因素分析显示,SOFA评分为预后的独立危险因素,死亡组具有更高的SOFA评分,表明了器官功能障碍及衰竭对血流感染患者来说很可能是致命的。统计学分析表明,SOFA评分<2分的患者生存时间显著高于SOFA评分≥2分的患者,说明SOFA评分高的患者器官功能状态较差。国外研究显示,SOFA评分程度和血流感染患者的院内病死率呈正相关,这与本文的结果也是对应的。
综上所述,ICU病房来源的不动杆菌耐药更为严重,需引起临床高度重视,应尽量减少患者的ICU住院时间,尽量减少侵袭性医疗操作,实施有效的消毒隔离措施,加强感染源的控制和管理,早期识别不动杆菌感染,并给予适当的抗菌药物治疗,并结合药敏试验结果合理调整抗生素的使用,以提高臨床疗效和减缓耐药株的产生,有助于改善患者预后。
参考文献
[1] Phu, V.D., et al., Burden of Hospital Acquired Infections and Antimicrobial Use in Vietnamese Adult Intensive Care Units. PLoS One, 2016. 11(1): p. e0147544.
[2] Kolpa, M., et al., Incidence, Microbiological Profile and Risk Factors of Healthcare-Associated Infections in Intensive Care Units: A 10 Year Observation in a Provincial Hospital in Southern Poland. Int J Environ Res Public Health, 2018. 15(1).
[3] Da, S.W.J., et al., Microbiologic isolates and risk factors associated with antimicrobial resistance in patients admitted to the intensive care unit in a tertiary care hospital. Am J Infect Control, 2013. 41(9): p. 846-8.
[4] 中华医学会呼吸病学分会感染学组, 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版). 中华结核和呼吸杂志, 2018(4): 第255-280页.
[5] Lin, M.F. and C.Y. Lan, Antimicrobial resistance in Acinetobacter baumannii: From bench to bedside. World J Clin Cases, 2014. 2(12): p. 787-814.
[6] Bloodstream Infection Event (Central Line-Associated Bloodstream Infection and Non-central Line Associated Bloodstream Infection.
[7] Shapiro, N.I., et al., The association of near-infrared spectroscopy-derived tissue oxygenation measurements with sepsis syndromes, organ dysfunction and mortality in emergency department patients with sepsis. Crit Care, 2011. 15(5): p. R223.
[8] Grundler, K., et al., Platelet mitochondrial membrane depolarization reflects disease severity in patients with sepsis and correlates with clinical outcome. Crit Care, 2014. 18(1): p. R31.
[9] Civitarese, A.M., et al., A 10-Year Review of Total Hospital-Onset ICU Bloodstream Infections at an Academic Medical Center. Chest, 2017. 151(5): p. 1011-1017.
[10] Lee, C.R., et al., Biology of Acinetobacter baumannii: Pathogenesis, Antibiotic Resistance Mechanisms, and Prospective Treatment Options. Front Cell Infect Microbiol, 2017. 7: p. 55.
[11] Suner, A., et al., Assessment of bloodstream infections and risk factors in an intensive care unit. Turk J Med Sci, 2015. 45(6): p. 1243-50.
[12] Matsumura, Y., et al., Serum procalcitonin level and SOFA score at discharge from the intensive care unit predict post-intensive care unit mortality: a prospective study. PLoS One, 2014. 9(12): p. e114007.
[13] Timsit, J., et al., Treatment of bloodstream infections in ICUs. BMC infectious diseases, 2014. 14(1): p. 489-489.
[14] Gutierrez-Gutierrez, B., et al., Effect of appropriate combination therapy on mortality of patients with bloodstream infections due to carbapenemase-producing Enterobacteriaceae (INCREMENT): a retrospective cohort study. Lancet Infect Dis, 2017. 17(7): p. 726-734.

