进境种牛及遗传物质的遗传缺陷病检测方法的建立与应用
马飞 许文超 宿雅彬 王建昌 李涛

摘要 本研究运用分子生物学方法,对进口荷斯坦奶牛遗传物质、进口种牛、国产牛精液等进行BLAD、CVM、DUMPS、FDS4种主要遗传病筛查,采用的PCR-RFLP方法是对提取产物的致病序列进行PCR扩增,后均采用酶切的方法对标本进行纯合子和隐性杂合子的鉴定,本文标本来自进口52份牛精液(美国、加拿大)、国产112份牛精液标本.650份进口种牛血液样品(澳大利亚、新西兰、乌拉圭、智利等国家),通过对814份样品的筛查,共检出携带BLAD隐性有害基因的样品6份,携带CVM隐性有害基因的样品15份,携带DUMPS隐性有害基因的样品4份,未检测到携带FDS隐性有害基因的样品。基于此,我国有必要尽快建立荷斯坦牛隐性遗传缺陷监控体系并进行系谱标注,以逐步降低我国奶牛群体中遗传缺陷隐性等位基因频率。
关键词 进境种牛;遗传缺陷病;检测方法;应用
中图分类号 S858.23
文献标识码 A
文章编号 1007-5739(2019)08-0218-05
1综述
遗传缺陷病是动物个体发生基因突变或染色体畸变导致的遗传疾病,导致发育个体出现身体结构上的缺陷或者功能性障碍,从而影响生产性能,具有先天性和家族性的特征。遗传缺陷病分为单染色体遗传病、染色体遗传病和多染色体遗传病。单基因遗传病是指一对主基因突变造成的疾病,其遗传符合孟德尔定律,荷斯坦牛中最常见以常染色体隐性为主如荷斯坦牛脊柱畸形综合症(CVM)、荷斯坦牛白细胞粘附缺陷(BLAD)、荷斯坦牛尿氨酸合酶缺陷症(DUMP),以及新发现的牛面部畸形综合症(FDS)等。
近年来,由于人工授精技术的普及以及奶牛生产力和养殖效益的大幅提高,奶牛遗传缺陷病危害逐年增加。目前,一些国家每年都会检测公牛的一些遗传缺陷,并淘汰携带者。2017年我国进口种牛逾10万头,进口牛精液及胚胎300万只,种公牛数百头。本研究对部分进口公牛和奶牛的精液及血液标本进行筛查,旨在了解我国部分进口和国内公牛及奶牛的遗传缺陷情况,并希望初步建立一种方便快捷的遗传缺陷病筛查方法。这样以来,就可提前把具有及携带遗传缺陷病基因的病牛拒国]之外,对我国畜牧业稳定发展及保障畜禽卫生健康具有重要意义。
1.1CVM疾病简述
脊柱畸形综合征(complexvertebralmalformation,CVM),是荷斯坦牛的一种常染色体致死性隐性遗传病,CVM主要表现为纯合子胎儿的早期死亡,纯合子胎儿在出生后极少能存活,但是CVM杂合子后代(携带者)表现正常,能存活。患病犊牛的病状为胸椎和颈椎较正常犊牛短,掌指关节和跖趾关节对称性地收缩和弯曲,体重较同期正常犊牛轻20%左右,另外还常见不同程度的椎骨半侧缺失、脊柱侧凸以及脊柱的骨间连合等(注:在CVM患者中发现了脊椎没有损伤的特例)。一些CVM患病胎儿还存在肺部和心脏畸形.CVM严重影响奶业生产。
Agerholm等研究确诊CVM为常染色体隐性遗传病,确定CVM的候选基因是SLC35A3(solutecarrierfamily35,memberA3)基因,本研究根据CVM发病的分子机理为CVM患牛的3号染色体(BTA3)上的SLC35A3(BovineSoluteCarrierFamily35Member3)基因的第4外显子559处发生G-T突变,导致180处缬氨酸置换为苯丙氨酸,致使异常的核苷酸转运至高尔基体从而使Rsal限制性酶切位点消失的原理,通过PCR-RFLP方法对此标本进行鉴定分析。针对G559T突变位点设计了一对引物,特异性扩增牛SLC35A3基因含有上述点突变的片段,长度为225bp。经限制性内切酶RsaI酶切后,正常个体产生201bp和24bp的DNA条带,而携带者产生201、24、225bp的DNA条带,纯合隐性个体仍为225bp。
1.2BLAD疾病简述
荷斯坦牛白细胞粘附缺陷(bovineleukocyteadhesiondeficiency,BLAD)是荷斯坦牛的一种重要的单碱基突变隐性遗传疾病。在相同的饲养条件下,荷斯坦牛BLAD纯合子与正常荷斯坦牛相比,生长明显缓慢,皮毛无光泽,对于病原微生物尤其是细菌的易感性高,主要特征表现为严重的重复细菌感染、缺少化脓、损伤愈合延迟和白细胞增多。口腔内、舌和牙眼出现溃疡,严重时由于牙床及骨翻的炎症而引起整个下领肿大。咽部出现明显炎症,呼吸道和肺部出现炎症。在胃和肠道出现溃疡,肾脏炎症,大多数淋巴结肿大。骨髓内的血细胞,主要是白细胞成熟中性颗粒细胞增多。在毒血症时,血管内的中性颗粒细胞浓度非常高,但在炎症部位反而很低,导致炎症长期不愈。
在荷斯坦牛育种中以剔除荷斯坦牛BLAD杂合子为主。BLAD遗传缺陷病其分子遗传学机制为牛1号染色体上CD18基因编码区发生A383G突变,导致第128位氨基酸由天门冬氨酸变为甘氨酸。本研究根据BLAD患病牛CD18基因编码区序列第383位点的A/G突变,从而使TaqI限制性酶切位点消失的原理,通过PCR-RFLP方法对标本进行鉴定分析,针对A383G突变位点设计了一对引物,特异性扩增奶牛CD18基因含有上述点突变的片段,长度为343bp。经限制性内切酶TaqI酶切后,正常个体产生191bp和152bp的DNA条带,而携带者产生191、152343bp的DNA条带,纯合隐性个体仍为324bp。
1.3DUMPS疾病简述
尿苷酸合酶缺乏症(deficiencyofuridinemonophophatesynthase,DUMPS)是荷斯坦牛胚胎早期死亡的一种常染色体单基因隐性遗传缺陷病,最早于1987年在美国发现。临床症状为血液中瓜氨酸含量升高,尿素循环受阻引起高氨血症,从而导致犊牛在出生1周内死亡,或者母牛懷孕40d左右时流产.DUMPS的遗传学基础是奶牛1号染色体(BTA1)上的UMPS基因C-末端密码子405处存在着一个C-T点突变,可导致原来编码精氨酸的CGA转变为编码终止密码子的TGA,导致基因编码产物催化亚基C-末端缺失76个氨基酸。由于这种蛋白质的酶催化功能丧失,造成其作用底物乳清酸的大量积累。
本研究根据该病发生的分子机理通过PCR-RFLP的检测方法对大量标本进行检测分析,其原理是:针对C405T突变位点设计了一对引物,特异性扩增牛UMPS基因含有上述点突变的片段,长度为108bp,因酶切片段较小且较接近,为观察酶切反应是否充分,引入第二Aval酶切位点。经限制性内切酶Aval酶切后,正常个体产生53、36、19bp的DNA条带,而携带者产生89、53、36、19bp的DNA条带,纯合隐性个体产生89bp和19bp条带。因19bp条带太小,通常观察不到。
1.4FDS疾病简述
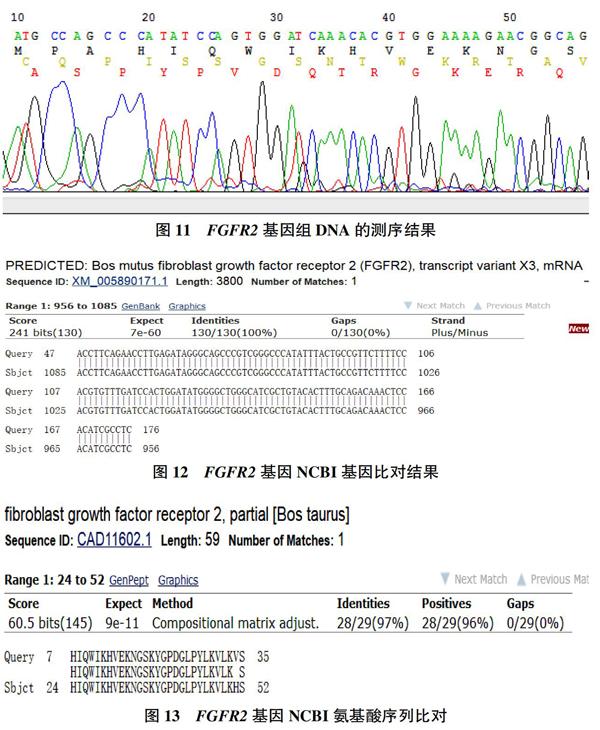
牛面部畸形综合症(FDS)是2017年被文献报道出来的新发现的遗传性疾病,其发病机理是位于26号染色体上编码FGFR2基因6号外显子第927位的碱基由G变为T(G.927T),与之相应的高度保守的氨基酸由色氨酸变为半胱氨酸(Trp309Cys),致使成千维细胞受体因子发生改变而引起临床发病。其临床表现为病畜面部严重发育不良、完全眼下垂、严重影响生存率。目前,国内和国外对此病研究均很少,本课题挑选该病提取标本基因组,用包含突变位点的引物特异性扩增牛FGFR2基因含有上述点突变的片段,长度为202bp。用基因测序的方法对进口及国内牛标本突变情况进行检测,以初步了解该病的遗传携带情况。
2牛遗传疾病分子生物学检测方法
2.1试验材料
2.1.1样本来源。本文中标本来自于进口52份牛精液(美国、加拿大)、国产112份牛精液标本650份进口种牛血液样品(澳大利亚新西兰、乌拉圭、智利)。
2.1.2主要仪器设备。BeckmanCoulter离心机(型号:Micro-fuge20R)、Eppendorf梯度PCR仪(型号:5331)、Bio-Rad伯乐凝胶成像系统SYSTEMGelDocXR+(型号:1708195)、Bio-Rad伯乐稳压稳流电泳仪及水平电泳槽、紫外分光光度计、水浴恒温振荡器、移液器(2、10、20、100、200、1000μL)、Millipore超纯水器。
2.2试验试剂
血液组织DNA提取试剂盒(货号:69504,Qiagen)、胶回收试剂盒(货号:28706,Qiagen)、PCR试剂盒(货号:M7123Promega)限制性内切酶TaqI(货号:1189A,Takara)、DL500Marker(货号:3590QTakara)、琼脂糖(北京化学试剂公司)、无水乙醇(北京化学试剂公司)、异丙醇(北京化学试剂公司)。
2.3引物合成
弓物均由上海生工生物技术服务有限公司合成,如表1所示。
2.4试验方法
2.4.1样品制备。收集牛精液液氮保存;收集牛未抗凝血液的血细胞成份于-20C条件下保存。
牛精液及血液中DNA提取:取500μL牛精液(或100μL血液),1500r/min离心5min,弃上清,加20μL蛋白酶K,混匀。加200μLBufferAL充分混匀,56C孵育10min。加200μL乙醇充分混匀,移入洗脱柱,8000r/min离心1min。弃废液,加入500μLAW1,8000r/min离心1min。弃废液,加人500μLAW2,13000r/min离心3min,弃废液及废管。更换1.5mL离心管,加入50μL去离子水8000r/min离心1min,再加入50μL去离子水洗脱2次,共100μLDNA标本。
2.4.2引物配置。按说明书要求加入双蒸水至100pmol/μL的储存液,再两次10倍稀释至10pmol/μL的即用引物备用。2.4.3PCR反应体系及条件。①BLAD、CVM、DUMPS、FDSPCR反应体系:20μLMasterMix、2μLPrimerF(l0pmol/uL)、2μLPrimerR(10pmol/μL)、16μLDNA,总体积40μL。②BLAD、CVM、DUMPSPCR反应条件为959C预变性2min,959C变性30s,59C退火30s,72C延伸1min,反应30个循环。循环结束后,95C延伸5min,4C保存。③FDSPCR反应条件为95C预变性2min,959C变性30s,57C退火30s,72C延伸1min,反应30个循环。循环结束后,72C延伸5min,4C保存。
2.4.4琼脂糖制作及制胶。①琼脂糖凝胶制作。取1g琼脂糖溶于100mLTAE中,在微波炉加热至琼脂糖全部熔化,使溶液冷却至60C,加入10mg/mLEB2μL.②灌胶。用橡皮膏将电泳内槽的两端边缘封好,不留缝隙。将内槽放置于水平台面,并插好梳子。待琼脂糖凝胶液冷却至60C左右,将其缓慢倒入内槽至厚度0.5cm左右,不要形成气泡,特别是梳子下,如有气泡可用牙签挑破。待胶凝固后,拔出梳子,撕去橡皮膏或透明胶带,将带凝胶的内槽放人电泳槽中,靠近负极端点样。加入1xTAE缓冲液至电泳槽,缓冲液刚没过凝胶表面即可。
2.4.5加样。直接取40μLPCR产物将其分别加入凝胶的点样孔并记录点样顺序。
2.4.6电泳。接通电源槽与电泳仪的电源,检查正负极。DNA的迁移率与电压成正比,电压150V电压,当溴酚蓝染料移动至凝胶前沿1.5cm处,切断电源,停止电泳。取出内槽,推出凝胶,将其放人凝胶成像系统紫外灯下观察结果,DNA存在处应显出明亮条带,观察分析、拍照、切胶保存。
2.5PCR产物胶纯化
将300μLQG液体加入装有胶的EP管中,放入50C水浴锅中孵育10min,每3min上下混匀1次。加入350μL异丙醇,上下充分混勻。将约750μL混合液移人纯化柱,13000r/min离心1min,弃废液。加500μLQC至纯化柱,13000r/min离心1min,弃废液。加入750μLPE至纯化柱,13000r/min离心1min,弃废液。将纯化柱放人新的回收座中,13000r/min离心1min,弃废液及回收座。
将纯化柱移人1.5mLEP上,加入15μL双蒸水,孵育1min,13000r/min离心2min。弃纯化柱,将EP管收集的产物放-20C保存供酶切及测序。
2.6BLAD胶纯化产物酶切体
BLAD酶酶切体系及条件:0.5μLTaqI酶、1.0μL1%BSA、1.0μL10xTaqIbuffer、7.5μLDNA、10.0μL总体积,酶切温度及时间:65C过夜.CVM酶切体系及条件:0.5μLAfaI酶、1.0μL1%BSA、1.0μL10xTaqIbuffer、7.5μLDNA、10.0μL总体积,酶切温度及时间:37C过夜。DUMPS酶切体系及条件:0.5μLAval酶、1.0μL1%BSA、1.0μL10xTaqIbuffer、7.5μLDNA、10.0μL总体积,酶切温度及时间:30C过夜。
3结果与分析
3.1牛精液及血液基因组DNA提取结果
取1μL基因组DNA放人紫外分光光度计中读值,检测牛精液及血液的浓度及纯度。
3.1.1BLAD目的基因PCR结果。由图1可知,试验样本经扩增得到一条DNA片段,长度为324bp,与试验预期结果吻合,可进行RFLP分析。
3.1.2酶切结果,如图2可知,试验样本PCR扩增产物经TaqI酶切后产生AB基因型和AA基因型2种不同分型。其中,AB基因型(即隐形携带者):324、191、152bp,无纯合隐性个体;AA基因型(即纯合子):191bp和152bp2条带,属正常个体。
3.2CVM牛精液及血液基因组DNA提取结果
CVM牛精液及血液基因组DNA提取结果如图3所示。1~4号为牛精液基因组DNA提取結果,5~9号为血液基因组DNA提取结果。
3.2.1目的基因PCR结果。由图4可知,试验样本经扩增得到一条DNA片段,长度为225bp,与试验预期结果相吻合,可进行RFLP分析。
3.2.2胶纯化产物酶切结果。如图5可知,试验样本PCR扩增产物经TaqI酶切后产生AB基因型和AA基因型2种不同分型。其中,AB基因型(即隐形携带者):201、24、225bp,无纯合隐性个体;AA基因型(即纯合子):201bp和24bp2条带,属正常个体。
3.3DUMPS牛精液及血液基因组DNA提取结果
本试验所提取的牛精液基因组DNA条带单一、清晰,但血液标本提取DNA含量有差别,冻存时间长的标本,提取效率越低,提取DNA经紫外分光光度计检测基因组浓度后,于-20C冻存待用。选提取质量高的标本左基因组DNA的1%琼脂糖凝胶电泳检测结果见图6。
3.3.1目的基因PCR结果。由图7可知,试验样本经扩增得到一条长度为108bp的DNA片段,与试验预期结果相吻合,可以进行RFLP分析。
3.3.2酶切。如图8可知,试验样本PCR扩增产物经AvaI酶切后产生2种不同分型,AA基因型(即纯合子):53bp和36bp2条带,属正常个体;AB基因型(即隐形携带者):89、53、36bp,无纯合隐性个体。因19bp条带太小,通常观察不到。3.4FDS牛精液及血液基因组DNA提取结果
本试验所提取的牛精液基因组DNA条带单一、清晰,但血液标本提取DNA含量有差别,冻存时间长的标本,提取效率越低,提取DNA经紫外分光光度计检测基因组浓度后,于-20C冻存待用。选提取质量高的标本左基因组DNA的1%琼脂糖凝胶电泳检测结果见图9。
3.4.1目的基因PCR结果。由图10可知,试验样本经扩增得到一条长度为202bp的DNA片段,与试验预期结果相吻合,可以进行RFLP分析。
3.4.2测序结果。图11为FGFR2目的基因测序结果,从结果上看927位的碱基由G未变为T,未发现突变位点。图12、13分别为FGFR2基因NCBI基因比对结果、FGFR2基因NCBI氨基酸序列比对。
4结论与讨论
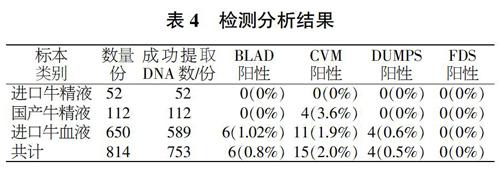
本试验通过对进口52份牛精液、国产112份牛精液标本、进口650份牛血液标本共计814份综合研究,结果如表4所示。本研究利用PCR-RFLP的方法对进口及国产共814份标本进行BLAD遗传缺陷病检测分析,发现进口种公牛及国内种公牛无BLAD遗传病基因,进口650份奶牛中共发现6头BLAD隐性基因携带者,携带率占总共标本数的1.02%,低于部分文献报道的地区携带率2%~20%。而且没有发现BLAD纯合个体,即BLAD感染者,因为这样的个体在出生后不久便死亡。该研究的目的就是筛查BLAD携带者,即AB基因型个体,及时淘汰BLAD携带者,掌握BLAD遗传缺陷在奶牛群中分布情况。
在对CVM的筛查中,进口种公牛精液中CVM携带率为零,说明目前国外已重视且做到了对种公牛的CVM遗传病的有效筛选,这有助于减少CVM在我国荷斯坦牛群中的扩散。国产牛精液检测出4例阳性,说明但随着CVM检测方法的越来成熟和完善,依然有必要对国内种公牛建立一种长期有效的检测机制,一旦发现,立即处理,防止牛群生产性能及繁殖性能下降;同时,国内畜牧场也应进行CVM的基因检测,避免近交繁殖加大致死率。虽然进口荷斯坦奶牛基因CVM携带率低于报道水平(11例,1.9%),但伴随着我国对进口荷斯坦活牛需求的激增,有必要对进口牛的谱系及遗传病进行筛查,并建立一定范围的信息共享机制,选择种群优秀的个体进行扩种繁育。
在对DUMPS遗传缺陷病筛查中,共发现4头DUMPS隐性基因携带者,发生率为0.5%,虽然发生率不高,但如果近交率较大时,将严重影响牛群的繁殖性能。因此,还是有必要对进口牛精液及种牛的谱系进行筛查,防止牛群生产性能及繁殖性能下降;同时,国内畜牧场也应进行DUMPS的基因检测,避免近交繁殖加大致死率。在进口及国产牛精液的谱系检测中,可建立一定范围的信息共享机制,选择种群优秀的个体进行扩种繁育。
本次研究未发现有FDS隐形基因携带者,但FDS致死率较大,但如果近交率较大时,将严重影响牛群的繁殖性能。因此,有必要对进口牛精液及种牛的谱系进行筛查,防止牛群生产性能及繁殖性能下降。
5展望
PCR-RFLP均可适合于以上3种疾病的常规检测筛选,标本可选择精液或血液,该方法简单快捷、准确性高、成本低廉,适合对牛进行大规模检测。对814份样品的检测结果为:6头荷斯坦牛为BLAD携带者,携带率为0.8%;15头荷斯坦牛为CVM携带者,携带率为2.0%:4头牛为DUMPS携带者,携带率为0.5%,说明进口奶牛和国内牛隐性遗传疾病虽然携带率低于报道,但还有一定比例。对进口32份牛精液的检测结果为均无携带率,说明国外畜牧业大国对种公牛遗传疾病检测还是做到了有意义的筛查。
本研究同时用测序的方法对2017年新报道的遗传疾病牛面部综合症(FDS)进行筛选,对以上标本均为检测出阳性。说明FDS的携带率比较低,可不必要对牛进行大规模检测,但对种公牛的筛选还是有长远意义。
优秀种公牛在荷斯坦牛育种过程中被高强度使用,当优秀种公牛携带隐性遗传疾病时,隐性遗传疾病很易被迅速传播。目前,我国有种公牛超过2000头,但对遗传疾病的携带率情况不清楚。因此,应对我国荷斯坦种公牛尽快进行遗传疾病的检测。由于试验抽取样本有限只能对我国荷斯坦牛隐性遗传疾病携带情况进行初步调查,还应对我国荷斯坦牛隐性遗传疾病携带情况进行大规模的抽查。隐性遗传疾病的剔除是一项长期任务,各职能部门应共同努力,加强对进口奶牛、精液及胚胎的检验,同时逐步淘汰现已检测出的携带隐性遗传疾病的荷斯坦奶牛。
6参考文献
[1]孙艺,孙东晓,张沅中国荷斯坦牛白细胞粘附缺陷病遗传分析[J].中国奶牛,2007(11):7-10.
[2]王洪梅,李建斌,侯明海,等牛脊柱畸形综合征检测方法的建立与应用[J].遗传,2008(9):1223-1227.
[3]朱凯,刘光磊,张长斌,等.荷斯坦牛遗传缺陷病研究进展[J].中国奶牛,2014(5):17-20.
[4]JORGENSA,MCEVOYFJ,HEEGAARDS,etal.AdenovomissensemutationofFGFR2causesfacialdysplasiasyndromeinHolsteincattle[J].BMCGenetics,2017,18:74.
[5]马金柱,崔玉东,朱战波,等.牛白细胞粘附缺陷病(BLAD)的调查[J].遗传,2006(10):1233-1236.
[6]李艳华,张胜利,刘振君,等中国荷斯坦牛脊椎畸形综合征的研究现状与展望[J].中国奶牛,2008(6):27-29.
[7]范学华,张毅,孙东晓,等.中国荷斯坦种公牛BLAD遗传缺陷的分子检测及系谱分析[J].中国奶牛,2011(8):1-4.
[8]施紅.新型的DNA序列测定策略:PCR产物直接测序[J].生物技术通讯,2005,11(2):10.
[9]徐祖元,包其郁,牛宇欣.PCR产物直接测序技术中影响因素研究[J].遗传,2007,24(5):548-550.
[10]王洪梅,李建斌,许尚忠,等中国荷斯坦牛白细胞黏附缺陷症PCR-RFLP检测方法的研究[J].生物技术通报,2007(3):155-158.
[11]张开展.中国奶牛进口情况与趋势[J].中国牧业通讯,2005(11):14-15.
[12]苏光华,张元跃.奶牛血液保存条件和DNA提取方法的优化[J].中国奶牛,2007(5):7-9.
[13]马春生一种新的荷斯坦牛遗传缺陷短脊椎综合症(Brachyspina)[CV/
中国奶业协会繁殖专业委员会、国家肉牛产业技术体系疾病控制研究室、国家奶牛产业技术体系疾病控制研究室中国奶业协会第24次繁殖学术年会暨国家奶牛/肉牛产业技术体系第一届全国牛病防治学术研讨会论文集.北京:中国奶业协会繁殖专业委员会,国家肉牛产业技术体系疾病控制研究室,国家奶牛产业技术体系疾病控制研究室,全国牛病大会组委会,2009:4.
[14]李建斌,王洪梅,高运东,等.利用PCR-RFLP检测中国荷斯坦牛遗传缺陷:瓜氨酸血症[J].生物技术通报,2006(6):97-99.

