动态增强MRI鉴别乳腺导管内乳头状瘤与其他良性病变
黎鑫乐, 李 雅, 柴维敏
(上海交通大学医学院附属瑞金医院放射科,上海 200025)
乳腺导管内乳头状瘤(intraductal papilloma,IDP)常见于乳腺导管上皮,是良性乳头状病变。根据结节的位置,IDP可分为中央型 (发生于中央导管)、周围型(发生于终末导管小叶单位)[1]。中央型IDP一般位于乳晕后区。乳晕后区的富血供结节较易诊断,而非乳晕后区的富血供结节则易与纤维腺瘤、腺病结节等混淆。表现为非肿块强化的IDP则易与腺病、炎症、良性增生性病变等混淆。本研究旨在分析动态增强MRI对于IDP与其他良性病变(纤维腺瘤、腺病、炎症、分叶状瘤等)的鉴别诊断价值。
资料与方法
一、资料
回顾性分析我院外科乳腺疾病诊治中心2016年10月至2017年10月,行乳腺MRI检查并经手术病理诊断296例女性病人,均为单个病灶。良性乳头状病灶96个,均为IDP。其他良性病灶200个。病灶为乳腺MRI检查BI-RADS 4类及以上。病人以往未行乳腺穿刺或手术。
二、方法
(一)MRI检查及后处理
MRI的扫描设备是德国Siemens Aera 1.5T超导型磁共振,采用4通道乳腺专用相控阵线圈,均为横轴位扫描。病人俯卧位,双侧乳腺自然悬垂于乳腺线圈内。扫描范围从腋窝至双侧乳房下界。扫描序列:脂肪抑制T2加权;双b值弥散加权成像(diffusion weighted imaging,DWI)50 800 s/mm2;T1加权动态增强扫描 (平扫一期+增强五期90 s×5)。每个时相扫描时间为90 s。第1序列平扫后,静脉注射钆喷替酸葡甲胺,流速2.0 mL/s。其后以同样速率注入15 mL生理盐水,冲洗管腔残留的钆喷替酸葡甲胺。动态增强扫描后,数据传送至1.5T后处理工作站。使用1.5T工作站,在b=800 s/mm2ADC图像上划取感兴趣区(region of interest,ROI),测量表观弥散系数 (apparent diffusion coefficient,ADC)值。ROI为病灶实性成分最大层面,避开明显坏死、囊变液化区。使用mean curve软件,选取T1平扫和T1动态增强五期图像。ROI取病灶强化最显著区,避开纤维腺体组织及导管血管,获得时间信号强度曲线 (time-signal intensity curve,TIC)。
(二)MRI图像分析
数据测量及后处理均在1.5T工作站上完成。依据2013版MRI BI-RADS分类标准,将病变分为肿块样强化和非肿块强化2类。分析ROI的TIC,分为上升型、平台型、流出型。
所有病灶的MRI形态学特点、强化特点及ADC值由2名影像科医师采用双盲法判定。意见不同时通过讨论达成共识,进行分类及诊断。
三、统计学分析
采用SPSS 22.0软件处理数据。计数资料行χ2检验。计量资料采用t检验,P<0.05为差异有统计学意义。
结 果
一、临床资料
IDP组平均年龄(49.9±12.0)岁,其他良性病变组平均年龄(41.2±11.8)岁,两组间差异有统计学意义(P<0.05)。IDP中肿块型强化病灶68个,非肿块型强化病灶28个;其他良性病变中肿块型强化病灶146个,非肿块型强化病灶54个(见表 1)。
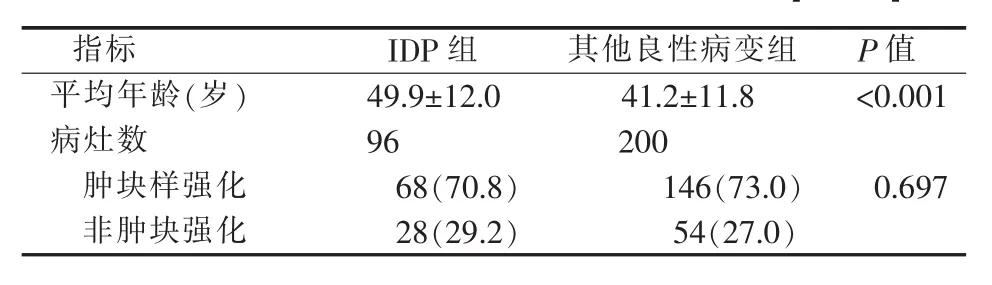
表1 乳腺IDP与其他良性病变的一般情况[n(%)]
二、病理诊断结果
本研究病人的病理诊断结果见表2。
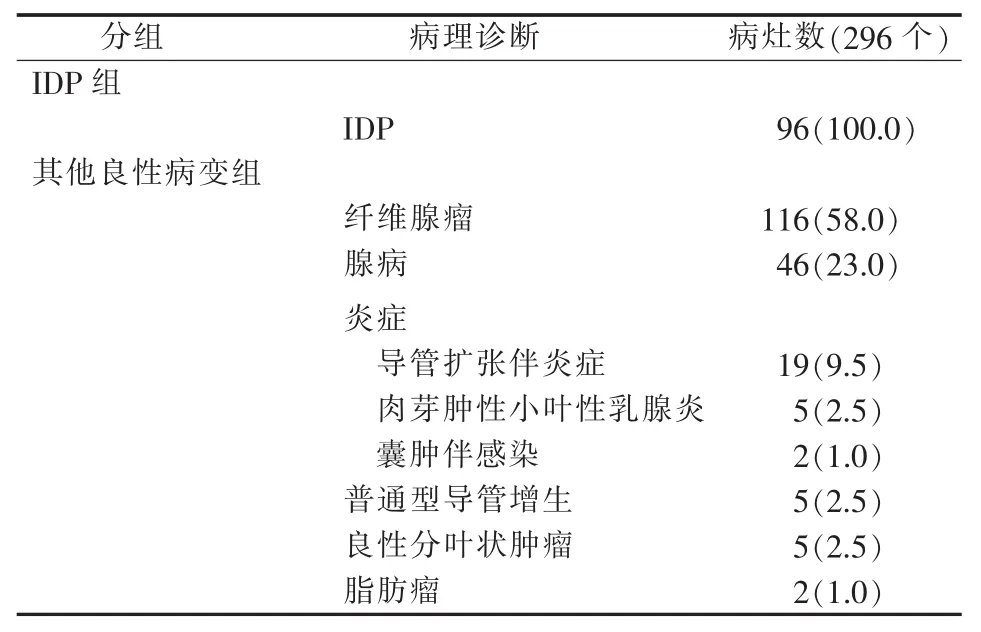
表2 乳腺良性病变病灶的病理诊断[n(%)]
三、MRI特征
IDP和其他良性病变均以肿块型强化病灶为主[70.8%(68/96)比 73.0%(146/200),P=0.697](见表1)。肿块型强化病灶中,IDP与其他良性病变的边缘光滑者均占 50%以上 (54.4%比 57.5%,P=0.668)。IDP可见边缘毛刺 3个(4.4%),其他良性病变未见边缘毛刺(P=0.011)。IDP以直径<1 cm为主(58.8%),其他良性病变以 1~5 cm 为主(65.1%)。IDP位于乳晕后区者较其他良性病变多见(29.4%比 17.8%,P=0.054)。典型 IDP以均匀强化为主(47.1%),其他良性病变以内部不规则低信号分隔样强化为主(47.9%)。其他良性病变肿块型强化病灶中,纤维腺瘤占72.6%(106/146),其中呈内部低信号分隔样强化者占 60.4%(64/106)(见表 3)。5个良性分叶状肿瘤病灶中3个呈内部低信号分隔样强化,占60%。2个脂肪瘤病灶中1个病灶呈内部低信号分隔样强化,占50%。21个腺病病灶中2个呈内部低信号分隔样强化,占9.5%。58岁IDP病人,MRI检查图像见图1。36岁纤维腺瘤病人,MRI检查图像见图2。36岁导管扩张伴炎症病人,MRI检查图像见图3。
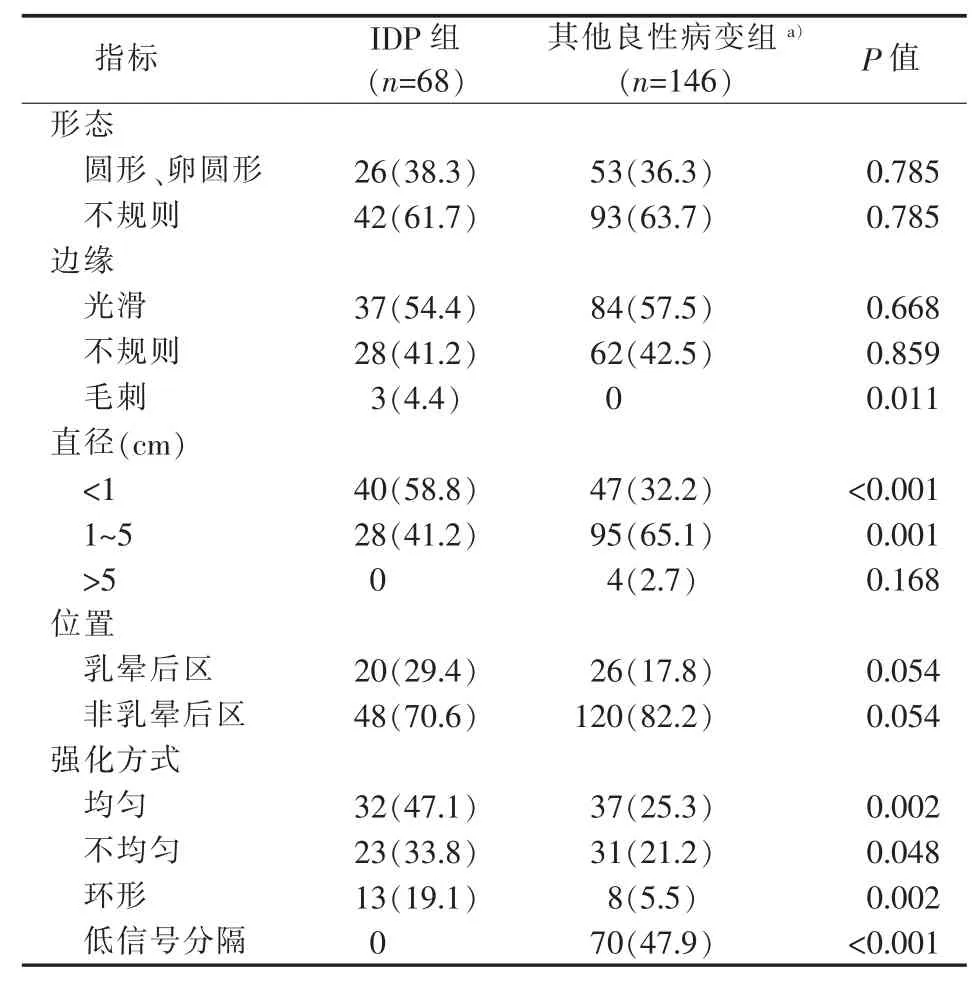
表3 IDP与其他良性病变肿块型强化病灶的 MRI特征[n(%)]
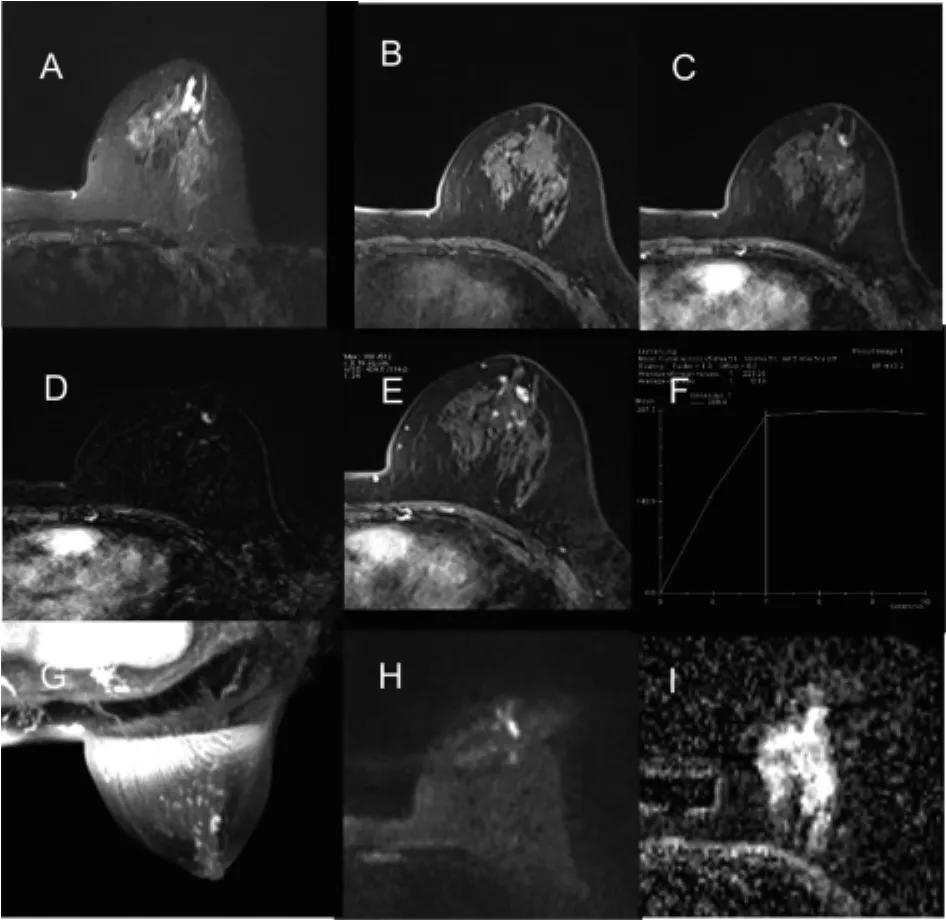
图1 IDP的MRI图像
非肿块型强化病灶中IDP 28个,其他良性病变54个,IDP病灶以节段分布为主[57.1%(16/28)],其他良性病变病灶以局灶分布为主[44.4%(24/54)]。IDP及其他良性病变均以不伴囊性灶为主(89.3%比77.8%,P=0.458)。IDP及其他良性病变病灶强化方式均以集簇强化为主(60.7%比42.6%,P=0.120)(见表 4)。
IDP较其他良性病变更多见伴导管扩张(65.6%比 22.5%,P<0.001)。IDP 以流出型曲线为主44.7%(43/96),其他良性病变以上升型曲线为主56.5%(113/200)(见表 5)。
IIDP 的平均 ADC 值 (1.15±0.19)×10-3mm2/s,其他良性病变的平均ADC值(1.30±0.29)×10-3mm2/s(P<0.001)。ADC值对IDP与其他良性病变有较好的鉴别诊断效能,曲线下面积为0.710,其最佳区分阈值 1.30×10-3mm2/s(见图 4)。本研究以 ADC值≥1.30×10-3mm2/s诊断为其他良性病变,灵敏度为56.5%(113/200),特异度为 79.2%(76/96),准确率为63.9%(189/296)。其他良性病变中纤维腺瘤等ADC平均值见表6。可见IDP与纤维腺瘤、腺病、炎症、分叶状瘤及脂肪瘤的ADC值差异有统计学意义(P值均<0.05)。IDP与普通型导管增生的ADC值差异无统计学意义(P>0.05)。
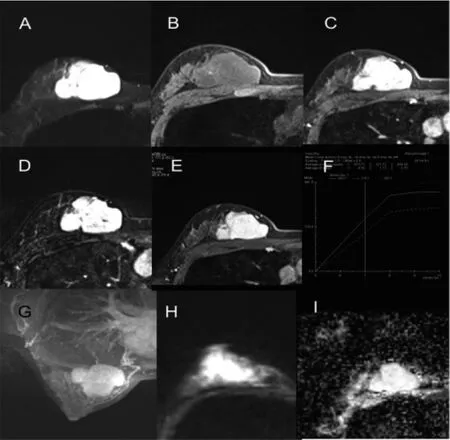
图2 纤维腺瘤MRI图像
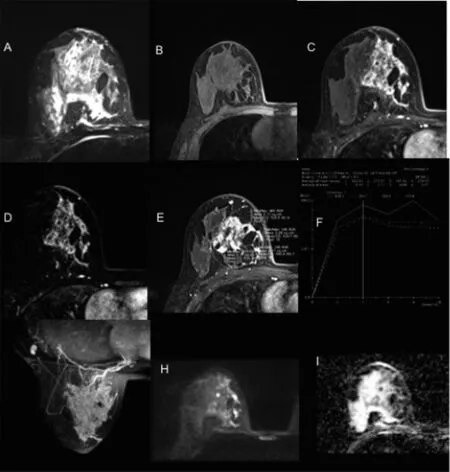
图3 炎症MRI图像
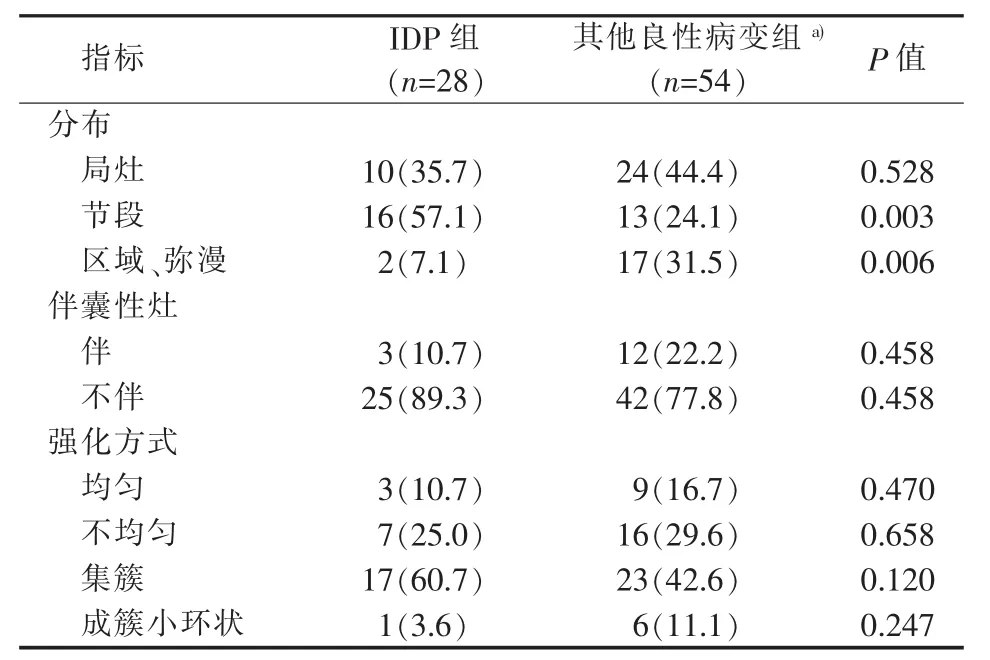
表4 IDP与其他良性病变非肿块型强化病灶的 MRI特征[n(%)]
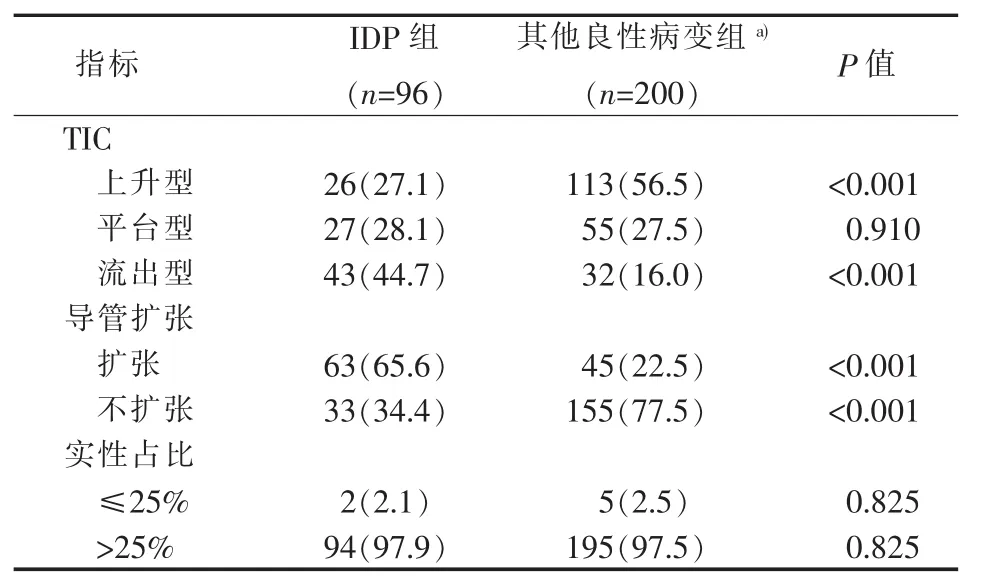
表5 IDP与其他良性病变共同的MRI特征[n(%)]
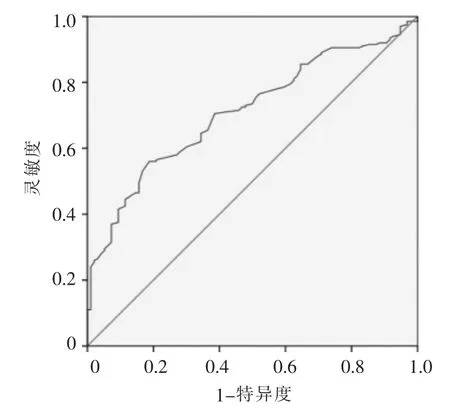
图4ADC值的ROC曲线图
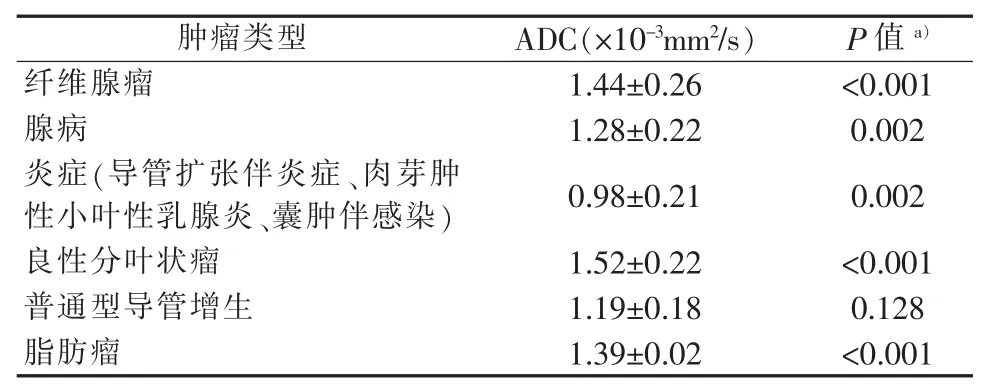
表6 各种其他良性病变的ADC均值
讨 论
IDP是最常发生于乳腺导管上皮的良性乳头状肿瘤,发病率为0.7%~4.0%[1-3]。其在良性肿瘤中的发病率仅次于乳腺纤维腺瘤,发病以40~45岁居多。乳腺IDP可发生于乳腺导管系统的任何部位。依据其部位分为2型:中央型和周围型。典型的IDP表现为乳晕后区的富血供结节。本研究显示大部分IDP位于非乳晕后区。当不伴导管扩张时,易与纤维腺瘤、腺病、炎症(导管扩张伴炎症、肉芽肿性小叶性乳腺炎、囊肿伴感染)、分叶状肿瘤等混淆。单纯IDP是否需手术一直存在争议[4-10]。但IDP易合并不典型增生,甚至合并原位癌。Maxwell等[8]认为,发病年龄>50岁、结节直径>1.5 cm、结节距离乳头>3 cm的IDP更可能合并不典型增生,甚至恶变。因此,IDP较腺病、纤维腺瘤等其他良性病变需更密切的影像学检查随访。纤维腺瘤是最常见的乳腺良性肿瘤,好发于20~40岁女性,一般不需手术。分叶状肿瘤分为良性、交界性及恶性,占乳腺肿瘤的0.3%~1.0%[11]。20%~30%的分叶状肿瘤是恶性病变[11]。分叶状肿瘤和纤维腺瘤均起源于特化间质的成纤维细胞,但分叶状肿瘤中的肿瘤性成纤维细胞具有非限制性生长和浸润性潜能。分叶状肿瘤通常起源于先前存在的纤维腺瘤,因此发病年龄比纤维腺瘤晚约10年。所有分叶状肿瘤均具有局部复发潜能。良性分叶状肿瘤术后局部复发率约20%[12]。一旦复发,常比原发肿瘤更具侵袭性,反复复发则侵袭性会进一步增强。少数病例最终进展出现转移。因此,分叶状肿瘤一般建议手术切除。腺病、良性增生性病变及炎症不具有手术指征。因此,MRI检查鉴别IDP与其他良性病变,对于指导治疗和随访有现实意义。
IDP一般呈圆形或不规则形结节,边缘光滑,直径1 cm左右,常伴导管扩张。典型者位于乳晕后区,血供较丰富,TIC呈流出型及平台型为主,ADC值一般位于良、恶性病变的交界。本研究中IDP以边缘光滑为主,偶可见边缘毛刺(4.4%),而其他良性病变未见边缘毛刺。Sarica等[13]对22个IDP病灶进行分析,均呈边缘光滑,未见边缘毛刺。展颖等[14]对31个IDP进行分析,其中25个肿块型病灶中4个表现为边缘毛刺。在组织病理学上,IDP常有纤维化和瘢痕形成,可能是自发性梗死造成。可将周围的腺体卷入其中并使之扭曲变形,形成“假性浸润”,从而造成形态边缘不规则。既往诸多文献报道,MRI显示的 IDP 直径中位数为 9.5(3~18) mm[15-19]。本研究IDP直径以<1 cm为主(58.8%),其他良性病变直径以1~5 cm为主(65.1%)。既往研究显示纤维腺瘤、良性分叶状等肿瘤直径一般在数厘米[11,20-21]。本研究5个肿块样强化的良性分叶状肿瘤病灶中,平均直径在4 cm,有1个良性分叶状肿瘤病灶直径超过5 cm。Wada等[22]研究发现,良性分叶状肿瘤直径约4.2 cm。本研究IDP位于乳晕后区者较其他良性病变更多见(29.4%比17.8%),符合IDP可发生于乳晕后区中央导管上皮的病理基础。IDP病灶内部强化方式以均匀强化为主(47.1%),其他良性病变病灶内部强化方式以不规则低信号分隔样强化为主(47.9%)。这主要是由于其他良性病变中纤维腺瘤占多数 [肿块型病灶中占72.6%(106/146)],其中呈低信号分隔样强化者占60.4%(64/106),因此强化方式差异较大。低信号分隔样强化是纤维腺瘤的特征性强化方式[20-21]。有文献报道,纤维腺瘤低信号分隔出现率为40%~64%[23],是区分纤维腺瘤与边界清楚乳腺癌及其余肿瘤的有效征象之一。Hochman等[24]发现低信号分隔的病理基础为大部分纤维腺瘤被胶原纤维包裹和分隔。此外,本研究5个良性分叶状肿瘤病灶中3个(60.0%)呈内部低信号分隔样强化,1个脂肪瘤病灶呈内部低信号分隔样强化。Kamitani等[25]研究发现,分叶状肿瘤同纤维腺瘤一样易表现为内部低信号分隔样强化。
本研究中非肿块型IDP病灶以节段分布为主57.1%(16/28)。王丽君等[26]对33个表现为非肿块样强化的IDP病灶进行分析,发现84.8%(28例)表现为导管样强化,推测IDP表现为非肿块样强化与导管上皮增生有关。本研究非肿块型其他良性病变病灶以局灶分布为主44.4%(24/54),内部以集簇强化为主 42.6%(23/54)。 Tozaki等[27]分析 26个非肿块强化的良性病变,其中呈局灶分布及弥漫分布最常见,两者各占27%。内部呈点状强化占50%,仅有4%伴有成簇小环状强化。
IDP的TIC以流出型曲线为主(44.7%),其他良性病变为上升型曲线(56.5%)。然而炎症呈上升型者仅 23.1%(6/26),大多呈平台型及流出型[76.9%(20/26)]。既往研究多提示良性病变TIC呈上升型[11-13]。IDP较其他良性病变更多见导管扩张(65.6%比 22.5%)。
本研究 IDP 平均 ADC 值(1.15±0.19)×10-3mm2/s,低于其他良性病变。Kul等[28]研究发现,乳腺良性病变的ADC值中位数为1.26×10-3mm2/s,其中乳头状瘤和乳腺炎易表现为弥散受限,ADC值低于良、恶性阈值,腺病的ADC值较高。因此,在MRI形态学类似的良性病变中,结合偏低的ADC值更易识别IDP。
综上所述,动态增强MRI的形态学、TIC结合DWI成像的ADC值对于IDP与其他良性病变的鉴别诊断具有重要价值。

