西瓜品种‘蜜多’种子纯度SSR标记鉴定
焦荻 商纪鹏 高素燕 王钦 郝建全 何伟 焦定量 吕敬刚 陈则明
摘 要:为了准确、快速鉴定西瓜杂交种纯度,建立8424类型西瓜品种的SSR分子标记纯度鉴定体系。基于23对西瓜SSR核心引物,对天津市静海区主要种植的8424类型西瓜品种‘蜜多进行分子标记纯度鉴定。从供试引物中,总共筛选到4对在双亲上具有多态性差异的特异性引物,并从中选出2对多态性良好,条带清晰的引物10号和22号,应用于‘蜜多的分子标记纯度鉴定。对4份杂交F1代樣品进行分子鉴定,结果分别为97.4%、94.9%、98.1%、97.8%,对比分子鉴定结果和田间形态学鉴定结果,结果偏差≤1.5%,表现出高度一致。研究结果表明,SSR分子标记适用于该品种纯度鉴定,并可以取缔田间表型鉴定,实现准确、快速检测。
关键词:西瓜;分子标记;SSR;纯度鉴定
Abstract:In order to accurately and quickly identify the purity of watermelon hybrids, a SSR molecular marker purity identification system for 8424 type watermelon varieties was established. Based on the 23 pairs SSR core primers in watermelon, the molecular marker purity of 8424 type watermelon variety ‘Miduo which is mainly planted in Jinghai district of Tianjin was identified. From the test primers, a total of 4 pairs of specific primers with polymorphism differences in the parents were selected. Two pairs numbered 10 and 22, which have good polymorphisms and clear bands, were selected out of those 4 pairs to test the molecular purity of the ‘Miduo watermelon. Four hybrid F1 samples were identified by molecular identification, the results were 97.4%, 94.9%, 98.1% and 97.8%. The deviation between the results from the molecular identification and the field morphological identification is less than 1.5%, which reveals a high degree of consistency between the two methods. The results show that the SSR primers are suitable for testing the molecular purity for the ‘Miduo watermelon, and it can be used as an efficient and effective alternative method to the field morphological identification.
Key words: Watermelon;Molecular marker;SSR markers;Purity identification
我国是西瓜生产与消费大国,据统计2016年我国西瓜播种面积189.08万hm2,总产量7 940万t[1]。天津静海地区西瓜栽培历史悠久,栽培面积1 333 hm2左右[2],具有代表性的地标产品——台头西瓜,是天津市静海县台头镇特产,同样是中国地理标志产品,享誉盛名。目前当地栽培的西瓜品种主要为8424类型,‘蜜多是天津科润蔬菜研究所最新选育的8424类型西瓜品种,该品种果实发育期30 d左右,果实圆形,果皮浅绿色覆墨绿锯齿条带,瓤色鲜红,瓤质酥脆多汁,纤维少,口感好,产量较‘早佳(8424)提高,市场表现良好。
为了更好地保障瓜农收益,对于种子企业来说,严格把控好种子质量的四大指标(纯度、净度、水分、芽率)显得尤为重要。西瓜种子纯度鉴定一直以来多是依赖于传统的田间鉴定方法,主要依靠人为进行田间的形态学观察[3]。如果亲本之间表型差异不明显,很容易造成田间鉴定不准确,增加了人为鉴定误差,并且费工费时,鉴定效率不高。
随着分子标记技术的不断发展,利用分子标记技术实现农作物种子纯度快速检测成为了一种可能[4-6]。目前,基于西瓜全基因组序列开发出来的能够最大限度代表了西瓜遗传多样性的23对核心SSR引物[7],其位点覆盖全基因组且均匀分布于西瓜的染色体上。笔者正是利用这23对核心引物,为天津地区主栽的‘蜜多西瓜品种,寻求一种快捷、准确的纯度检测方法,也为今后鉴定该类型西瓜品种种子纯度、保证种子质量提供了参考。
1 材料与方法
1.1 材料
本试验供试材料‘蜜多及其亲本由天津科润蔬菜研究所西瓜课题组提供(表1)。田间纯度鉴定于2018年9—12月,在海南省乐东县进行。SSR分子标记纯度鉴定于2018年9—10月在天津科润蔬菜研究所蔬菜种质创新国家重点实验室进行试验。
表1 供试西瓜材料及形态学差异
[供试材料 种类 形态学差异 果皮颜色 果形 蜜多 子一代(F1) 绿花皮 高圆 蜜多母本 亲本(♀) 浅绿花皮 圆 蜜多父本 亲本(♂) 绿花皮 高圆 ]
1.2 分子标记纯度鉴定方法
1.2.1 亲本DNA提取 亲本材料取小片子叶,DNA提取采用CTAB法[8]。
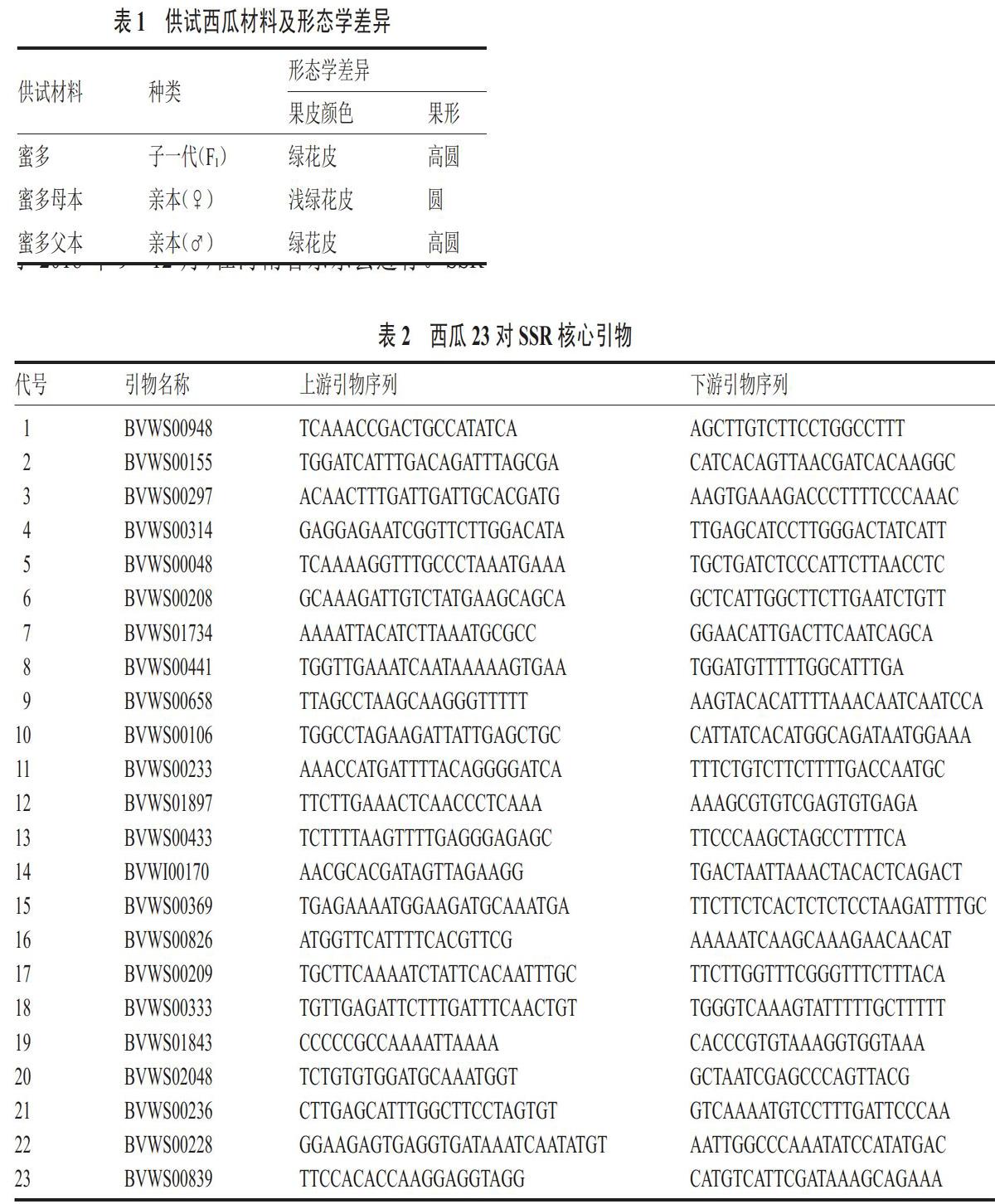
1.2.2 特异性引物筛选 特异性引物来源,参照国家蔬菜工程研究中心发表的最大限度代表西瓜遗传多样性的23对核心引物(表2)。引物由上海生工生物工程股份有限公司合成。
PCR扩增反应体系为12.5 μL:10× buffer 1.25 μL,dNTPs (2.5 mmol·L-1) 1 μL,每条引物(10 μmol·μL-1) 0.5 μL,TaqDNA聚合酶(2.5 U·μL-1) 0.2 μL,H2O 7.05 μL,DNA 2 μL。TaqDNA聚合酶购自全式金公司TransStar TaqDNA Polymerase。PCR扩增反应程序为:94 ℃预变性 5 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,34个循环;72 ℃延伸5 min。4 ℃保存。PCR产物经8%聚丙烯酰胺凝胶电泳分离,进行银染显色,统计分析结果。
1.2.3 杂交种DNA提取及纯度鉴定 每份待检测样品取100粒种子催芽。DNA提取采用碱式快速提取法,取1 cm长度的新鲜种子芽,放入2 mL离心管中,放入2个钢珠,加入100 μL NaOH(0.1 mol·L-1)。用组织打碎仪将叶片打碎后沸水浴1 min。取10 μL上清液加入100 μL Tris-HCL(10 mmol·L-1,pH 2.0),吸打混匀,置于4 ℃冰箱保存待用。PCR扩增反应和聚丙烯酰胺凝胶电泳方法同上,分析电泳结果。
1.3 田间形态学鉴定方法
通过观察幼瓜果皮颜色和果实形状,在坐果期和幼瓜期进行形态学鉴定,并将田间鉴定结果和分子鉴定结果进行比对。
2 结果与分析
2.1 亲本特异性引物筛选结果
利用23对SSR核心引物,在‘蜜多品种亲本上进行扩增。结果显示(图1),共有3、8、10、22等4对引物,在双亲之间表现出特异性差异,可作为杂交种纯度鉴定候选引物。其中10号和22号引物,亲本之间差异明显,扩增条带清晰,无杂带。适用于杂交种纯度鉴定,并进行进一步验证。
2.2 ‘蜜多品种杂交种分子标记纯度鉴定
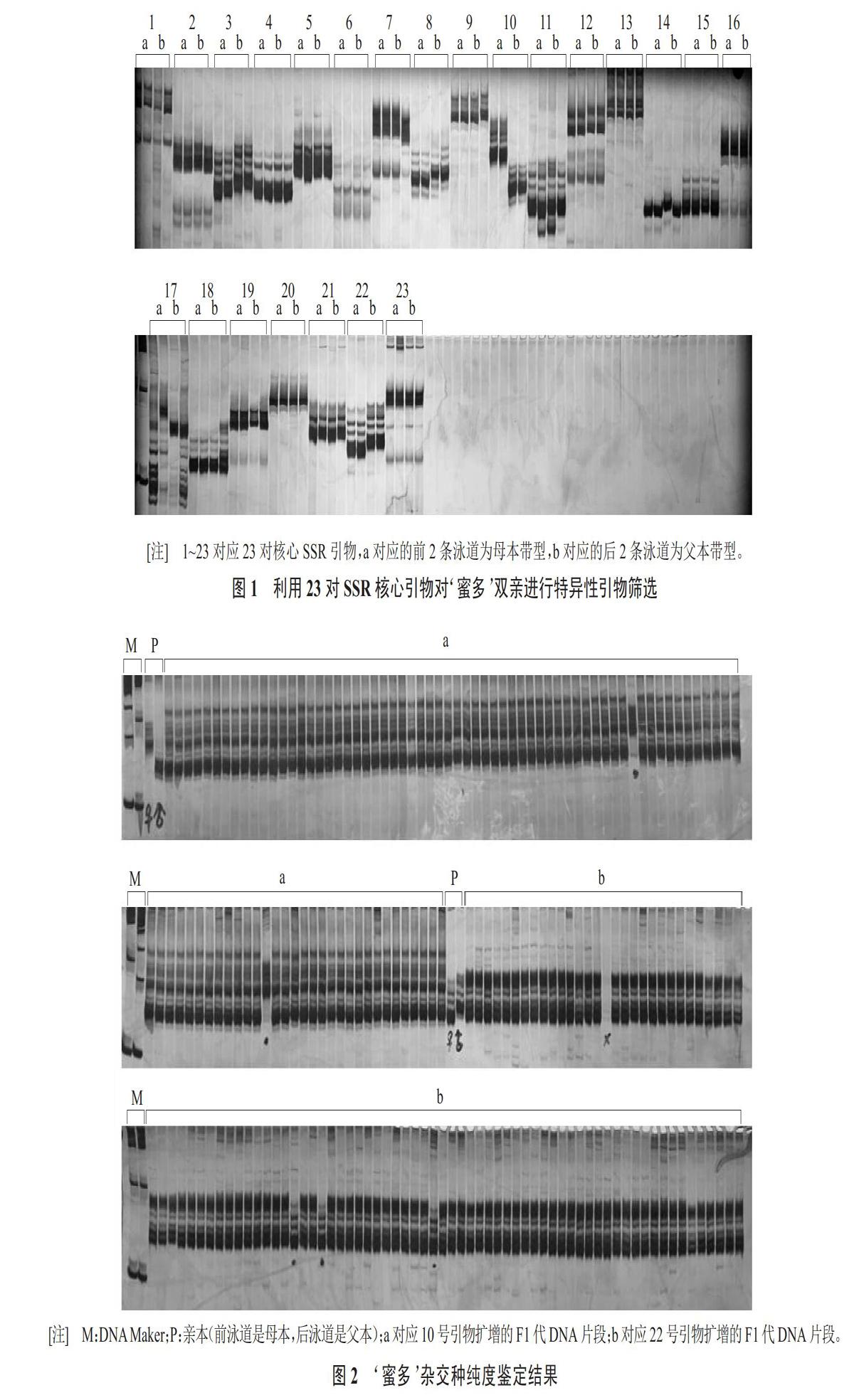
待检测‘蜜多品种杂交种每份样品取100粒种子进行催芽,选取出芽的94粒种子进行纯度检测。选用10号和22号引物进行分子标记纯度鉴定,通过聚丙烯酰胺凝胶电泳,统计试验结果(图2)。10号引物扩增结果:94粒种子中有2个母本带型,纯度结果为97.9%。22号引物扩增结果:94粒种子中有1粒未跑出条带,其余共有3个母本带型,纯度鉴定结果为96.8%。10号引物与22号引物鉴定结果吻合率为96.8%/97.9%≈98.9%。2对引物鉴定结果基本一致,分子鉴定结果取平均值为97.4%。
2.3 分子标记鉴定结果与田间鉴定结果比对
2018年9—12月,对分子标记纯度鉴定的同批次种子在海南进行田间纯度鉴定验证。根据田间形态学观察统计田间鉴定结果,并与分子鉴定结果进行比对(表3)。
结果显示,分子鉴定结果与田间鉴定结果基本相同,两者的纯度偏差≤1.5%,符合允许的误差范围(≤2%)。因此可以应用10号引物和22号引物对‘蜜多品种进行分子标记纯度鉴定,从而代替田间表型鉴定。
3 讨论与结论
诸如8424类型的西瓜品种及本研究中涉及到‘蜜多西瓜品种,在制种过程中都容易受到外界环境影响而出现兩性花,授粉过程中去雄不及时的话,便可能产生自交瓜,导致制种纯度下降。为了保证种子纯度,一方面,我们要严格按照制种流程,规范化制种,授粉过程中,对两性花株要及时去除雄蕊[9]。另一方面,要加强对生产出来的种子,进行严格、准确的纯度鉴定。笔者通过在双亲材料上对23对核心SSR引物进行筛选,得到了4对特异性引物,为该类型品种进行分子标记纯度鉴定时提供了一个参考。但是,此种方法筛选到杂株均为亲本带型的自交材料,对于外缘的机械混杂和‘蜜多品种种子真实性鉴定还存在局限性[10]。
为了进行西瓜种子纯度和真实性方面的检测,目前的方法多是在核心引物的基础上进一步扩大引物筛选,通过建立不同品种的DNA指纹图谱[11],利用多对既可以在2个亲本上表现出特异性,又可以在不同品种杂交种F1代间表现出差异的引物进行鉴定。根据所运用的引物对数,进行多次PCR反应,最终分析纯度和真实性结果[12-13]。但是此种方法反应步骤多,较为繁琐。目前已有研究报道,利用多对SSR引物通过建立多重PCR检测体系,实现了对种子纯度和真实性的共同检测[14-15]。今后在核心引物的基础上扩大引物筛选,通过多重PCR体系构建,可以实现对种子纯度和真实性的共同检测。
笔者针对目前天津市主要栽培的8424类型西瓜品种‘蜜多进行分子标记纯度鉴定,其分子鉴定结果与田间鉴定结果偏差≤1.5%,符合允许的误差范围(≤2%),因此可以应用分子鉴定的方法来代替田间纯度鉴定方法。但是考虑到同类型不同品种的遗传背景差异性,在进行分子标记进行纯度鉴定前提,还应该进行多次的田间试验验证,已确保所筛选到的特异性SSR标记鉴定结果可以真实、准确反映品种在田间的表型差异。
参考文献
[1] 屈冬玉.中国农业统计资料(2016)[M].北京:中国农业出版社,2016:57.
[2] 张洪立.静海县西瓜设施栽培的演变与实践[J].天津农业科学,2010,16(1):34-35.
[3] 马双武,韦小敏,王吉明.我国西瓜杂交种子纯度鉴定方法综述[J].长江蔬菜,2006(10):27-30.
[4] 方宣钧,刘思衡,江树业.品种纯度和真伪的DNA分子标记鉴定及其应用[J].农业生物技术学报,2000,8(2):106-110.
[5] 李晓辉,李新海,李文华.等.SSR标记技术在玉米杂交种种子纯度测定中的应用[J].作物学报,2003,29(1):63-68.
[6] 彭锁堂,庄杰云,颜启传,等.我国主要杂交水稻组合及其亲本SSR标记和纯度鉴定[J].中国水稻科学,2003,17(1):1-5.
[7] ZHANG H Y,WANG H,GUO S G,et al.Identification and validation of a core set of microsatellite markers for genetic diversity analysis in watermelon,Citrullus lanatus Thunb. Matsum & Nakai[J].Euphytica,2012,186(2):329-342.
[8] 李荣华,夏岩石,刘顺枝,等.改进的CTAB提取植物DNA方法[J].实验室研究与探索,2009,28(9):14-16.
[9] 肖淑凤,高华岳,方云梅.提高西瓜杂交制种产量和纯度的技术措施[J].现代园艺,2015(4):40-40.
[10] 孙波,邹甜,王志伟,等.利用SSR技术鉴定西瓜品种纯度[J].中国瓜菜,2018,31(6):16-19.
[11] 范建光,张海英,宫国义,等.西瓜DUS测试标准品种SSR指纹图谱构建及应用[J].植物遗传资源学报,2013,14(5):892-899.
[12] 岳静,朱志成,申雅娟,等.利用SSR标记技术鉴定玉米品种真实性的研究[J].中国农学通报,2011,27(12):201-204.
[13] 黄歆贤.ISSR和SSR标记在大豆、油菜、西瓜种子真实性和纯度鉴定中的比较[D].杭州:浙江大学,2011.
[14] 常宏,王汉宁,张金文,等.玉米品种真实性和纯度鉴定的SSR标记多重PCR体系优化[J].草业学报,2010,19(2):204-211.
[15] 陈浩东,刘方,王为,等.棉花多重 PCR 技术及其对杂交棉纯度鉴定的初步研究[J].棉花学报,2011,23(1):22-27.

